柠檬籽蛋白提取工艺优化及其不同酶解肽抗氧化活性分析
丛之慧,李 迪,周法婷,刘梦雅,张帮奎,马 莉,付 乐,张宇昊,顾 欣,,4,
(1.重庆三峡学院 生物与食品工程学院,重庆 404199;2.重庆汇达柠檬科技集团有限公司,重庆 402600;3.西南大学 食品科学学院,重庆 400715;4.三峡研究院(三峡库区可持续发展研究中心),重庆 404199)
近年来,中国柠檬产量逐年递增,废弃柠檬籽的数量也大幅上升。柠檬籽的处理方法一般为丢弃或填埋,会对自然和社会环境造成破坏[1]。柠檬籽中含有多种具有生理功能的活性成分,如蛋白质、黄酮类和柠檬苦素、果胶以及丰富的维生素[2]。柠檬籽蛋白作为植物蛋白有具有很高的研究价值。
现今关于植物籽蛋白酶解肽的研究众多。徐世涛等[3]研究苏麻饼粕多肽的氨基酸组成发现,它是一种优质高值的活性天然蛋白肽。杨玉蓉[4]研究了西藏野桃仁酶解多肽制备工艺以及抗氧化活性。吴峰等[5]则优化了亚麻籽多肽的制备条件,并通过分析发现亚麻籽多肽具有一定的抗氧化活性。
抗氧化肽具有清除羟基自由基、终止单线态氧的生成、结合促氧化的过渡金属离子以及与其它抗氧化物质协同作用的功效,并且对防止机体生物膜的破坏,延缓衰老具有一定的功效。国外学者 Gholamali 等[6]对柠檬果实蛋白质和多肽的研究表明其具有降血糖功效。已知柑橘种子中含有多种具有抗氧化功效的物质。但目前研究植物源天然抗氧化肽主要集中在豆科和乔木科。柠檬籽蛋白肽在抗氧化方面则鲜有人探究。因此对柠檬籽蛋白肽及其抗氧化功能进行探究将会提高柠檬籽的利用率。
本研究以柠檬籽经脱脂粉碎得到的柠檬籽粕为原料,对其柠檬籽蛋白提取工艺进行响应面优化,使用不同的蛋白酶酶解肽进行氨基酸组成分析、氨基酸评分、抗氧化能力研究及红外光谱分析,为后续的柠檬籽多肽的研究以及柠檬籽多肽功能性食品的开发提供理论基础;同时可以为植物蛋白原料的选择提供实验依据,为柠檬籽多肽以及其抗氧化的研究应用供给一些实践基础。
1 材料与方法
1.1 材料与仪器
尤力克柠檬籽 重庆汇达柠檬科技集团有限公司;石油醚 淄博市临淄东方红化工厂;考马斯亮蓝G250 石家庄市拜昂生物技术有限公司;胰蛋白酶(1×105U/g)河南圣斯德实业有限公司;木瓜蛋白酶(5.0×105U/g)上海如吉生物科技发展有限公司;复合蛋白酶(120 U/mg)、风味蛋白酶(5.0×104U/g)生化级别 上海源叶生物科技存限公司;二苯代苦味酰肼自由基 福建领江生物科技公司;三氯化铁、邻苯三酚、三氯乙酸、氢氧化钠 国药化学集团;无水乙醇、水杨酸、硫酸亚铁 重庆川东化工集团有限公司;维生素C、过氧化氢 天津市化工试剂一厂。
DDQ-A01G1 型袖珍数显笔式酸度计 河南双洋环保科技有限公司;TLXJ-JIC 型飞鸽牌低速离心机 上海安亭科学仪器厂;L-8800 型全自动氨基酸分析仪 日本日立公司;SP-756 型紫外可见分光光度计 上海菁华科技仪器有限公司;Alpha 1-2 LDplus型真空冷冻干燥机 德国Marin Christ 公司;FTIR-650 型傅里叶变换红外光谱仪 天津港东科技发展股份有限公司。
1.2 实验方法
1.2.1 尤力克柠檬籽粕的制备 称取一定质量干燥的柠檬籽,经粉碎过60 目筛后加入料液比1:5 的石油醚脱脂,在20 ℃的水浴振荡器中提取3 h,经抽滤固液分离,重复2 次,干燥固相,得到柠檬籽粕。再次研磨后得柠檬籽粕粉,用于蛋白质提取。
1.2.2 柠檬籽可溶性蛋白的提取 采用赵功玲等[7]的方法稍作改动提取柠檬籽蛋白。将按1.2.1 方法取得的柠檬籽粕粉,按一定料液比调配柠檬籽粕粉水溶液,调节pH,进行恒温搅拌后以5000 r/min 的速度离心10 min 后取上清液再次调 pH 获得沉淀,经过水洗,离心,真空冷冻干燥后得到柠檬籽蛋白。
1.2.3 柠檬籽蛋白得率的测定 根据吴炳云等[8]方法稍作改动,用Bradford 法测定溶解蛋白含量。吸取0.60 mL 蛋白质提取液于20 mL 离心管中,再加入1.40 mL 的蒸馏水和510 mL 的考马斯亮蓝溶液,振荡混匀,静置3 min。于波长595 nm 处测定蛋白质提取液的吸光度值,以牛血清白蛋白为标准蛋白质制作标准曲线,并建立回归方程:y=5.905x+0.0619,R2=0.993。式中:y 为样品中蛋白质含量,x 为吸光度值。根据公式计算柠檬籽蛋白质得率:

1.2.3.1 柠檬籽蛋白质提取的单因素实验 以pH=9.5,液料比20 mL/g,碱提时间60 min,碱提温度50 ℃为基础实验条件。考察pH(8.5、9.5、10.5、11.5、12.5)、提取时间(30、60、90、120、150 min)、液料比(10:1、20:1、30:1、40:1、50:1 mL/g)和提取温度(40、45、50、55、60 ℃)对柠檬籽蛋白质得率的影响。
1.2.3.2 响应面优化 根据单因素实验的pH、时间、液料比,温度的结果,利用Design Expert 11 软件进行响应面优化设计,响应面因素水平设计见表1。
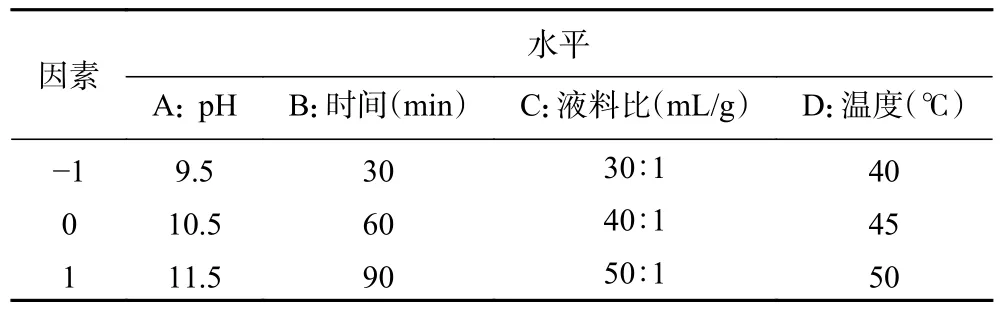
表1 响应面分析因素与水平Table 1 Factors and levels of response surface analysis
1.2.4 尤力克柠檬籽蛋白氨基酸分析 参照 GB/T 5009.124-2016 等相关检测方法进行检测。使用L-8800 全自动氨基酸分析仪对试样中的氨基酸进行分析。
1.2.5 营养价值评价 氨基酸评分采用氨基酸比值(ratio of amino acid,RAA)法[9]。按式(2)计算RAA;氨基酸比值系数(ratio coefficient of amino acid,RC)可以反映食物中氨基酸含量与模式氨基酸的偏离程度,RC 按式(3)计算。

式中:RC 为被测食物蛋白质的第i 种EAA 的比值系数(1≤i≤7);RAAi 为被测食物蛋白质中的第i 种EAA 评分值(1≤i≤7);RAA 为被测食物蛋白质中的第i 种EAA 评分值的均值。
1.2.6 不同酶酶解柠檬籽蛋白 取蒸馏水,将蛋白粉末溶解制成一定浓度的蛋白溶液,分别在各酶的最适条件下进行酶解。将蛋白溶液置于恒温水浴锅中保温放置,用1 mol/L 的NaOH 溶液调节pH 至酶最适pH 后,分别加入不同种类的蛋白酶,酶解过程中每间隔20 min 用1 mol/L 的NaOH 溶液维持反应体系的pH,具体条件见表2。酶解时间为结束后沸水灭酶10 min,冷却至室温,8000 r/min 离心10 min,取上清液冷冻干燥,-20 ℃保存备用。
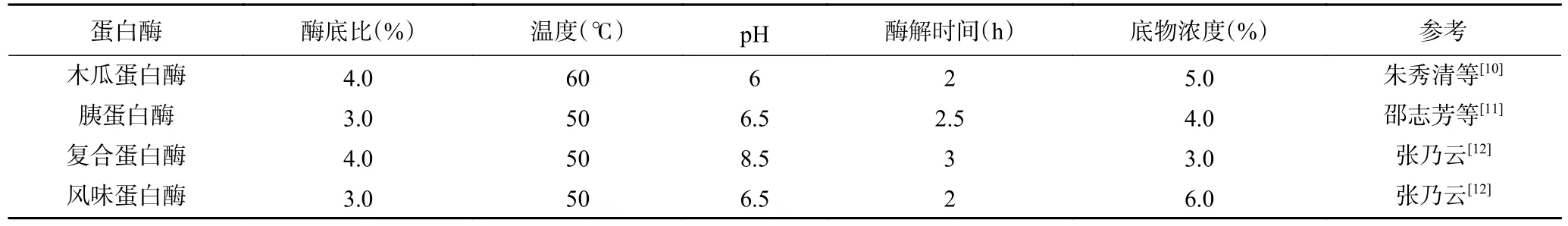
表2 不同蛋白酶酶解柠檬籽蛋白条件Table 2 Conditions for enzymatic hydrolysis of lemon seed protein by different proteases
1.2.7 不同柠檬籽蛋白酶解肽的抗氧化能力的研究
1.2.7.1 1,1-二苯基-2-三硝基苯肼自由基(DPPH·)清除能力的测定 采用Jamdar 等[13]的方法,配制不同浓度梯度的样品溶液为取2 mL 样品溶液,和2 mL DPPH·无水乙醇溶液混合均匀,25 ℃下避光反应30 min;在517 nm 处测定样品反应液吸光度,以维生素C 做对照。计算DPPH·清除率公式如下所示:
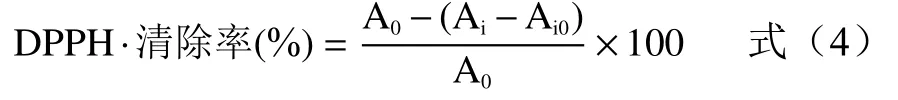
式中,Ai:样品吸光度;A0:蒸馏水代替样品的吸光度;Ai0:无水乙代替DPPH·无水乙醇溶液的吸光度。
1.2.7.2 羟基自由基(·OH)清除能力的测定 采用缪福俊等[14]的方法,在1 mL 不同质量浓度的样品溶液中加入过氧化氢2 mL、FeSO4溶液1 mL、水杨酸乙醇溶液1 mL,均匀混合;37 ℃下恒温反应30 min,510 nm 处测其吸光度,以维生素C 作对照,采用公式(5)计算·OH清除率。

式中:A1:样品的吸光度值;A2:蒸馏水替换H2O2的吸光度值;A0:乙醇替换样品的吸光度值。
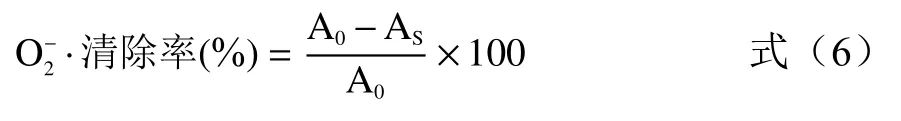
式中:A0:蒸馏水代替样品溶液;As:样品组吸光度。
1.2.8 红外光谱分析 将木瓜蛋白酶酶解肽、胰蛋白酶酶解多肽、复合蛋白酶酶解肽、风味蛋白酶酶解肽放置于冷冻干燥机种干燥24 h 至恒重,备用。将上述少许样品和KBr 以1:200 比例碾磨成粉,使用压片机将混合物制作成透明薄均匀薄片,以KBr 为参照样,在室温干燥环境中使用傅里叶变换红外光谱仪进行红外图谱扫描,扫描范围为400~4000 cm-1[16]。
1.3 数据处理
每组实验重复三次,利用Design Expert 11 软件进行响应面优化设计,采用方差分析进行显著性检验,绘图采用Origin 2018 软件,采用 SPSS 23.0 软件根据Probit 回归模型进行分析IC50计算。
2 结果与分析
2.1 尤力克柠檬籽粕可溶性蛋白的提取
2.1.1 柠檬籽蛋白质提取的单因素实验结果及分析如图1 所示,在基础实验条件下,当pH 在8.5~10.5 范围内时,蛋白质得率随着pH 的升高而显著提高(P<0.05)。这可能是由于在一定碱性范围内,pH 越高,溶液中蛋白质分子间的氢键越容易被打破,随着氢键被打破,蛋白质分子间的相互作用力减小,会加强蛋白质分子与水分子的结合,增加其与水的溶解度[17]。当pH 大于10.5 时,蛋白质得率随着pH 的升高而显著下降(P<0.05);这可能是因为强碱导致溶液含盐量增加,不易使蛋白质溶出,且pH 过高容易使蛋白质变性。为蛋白的进一步利用带来限制。因此选择pH 为10.5 左右可以获得更高的蛋白质得率。
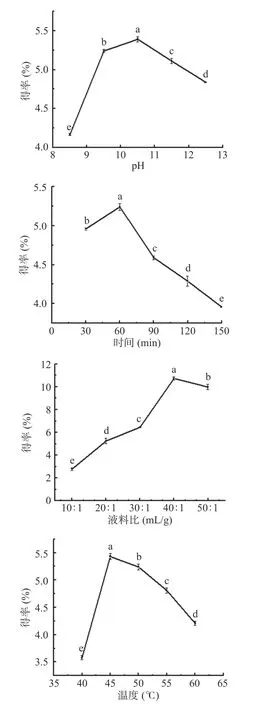
图1 单因素实验结果Fig.1 Results of single factor experiment
在基础实验条件下,当碱提时间小于60 min 时,得率随着碱提时间的延长而显著提高(P<0.05)。随着时间的延长,对柠檬籽细胞壁的破坏作用更加完全,柠檬籽蛋白可以充分溶出。但当碱提时间处于90~150 min 时,蛋白质得率随着碱提时间的延长而显著降低(P<0.05)。这可能是由于当蛋白质长时间处于碱溶液时部分蛋白质会出现聚集现象而产生沉淀,而与杂质一起被离心分离,影响蛋白提取。综上,选择60 min 为最佳碱提时间。
在基础实验条件下,在液料比10:1~50:1 mL/g之间柠檬籽蛋白质得率逐渐升高,至液料比40:1 mL/g时达到最大值10.73%,在此之后,得率随着液料比的增加而显著降低(P<0.05)。其原因在于,当液料比较低时,溶剂量较少,溶液中的蛋白质溶解度逐渐增大直至饱和,而随着料液比继续增加时,蛋白质得率略微下降,但下降趋势较为平缓,此时蛋白质得率已达到最大,所以蛋白质得率变化不大,因此选择液料比为40 mL/g 更合适。
在基础实验条件下,当温度小于45 ℃时,蛋白质得率随着温度的升高而提高(P<0.05)。在反应初期,温度升高,反应速度加快,溶液中的分子的扩散速率增加,导致氮溶解指数升高,蛋白质的溶出量增加,蛋白质得率达到最大值[18]。温度高于45 ℃,得率逐步下降,其原因在于随着温度升高,蛋白质出现变性。因此,确定酶解温度为45 ℃。
2.1.2 响应面分析法对柠檬籽蛋白提取工艺的优化
2.1.2.1 响应面模型的建立及结果 根据Box-Behnken 中心组合实验设计的原则,设计响应面分析试验的因素和水平的数值,见表3。响应面分析结果见表4。
表3 响应面分析的试验结果Table 3 Test results of response surface analysis
利用Design-expert.8.0.6 软件程序进行回归拟合,得出柠檬籽蛋白质的得率对pH、碱提时间、液料比、碱提温度的四元二次回归方程如下:
Y(得率)=11.16+0.71A-0.20B+1.52C+0.27D-0.020AB-0.31AC+0.063AD+0.10BC+0.015BD+0.14CD-0.22A2+0.20B2-2.51C2-0.050D2
从表4 可以得出,模型项在P<0.01 时有显著差异,相关系数较高,失拟项不显著,并且该模型R2=0.9790,R2Adj=90.46%,表明模型的拟合程度有效,说明该模型与实验拟合良好,自变量与响应值之间线性关系显著,实验误差小,能够较好地描述试验结果,由图2 可得各项对柠檬籽蛋白质提取的曲面效应显著,说明模型有较复杂的线性关系。由方程系数的绝对值可知柠檬籽蛋白质得率影响因素依次为:D(温度)>B(时间)>C(液料比)>A(pH)。
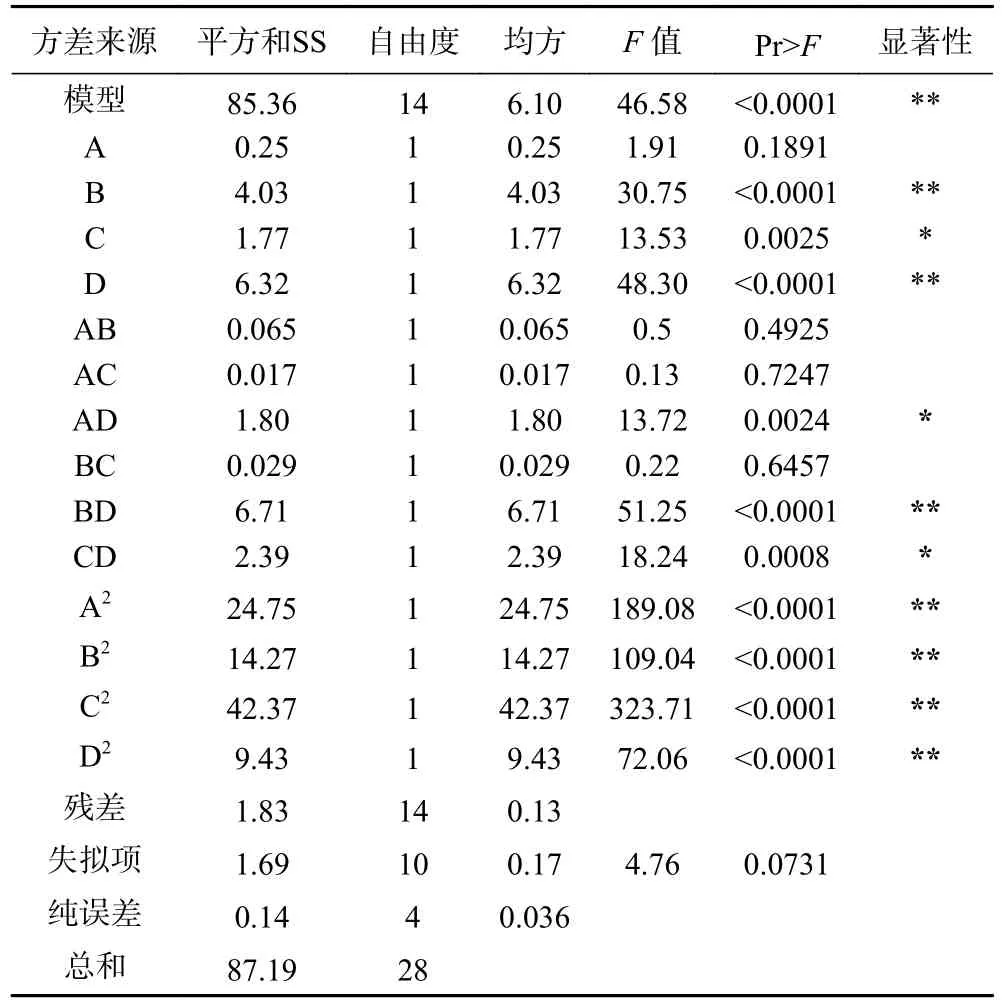
表4 二次响应面回归模型方差分析Table 4 Analysis of variance of quadratic response surface regression model
图2 是通过二次回归模型拟合的各因素之间交互作用的响应面分析图。当响应面图的曲面越陡峭,两两因素的交互作用就越明显,相反,当响应面图的曲面越平缓,两两因素的交互作用就越不显著。由图2 可知,各图均开口向下,凸形曲面,都存在极值。交互项 AB、AC、BC 对响应值影响不显著(P>0.05),AD、CD 对响应值影响极显著(P<0.05),BD 对响应值影响极显著(P<0.01)。

图2 各因素交互作用对柠檬籽蛋白得率的影响的响应面图Fig.2 Response surface plot and of the effects of interaction of various factors on the extraction rate of lemond seed protein
2.1.3 柠檬籽蛋白质最佳提取工艺的确定 通过Design-Expert 软件设计响应面试验优化柠檬籽蛋白的提取工艺,结果显示最佳提取工艺为:pH 10.410,时间60.950 min,液料比41.630:1 mL/g,温度41.850 ℃。柠檬籽蛋白质得率的预测值为13.06%,为了实际操作可行,最佳工艺条件修正为pH10.5,时间60 min,液料比41:1 mL/g,温度40 ℃,在修正工艺条件下进行验证的得率为12.25%± 0.01%,预测值与实际值误差为0.81%,相差较小,表明该模型具有一定的可行性。
2.2 柠檬籽蛋白的氨基酸分析
对上述方法制得柠檬籽蛋白进行氨基酸分析,可知其共含有17 种氨基酸,其中包括7 种必需氨基酸(表5)。必需氨基酸(Essential amino acid,EAA)含量占比总氨基酸(Total amino acid,TAA)含量为31.8%,必需氨基酸占非必需氨基酸(Non-essential amino acid,NEAA)的46.7%。柠檬籽蛋白所含氨基酸量最高的两种是谷氨酸和精氨酸,分别占据氨基酸总量的21.4%和10.6%。目前已有研究表明精氨酸具有较强的清除DPPH 自由基、ABTS+自由基、超氧自由基能力以及一定的还原力[19],谷氨酸可以通过提高苹果抗氧化酶系统和诱导抗氧化剂的积累来抑制活性氧的大量生成和细胞死亡[20],可见这两种氨基酸在食品的抗氧化性中发挥效用[21]。说明柠檬籽在抗氧方面具有潜力,可进一步进行抗氧化研究。

表5 柠檬籽蛋白氨基酸组成Table 5 amino acid composition of lemon seed protein
桑叶蛋白[22]与松茸蛋白[23]同属于植物蛋白,氨基酸组成与柠檬籽蛋白较为相似,柠檬籽蛋白与桑叶蛋白对比,其必需氨基酸含量较高;其芳香族氨基酸(酪氨酸和苯丙氨酸)的含量为6.7 g/100 g,可以显著提高柠檬籽蛋白的抗氧化能力[24]。相较于松茸蛋白,柠檬籽蛋白疏水性氨基酸亮氨酸含量较高,为15.8 g/100 g,疏水性氨基酸被认为是影响自由基清除能力的关键因素之一[25]。
营养学上通常认为,所含的EAA 组成比例越接近人体需要,则品质越优。联合国粮农组织(Food and Agriculture Organization of the United,FAO)和世界卫生组织(World Health Organization,WHO)提出了评价蛋白质营养价值的EAA 模式(FAO/WHO模式)。由表6 可知,在柠檬籽蛋白中除亮氨酸与赖氨酸,其他必需氨基酸呈现过剩的状态(RC>1);第一限制性氨基酸为亮氨酸(RC=0.49)。含有酪氨酸、苯丙氨酸等芳香族氨基酸的肽具有较强的自由基淬灭能力[26]。
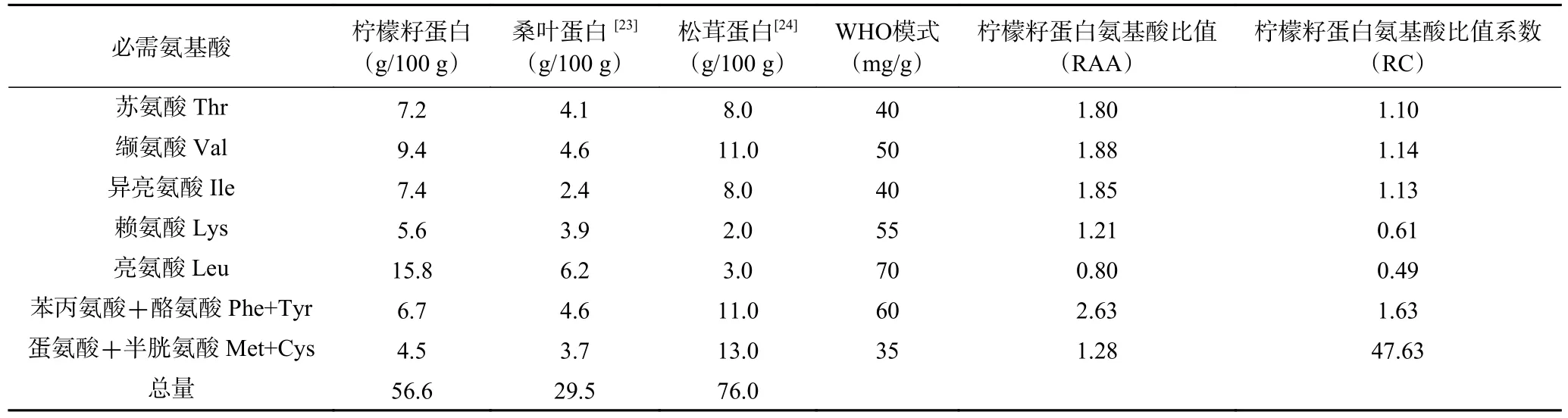
表6 必需氨基酸组成比较及氨基酸评价Table 6 Comparison of amino acid composition and essential amino acid evaluation
综上,柠檬籽蛋白中必需氨基酸种类齐全。与桑叶蛋白、松茸蛋白相比较,柠檬籽蛋白在总体评分上高于桑叶蛋白,与松茸蛋白基本持平,可进一步进行抗氧化性的研究。
2.3 柠檬籽蛋白酶解物抗氧化能力比较
四种蛋白酶酶解肽的DPPH·清除能力、羟自由基(·OH)清除能力、超氧阴离子()清除能力数值,做出清除率趋势图。使用SPSS 23.0 软件计算出IC50值,进行绘图,结果如下。
从图3 可得,四种酶解肽清除率都是随着浓度的增加呈现上升趋势,木瓜蛋白酶酶解多肽在浓度为1~2 mg/mL 之间DPPH·的清除率增长幅度最大,之后趋于平缓。而胰蛋白酶酶解多肽在1~2 mg/mL之间DPPH·的清除率增长幅度较大,而后趋于平缓,浓度超过5 mg/mL 后,呈现继续增长的趋势,从清除率来看,复合蛋白酶酶解肽和风味蛋白酶酶解多肽对于DPPH·的清除率都比较强。结合表7 分析,风味蛋白酶酶解肽对DPPH·的清除能力略高于复合蛋白酶酶解肽。清除DPPH·能力的大小依次为:风味蛋白酶酶解肽(IC50值为1.02 mg/mL)>复合蛋白酶酶解肽(IC50值为1.52 mg/mL)>胰蛋白酶酶解肽(IC50值为1.52 mg/mL)>木瓜蛋白酶酶解肽(IC50值为3.54 mg/mL)。根据显著性分析,四种酶解肽与维生素C 的DPPH·的清除能力IC50值存在极显著差异(P<0.01)。
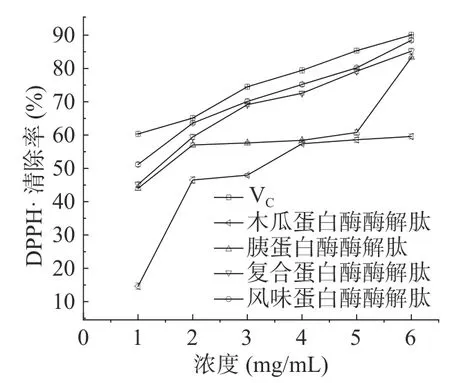
图3 酶解肽的DPPH·清除率Fig.3 DPPH·clearance rate of enzymatic hydrolysate peptide
在·OH清 除能力方面,如图4 所示。四种酶解肽的羟自由基清除率都随浓度增加而增加,具有较好的构效关系,其中木瓜蛋白酶酶解多肽在5 mg/mL 后增长速率明显加快。从清除率的趋势图来看,风味蛋白酶酶解肽在羟自由基清除表现最好。结合表7 可以看出,四种酶解肽对·OH清除能力的大小依次为:风味蛋白酶酶解肽(IC50值为5.02 mg/mL)>复合蛋白酶酶解肽(IC50值为8.29 mg/mL)>木瓜蛋白酶酶解肽(IC50值为8.92 mg/mL)>胰蛋白酶酶解肽(IC50值为8.77 mg/mL)。木瓜蛋白酶酶解肽和胰蛋白酶酶解肽的·OH 清除能力IC50值无显著差异(P>0.05),木瓜蛋白酶酶解肽与风味蛋白酶酶解肽的·OH 清除能力IC50值存在显著差异(P<0.05),四种酶解肽与维生素C 的·OH 清除能力IC50(0.86 mg/mL)值存在显著差异(P<0.05)。
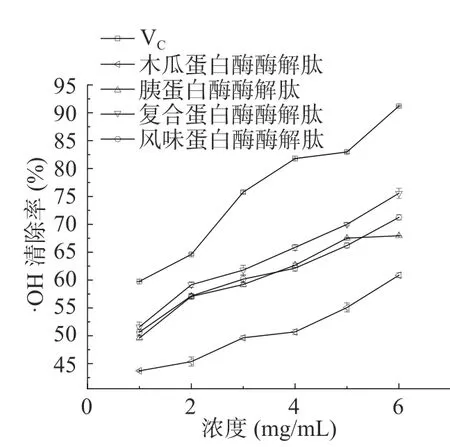
图4 酶解肽·OH清除率Fig.4 ·OH clearance rate of enzymatic hydrolysate peptide

表7 各酶解肽抗氧化能力的比较Table 7 Comparison of antioxidant capacities of enzyme-hydrolyzed peptides
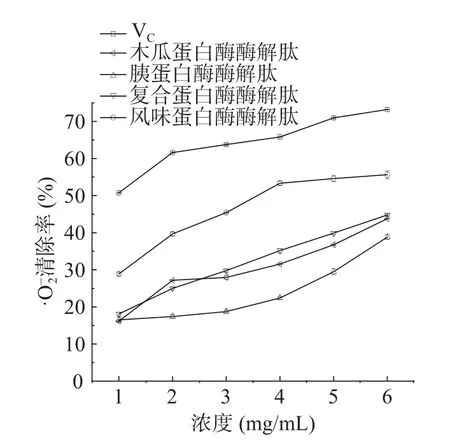
图5 酶解肽·清除率Fig.5 clearance rate of enzymatic hydrolysate peptide
通过对比研究发现,海参多肽[27]清除DPPH·的IC50值(8.39 mg/mL)是胰蛋白酶酶解肽的DPPH·清除能力的IC50值的1.35 倍。魔芋飞粉多肽[28]清除·OH 能力的IC50值(14.16.mg/mL)是木瓜蛋白酶酶解肽的·OH 清除能力的IC50值的2.22 倍。杨梅蛋白酶解总肽[29]清除的IC50值(5.745 mg/mL)是胰蛋白酶酶解肽的清除能力的IC50值的4.33 倍。由此可见,柠檬籽蛋白酶解肽表现出较优的抗氧化能力。
2.4 红外光谱的测定
由图6 可以得出,风味蛋白酶酶解肽相较其他三组样品在2937 cm-1处出现了一处酰胺B 带吸收峰,并且波长较短,其吸收峰波动较其他三组样品波动幅度较大。在3440 cm-1附近的宽峰属于酰胺A 带,是由N-H 的伸缩振动导致的特征峰。酰胺I 带(1656 cm-1)主要是由C=O伸缩振动引起的,N-H弯曲振动和C-N 伸缩振动引起酰胺带。1415 cm-1为氨基酸残疾侧链基团-COO-伸缩振动引起的吸收峰,1076 cm-1附近的吸收峰由C-O的伸缩振动导致,400~800 cm-1范围内的吸收峰由N-H和C-H伸缩振动导致。1245 cm-1处的吸收峰被认为是由C-O-C 的特征吸收峰,在1076 cm-1处出现的吸收峰说明样品分子中含吡喃环。四种酶解肽在1415 cm-1处吸收峰出现差异,可能由于木瓜蛋白酶解肽和风味蛋白酶酶解肽存在氨基酸残疾侧链基团-COO-,氨基酸残基侧链基团对抗氧化性有影响。相比较于胰蛋白酶酶解肽,存在-COO-的木瓜蛋白酶的抗氧化能力更强,木瓜蛋白酶解肽与风味蛋白酶酶解肽中可能存在醛基,在1656 cm-1附近是由于C=O伸缩振动和N-H 变角振动引起的非对称伸缩振动峰,这表明样品具有芳香性。醛基对抗氧化起到支持积极作用,使得木瓜蛋白酶酶解肽在抗氧化方面的清除·OH的能力上表现更强。在1076 cm-1处出现的吸收峰,说明样品分子中含吡喃环,表明物质不易发生氧化反应[30]。
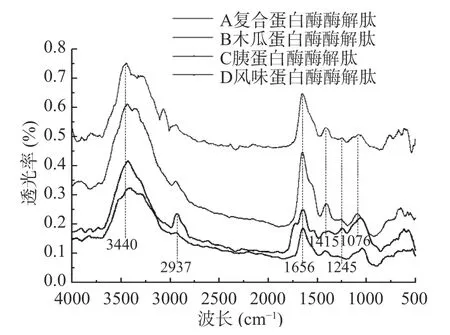
图6 酶解多肽的红外光谱Fig.6 Infrared spectrum of enzyme-hydrolyzed polypeptides
3 结论
本文开展了以柠檬籽粕粉为原料,对柠檬籽蛋白进行提取,通过单因素实验和响应面优化试验得出柠檬籽蛋白质得率的影响因素:D(温度)>B(时间)>C(液料比)>A(pH)。由Design-expert.8.0.6 软件程序进行回归拟合,柠檬籽蛋白质的最佳提取条件为:pH10.5,时间60 min,液料比41:1 mL/g,提取温度40 ℃,此时柠檬籽蛋白实际得率为12.25%±0.01%。对提取出的柠檬籽蛋白进行氨基酸组成分析,结果显示:柠檬籽蛋白含有检测的17 种氨基酸,种类完备,包括7 种必需氨基酸,含量为总氨基酸含量的31.8%。四种酶解肽均表现出体外抗氧能力,对DPPH·,· OH,清除率的IC50值均在10 mg/mL 以下,其中风味蛋白酶酶解肽与复合蛋白酶酶解肽能力较优,但其抗氧化能力均弱于维生素C。结合红外光谱分析柠檬籽蛋白酶解肽具有抗氧化活性官团特征吸收峰。本研究表明柠檬籽蛋白氨基酸种类齐全,柠檬籽蛋白酶解肽抗氧化能力较优,可为柠檬籽食用价值提供参考依据,为今后进一步开发利用柠檬籽提供了数据支持。虽然本研究中柠檬籽肽在体外表现出较好的抗氧化活性,但是其在体内是否还能保持相同抗氧化活性以及其发挥抗氧化作用的机制以及还需要进一步研究。

