西兰花茎提取液对西兰花贮藏品质的影响
孙玉芃,陈 颖,郭衍银,,张玉笑,马阳历,杨 梅,付瑞青,王玉江
(1.山东理工大学农业工程与食品科学学院,山东淄博 255049;2.淄博市数字农业农村发展中心,山东淄博 255000)
西兰花(Brassica oleraceaL.var.italica)因口感清爽、外形美观、营养价值高,被人们称作“蔬菜之冠”[1]。然而,采收后西兰花因与母体分离造成营养等供应中断,各种代谢十分加强,进而致使其迅速衰老,室温下2~3 d 就会变黄,严重影响其市场价值[2-4]。因此,如何有效延长西兰花的贮藏期及货架期是当前研究的热点。
目前,利用天然植物提取液进行果蔬保鲜已广泛应用于果蔬的采后保鲜,在马铃薯[5]、葡萄[6]、猕猴桃[7]等方面都有了一定的研究。孙树杰等[8]通过研究发现金银花营养液能够抑制西兰花的呼吸强度,延缓VC和叶绿素含量的下降,对西兰花的贮藏效果有较好表现;赵冬艳等[9]研究发现大蒜提取液能够抑制秋葵MDA 的产生,降低秋葵的腐烂率,提高秋葵的贮藏品质;杨英等[10]使用山丹百合鳞茎提取液对樱桃番茄进行保鲜效果的研究,发现山丹百合鳞茎提取液能够抑制使樱桃番茄腐烂的青霉菌的生长,使抗氧化物质保持较高的活性,具有良好的保鲜效果;吕静祎等[11]利用壳聚糖-山竹果皮提取液对蓝莓进行复合涂膜保鲜,发现壳聚糖-山竹果皮提取液能够抑制蓝莓硬度和含水量的下降,降低蓝莓的呼吸强度,推迟呼吸高峰的出现,保持蓝莓的营养水平,保鲜效果较好。但是,在以往的研究中,多为植物提取液对另一种果蔬的保鲜效果,并未有关于果蔬材料对果蔬本身保鲜效果的研究。
与通过果蒂连接的果蔬如苹果、梨、西红柿等不同,西兰花采收时需要对茎进行切割采收,因而会造成较大的采收切割面,这样的采收操作必然会切断营养、激素等的供应,进而影响西兰花花球的代谢活动[12-14]。同时西兰花茎属于废弃物,遗留于田地中,利用率不高。能否模拟西兰花生长状态的营养供应,进而延长西兰花花球的保鲜期,同时对西兰花茎进行废物利用,是一个值得研究的课题。
据美国农业部(U.S.Department of Agriculture,USDA)数据库[15]所示,西兰花茎的成分几乎与西兰花花球相当,西兰花茎制作的茎提取液能够最大限度地补充西兰花生长所需要的物质。为此,本文利用西兰花茎提取液,通过茎基部浸施方式模拟西兰花生长状态的营养供应,探讨西兰花茎提取液对西兰花贮藏期间保鲜效果的影响,为西兰花乃至切割采后果蔬的补偿性保鲜提供理论依据。
1 材料与方法
1.1 材料与仪器
西兰花 品种为‘优秀’,采自山东省寿光市刘家茅坨村种植基地,选择直径为14~17 cm 左右的西兰花,确保西兰花大小均一,花球紧实不脱落,去除茎部叶片,并保留花茎6 cm[16],迅速运送到山东理工大学实验室冷库,于2 ℃下预冷4 h;三氯乙酸、2,6-二氯酚靛酚钠 北京索莱宝科技有限公司;硫代巴比妥酸、2,4-二硝基苯肼 上海麦克林生物科技有限公司;偏磷酸 上海展云化工有限公司;硫酸、丙酮国药集团化学试剂有限公司;硫脲 天津巴斯夫化工有限公司;所有试剂 均为国产分析纯。
HP-2132 色差仪 上海汉谱光电科技有限公司;DDS-307A 电导率仪 上海仪电科学仪器股份有限公司;Vari-anCP-3800 气相色谱-质谱联用仪 美国安捷伦科技公司;MapScan 果蔬呼吸强度测定仪上海锦川机电技术有限公司;UV-1750 紫外可见分光光度计 岛津国际贸易有限公司;405286 手持阿贝折射计 成都泰华光学有限公司。
1.2 实验方法
1.2.1 西兰花处理与贮藏 基于预实验实验结果,发现12 h 的浸施效果最好且不会腐烂,因此在本实验选择浸施12 h;在20 ℃下,西兰花仅能贮藏3 d 左右,贮藏时间过短,不利于测定不同处理下的品质变化。在10 ℃下,西兰花可以贮藏8~10 d,方便观察及取样,因此选择在10 ℃环境下进行实验。
提取液制备:收集采收后剩余在田地里的西兰花茎,去除外皮后切块,使用破壁机打碎,用多层纱布过滤后5000 r/min 低温离心20 min,上清液即为提取液;提取液具体成分来自于美国农业部数据库[15]。
实验用西兰花分为三组,在10 ℃环境下,一组西兰花使用提取液茎部浸施处理12 h(提取液),一组使用蒸馏水茎部浸施处理12 h(蒸馏水),最后一组不作任何处理(对照)。每组40 个西兰花,3 次重复。浸施过程如下:准备具有一定深度的托盘,将营养液倒入托盘中,然后将西兰花立着放入托盘并确保提取液浸没西兰花茎部,每个托盘放5 个西兰花。浸施后西兰花贮藏在10 ℃冷库中,每2 d 取样并进行相关指标测定。取样后鲜样用于乙烯释放量、呼吸速率、含水量、TSS、TA、MDA 和相对电导率的测定,另一部分使用液氮迅速冷冻,保存在-80 ℃冰箱中,用于叶绿素和VC含量的测定。
1.2.2 乙烯释放量测定 根据李玲等[17]的方法进行乙烯释放量的测定。采用气相色谱测定,具体测定如下:每处理取4 个西兰花花球,在15 ℃的空气中放置20~30 min 以利于处理气体的挥发,然后分别将单个花球放入1.8 L 的塑料桶内封口,在15 ℃下放置40~60 min 后进行乙烯含量的测定;测定时,柱温、热导检测器和氢火焰检测器分别设置为50、100和150 ℃;每个处理重复3 次。
1.2.3 呼吸速率测定 按照Cuo 等[18]的方法进行,略有改动。每组随机取3 个西兰花,称重后分别密封在容器中,在10 ℃下恒温密封1 h,利用果蔬呼吸强度测定仪测量CO2生成量并计算呼吸强度。
1.2.4 叶绿素含量测定 根据邹琦[19]的方法进行叶绿素的测定。准确称取0.2 g 西兰花花球,用6 mL丙酮冰浴研磨,暗处放置过夜。之后5000 r/min 低温离心10 min,将上清液在50 mL 量筒中用95%乙醇定容至20 mL,充分混匀后在665、649 和447 nm下读取吸光值。
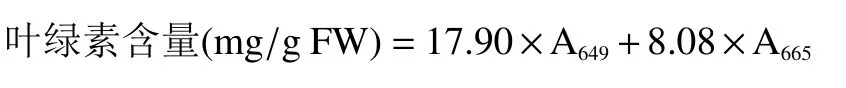
1.2.5 含水量测定 准确称取10 g 西兰花花球于培养皿中,70 ℃烘干至恒重,称取重量。

1.2.6 失重率测定 根据Giulia 等[20]的方法进行。实验前每组标记3 个西兰花并称重,贮藏期间每隔2 d 称取其质量。失重率即前后两次测量的差值与最初质量的比值。
1.2.7 MDA 含量测定 MDA 的测定依据林本芳[21]的方法。准确称取0.5 g 花球,用5 mL 10%(w/v)三氯乙酸分三次研磨,5000 r/min 低温离心15 min。取2 mL 上清液加入2 mL 0.67%硫代巴比妥酸后,沸水浴15 min 后冰上降温,然后5000 r/min 低温离心10 min。在450、532 和600 nm 下比色。
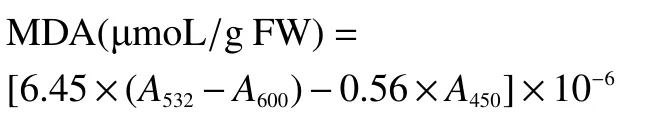
1.2.8 相对电导率测定 相对电导率的测定参照Liu 等[22]的方法,略有改动。准确称取花球0.5 g,置于100 mL 的锥形瓶中,加入25 mL 蒸馏水,25 ℃水浴30 min 后测定电导率P1。利用封口膜将上述溶液封口,沸水浴20 min,冷却至室温后,加水至原刻度线测定电导率P2。
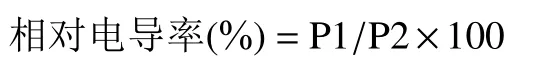
1.2.9 VC含量测定 根据金邦荃[23]的方法测定VC,略有改动。称取0.2 g 西兰花花球,用8 mL 混合酸(6%偏磷酸+2 moL/L 醋酸)冰浴研磨,然后10000 r/min 低温离心20 min。室温下放置15 min,取1 mL 上清液,各加入50 μL 0.2% 2,6-二氯酚靛酚溶液,室温下放置1 h。之后加入1 mL 硫脲,除空白管外各管均加入0.5 mL 2% 2,4-二硝基苯肼(2,4-Dinitrophenylhydrazine,DNPH)。空白管于25 ℃下放置3 h,其余各管置于水浴锅60 ℃水浴3 h。冰上降温。各管均加入2.5 mL 预冷90% H2SO4,空白管补加0.5 mL 2% DNPH,540 nm 下比色。
1.2.10 TSS 测定 称取花球5 g,加入10 mL 水研磨后拿纱布滤出汁液,采用阿贝折光仪进行TSS 含量测定。
1.2.11 TA 测定 采用酸碱滴定法进行TA 的测定。
1.3 数据处理
每组试验进行三次重复,使用Excel 2021 软件进行数据统计与分析,并用Origin Pro 9 软件作图,利用 IBM SPSS Statistics 26.0 软件对数据进行差异显著性检验(P<0.05)。
2 结果与分析
2.1 茎提取液对西兰花乙烯释放及呼吸速率的影响
乙烯的释放量反映果蔬采后的生理变化,在果蔬的成熟过程中起着重要的作用[24]。由图1A 可知,整个贮藏期间乙烯释放量呈现先增高后下降的趋势。其中,对照处理最先出现乙烯释放高峰,并且释放量最大,在4 d 时达到115.52 μL/(kg·h),随后迅速下降;蒸馏水和提取液处理在6 d 时达到峰值,分别为93.47、69.65 μL/(kg·h);贮藏末期,提取液处理的西兰花保持着较低的乙烯释放量,仅为对照处理和蒸馏水处理的64.19%、76.69%,这可能是提取液处理在一定程度上模拟了西兰花在母体上的状态,从而抑制西兰花的乙烯释放,延缓西兰花的成熟衰老。
西兰花属于跃变型果蔬,采后呼吸加快,因此呼吸速率是衡量西兰花品质的重要依据。如图1B 所示,西兰花各处理的呼吸速率基本呈现出标准的跃变型变化趋势,与乙烯释放量相对应,但呼吸高峰出现的时间存在差异,对照处理的呼吸高峰出现在第6 d,而提取液处理和蒸馏水处理的呼吸高峰则出现在第8 d,表明提取液处理可延缓呼吸高峰的到来。同时,就呼吸强度而言,提取液处理的呼吸强度显著低于蒸馏水和对照处理(P<0.05),其平均呼吸速率仅为蒸馏水和对照处理的85.52%、83.19%,这可能是由于提取液处理抑制了西兰花采后生理活动的剧烈变化,使得呼吸强度降低,并且推迟呼吸高峰的出现[25]。表明提取液处理可显著降低西兰花的呼吸速率。
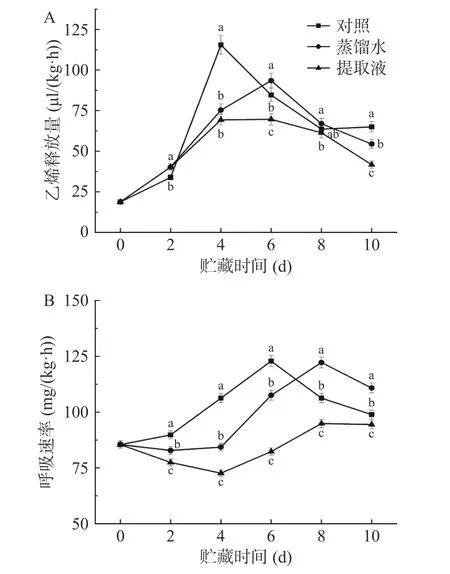
图1 不同处理对西兰花呼吸速率的影响Fig.1 Effects of different treatments on respiratory rate of broccoli heads
2.2 茎提取液对西兰花外观和叶绿素含量的影响
叶绿素的降解和黄化是西兰花品质劣变的直观表现[26]。如图2 所示,明显看出蒸馏水处理和对照处理在贮藏第8 d 已呈现黄化现象,而提取液处理在第10 d 仍未完全黄化。在贮藏期间,叶绿素含量总体均呈下降趋势(图2),提取液处理下降最慢,蒸馏水处理次之,对照处理下降最快。整个贮藏期间,三个处理叶绿素含量分别下降了53.31%、71.72%和77.70%;贮藏末期,提取液处理的叶绿素含量分别比蒸馏水和对照处理高65.08%和109.36%。在贮藏初期能够减缓叶绿素的下降,可能是由于提取液浸施使得西兰花短暂模拟了母体上的状态,缓解了叶绿素的分解,使得西兰花保持较好的贮藏品质。
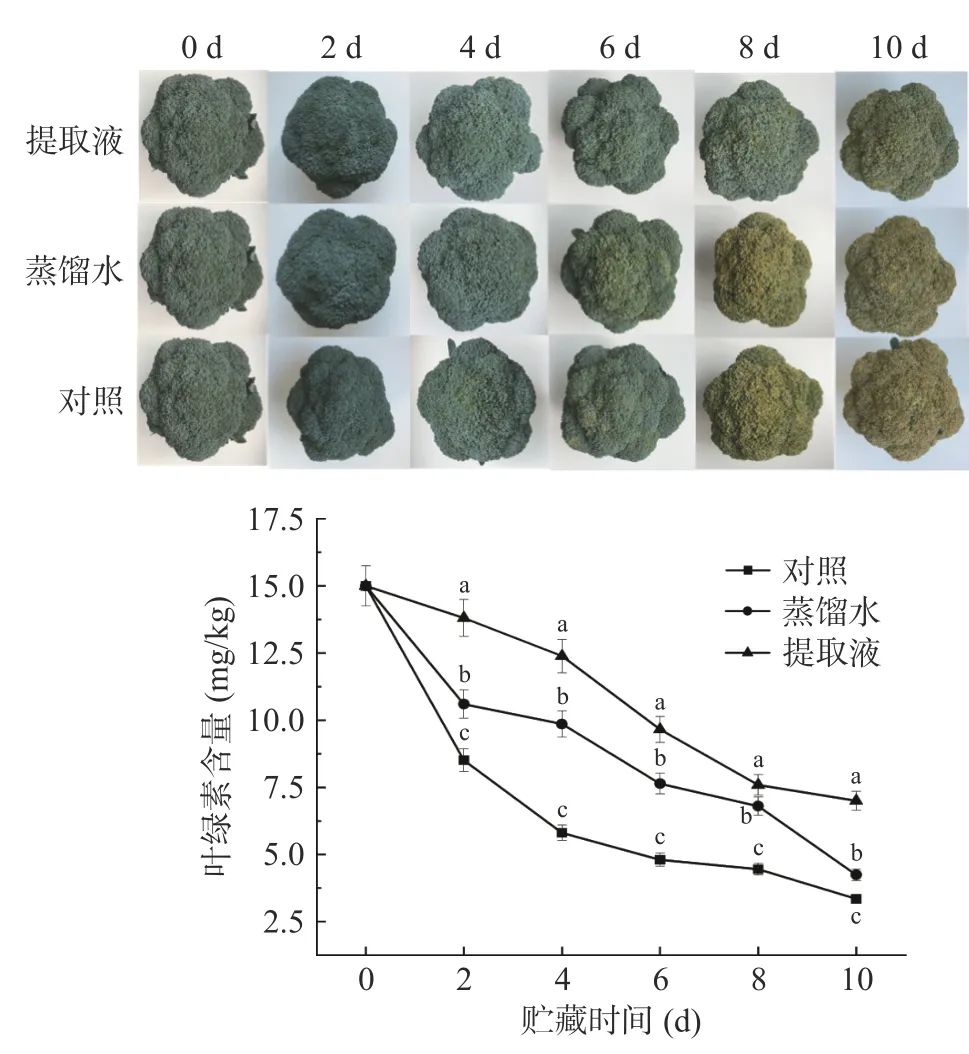
图2 不同处理对西兰花外观和叶绿素含量的影响Fig.2 Effects of different treatments on the appearance and chlorophyll content of broccoli heads
2.3 茎提取液对西兰花含水量及失重率的影响
西兰花含水量的变化能够反映西兰花品质的优劣。如图3A 所示,在整个贮藏期间,所有处理的西兰花含水量均呈下降趋势,但提取液处理明显延缓了西兰花含水量的下降。整个贮藏期间,提取液、蒸馏水和处理的西兰花含水量分别下降了1.68%、2.95%和3.28%。可能是提取液浸施过程中西兰花补充了水分,同时保持原有的营养与激素平衡,使得西兰花在贮藏期间保持水分,抑制水分的散失。
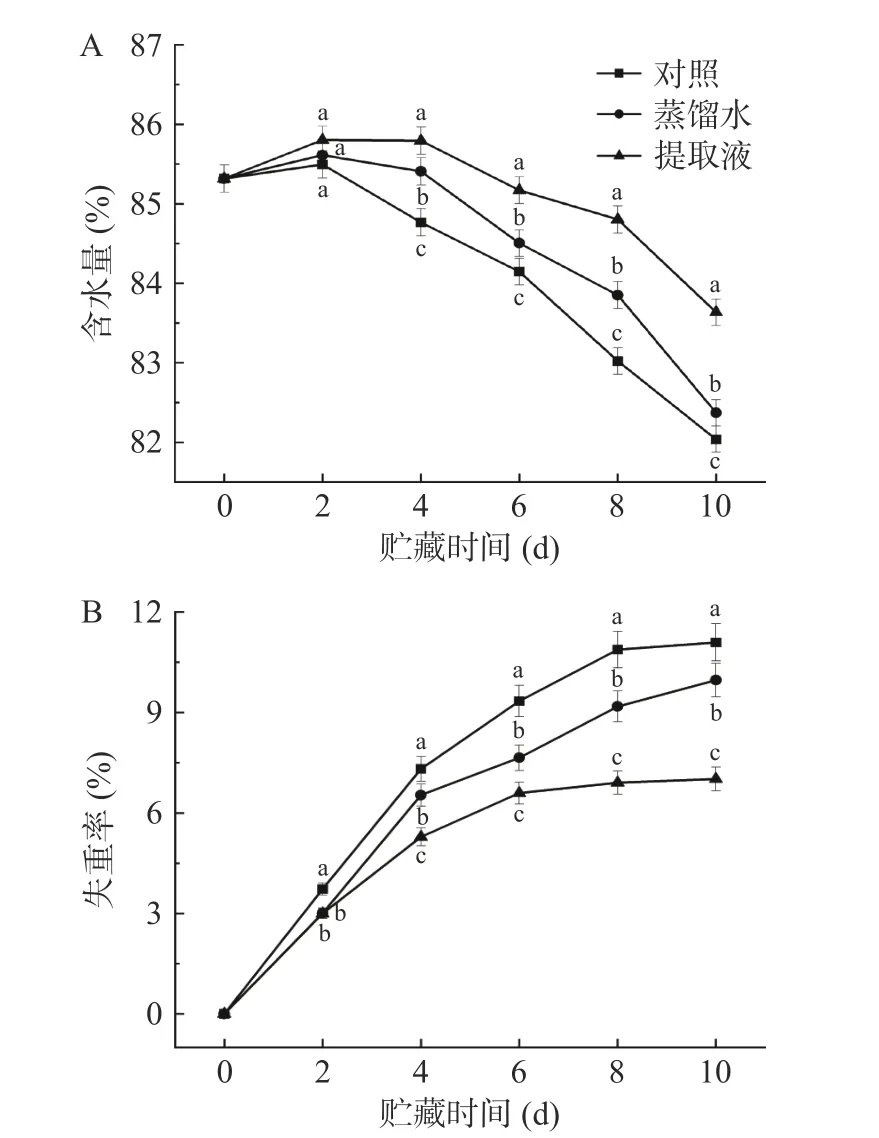
图3 不同处理对西兰花含水量(A)及失重率(B)的影响Fig.3 Effects of different treatments on the water content (A)and weight loss rate (B) of broccoli heads
蒸腾失水和呼吸作用消耗营养物质是导致西兰花质量减少的主要原因,如图3B 所示,在整个贮藏期间,各处理西兰花的失重率均呈上升趋势,但提取液处理明显延缓了上升速率。整个贮藏期间,提取液、蒸馏水和对照处理的西兰花日平均失重率分别为0.71%、0.99%和1.10%;贮藏末期,提取液处理的西兰花失重率仅为蒸馏水和对照处理的70.38%和63.23%。这可能是由于提取液调节了水分的补充,抑制重量的下降。同时提取液抑制了微生物的生长繁殖,保证了西兰花的贮藏品质[27]。另外,保持较高的含水量也是西兰花失重率上升缓慢的另一个原因。
2.4 茎提取液对西兰花MDA 及相对电导率的影响
MDA 含量和相对电导率可以反映西兰花氧化胁迫和膜脂过氧化损伤的程度,以及植物体细胞膜的完整性和通透性[28]。如图4 所示,在整个贮藏期间,各处理的西兰花MDA 含量和相对电导率均呈上升趋势,但提取液处理明显减缓了上升速率,贮藏末期提取液处理的MDA 含量、相对电导率仅为蒸馏水和对照处理的81.85%、70.19%和62.28%、49.93%。说明提取液处理能够在一定程度上减少西兰花的细胞损伤,延缓了伤口处的氧化作用。Cun 等[29]证明大蒜提取物能够保持植物细胞膜的通透性,与本文结果有一定的相似性。
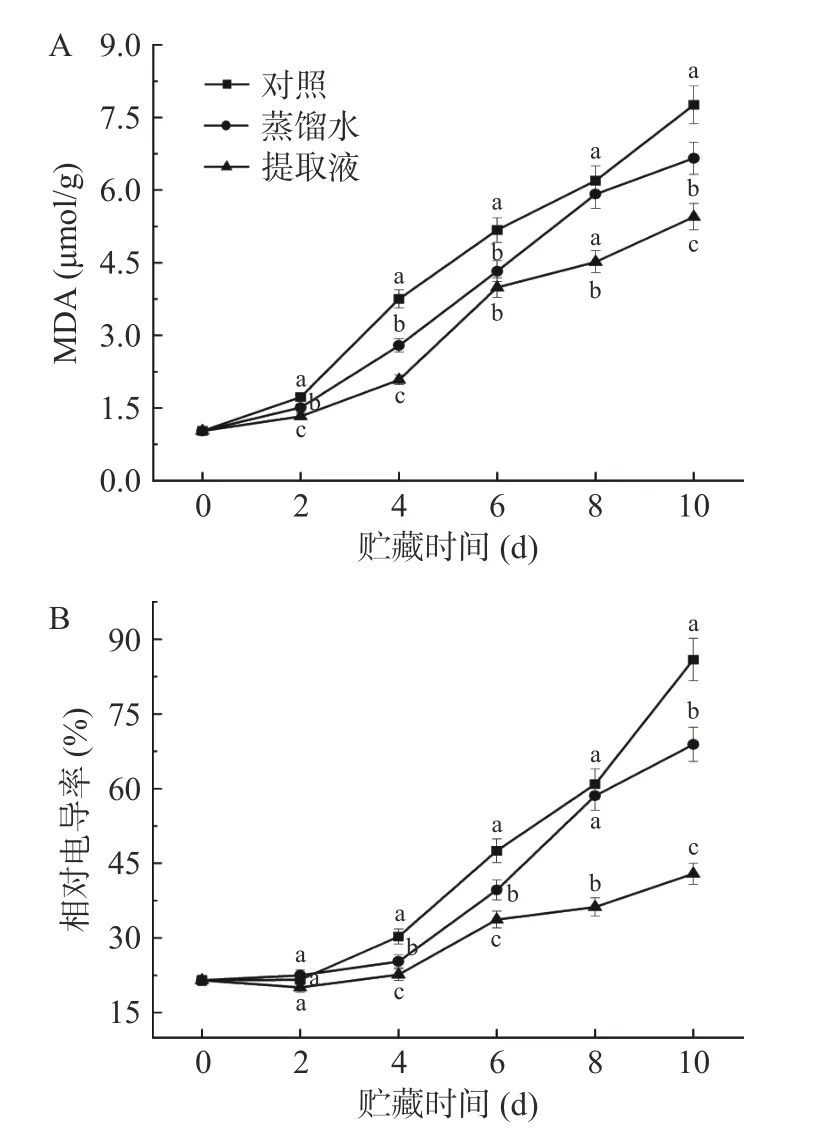
图4 不同处理对西兰花 MDA(A)及相对电导率(B)的影响Fig.4 Effects of different treatments on the MDA content (A)and relative conductivity (B) of broccoli heads
2.5 茎提取液对西兰花VC 含量和TSS 的影响
西兰花VC含量丰富,也是衡量贮藏条件优劣的重要指标[30]。如图5 所示,各处理西兰花的VC含量整体上呈下降趋势,但提取液处理明显延缓了下降速率。提取液、蒸馏水和对照处理的西兰花的VC日平均下降速率分别为4.74%、5.69%和6.73%;贮藏末期,提取液处理的西兰花的VC含量分别比蒸馏水和对照处理高22.04%和60.99%。曾维丽等[31]选用了白菜花提取物对西兰花进行浸泡,也证明提取物处理能够抑制VC含量的下降,与本文研究结果一致。
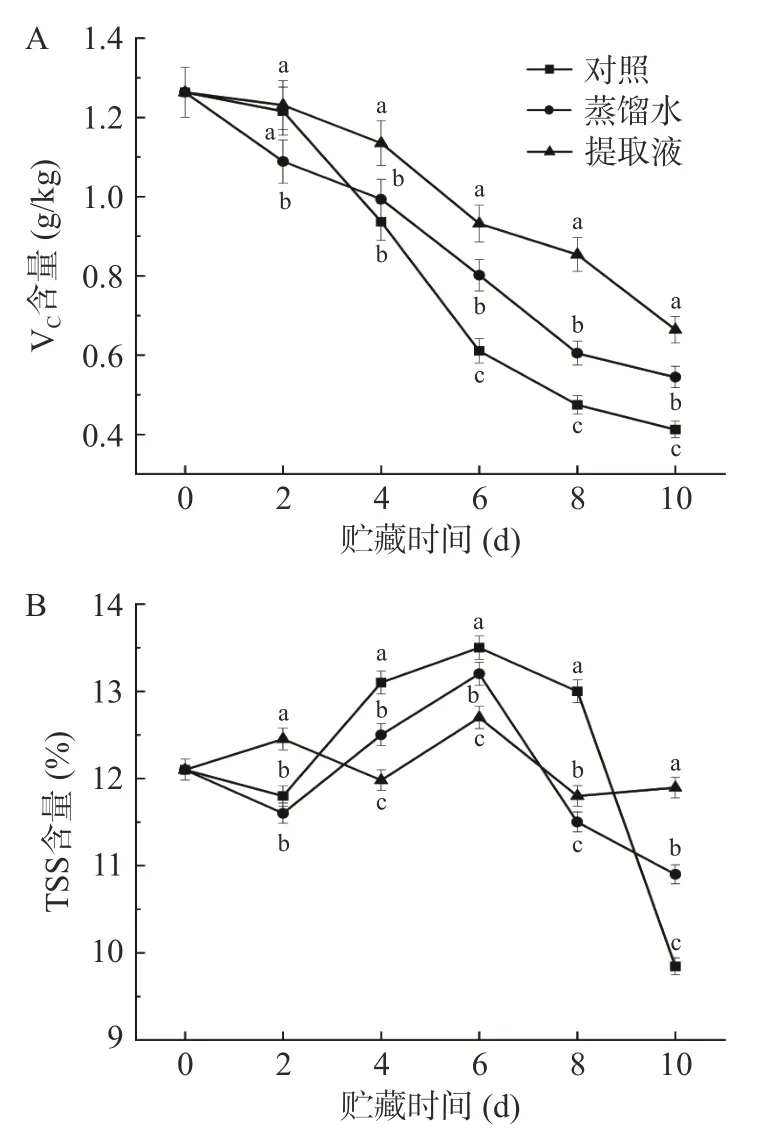
图5 各处理对西兰花 VC 和 TSS 含量的影响Fig.5 Effects of different treatments on the Vc and TSS content of broccoli heads
在整个贮藏过程注对照处理和蒸馏水处理的TSS 含量呈现先上升后下降的趋势,而提取液处理保持了较为稳定的状态。三种处理都在6 d 时出现峰值,其中对照处理最高,达到了13.5%,提取液处理最低,仅为12.7%。随后,对照处理和蒸馏水处理的TSS 含量迅速降低,这可能是由于贮藏后期微生物生长繁殖导致西兰花营养物质含量下降[32],而营养液处理能够在一定程度上抑制微生物的生长繁殖[33]。
2.6 茎提取液对西兰花TA 的影响
TA 对西兰花的风味起着重要的作用,因此贮藏过程中的TA 含量是反应西兰花贮藏品质的重要指标[34]。如图6 所示,各处理均呈现下降趋势。在2 d,各处理TA 含量出现轻微上升,但无显著区别(P>0.05)。随后,各处理TA 含量迅速下降,其中提取液处理保持较高的TA 含量,而对照处理和蒸馏水处理在贮藏6~8 d 时无显著差异(P>0.05)。表明提取液处理能够缓解TA 含量的下降,孙树杰等[8]采用中草药提取液处理西兰花,也证明能够抑制TA 含量的下降。
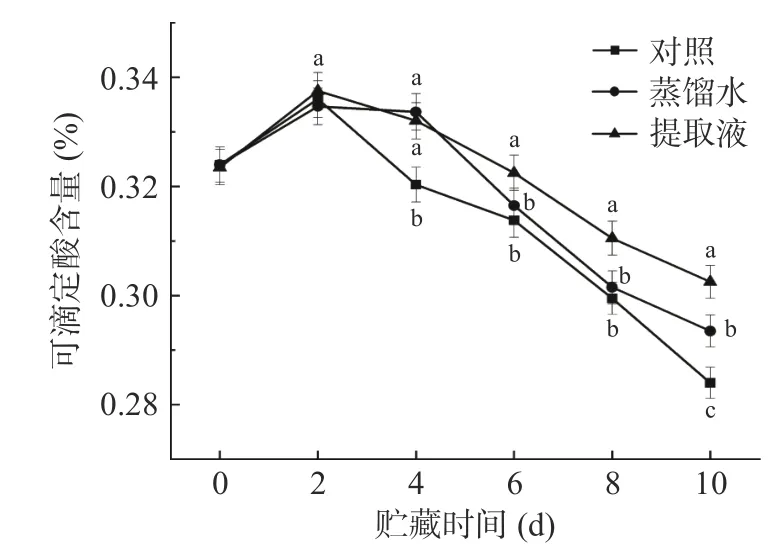
图6 各处理对西兰花 TA 含量的影响Fig.6 Effects of different treatments on the TA content of broccoli heads
3 讨论与结论
本实验主要是借鉴中医“以形补形,以脏补脏”理论[35],利用植物提取液进行果蔬保鲜的一种尝试[36-38]。西兰花采收时正处于快速的生长阶段,切割采收这一操作则打断了西兰花的生长状态,致使花球和茎部分离,从而导致了诸如根部营养供应的中断[39]、激素平衡紊乱[40]、切割造成机械伤害[41]等系列问题。西兰花采收后,能否模拟其生长状态继续供应营养,进而达到保鲜效果,是本文重点研究的目标。
西兰花花茎含有几乎等同花球一样的各种物质[42],其提取液可很好地模拟切割采收后西兰花花球的营养供应。西兰花属于呼吸跃变型果蔬,采后乙烯释放加速,呼吸旺盛,出现呼吸高峰,均呈现先上升后下降的趋势[43]。本实验研究表明,提取液处理能够显著降低乙烯释放速率,抑制呼吸强度,推迟呼吸高峰的出现。
叶绿素含量、失重率及含水量是最能直观表现西兰花质量的指标。通过提取液处理的西兰花叶绿素分解速度得到了明显缓解,也保持了较好的失重率和含水量。这可能是由于提取液使西兰花保持了营养与激素平衡,从而使得西兰花保持较好的贮藏品质。
MDA 含量以及相对电导率的上升,反映出西兰花细胞膜透过率正在逐渐增大。而提取液处理能够维持西兰花细胞膜的透过性,保证西兰花细胞的完整性,从而抑制西兰花的衰老,这可能与提取液为西兰花补充类黄酮物质有关[44]。
而VC保持较高水平说明西兰花有着较高的抗氧化能力,能够抑制氧化衰老,另一方面,TSS 保持较为稳定的水平也能够说明这一问题。在提取液浸施的作用下,TA 含量的下降得到了缓解,亦能说明提取液对于西兰花的保鲜效果。何丽芳等[45]采用芒果皮提取液也能够对巨峰葡萄产生相同的效果。
李盼等[46]通过自制营养液浸施白芦笋的研究结果与本研究类似。但是,本研究中保鲜效果的体现,是提取液中的营养物质起主要作用,还是激素或者其他物质起重要作用,或者是综合作用的结果,需要进一步研究。
本文仅对营养液茎部浸施的保鲜效果进行了初步研究,后续研究中还需进行多方面的考虑,如采后果蔬对提取液的吸收能力[47]、如何防止补偿性保鲜产生的微生物污染[48]、操作的便利性[49]等。尽管如此,本研究提供了一种新的保鲜研究思路供广大研究者参考。总之,本实验证明了西兰花茎提取液能够对西兰花产生较好的保鲜效果,同时实现了西兰花茎的废物利用,充分利用资源的同时提高西兰花的贮藏品质,为西兰花的保鲜方法提供了新的思路和依据。

