靶向GPC3的第4代嵌合体抗原受体慢病毒载体构建及病毒包装滴定
近年来,随着分子生物学、肿瘤免疫学的进展,免疫细胞治疗技术得到快速发展,其中嵌合抗原受体(chimeric antigen receptor,CAR)修饰免疫细胞治疗技术成为肿瘤治疗领域前沿技术之一
,CAR由识别和结合特定抗原的单链抗体可变片段(single-chain variable fragments,scFv)、胞外铰链区、跨膜区和提供增殖和激活信号的结构域(CD28、OX40、41BB和CD3ζ)组成
。CAR修饰的免疫细胞治疗技术是通过转基因技术使其免疫细胞膜表面表达相应肿瘤抗原的抗体,赋予其抗原特异性,可以MHC非限制性的方式杀伤肿瘤细胞,因而一定程度上能克服肿瘤的免疫逃逸
。本实验室前期通过改变CAR的结构域实现了对CAR的部分功能的改善(暂未发表),本研究拟通过加入IL-15/IL-15Rα序列进一步改构CAR分子。IL-15包含一种三聚体受体,由IL-15特异性结合的IL-15Rα、与IL-2共享的IL-15Rβ及γ链(γC)组成。其中,α受体(IL-15Rα)是一种对IL-15亲和力极高的跨膜蛋白,主要由T细胞、NK细胞、不变的自然杀伤T(invariant natural killer T,iNKT)细胞、B细胞、DC、单核细胞和巨噬细胞表达,IL-15需先与IL-15Rα结合后形成IL-15/IL-15Rα复合物
后可以与效应细胞上表达的IL-15Rβ和γ异二聚体结合,进而增强效应细胞的存活和成熟,以促进其杀伤肿瘤细胞的效力
。研究发现,IL-15在多种淋巴细胞,如记忆细胞毒性CD8 T细胞
、NK细胞
、iNKT细胞
的发育、稳态和生理学中发挥着重要作用。IL-15不仅使得CAR基因修饰的免疫细胞在抗原及外源细胞因子刺激下具有记忆表型
,并且还会使免疫抑制性相关受体,如PD-1、LAG-3表达减少,减弱了回输过程中受肿瘤细胞表面PD-L1介导的抑制作用
。Nair等
在实验中进一步证明了在CAR配置中包含IL-15/IL-15Rα的必要性。
我们在靶向GPC3的第2代CAR(GC33-CD28/OX40/41BB-CD3ζ)慢病毒载体基础上构建了含IL-15/IL-15Rα编码基因的第4代CAR的慢病毒表达载体,并探讨其生物学功能优势。磷脂酰肌醇蛋白聚糖3(glypican-3,GPC3)属于硫酸乙酰肝素蛋白多糖家族,该分子通过内部的糖基磷脂酰肌醇锚(glycosylphos-phatidylinositol anchor,GPI)与细胞膜的表面连接,而分子的羧基末端则被硫酸乙酰肝素侧链修饰
。研究
表明,GPC3在70%以上的肝癌组织中表达,在正常成人组织及肝炎、肝硬化、脂肪肝等病理情况下并不表达,是肝细胞癌(hepatocellular carcinoma,HCC)潜在的治疗靶点
,目前靶向GPC3的第2代及第3代CAR-T已经开展了Ⅰ期及Ⅱ期临床试验,其中,Ⅰ期临床试验已经证明了CAR-T的安全性,且HCC的中位无进展生存期与肿瘤中GPC3的表达呈正相关,提示了CAR-T细胞的有效性
。但由于HCC免疫微环境的特异性,在随机Ⅱ期试验中,患者未获得明显临床益处
。本研究拟构建并优化第4代CAR分子,为CAR技术精准靶向治疗肝癌奠定基础。
1 材料与方法
EP是子宫内膜基底层局部增生的良性病变[6]。目前尚不清楚病因和发病机制。可能与炎症、内分泌功能紊乱,特别是雌激素水平过高有关[7]。Kosei等[8]在研究过程中发现孕激素缺乏和局部免疫失衡与严重功能不良的NK细胞对抗病毒和真菌感染导致了过度的子宫内膜细胞增殖和独立息肉的发育。Serhat等[9]认为肥胖是子宫内膜息肉形成的独立危险因素。Korucuoglu等[10]首次在医学文献中研究了HPV对EP发育的可能影响,证明HPV可能在某些EP的发育中起作用。
狐臭柴生长周期通常在每年的4~11月份,早春和深秋冬无法正常提供鲜叶制作神仙豆腐。此外,生长旺盛期的鲜叶由于未合理开发利用,造成资源的浪费。因此,综述了近几十年来国内外有关狐臭柴的研究报道,以期为充分利用及开发生长旺盛期的狐臭柴资源提供参考。
1.3.3 慢病毒滴度鉴定:转染前1 d,将2×10
个/cm
的293T细胞种于12孔板中,随后将3个转染组收集得到的慢病毒原液用细胞培养基分别进行不同比例稀释后以制备病毒滴度测定工作液,并感染293T细胞。感染前,收集3个未感染培养孔的293T细胞并计数,求每个孔的平均细胞数,作为病毒感染的起始细胞数。感染48 h后,流式细胞术检测各组CAR表达率,使用Lowjo软件进行分析,根据CAR
细胞比例及感染前起始293T细胞数目估计病毒滴度,选取CAR
293T细胞比例为10%~15%组的稀释倍数进行病毒滴度计算。计算公式为:病毒滴度(TU/ml)=感染前起始293T细胞数×CAR
293T细胞比例×稀释倍数。
1.1.2 试剂:DNA凝胶回收试剂盒(北京天根有限公司,货号DP209)、质粒提取试剂盒(美国ThermoFisher公司,货号K0481),Xba Ⅰ、Sal Ⅰ内切酶(日本TaKaRa公司,货号1080A及1093A)、DNA连接试剂盒(日本TaKaRa,货号6022),Lipofectamine 3000试剂盒(美国Invitrogen公司,货号2332077),DMEM 高糖培养基、胰酶及胎牛血清(美国Gibco公司),anti-Strep-tag Ⅱ抗体(南京金斯瑞生物科技有限公司,货号A01732)。
另根据史料记载⑦核俊哲:《福建海上丝绸之路泉州港与出土货币》,载于张忠山主编《中国丝绸之路货币》,兰州:兰州大学出版社,1999年。,在宋朝,还曾因大量的钱币外流而引起国内的钱荒,以至宋哲宗不得不下令禁止钱币外流,但法禁虽严,商人贪利,钱币外流之弊卒不可禁,直到北宋快亡之际,钱荒局面仍未改变。这些钱币的外流是古代中国影响力之广的见证,是古代中国当时经济实力、贸易实力强盛的真实写照。
1.2.2 目的片段与载体的线性化:分别将上述合成的第4代GC33-CAR的基因片段与慢病毒表达载体pCDH以Xba Ⅰ、Sal Ⅰ为限制性酶切位点进行双酶切。酶切完成后取出样品加入0.75%琼脂糖凝胶电泳上样孔中,70 V电泳鉴定并回收,最后采用DNA连接试剂盒将上述3个第4代CAR分子与线性化的pCDH连接,即得到3个第4代pCDH-GC33-CAR慢病毒表达载体。


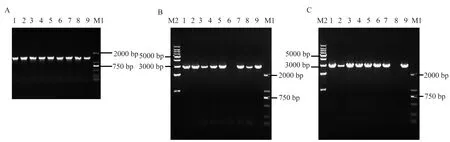
1.2.4 阳性克隆的筛选与鉴定:观察对照组的固体LB平板,确认未孵育出克隆后,挑取各组单克隆进行摇菌,经10 h扩增培养后,pCDH-GC33-41BB-T2A-IL15连接组以F-15-2/R-15-2为引物,另外两组则均以F-5-1/R-15-2为引物进行菌落PCR,DNA凝胶电泳确认阳性后,分别取对应菌液送至上海捷瑞生物有限公司测序。
1.2.3 重组慢病毒载体转化:于-80 ℃冰箱中取出 DH5α 感受态细胞,置于冰上解冻,之后分别将上述3组及空白对照组连接产物取出加入100 μl感受态细胞DH5α菌中,冰浴30 min,42 ℃热激45 s,冰浴3 min,随后加入100 μl未添加抗生素的LB液体培养基,置于37 ℃摇床内200 r/min,孵育2 h后取出,加入200 μl Amp
-LB液体培养基,混匀后铺于Amp
-LB固体培养基上,倒置过夜。
(三)丰富互动形式。在应用互动教学模式促进高中生物课堂教学的优化时,师生互动是较为常见的一种互动模式,教师通过由浅入深的问题作为引线,以此促成师生间的互动。但单纯的师生互动对于高中生物课堂教学的优化效果并不十分明显,要培养学生在生物课堂中自主探究的能力,还需在师生互动的基础上,丰富互动形式,通过生生互动促进高中生物课堂教学的优化。
1.2.1 第4代anti-GPC3-CAR构建:已经构建的第2代CAR基因片段结构如图1A所示,基于2A的多肽策略,分别在3个携带不同共刺激因子(CD28/OX40/41BB)的第2代CAR慢病毒表达载体基础上连接人源化IL-15/IL-15Rα序列(见图1B):(1)首先以2代CAR慢病毒载体为模板,F-5-1/R-5-1为引物,PCR扩增分别得出GC33-CD28-CD3ζ、GC33-OX40-CD3ζ及GC33-41BB-CD3ζ的基因片段,即Q1、Q2、Q3;(2)以15-2A-3为模板,F-15-2/R-15-2为引物,PCR扩增得出人源化IL-15/IL-15Rα序列片段Q4;(3)Q1、Q2、Q3分别与Q4经DNA凝胶电泳回收后作为模板,以F-5-1/R-15-2为引物进行搭桥PCR,经DNA凝胶电泳确认连接成功,PCR所用引物如表1所示。
1.3.1 293T细胞培养:在37 ℃水浴锅中复苏293T细胞,于10 cm培养皿中采用高糖DMEM+10%FBS培养基,在37 ℃,体积分数为5% CO
的孵箱中培养。
1.3.2 慢病毒包装:选择处于对数生长期的293T细胞以一定数量接种于T25培养瓶中。待细胞生长至 70%汇合度时进行转染,转染前4 h换液。将实验分为4组,分别为pCDH-GC33-CD28-T2A-IL15、pCDH-GC33-OX40-T2A-IL15、pCDH-GC33-41BB-T2A-IL15及未转染组。根据质粒抽提试剂盒说明书提取质粒DNA,-20 ℃保存。参考Lipofectamine
3000说明书如下方法配置试剂:(1)转染组操作:每组分别准备两个EP管,在每组的EP1管中加入375 μl Opti-MEM及21.5 μl的Lipofectamine
3000并混匀,每组的EP2管中加入375 μl Opti-MEM,2.5 μg的表达质粒,1.875 μg psPAX2,0.625 μg PMD2.G,25 μl P3000
并混匀,将每组稀释后的质粒溶液EP2加入到稀释后的含Lipofectamine
3000的EP1中并混匀,孵育 15 min后形成DNA-Lipofectamine
3000复合物;(2)将混合液逐滴加入到待转染的T25瓶中,转染6 h后换液,转染48 h后分别收集培养上清,800
离心10 min,用0.45 μm的滤器将其过滤后-80 ℃保存。
1.1.3 质粒及细胞:第2代pCDH-GC33-CAR慢病毒表达载体、质粒pCDH、PMD2.G、psPAX2及293T细胞由本实验室保存。通过SnapGene软件在第2代CAR基因序列两端设计引物F-5-1/R-5-1,人源化含IL-15序列的质粒(15-2A-3)及其相关引物均由上海捷瑞生物有限公司合成。
1.1.1 仪器:生物安全柜(苏净安泰)、低温超速离心机(Beckman)、恒温摇床(培英THZ-C)、CO
恒温细胞培养箱(Thermo)、流式细胞仪(BD公司)、电泳仪、PCR仪及凝胶成像仪(Biorad)、数字型干式加热器(BioCote)、全电动倒置荧光显微镜(Nikon)等。
2 结果
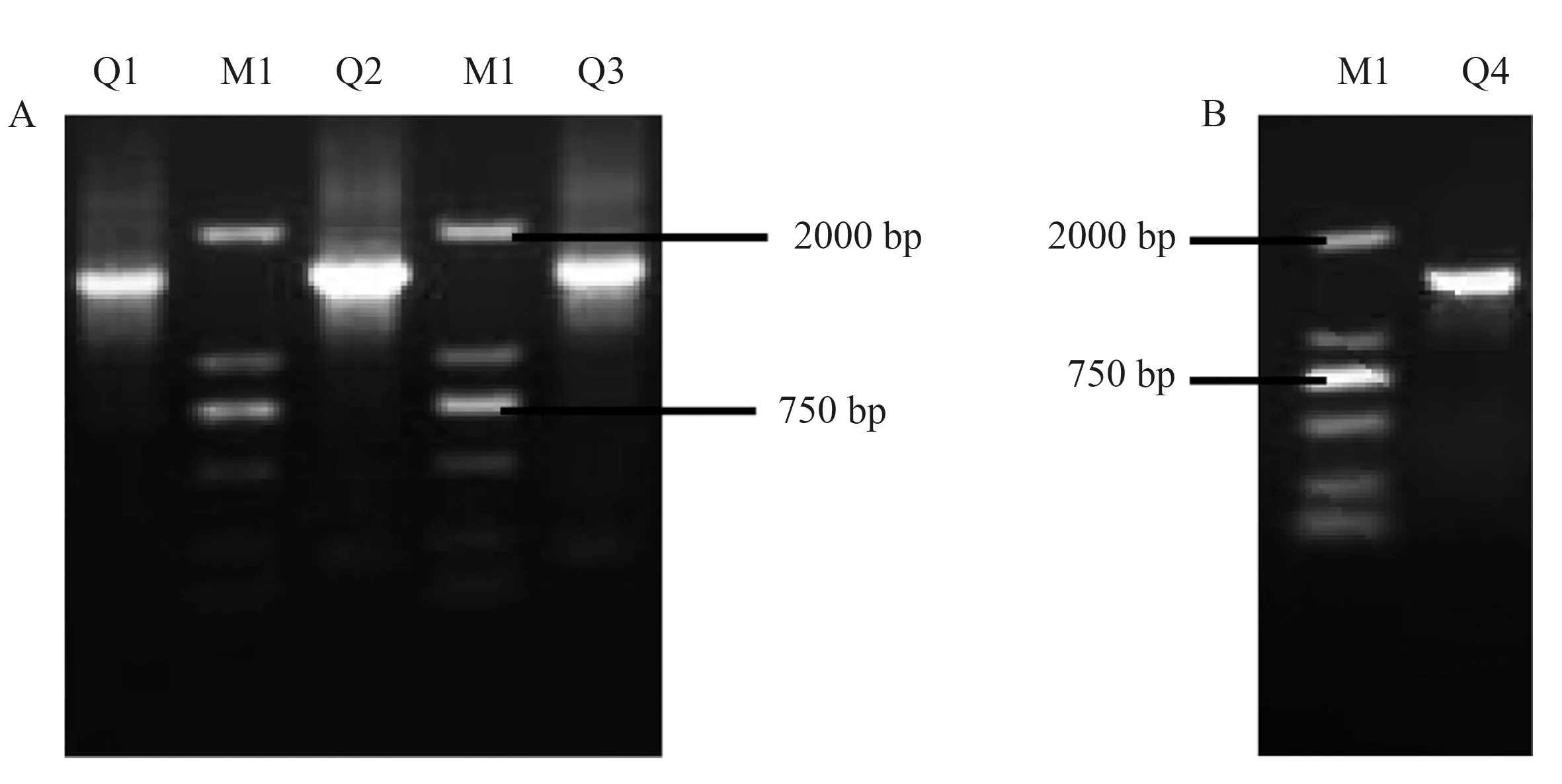
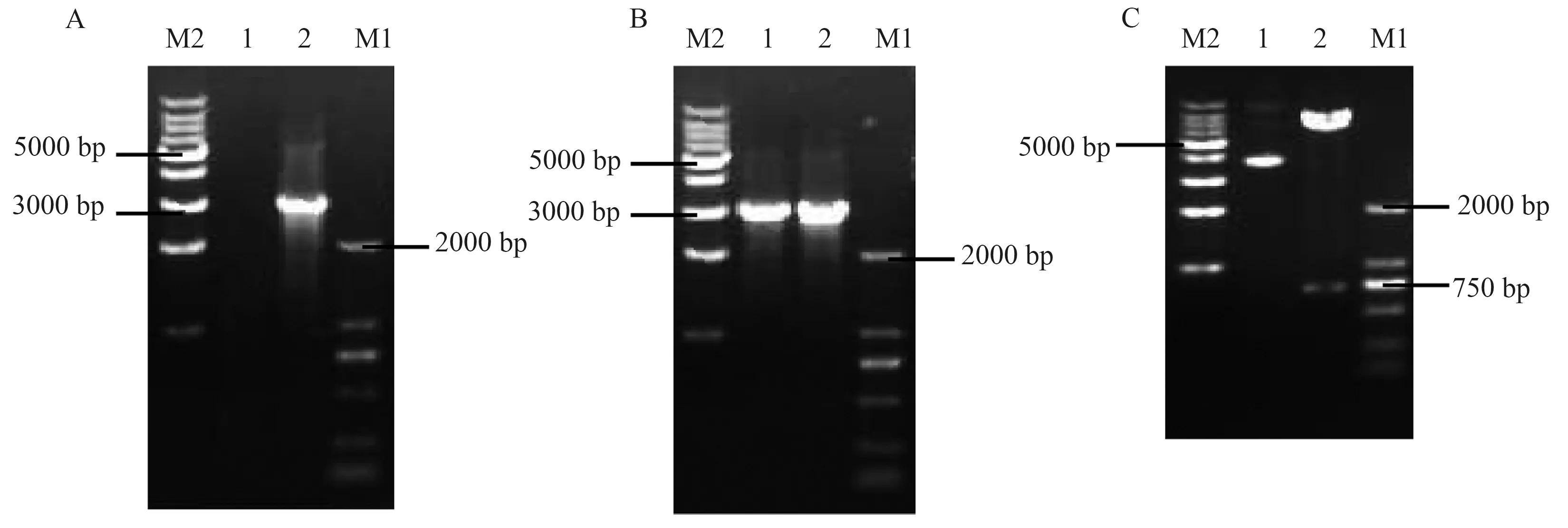
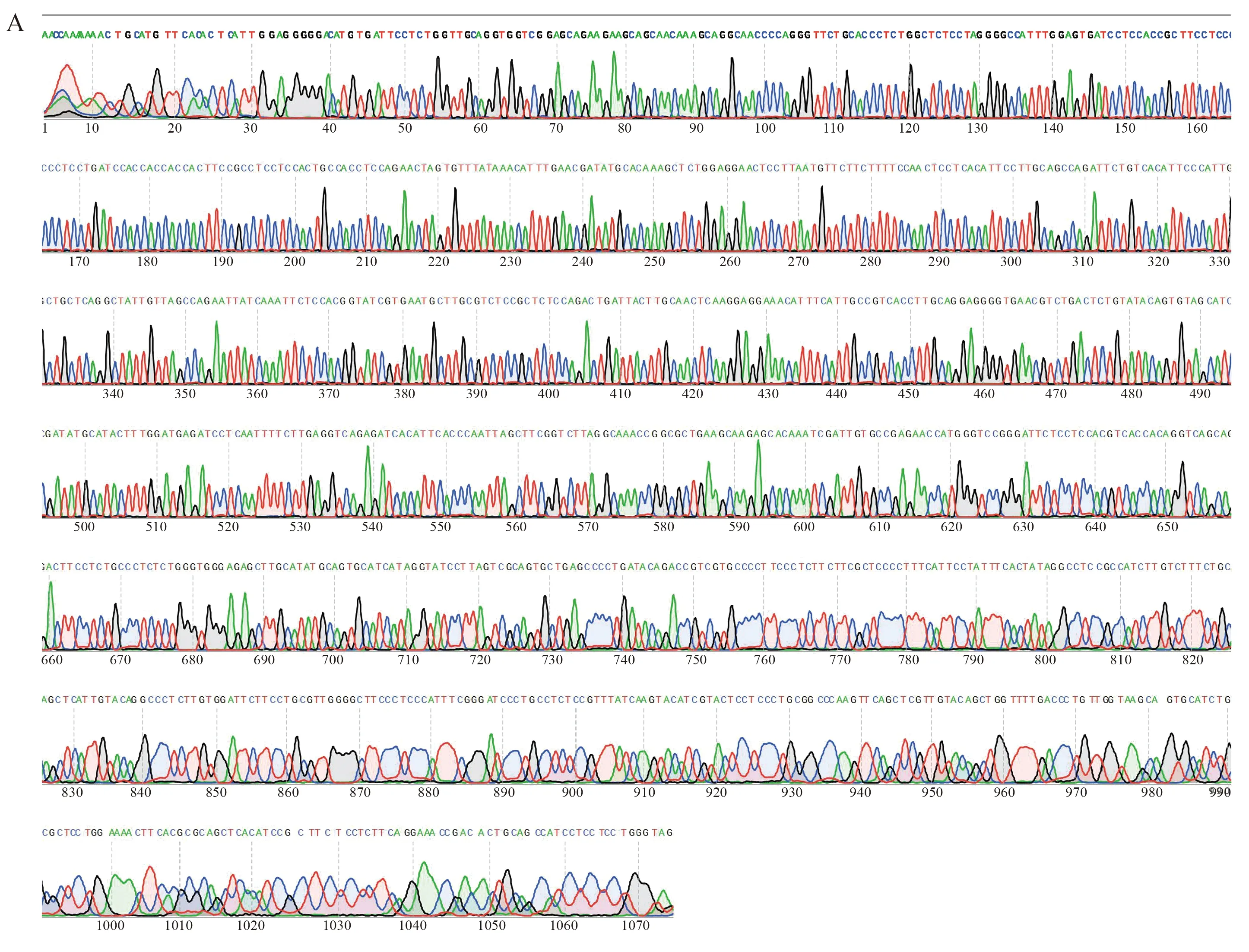
分别以靶向GPC3的第2代CAR慢病毒表达载体为模板,扩增获得Q1~Q3序列,进行 0.75%琼脂糖核酸凝胶电泳鉴定,结果显示,扩增产物DNA片段大小分别在1 359 bp、1 344 bp及1 344 bp左右有目的条带,与预期一致(见图2A)。人源化IL-15/IL-15Rα基因片段经PCR扩增得到DNA产物在1 389 bp左右有目的条带,与预期一致(见图2B),运用搭桥PCR技术分别将Q1、Q2、Q3与Q4拼接,核酸电泳结果提示分别在2 896 bp、2 881 bp及2 881 bp左右有目的条带,与预期一致(见图3A~3B)。上述连接产物双酶切后分别插入经XbaⅠ、SalⅠ限制性内切酶剪切的慢病毒表达载体PCDH中(见图3C),经转化、摇菌、菌落PCR(见图4)及测序验证(见图5),将构建的第4代CAR表达载体与设计的CAR基因序列比对,结果完全一致,提示成功构建了3个第4代CAR慢病毒表达载体(见图6)。
市场经济是逐利经济,市场经济主体的首选必然是利益。市场经济是中国迅猛发展的内在动力,必须承认并激发人们的追求经济利益和其他正当社会利益的合理性。民办高校的工作收入明显地低于公办院校。更多地追求经济利益导致民办高校教职员工的离职率较高。民办高校党建要求党员更多地为了国家的整体利益、院校的整体长远利益做出必要的牺牲。两者之间必然形成矛盾。寻求一种既努力提高党员自觉的党的意识、党员意识、大局意识、奉献意识、先锋意识,也合理保障民办高校党员业务能力发展、工作收入提高的办法现实至关重要。
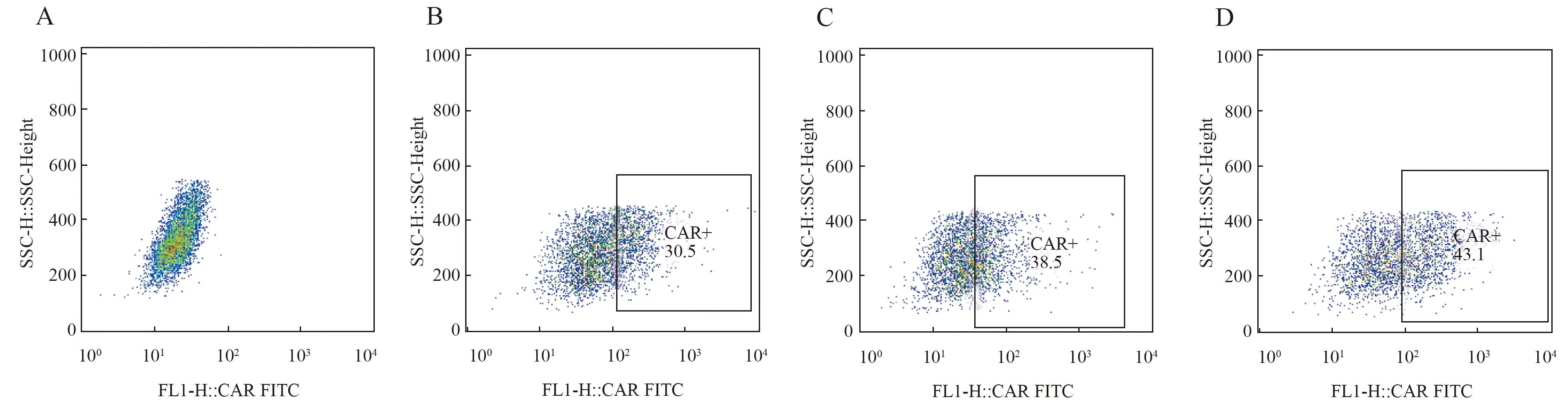
3组重组质粒分别与包装质粒共转染293T细胞,48 h后显微镜下可见细胞生长良好,流式细胞术检测转染效率(见图7),收集病毒进行滴度测定,经计算,慢病毒滴度为(1.84~3.41)×10
TU/ml(见图8)。

3 讨论
基于CAR基因修饰的免疫细胞疗法目前已成为肿瘤免疫治疗中最具有吸引力的疗法,具有以下优势:(1)抗原特异性:能够直接靶向肿瘤细胞表面;(2)自体来源:与靶向药物相比,不良反应少; (3)效率高:该基因修饰的免疫细胞不仅具有CAR依赖性的肿瘤杀伤能力,同时CAR共刺激分子的组合可以增强免疫细胞的自身抗肿瘤活性,为一些常规治疗失败的患者带来了希望。目前第2代乃至第3代CAR-T疗法已在多系统肿瘤,包括急性淋巴细胞白血病
、神经母细胞瘤
及HCC
治疗中广泛研究,其中第2代CAR-T细胞在治疗血液系统肿瘤中疗效显著
,然而CAR-T细胞在治疗实体性肿瘤包括神经母细胞瘤及HCC方面,疗效不明显,研究认为这与实体性肿瘤的微环境难以攻破、CAR-T细胞难以正常发挥杀伤肿瘤细胞相关
:(1)血液系统恶性肿瘤的肿瘤细胞存在于全身的循环血液中,肿瘤抗原CD19/20在患者体内几乎所有的肿瘤细胞中均表达,CAR-T细胞一经回输即可看到治疗效果。而在实体肿瘤中,CAR-T细胞首先需到达肿瘤细胞表面,由于CAR-T细胞渗透性弱,能够到达肿瘤部位且能发挥作用的细胞极少;(2)肝癌细胞表面缺乏T细胞募集所必需的关键趋化因子,如趋化因子受体CXCR2、CCL21
或IL-15
等,使得T细胞难以到达并进入肿瘤发挥杀伤作用;(3)由缺氧、酸中毒、营养缺乏、多种免疫抑制性受体,如PD-1高表达的免疫抑制微环境影响了CAR-T的生存及浸润能力,从而降低了CAR-T细胞介导的抗肿瘤作用
。
第4代CAR在第2代CAR的基础上,整合免疫调节因子包括IL-12
、IL-15
等以改善肿瘤微环境。通过阅读文献,我们发现,IL-15在多种淋巴细胞的发育、稳态和生理学中发挥着重要作用。且DC细胞表面表达IL-15Ra受体,可以提呈IL-15信号促进效应细胞,包括T细胞及iNKT细胞成熟与活化
。Xu等
发现,IL-15不仅可以保护肿瘤微环境受缺氧刺激的iNKT细胞,增强其抗肿瘤活性,而且可以促使iNKT细胞向肿瘤部位迁移。Cieri等
则证实IL-15的加入可以使CAR修饰的免疫细胞克服肿瘤微环境的限制,明显提高效应功能。本研究通过分子克隆技术将IL-15/IL-15Rα融合蛋白构建到CAR载体,在靶向GPC3的第2代CAR慢病毒载体基础上构建了第4代CAR的慢病毒载体。通过慢病毒包装生产出含有4代CAR载体的慢病毒,通过病毒滴定显示目前包装系统和产毒滴度稳定。由于不同共刺激分子的组合对同种底盘细胞的影响不同,相同的共刺激分子对不同的底盘细胞影响也不同。我们将进一步对CAR元件进行组合的优化,后续将其转染不同的底盘细胞,包括T细胞、iNKT细胞等,为后续生物学实验奠定基础。
[1]Pang Y, Hou X, Yang C, et al. Advances on chimeric antigen receptor-modified T-cell therapy for oncotherapy [J]. Mol Cancer, 2018, 17(1): 91. DOI:10.1186/s12943-018-0840-y.
[2]Guedan S, Calderon H, Posey Jr AD, et al. Engineering and design of chimeric antigen receptors [J]. Mol Ther Methods Clin Dev, 2019, 12: 145-156. DOI: 10.1016/j.omtm.2018.12.009.
[3]Nishida T, Kataoka H. Glypican 3-targeted therapy in hepatocellular carcinoma [J]. Cancers (Basel), 2019, 11(9): 1339. DOI: 10.3390/cancers11091339.
[4]Waldmann TA. The shared and contrasting roles of IL2 and IL15 in the life and death of normal and neoplastic lymphocytes: implications for cancer therapy [J]. Cancer Immunol Res, 2015, 3(3): 219-227. DOI: 10.1158/2326-6066.CIR-15-0009.
[5]Watkinson F, Nayar SK, Rani A, et al. IL-15 upregulates telomerase expression and potently increases proliferative capacity of NK, NKT-Like, and CD8 T cells [J]. Front Immunol, 2020, 11: 594620. DOI: 10.3389/fimmu.2020.594620.
[6]Waldmann TA, Miljkovic MD, Conlon KC. Interleukin-15 (dys) regulation of lymphoid homeostasis: implications for therapy of autoimmunity and cancer [J]. J Exp Med, 2020, 217(1): e20191062. DOI: 10.1084/jem.20191062.
[7]Castillo EF, Acero LF, Stonier SW, et al. Thymic and peripheral microenvironments differentially mediate development and maturation of iNKT cells by IL-15 transpresentation [J]. Blood, 2010, 116(14): 2494-2503. DOI: 10.1182/blood-2010-03-277103.
[8]Cieri N, Camisa B, Cocchiarella F, et al. IL-7 and IL-15 instruct the generation of human memory stem T cells from naive precursors [J]. Blood, 2013, 121(4): 573-584. DOI: 10.1182/blood-2012-05-431718.
[9]Xu Y, Zhang M, Ramos CA, et al. Closely related T-memory stem cells correlate with in vivo expansion of CAR.CD19-T cells and are preserved by IL-7 and IL-15 [J]. Blood, 2014, 123(24): 3750-3759. DOI: 10.1182/blood-2014-01-552174.
[10]Dadi S, Chhangawala S, Whitlock BM, et al. Cancer immunosurveillance by tissue-resident innate lymphoid cells and innate-like T cells [J]. Cell, 2016, 164(3): 365-377. DOI: 10.1016/j.cell.2016.01.002.
[11]Nair S, Wang JB, Tsao ST, et al. Functional improvement of chimeric antigen receptor through intrinsic interleukin-15Rα signaling [J]. Curr Gene Ther, 2019, 19(1): 40-53. DOI: 10.2174/1566523218666181116093857.
[12]Filmus J, Selleck SB. Glypicans: proteoglycans with a surprise [J]. J Clin Invest, 2001, 108(4): 497-501. DOI: 10.1172/JCI200113712.
[13]Zhou F, Shang W, Yu X, et al. Glypican-3: a promising biomarker for hepatocellular carcinoma diagnosis and treatment [J]. Med Res Rev, 2018, 38(2): 741-767. DOI: 10.1002/med.21455.
[14]Ho M, Kim H. Glypican-3: a new target for cancer immunotherapy [J]. Eur J Cancer, 2011, 47(3): 333-338. DOI: 10.1016/j.ejca.2010.10.024.
[15]Ikeda M, Ohkawa S, Okusaka T, et al. Japanese phase I study of GC33, a humanized antibody against glypican-3 for advanced hepatocellular carcinoma [J]. Cancer Sci, 2014, 105(4): 455-462. DOI: 10.1111/cas.12368.
[16]Abou-Alfa GK, Puig O, Daniele B, et al. Randomized phase Ⅱ placebo controlled study of codrituzumab in previously treated patients with advanced hepatocellular carcinoma [J]. J Hepatol, 2016, 65(2): 289-295. DOI: 10.1016/j.jhep.2016.04.004.
[17]Cao Y, Lu W, Sun R, et al. Anti-CD19 chimeric antigen receptor T cells in combination with nivolumab are safe and effective against relapsed/refractory B-cell non-hodgkin lymphoma [J]. Front Oncol, 2019, 9: 767. DOI: 10.3389/fonc.2019.00767.
[18]Yu J, Wu X, Yan J, et al. Anti-GD2/4-1BB chimeric antigen receptor T cell therapy for the treatment of Chinese melanoma patients [J]. J Hematol Oncol, 2018, 11(1): 1. DOI: 10.1186/s13045-017-0548-2.
[19]Shi D, Shi Y, Kaseb AO, et al. Chimeric antigen receptor-Glypican-3 T-cell therapy for advanced hepatocellular carcinoma: results of phase I trials [J]. Clin Cancer Res, 2020, 26(15): 3979-3989. DOI: 10.1158/1078-0432.Ccr-19-3259.
[20]Sheridan C. First approval in sight for Novartis' CAR-T therapy after panel vote [J]. Nat Biotechnol, 2017, 35(8): 691-693. DOI: 10.1038/nbt0817-691.
[21]Waaijer SJ, Giesen D, Ishiguro T, et al. Preclinical PET imaging of bispecific antibody ERY974 targeting CD3 and glypican 3 reveals that tumor uptake correlates to T cell infiltrate [J]. J Immunother Cancer, 2020, 8(1): e00548. DOI: 10.1136/jitc-2020-000548.
[22]Luo H, Su J, Sun R, et al. Coexpression of IL7 and CCL21 increases efficacy of CAR-T cells in solid tumors without requiring preconditioned lymphodepletion [J]. Clin Cancer Res, 2020, 26(20): 5494-5505. DOI: 10.1158/1078-0432.Ccr-20-0777.
[23]Liu G, Rui W, Zheng H, et al. CXCR2-modified CAR-T cells have enhanced trafficking ability that improves treatment of hepatocellular carcinoma [J]. Eur J Immunol, 2020, 50(5): 712-724. DOI: 10.1002/eji.201948457.
[24]Chen Y, Sun C, Landoni E, et al. Eradication of neuroblastoma by T cells redirected with an optimized GD2-specific chimeric antigen receptor and interleukin-15 [J]. Clin Cancer Res, 2019, 25(9): 2915-2924. DOI: 10.1158/1078-0432.Ccr-18-1811.
[25]Yong CSM, Dardalhon V, Devaud C, et al. CAR T-cell therapy of solid tumors [J]. Immunol Cell Biol, 2017, 95(4): 356-363. DOI: 10.1038/icb.2016.128.
[26]Liu Y, Di S, Shi B, et al. Armored inducible expression of IL-12 enhances antitumor activity of Glypican-3-targeted chimeric antigen receptor-engineered T cells in hepatocellular carcinoma [J]. J Immunol, 2019, 203(1): 198-207. DOI: 10.4049/jimmunol.1800033.
[27]Xu X, Huang W, Heczey A, et al. NKT cells coexpressing a GD2-specific chimeric antigen receptor and IL15 show enhanced in vivo persistence and antitumor activity against neuroblastoma [J]. Clin Cancer Res, 2019, 25(23): 7126-7138. DOI: 10.1158/1078-0432.Ccr-19-0421.

