氧化锰脱硫剂中活性组分锰、铁含量的测定
李艳荣
中国石化南京化工研究院有限公司,江苏南京210048
目前,在用的氧化锰脱硫剂大多是以活性组分MnO2、金属氧化物和助剂混合均匀,然后向混合物中加水混碾均匀后成型为条状或片状。将成型后的混合物烘干,然后将烘干后的混合物在200~550℃空气条件下焙烧2~6 h,得到氧化锰脱硫剂[1],其主要成分是Fe2O3和MnO2,使用前需要在加氢工艺中还原成具有脱硫活性的Fe3O4和MnO[2]。氧化锰脱硫剂作为一种转化吸收型双功能脱硫剂,不但能脱除H2S,还能将有机硫热解而有效脱除,因而被广泛应用于脱除天然气、油田气和焦炉气等气体中的硫化物。锰作为过渡金属,具有多种的价态和丰富的氧化物形式,锰的低价氧化物具有转化和吸收有机硫的特性,再添加的Fe2O3等活性组分可将硫合成、转化而加以吸收,脱硫条件温和、脱硫成本低,且原料易得,具有良好的热稳定性和再生性能,适用温度范围广、硫化反应速度快,对有机硫的转化率(除噻吩)及无机硫的吸收率都比较高,具体方程式[3]见(1)~(5)。
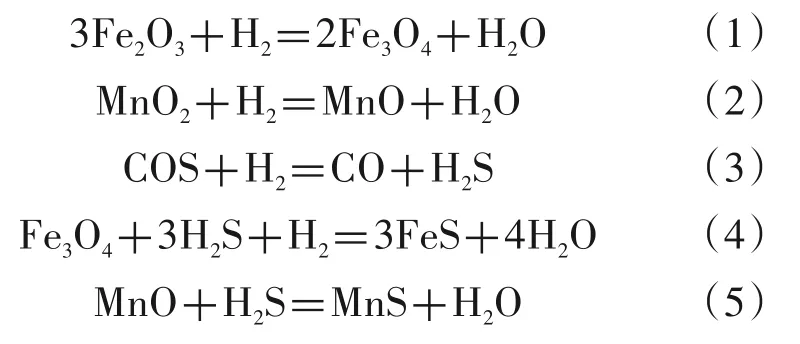
与氧化铁脱硫剂相比,氧化锰脱硫剂的硫容要大1倍以上;与氧化锌脱硫剂的硫容相当,而价格只有氧化锌脱硫剂的1/4。它的化学元素成分组成是催化剂的核心技术参数,其活性组分MnO2和Fe2O3质量分数直接决定了催化剂的反应性能与选择性。
目前国内四川天一科技股份有限公司、华烁科技股份有限公司等生产该类催化剂,因此分别取这两厂家的氧化锰脱硫剂进行含量的测定,标记为样品1和样品2。
锰的测定有亚砷酸钠(NaAsO2)-亚硝酸钠(NaNO2)滴定法[4]、硫酸亚铁铵((NH4)2Fe(SO4)2)氧化还原滴定法[5]和高碘酸钾(KIO4)氧化光度法[6]等。前2种方法适用于高含量锰的测定,后一种用于微量锰的测定。而氧化锰脱硫剂中的锰含量高达20%以上,且NaAsO2-NaNO2滴定法中用到的NaAsO2是受严格管制的有毒化学品,故采用(NH4)2Fe(SO4)2氧化还原滴定法作为锰质量分数的测定方法。
铁的测定方法有很多,主要为滴定法和光度法[7]。前者适用于铁含量高的试样,后者适用于铁含量低或微量铁的试样。氧化锰脱硫剂中铁含量10%以上,宜采用滴定法。滴定法又分为采用氯化亚锡或金属铋为还原剂的K2Cr2O7法[8]和配位化合滴定乙二胺四乙酸二钠(EDTA)法。K2Cr2O7法具有简便、准确、可靠的特点,其缺点是使用汞盐和铬盐等有毒试剂。另外,采用二苯胺类指示剂时,常显示出较大的指示剂空白值,而且这类指示剂空白值与指示剂用量、滴定溶液加入速度、被滴定物质浓度及滴定时间等多种因素有关,故不能单纯通过做空白试验加以校正。要较好地消除指示剂空白值的影响,需要用含量与分析试样相近的标准试样或标准溶液在同样条件下标定K2Cr2O7,这样就会增加很多工作量。而配位化合滴定EDTA法是快速法,无毒害,准确度和精密度均能满足氧化铁脱硫剂生产要求,所以拟采用配位化合滴定EDTA法作为铁质量分数的测定方法。
1 试验部分
1.1 主要试剂
水为《GB/T 6682—2016分析实验室用水规格和试验方法》规定的三级水;磷酸(H3PO4)、过硫酸铵((NH4)2S2O8)都是分析纯试剂。
分别配制硫磷混酸溶液,硫酸、磷酸和水三者体积比为2∶5∶3;H2O2溶液,H2O2和水的体积比为1∶9;盐酸溶液,盐酸和水的体积比为1∶1。
分别配制AgNO3溶液(10 g/L)、氯乙酸溶液(200 g/L)、(NH4)2S2O8溶液(200 g/L)、磺基水杨酸溶液(200 g/L)。
配制N-苯基邻氨基苯甲酸指示液(2 g/L):称取N-苯基邻氨基苯甲酸0.20 g,溶于100 mL Na2CO3溶液(2 g/L)中,搅匀后即得。
(NH4)2Fe(SO4)2标准滴定溶液、EDTA标准滴定溶液按照《GB/T 601—2016化学试剂标准滴定溶液的制备》配制,c[(NH4)2Fe(SO4)2]=0.1 mol/L,c(EDTA)=0.02 mol/L。
以上试剂均采购于西陇化工股份有限公司。
1.2 测定原理
试料用硫磷混酸溶液溶解后,AgNO3为催化剂,用(NH4)2S2O8将锰氧化成HMnO4,以N-苯基邻氨基苯甲酸为指示剂,用HMnO4标准溶液滴定[9]。
在溶液pH约2、温度为50~70℃条件下,以磺基水杨酸为指示剂,用配位化合滴定EDTA试料溶液中的Fe3+,Fe2+预先用(NH4)2S2O8氧化为Fe3+后被络合滴定[10]。
1.3 试验方法
1.3.1 试样制备
将实验室样品混合均匀,用四分法分取约40 g,在陶瓷研钵中破碎研细,再用四分法分取约20 g,继续研细至试样全部通过150 μm试验筛(按照GB/T 6003.1—2012中R40/3系列),置于称量瓶中,于105~110℃干燥2 h,取出放入干燥器内冷却至室温,备用。
1.3.2 试样的制备
由于测定原理不同,同一种试样处理方法所用试剂对后续的测定会产生干扰,故采用不同的试样处理方法。
1.3.2.1 锰试样的制备
称取约0.5 g试样,精确至0.000 1 g,置于250 mL烧杯中,用水润湿,在通风橱内,加入20 mL硫磷混酸溶液、10 mL H2O2溶液,盖上表面皿,缓慢加热使试料完全溶解,煮沸10 min。冷却后用水冲洗表面皿及烧杯内壁,用水稀释至约60 mL,加热至微沸,用中速滤纸过滤转移至250 mL容量瓶中,用热水冲洗烧杯内壁5~6次,洗液一并转入容量瓶中,待容量瓶中溶液冷却至室温后,用水稀释至刻度,摇匀。该试液A用于锰(Mn)质量分数的测定。
1.3.2.2 铁试样的制备
称取约0.5 g试样,精确至0.000 1 g置于250 mL烧杯中,用水润湿,在通风橱内,加入20 mL盐酸溶液,盖上表面皿,缓慢加热使试料完全溶解。冷却后用水冲洗表面皿及烧杯内壁,用水稀释至约60 mL,加热至微沸,用中速滤纸过滤转移至250 mL容量瓶中,用少量水冲洗烧杯壁5~6次,洗液一并转入容量瓶中,待容量瓶中溶液冷却至室温后,用水稀释至刻度,摇匀。该试液B用于铁(Fe)质量分数的测定。
1.3.3 测定
1.3.3.1 锰质量分数测定
量取25.00 mL试液A,置于250 mL锥形瓶中,加入10 mL磷酸,用热水稀释至约70 mL,加5 mL AgNO3溶液、2~3 g(NH4)2S2O8,静置10 min,煮沸5~7min,用流水迅速冷却至室温,用(NH4)2Fe(SO4)2标准滴定溶液滴定至溶液呈浅红色,加N-苯基邻氨基苯甲酸指示液3~4滴,继续滴至溶液变为亮绿色为终点。
1.3.3.2 铁质量分数测定
量取25.00 mL试液B,置于250 mL烧杯中,加入100 mL沸水、10 mL氯乙酸溶液、0.5 mL磺基水杨酸溶液、1 mL(NH4)2S2O8溶液,在50~70℃条件下,用EDTA标准滴定溶液滴定至溶液由紫色变为亮黄色即为终点。
2 结果与讨论
2.1 溶样方法的选择
由于锰元素在自然界存在多种价态,通常都是利用其氧化还原性通过定量分析测定其含量。虽然可以用盐酸分解试样,但是盐酸本身具有的还原性可能会干扰锰含量的测定。而H3PO4作为溶剂与配位化合剂可以为锰含量的测定提供合适的测定条件,故采用含有H3PO4的溶剂溶解试样,然后用(NH4)2Fe(SO4)2氧化还原滴定法进行检测。根据脱硫剂中元素的各自特性,采用了不同的溶样方法进行溶解并测定各元素的质量分数,结果见表1。

表1 不同溶样方法对测定结果的影响
由表1可知:不同溶样方法对锰的测定有影响,而SiO2的存在对锰含量的测定影响可以忽略。由于氧化锰脱硫剂中铁、锰的原材料不同,铁、锰在脱硫剂中的存在形态也不同,为了更好地溶解样品,拟采用H2SO4-H3PO4-H2O溶液(体积比2∶5∶3)+ H2O2-H2O溶液(体积比1∶9)的溶样方法测定锰质量分数,其中H2O2的加入是为了使溶液中锰离子以二价形式存在,减少溶解损失。
不同溶样方法对铁的测定也有影响。由表1可知:硫磷混酸、NaOH熔融和盐酸溶解样品,测定铁得到的质量分数结果相差不多,但硫磷混酸在后续的EDTA滴定时,终点指示不明显;NaOH熔融后,盐酸浸取,溶液澄清,省去了以酸溶样品后需过滤的步骤,但涉及高温、强碱等不安全因素,且溶液中增加了溶剂带入的大量盐类,对后续元素的测定带来不利影响;盐酸溶解样品快速、易操作,终点指示明显。因此拟采用HCl-H2O(体积比1∶1)的溶样方法测定铁质量分数。
2.2 (NH4)2S2O8加入量及放置与加热时间对锰质量分数的影响
(NH4)2S2O8是强氧化剂,它能氧化Mn2+至Mn7+,但又因其水溶液不稳定,会逐渐分解为NH4HSO4。根据反应方程式计算,0.2 g左右的(NH4)2S2O8与催化剂中相应的锰参与反应,加入2 g以上(NH4)2S2O8可以使反应完全。
加入足量的(NH4)2S2O8后一般需放置一段时间,以保证Mn2+与(NH4)2S2O8充分作用。对氧化锰脱硫剂加入(NH4)2S2O8后的放置时间进行验证试验,考察放置时间对催化剂测定结果的影响。结果发现:当放置时间小于5 min时,测定结果明显偏低;当放置时间在5 min以上时,结果稳定。
当低价锰被氧化至高价态后,必须将多余的(NH4)2S2O8通过加热煮沸使其分解,否则多余的(NH4)2S2O8会影响后续利用(NH4)2Fe(SO4)2测定锰含量的准确性,因此考察煮沸时间对锰含量测定的影响,结果见表2。

表2 煮沸时间对锰质量分数测定的影响
从表2可以看出,加热煮沸3 min后,用(NH4)2Fe(SO4)2滴定溶液中高价锰离子,其含量偏低;煮沸5 min以上,Mn的测定结果趋于稳定。本方法采用煮沸5~7 min来分解多余的(NH4)2S2O8。
2.3 酸度对EDTA络合滴定法测定铁质量分数的影响
试验表明,Fe3+在一定pH范围内与EDTA络合反应生成稳定的络合物,可避免许多元素的干扰。溶液pH控制在1.5~2.0时,测定结果显色明显且稳定。当pH小于1.5时,三价铁和磺基水杨酸的配位能力减低,同时三价铁与EDTA不能定量配位;当pH大于2时,铝、铁等易水解导致浑浊从而影响滴定。
2.4 不同测定方法对铁质量分数的影响
考察不同测定方法对铁质量分数测定的影响,结果见表3。由表3可以看出,EDTA络合滴定法和K2Cr2O7氧化还原滴定法测定氧化锰脱硫剂中铁质量分数,结果基本吻合。
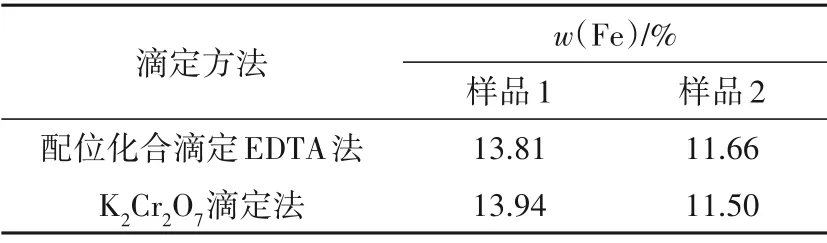
表3 不同方法对铁含量测定的影响
2.5 回收率试验
2.5.1 锰质量分数回收率试验
为了验证(NH4)2Fe(SO4)2氧化还原滴定法是否适宜用来测定氧化锰脱硫剂中锰的质量分数,分别取一定量的试液并加入不同质量的锰标准溶液,用(NH4)2Fe(SO4)2氧化还原滴定法进行了回收率测定,结果见表4。

表4 锰质量分数的回收率试验结果
由表4可知:氧化还原滴定法测定锰质量分数的回收率为97.8%~102.2%,说明采用该方法测定氧化锰脱硫剂中锰质量分数是切实可行的,完全能满足实际生产需求。
2.5.2 铁质量分数回收率试验
为了验证EDTA络合滴定法是否适宜用来测定氧化锰脱硫剂中铁的质量分数,分别取一定量的试液并加入不同质量的铁标准溶液,用EDTA络合滴定法进行了回收率测定,计算出铁的回收率,结果见表5。

表5 铁质量分数的回收率试验结果
由表5可知:铁的回收率为97.3%~101.7%,说明EDTA络合滴定法准确可靠,完全能满足实际生产需要。
2.6 精密度试验
2.6.1 锰质量分数精密度试验
(NH4)2Fe(SO4)2氧化还原滴定法测定锰质量分数,其精密度试验结果见表6。

表6 锰质量分数的精密度试验结果
由表6可知:首先对每个样品的8组数据进行离群值的判断,采用可靠性较高的格拉布斯检验,在置信度95%的情况下,每组数据的最大与最小值均小于临界值2.03,因此数据予以保留。精密度的允许差不大于0.22%,考虑实际生产情况,允许差可适当放宽,拟定2次平行测定结果的绝对差值应不大于0.30%。
2.6.2 铁质量分数精密度试验
采用(1+1)盐酸溶液来溶解制备试液,对不同样品用EDTA络合滴定法测定铁质量分数,其精密度试验结果见表7。

表7 铁质量分数的精密度试验结果
由表7可知:首先对每个样品的8组数据进行离群值的判断,采用可靠性较高的格拉布斯检验,在置信度95%的情况下,每组数据的最大与最小值均小于临界值2.03,因此数据予以保留。得出的允许差不大于0.25%,考虑实际生产情况,允许差可适当放宽,拟定两次平行测定结果的绝对差值应不大于0.30%。
3 结论
(NH4)2Fe(SO4)2氧化还原滴定法和EDTA络合滴定法为经典的化学计量的检测方法,所用试剂都为常用试剂且所受环境因素的干扰较少。通过考察试验条件、试剂用量及准确度和精密度等一系列试验,证明了本文所述方法具有灵敏度高、选择性好、精密度和准确度较高等特点,可以用于氧化锰脱硫剂中活性组分锰和铁含量的测定。

