基于蛋白质组学的乳腺癌标志物筛选及其应用
邓克瑜 赵莉 高琳 黄静怡 赵盼 吴伟晴
1.深圳市人民医院健康管理中心 暨南大学第二临床医学院 南方科技大学第一附属医院,广东深圳 518020;2.深圳市人民医院临床医学研究中心 暨南大学第二临床医学院 南方科技大学第一附属医院,广东深圳 518020
乳腺癌(breast cancer,BCA)是目前造成全球女性死亡的第二大癌症,自1990 年以来,在中国一些城市地区乳腺癌的发病率的增长速度约是全球发病率的2倍。至2008 年,中国有169 452 例浸润性乳腺癌病例和44 908 例相关死亡病例,占全球病例的12.2%和相关死亡病例的9.6%。肿瘤异质性是恶性肿瘤的重要特征之一,表现为同一肿瘤内存在不同基因型或表型的肿瘤细胞对药物的敏感度不同,是肿瘤治疗的巨大挑战。基因组的不稳定是造成肿瘤异质性的主要原因之一。目前乳腺癌治疗的主要挑战是由于肿瘤细胞具有异质性在治疗策略的选择上存在一定的问题。生物标志物是指可以标记系统、器官、组织、细胞及亚细胞结构或功能的改变或可能发生的改变的生化指标,多用于疾病诊断、判断疾病分期或评价新药或新疗法。尽管基因组学已经用于生物标记物的发现很长一段时间,但是所发现基因功能的解释需要在功能网络的背景下借助蛋白质组学的力量进行。蛋白质组学生物标志物可以提供蛋白质动态特性的关键信息,包括功能、转译后修饰、与其他生物分子的相互作用以及对环境因素的反应。有文献报道,与基因组数据比较,蛋白水平与基因组中基因的拷贝数变化之间具有低相关性,意味着许多基因组变异没有或只有部分参与到功能蛋白质的翻译。
因此,本研究通过以质谱(mass spectrometry,MS)技术和蛋白质组学工作流及qRT–PCR 技术筛选与乳腺癌发生发展及预后的标志物,有助于针对不同亚型患者,建立更有效的乳腺癌诊断手段、预测病因及干预治疗。
1 资料与方法
1.1 临床资料
1.1.1 组织标本 选取4 组(含癌组织和癌旁组织)乳腺癌患者的组织标本,所有患者均为侵袭性导管乳腺癌患者,年龄34~70 岁。经手术切除肿瘤组织,癌旁组织是距离肿瘤组织3~5cm。本研究经深圳市人民医院医学伦理委员会批准(医学伦理审批号LL–KY–2020170),并与患者签署知情同意书。
1.1.2 试剂 蛋白提取以及蛋白定量的试剂均购于美国Thermo 公司;色谱分级、液相色谱–串联质谱分析柱购于美国Thermo 公司;PCR 引物购于广东艾基生物公司;提取总RNA 试剂、qRT–PCR 试剂盒均购自美国Invitrogen 公司。
1.2 方法
1.2.1 组织蛋白的提取与肽段酶解 通过SDT[4%SDS,100mmol/L Tris/HCl pH7.6,0.1mol/L DTT]裂解法对组织中蛋白质进行提取,利用BCA 法对提取的蛋白质进行浓度测定。取适量的蛋白质通过(filter aided proteome preparation,FASP)方法对胰蛋白酶进行酶解,利用C18 Cartridge 对肽段进行脱盐,肽段冻干后加入40μl 0.1%甲酸溶液复溶,最后对肽段定量(A280)。
1.2.2 蛋白质质谱数据采集 每份样品采用纳升流速的HPLC 液相系统Easy nLC 进行分离。缓冲液A 液为0.1%甲酸水溶液,B 液为0.1%甲酸乙腈水溶液。色谱柱以95%的A 液平衡,样品由自动进样器上样到上样柱(Thermo Scientific Acclaim PepMap100,100μm×2cm,nanoViper C18),经过分析柱(Thermo scientific EASY column,10cm,ID75μm,3μm,C18–A2)分离,流速为300nl/min。样品经色谱分离后用Q–Exactive 质谱仪进行质谱分析。
1.2.3 蛋白质质谱分析 质谱分析原始数据为RAW文件,用版本号1.5.3.17 的MaxQuant 软件进行查库鉴定及定量分析。
1.2.4 qRT–PCR 检测 将经液氮速冻后的组织用研磨器磨碎后,利用TRIzol 试剂盒提取总RNA,再反转录为cDNA。用无酶水将cDNA 稀释20 倍备用。由广州艾基生物科技有限公司设计合成引物,用于qRT–PCR,引物序列如下。
按照qRT–PCR 说明书进行PCR 反应,条件为:95℃预变性10min,95 ℃ 35s,62 ℃ 35s,72 ℃ 5min,连续40 个循环,每组均设置4 个平行反应复孔,分析qRT–PCR 的扩增及熔解曲线,计算目的基因的相对表达量=2。
1.3 统计学方法
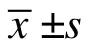
2 结果
2.1 乳腺癌表达差异标志物的筛选
通过对4 组乳腺癌样本进行蛋白质定量分析发现,肿瘤组织中差异表达上调的蛋白有263 个,下调的蛋白是36 个。设置差异倍数大于2 倍且<0.05为差异有统计学意义,共筛选出NANS、LCP1、ARF1、CCT3、VDAC1、NME1 等23 个癌组织中特异性表达的蛋白。且将相关蛋白所对应的基因与其癌旁进行比较筛选出NANS、LCP1、ARF1、CCT3、VDAC1、NME1、HSP90AA1、RAN、YWHAZ 等在侵袭性乳腺癌癌组织中表达升高(<0.05)的23个基因,详见图1。为了更准确地筛选乳腺癌特异性靶向治疗的标志物,集中在乳腺癌癌组织中蛋白表达上调。为了提高差异表达基因可信度,设置差异倍数大于2 倍且<0.05 为差异有统计学意义,如表2所示,共筛选出23 个癌组织中特异性表达的蛋白为YWHAZ、LCP1、CCT3、ERH、STIP1、ARF1、VDAC1、NME1、NANS、HSP90AA1、RAN、CKAP4、PRDX1、TUBB、SNRPD3、HSPA8、NME2、H2AFY、HSPE1、HDGF、SRP9、SFN、PDIA3。

表1 用于肿瘤标志物筛选的引物

图1 乳腺癌癌组织与癌旁组织中差异表达蛋白
2.2 GEPIA 数据库验证上述差异的蛋白在侵袭性乳腺导管癌患者中的mRNA 表达水平
通过GEPIA 数据库(http://gepia.cancer–pku.cn/)筛选表两种蛋白对应的基因。GEPIA 数据库是基于TCGA 癌症大数据分析的统计数据库。结果见图2所示,与癌旁组织比较,LCP1、ARF1、CCT3、VDAC1、NANS、NME1、HSP90AA1、RAN、YWHAZ、CKAP4、ERH、PRDX1、SFN、TUBB、STIP1、SNRPD3、HSPA8、NME2、H2AFY、HSPE1、HDGF、SRP9 和PDIA3 共23 个基因在侵袭性乳腺癌癌组织中表达升高。

图2 验证侵袭性乳腺导管癌中显著性差异表达的基因
2.3 筛选出的差异蛋白与侵袭性乳腺癌患者生存期的相关性
通过Kaplan–Meier 数据库(https://kmplot.com/analysis)分析,结果显示,乳腺癌患者中上述基因表达越高,乳腺癌患者的无复发生存期(relapse–free survival,RFS)越短,见图3。
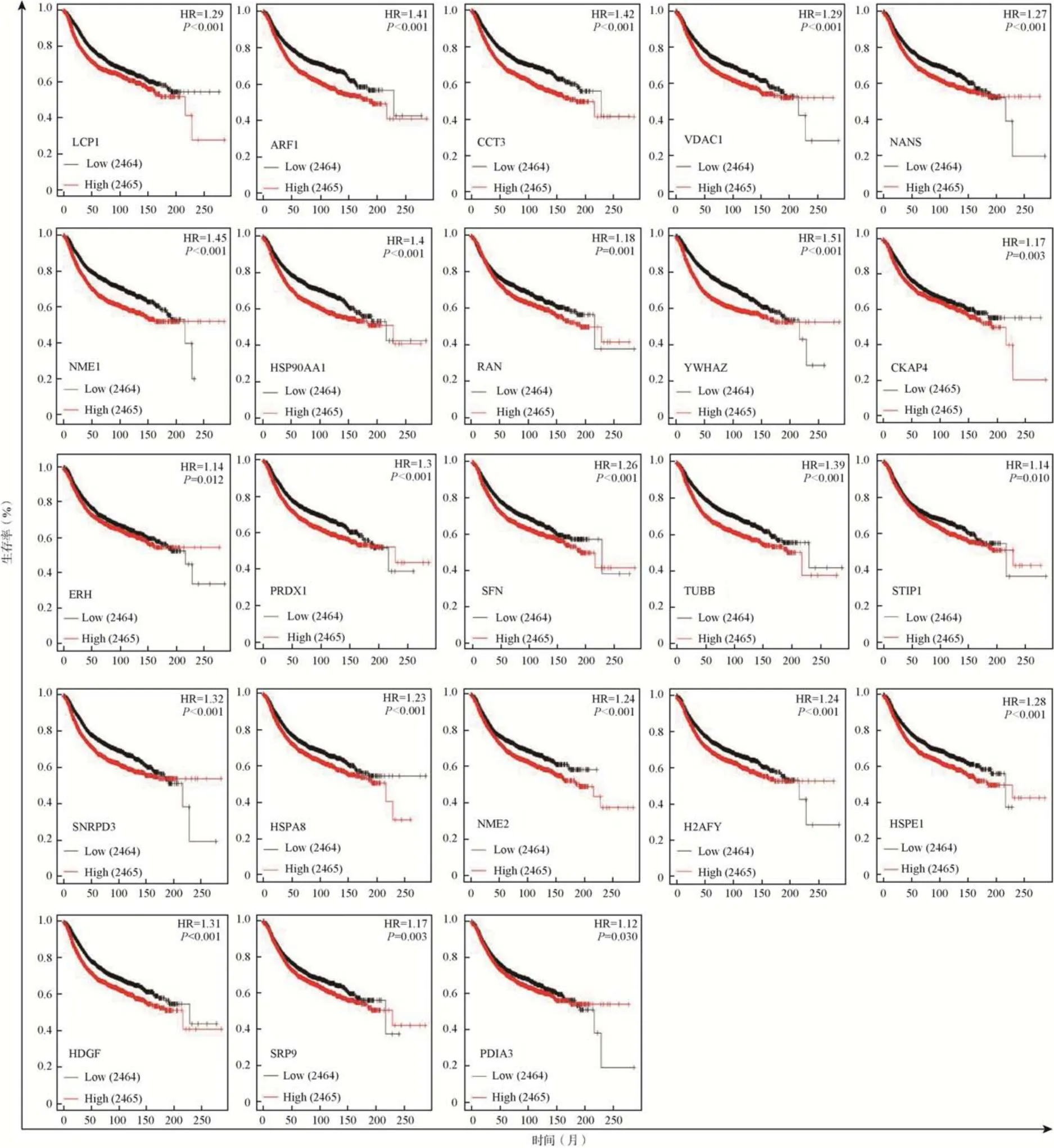
图3 侵袭性乳腺癌差异表达的蛋白与乳腺癌患者无复发生存期相关性分析
2.4 筛选出的差异基因在乳腺癌中表达水平验证
采用qRT–PCR 检测发现,与各自癌旁组织比较,2 例乳腺癌组织共有14 个基因:LCP1、CCT3、NANS、NME1、HSP90AA1、RAN、YWHAZ、ERH、PRDX1、STIP1、HSPA8、H2AFY、HSPE1 和PDIA3 表达升高,见图4。

图4 qRT-PCR 方法验证乳腺癌癌组织与癌旁组织中差异基因的相对表达量
3 讨论
基于蛋白质组学筛选得到的LCP1、CCT3、NANS、NME1、HSP90AA1、RAN、YWHAZ、ERH、PRDX1、STIP1、HSPA8、H2AFY、HSPE1 和PDIA3 14 个基因在乳腺癌中表达升高,其中LCP1 全称为淋巴细胞胞质蛋白1,是肌动蛋白家族的成员。目前相关的研究表明,LCP1 已在几种非造血部位的恶性肿瘤中被发现,如结肠、前列腺和乳腺中,LCP1可以作为胃癌免疫浸润相关的预后生物标志物;CCT3 作为CCT 复合体的一个重要亚基,作为分子伴侣可协助多种蛋白的折叠及重折叠过程,包括与细胞生长和分裂有关的细胞骨架蛋白,有研究表明在乳腺癌中CCT3 的表达量与乳腺癌的增殖和迁移相关,CCT3 敲低显著降低了乳腺癌细胞的增殖和转移能力,说明CCT3 可以作为一个新的治疗靶点;Nagasundaram等研究表明唾液酸的表达上调会影响受体-配体相互作用,且可能保护肿瘤细胞免受免疫系统的侵害。此外,在细胞膜上的唾液酸含量高低可以影响癌症对化学疗法和放射疗法的治疗效果,也就是说NANS 通过调控唾液酸的含量影响肿瘤的生长;NME1 基因也称为Nm23–H1 基因,这是第一个被发现的肿瘤转移抑制基因,在多种恶性肿瘤细胞系及动物模型中NME1 转录水平和蛋白水平均显著降低,且与肿瘤的转移潜能成负相关,作为转移抑制因子可以选择性地抑制肿瘤的转移性扩散,而不损害原发肿瘤的生长;HSP90AA1 基因主要编码Hsp90α,是分子伴侣Hsp90的亚型,目前已有一些实验报道HSP90α 在乳腺癌患者血液中的表达水平升高,因此可以推测HSP90AA1 可能在乳腺癌发生发展过程中起重要作用;近年来,Ran 的表达上调已被确定与多种癌症的发展有关。Ran 可能不仅是一个有用的预后生物标志物,而且还是一个潜在的抗癌治疗靶点;YWHAZ 是许多信号转导通路的中心枢纽蛋白,越来越多的证据表明,YWHAZ 在多种癌症中表达上调,并在细胞生长、细胞周期、细胞凋亡、迁移和侵袭等细胞活动中作为致癌基因发挥作用;PRDX1(peroxiredoxin 1)作为肿瘤发生的调节剂,其通过消除ROS 参与氧化还原平衡和过氧化物解毒,PRDX1 在许多癌症的细胞增殖、肿瘤促进和细胞凋亡过程中发挥作用;有研究发现,STIP1 的表达失调在癌症的发生、侵袭和转移中起重要作用;H2AFY 是核心组蛋白H2A 家族的成员之一,目前H2AFY 已被证明参与了乳腺癌、肺癌和结肠癌等多种肿瘤的发生发展;最后 HSPA8、HSPE1 和PDIA3 三个基因均是编码的分子伴侣蛋白,其中HSPA8 编码 HSP70 家族的组成型表达的同源蛋白,目前的研究显示其主要在肝癌中显著上调进而维持肝癌的恶性特征。HSPE1 基因编码HSP60/HSP10 分子伴侣的HSP10 亚基,有助于线粒体基质中的蛋白质折叠,有研究表明其参与了肝细胞早期的癌变过程。最后PDIA3 可调节新合成糖蛋白的折叠,具有异构酶和氧化还原活性,参与细胞周期和凋亡的调控,并与许多疾病的发病机制有关,将PDIA3 敲低之后可以影响急性髓系白血病的细胞增殖和侵袭过程,因此可以将PDIA3 看做是一个癌症生物标志物。
综上所述,癌症生物标志物是发现和开发新型癌症疗法的关键,它们也是临床实践中的关键要素,可用于风险评估、诊断、预后及确定治疗效果、安全性及复发等环节。肿瘤生物标志物发现中的蛋白质组学技术正处于不断发展变化中。过去几年,基于抗体和亲合性方法等技术快速发展,开启了癌症早期发现和个体化治疗策略可用生物标志物的开发之路。然而,将候选生物标志物有效和快速地从实验室转化到临床,仍然是一种挑战。克服这些挑战,需要多学科协作,获取不同领域的支持,采取多组学方法,这样转化成功概率才大。

