苯乳酸在食品保鲜中的应用研究进展
李波,郑凯茜,皇甫露露,马云芳
苯乳酸在食品保鲜中的应用研究进展
李波a, b,郑凯茜a,皇甫露露a,马云芳a
(郑州轻工业大学 a.食品与生物工程学院 b.河南省冷链食品质量安全控制重点实验室,郑州 450001)
介绍苯乳酸的抑菌机制,以及与微酸性电解水、醋酸和乳酸链球菌素的协同抗菌作用,为苯乳酸在食品保鲜中的应用提供一定的思路和依据。概述苯乳酸的理化性质、制备方法,以及对不同微生物的抑菌活性和机制,总结苯乳酸在肉制品、果蔬、水产品等保鲜领域的应用研究进展,并对现有研究的局限性和今后的研究方向进行讨论。苯乳酸通过破坏微生物的细胞结构,干扰DNA合成和蛋白质合成,从而抑制其生长,与微酸性电解水、醋酸和乳酸链球菌素协同处理可显著增强抑菌效果。苯乳酸对细菌和真菌具有广谱抑菌性,与其他抑菌剂有协同促进作用,在食品保鲜领域具有广阔的应用前景。
苯乳酸;抗菌机制;食品保鲜;协同作用
食品在加工、运输、储藏和销售等各个环节中极易受到微生物的污染,造成其营养品质和感官品质的劣变,甚至会引发食源性疾病,严重危害人体健康[1-2],因此食品保鲜一直是食品工业领域中的重要研究内容。添加防腐剂是一种常用的食品保鲜方法。目前,使用较为广泛的防腐剂是化学防腐剂,主要包括山梨酸、苯甲酸、对羟基苯甲酸酯类等[3]。研究表明,上述化学防腐剂的使用不仅会破坏食品的营养,而且还会对人体健康造成潜在危害[3],因此开发新型、安全、高效的抗菌剂是食品保鲜领域的重要研究方向之一。苯乳酸(Phenyllactic acid,PLA)是一种具有广谱抗菌作用的新型生物防腐剂[4-5]。PLA具有安全性高、来源广泛、稳定性强、亲水性好等优点,被广泛应用于肉制品、果蔬、水产品等的保鲜[6]。文中拟综述PLA在食品领域的国内外最新研究进展,并对今后的研究方向进行展望,旨在为PLA在食品保鲜中的广泛应用提供思路及参考。
1 苯乳酸
1.1 理化性质
PLA即2−羟基−3苯基丙酸,又名β−苯基乳酸或3−苯基乳酸(图1),是一种小分子有机酸,以L−PLA和D−PLA等2种形式存在于微生物中。PLA的分子式为C9H10O3,相对分子质量为166,熔点为121~125 ℃[7-8]。PLA的亲水性较好,对人体无毒无害,在高温和酸性条件下结构稳定,易于在食品体系中均匀扩散[6]。Cortés−Zavaleta等[9]将PLA溶液于121 ℃下加热20 min,并用冷却至室温的PLA溶液分别处理胶孢炭疽菌()、灰葡萄孢菌()、扩展青霉()和黄曲霉()等,结果表明,PLA对这4种真菌的抗菌活性与室温下处理的对照组相比均无显著变化,而pH值会影响PLA对微生物的失活效果。Sorrentino等[10]研究了不同pH(4.5~7.0)条件下PLA对单核细胞增生李斯特菌()的最小抑菌浓度(Minimal inhibitory concentration,MIC),结果表明,pH为4.5时PLA的MIC值约为1.6 mmol/L;当pH为7.0时,MIC值约为45 mmol/L。出现上述现象的原因可能是在酸性条件下,PLA主要以未解离的形式存在,且不带电荷的分子更容易穿过细胞膜进入细胞,进而在碱性的细胞质环境中释放质子(H+),导致微生物细胞内pH值降低,从而影响微生物的正常生理功能[10]。
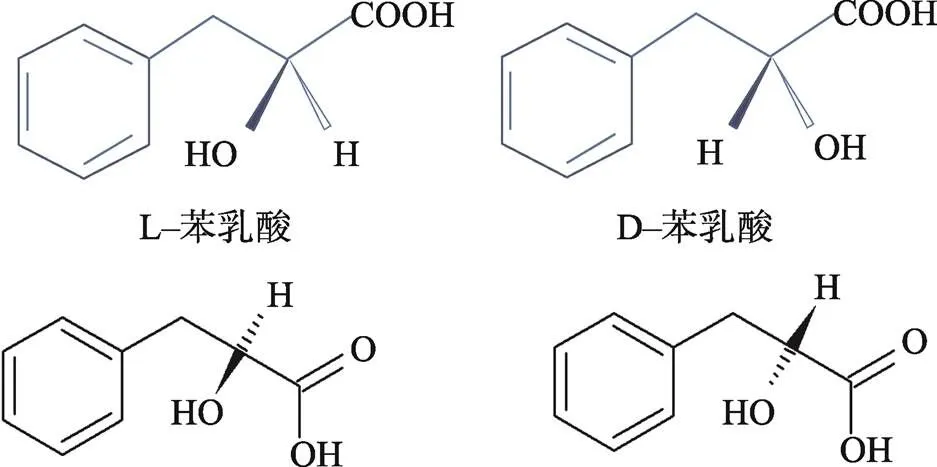
图1 苯乳酸的对映异构体结构
1.2 合成
目前,主要采用化学合成法和生物合成法制备PLA。由于化学合成法存在技术路线复杂、设备要求高、副产物多、分离纯化困难、环境污染等问题,因此近年来生物合成法备受关注[11-14]。研究证实,乳酸乳球菌()、白地霉()、肠膜明串珠菌()和凝结芽孢杆菌()等多种微生物均可代谢产生PLA,其产量为91~1 000 mg/L[15-21]。王海宽等[19]从脱脂奶粉中分离出一株产生PLA的TQ33,其PLA产量可达到726.1 mg/L。
虽然微生物能够合成PLA,但其产量普遍较低[6]。如何提高PLA的产量是当前重点研究的方向之一。PLA不仅可以在生物体内合成,也可以利用酶工程方法在体外合成。酶催化合成PLA主要包括2种方法:以过苯丙氨酸为底物,加入α−酮戊二酸,通过氨基转移酶发生转氨反应,生成苯丙酮酸,苯丙酮酸在乳酸脱氢酶(Lactate dehydrogenase,LDH)的作用下转化为PLA[22];苯丙酮酸在LDH的作用下直接生成PLA[23]。第1种合成方法需要加入α−酮戊二酸和氨基转移酶,不仅会增加生产成本,而且会生成副产物谷氨酸,加大了PLA分离纯化的难度,因此实际生产中常采用第2种方法[3]。由于采用这2种方法合成PLA的产量较低,一些学者采用基因工程等方法来提高PLA的产量[24]。王秀婷[25]首先采用酶偶联的方法将LDH与甲酸脱氢酶融合表达,然后与L−氨基酸脱氨酶共表达,构建了高产PLA的重组大肠杆菌(),经全细胞转化L−苯丙氨酸,L−PLA的产量高达30 g/L,而对照组仅为5 g/L。此外,由于D−PLA的抗菌活性大于L−PLA,而F44仅含有L−LDH,所以Liu等[26]采用基因打靶技术敲除该菌株上的2个L−LDH基因后,通过电穿孔技术引入外源D−LDH基因,构建了一株新型乳酸菌,使其合成D−PLA的产量相对于野生乳酸菌增加了1.77倍。
1.3 PLA的抑菌特性和抑菌机制
1.3.1 PLA对不同微生物的抑制效果
PLA是一种广谱抑菌剂,能够有效抑制细菌和大部分真菌的生长,它对不同微生物的最小抑菌浓度见表1[27-32]。刘韵昕[31]采用试管倍半稀释法测定D−PLA和L−PLA对革兰氏阳性细菌和阴性细菌的MIC值,结果表明,当质量浓度均为2.5 mg/mL时,D−PLA和L−PLA能够有效抑制金黄色葡萄球菌()、白色葡萄球菌()、痢疾志贺氏菌()、铜绿假单胞杆菌()和鼠伤寒沙门氏菌()的生长。此外,Lavermicocca等[32]发现,当PLA的质量浓度达到10 mg/mL时,对从烘焙面包、面粉和谷物中分离出的镰刀菌(spp)、疣孢青霉()、罗克福尔青霉菌()、产黄青霉()、黑曲霉()、和土曲霉()等真菌均具有良好的抑制作用。
从表1可知,不同微生物对PLA具有不同的敏感性。其中,真菌对PLA的抵抗性最强。原因可能是细胞壁的厚度和结构组成不同,真菌细胞壁的厚度一般为100~250 nm,而细菌仅为15~30 nm,且真菌细胞壁构成较为复杂,含有葡聚糖、半乳聚糖、蛋白质等多种组分,不同的多糖链相互缠绕交联,会嵌入蛋白质、类脂及一些小分子多糖的基质中[33]。
1.3.2 PLA抑制微生物生长的作用机制
国内外学者对PLA的抗菌机制进行了大量研究,普遍认为PLA失活微生物的作用机制主要包括以下3个方面。
1)破坏细胞结构。研究发现,PLA能够破坏细胞膜的完整性,进而导致蛋白质、核酸等细胞内容物泄露,最终使微生物死亡。Ning等[34]通过碘化丙啶(Propidium iodide,PI)染色结合流式细胞仪观察发现,经4.5 mg/mL PLA处理30 min后,PI染色的细胞的百分比高达94.5%,而未经PLA处理的对照组的仅为6.1%,表明经PLA处理后破坏了细胞膜的完整性。Ning等[34]使用2.25 mg/mL PLA处理细胞1 h后,采用扫描电子显微镜观察到细胞膜上出现了褶皱和局部破裂,内容物泄出,形成了聚集和粘连,表明PLA处理破坏了的形态和超微结构。
2)干扰DNA的合成。PLA能够与DNA结合,并影响DNA的正常复制和转录,从而抑制细胞生长,甚至导致细胞死亡。Ning等[34]采用溴化乙锭(Ethidium bromide,EB)荧光探针研究了PLA与DNA的结合作用,发现DNA−EB混合溶液中加入PLA可以导致EB荧光发生淬灭,而且淬灭强度与PLA的浓度呈正相关。以上结果表明,PLA以与EB类似的方式嵌入DNA螺旋的碱基对中。
3)影响蛋白质的合成。PLA进入细胞后能够干扰核糖体的功能,进而影响蛋白质的合成,最终导致细胞死亡。Ning等[30]采用基于相对和绝对定量同位素标记(Isobaric tags for relative and absolute quantitation,iTRAQ)技术研究了PLA处理对蜡样芽胞杆菌()蛋白质表达的影响。结果表明,经质量浓度为1.25 mg/mL的PLA处理1 h后,出现30个差异表达蛋白,其中19个蛋白表达水平上调,11个蛋白表达水平下调。由于kdpB蛋白(K+转运蛋白)表达水平下调,从而导致K+的运输受到抑制,最终导致膜电位耗散。此外,编码为50s核糖体蛋白L30(rpmD)和30s核糖体蛋白S13(rpmG)的基因表达下调,而与RNA降解体相关的蛋白GroEL基因表达上调。
表1 PLA对不同微生物的最小抑菌浓度
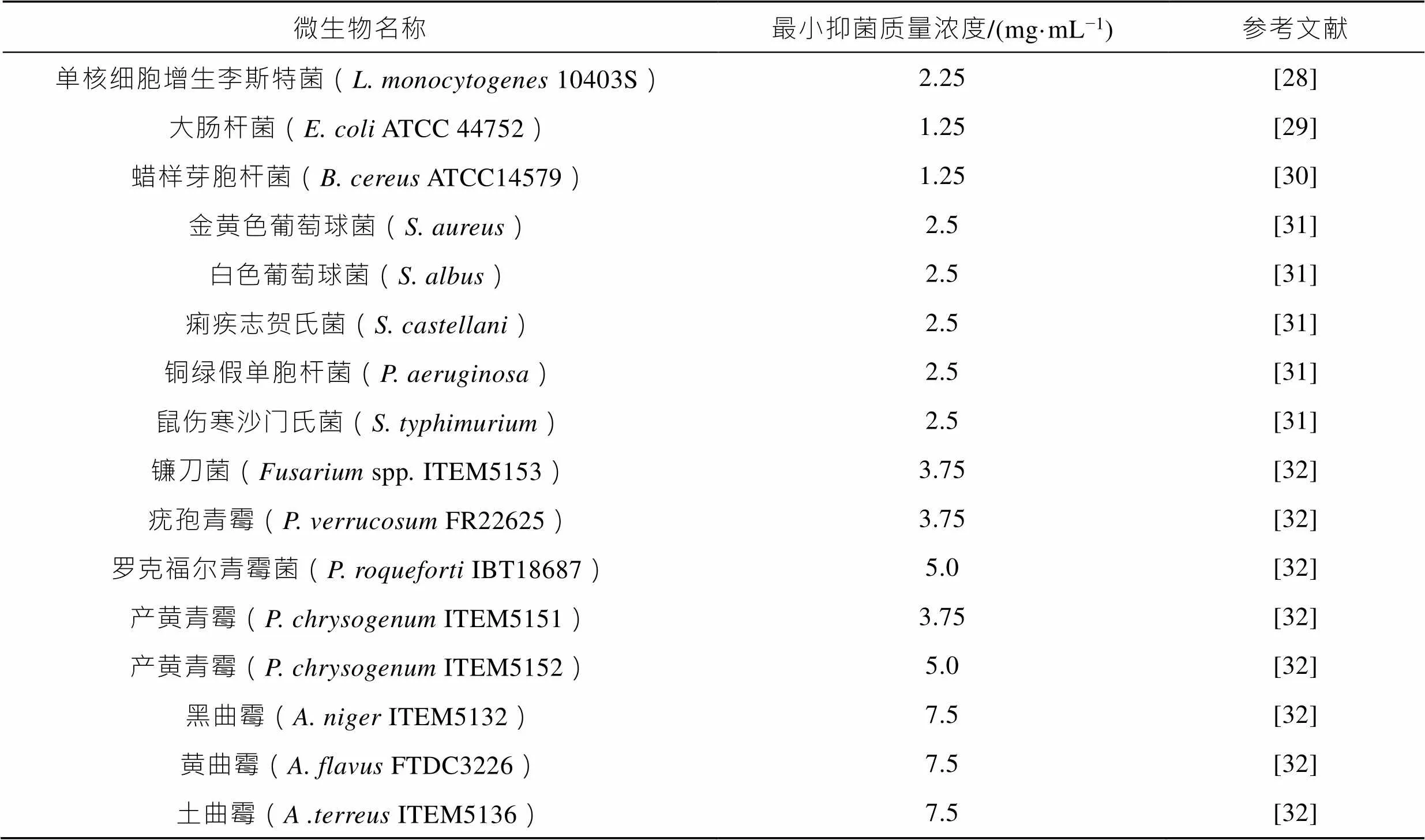
Tab.1 MICs values of PLA to different microorganisms
2 苯乳酸与其他抑菌剂协同抑菌
近年来,为了增强PLA的生产效率及降低使用成本,大量研究者将PLA协同其他物质处理微生物,发现其抑菌效果显著增强,同时还对其协同杀菌机理进行了研究。
2.1 苯乳酸与微酸性电解水协同抑菌
微酸性电解水(Slightly acid electrolyzed water,SAEW)是一种广谱抗菌剂,具有安全、便利、成本低和环境友好等优点。研究表明,使用低浓度的PLA协同SAEW处理与使用高浓度PLA的灭菌效果相当。史云娇[35]使用质量分数为1%的PLA与余氯质量浓度为30 mg/L的SAEW协同处理5 min,可将粪肠球菌()从初始值8.23 lg(CFU/mL)降至3.01 lg(CFU/mL);使用质量分数为2%的PLA处理5 min,可将其降至2.98 lg(CFU/mL)。同样地,Liu等[36]使用质量分数为1%的PLA与余氯质量浓度为30 mg/L的SAEW协同处理5 min后,产酸克雷伯氏菌()游离细胞由初始值约8 lg(CFU/mL)降至1.4 lg(CFU/mL)以下。此外,Liu等[36]研究了PLA协同SAEW对生物被膜的失活作用,经质量分数为1%的PLA和余氯质浓度为30 mg/L的SAEW单独处理20 min后,生物被膜中的细胞数量分别降低了1.4和0.9个对数值,而经二者协同处理20 min后约降低了4.5个对数值。以上结果表明,二者协同的抑菌机制可能是PLA破坏细胞壁后,SAEW与细胞膜上物质发生了反应,引起质壁分离、细胞膜通透性增加,致使细胞内容物流出,最终导致菌体死亡。在今后的研究中,还应开展PLA和SAEW在肉制品、果蔬等食品杀菌保鲜中的应用研究。
2.2 苯乳酸与醋酸协同抑菌
研究证实,PLA协同醋酸处理可以显著抑制大多数食源性致病菌和腐败菌的活性[37]。宁亚维等[28]研究发现,PLA协同醋酸处理可以有效失活和。将PLA(0.562 5 mg/mL)和醋酸(0.875 mg/mL)单独或协同处理24 h,结果表明,协同处理组的活菌数与单独处理组相比均降低了2 lg(CFU/mL)以上,在中也发现了类似的现象。将PLA(0.312 5 mg/mL)与醋酸 (0.25 mg/mL)单独或协同处理24 h,结果表明,协同处理组的活菌数比单一抑菌剂处理组的活菌数降低了2 lg(CFU/mL)以上。笔者推测二者协同的抑菌机制可能是通过改变细胞膜的通透性、破坏细胞膜完整性,从而进入细胞与DNA发生相互作用,最终导致细胞死亡。关于PLA协同醋酸处理对食品表面微生物的杀灭作用及品质影响还有待深入研究。
2.3 苯乳酸与乳酸链球菌素协同抑菌
Nisin是由乳酸菌的某些菌株产生的一种天然的抗菌肽,可以有效地抑制革兰氏阳性菌的活性,但对革兰氏阴性菌、酵母和霉菌等的抑制作用较弱[38]。Liu等[26]通过对和藤黄微球菌()进行抑菌圈实验,研究了PLA与Nisin的协同抗菌活性。结果表明,协同处理组的抑菌圈直径达到了13.72 mm,而PLA和Nisin单独处理组的抑菌圈直径分别为11.59 mm和10.88 mm。笔者推测PLA与Nisin协同抑菌机制可能是作用位点不同,PLA通过作用于细胞隔膜,进而影响细胞的正常分裂;Nisin通过作用于细胞膜,进而影响细胞膜的通透性,最终使细胞失活。今后应对PLA协同Nisin失活食品中的有害微生物进行深入研究。
3 苯乳酸在食品保鲜中的应用
乳酸菌是公认安全(Generally recognized as safety,GRAS)的微生物,广泛用于食品的防腐保鲜,而PLA作为乳酸菌的代谢产物,对人和动物细胞同样无毒、无害[39],因此PLA被广泛应用于肉制品、果蔬、水产品等的保鲜。研究证实,PLA可以有效抑制微生物的生长繁殖,并延长食品的货架期。
3.1 苯乳酸在肉制品保鲜中的应用
肉制品因含有丰富的蛋白质和微量元素而深受消费者的喜爱,但其水分含量过高,容易发生微生物污染,造成品质劣变,甚至引发食源性疾病[40]。邓林等[41]研究发现,将鲜牛肉浸泡于体积分数为3%的苯乳酸发酵液5 min后于25 ℃下密封保存,其贮存时间可达10 d以上,而对照组的鲜牛肉在贮藏6 d时已发生变质。研究证实,将PLA与其他抑菌剂协同处理肉制品,可以有效地延长肉制品的货架期。刘绍鹏等[42]将鸡肉浸泡于质量分数为0.4%的PLA和质量分数为3%的大蒜及生姜精油溶液中15 s,然后于4 ℃下储存12 d,不仅可使鸡肉的货架期相对于对照组延长了4 d,且无腐败气味出现。以上结果表明,PLA单独或联合其他抑菌剂处理可以有效灭活肉制品中的微生物,从而延长肉制品的货架期。
3.2 苯乳酸在果蔬保鲜中的应用
果蔬中富含多种营养成分,对人体健康十分有益,但微生物污染和酶促褐变是果蔬保鲜中的两大难题[43]。在实际应用中,通常将PLA与其他抑菌剂协同使用,以增强抑菌效果。Liu等[26]将草莓在质量浓度均为0.1 g/L的PLA和乳酸链球菌素(Nisin)的混合溶液中浸泡30 s,并于25 ℃下贮藏6 d,结果表明,与对照组相比,PLA和Nisin处理组样品的腐烂率下降了约30%。此外,有学者将PLA制成可食膜用于果蔬的保鲜。赵珊等[44]将质量浓度为6 g/L的PLA、5 g/L的甘油、5 g/L的黄原胶和2 g/L的海藻酸钠制成保鲜剂,并涂膜于甜樱桃表面,在低温条件下贮藏。结果表明,贮藏40 d后,未涂膜组样品的腐烂率和质量损失率分别为18.01%和5.27%,而涂膜处理组样品的腐烂率和质量损失率分别为7.26%和2.79%。
此外,PLA可以有效地抑制多酚氧化酶的活性,从而抑制果蔬的酶促褐变。Ren等[45]将鲜切双孢蘑菇分别浸泡于浓度为0.5、3.0 mmol/L的PLA溶液中15 min,自然干燥后于4 ℃下储存12 d,发现与蒸馏水处理组样品相比,PLA处理组的多酚氧化酶活性降低了12.7%。国内外学者对PLA抑制酶促褐变的机制进行了大量研究,目前普遍认为PLA结构中的苯基会与多酚氧化酶中的氨基酸残基形成CH−π,并相互作用,且会与多酚氧化酶中的铜原子发生螯合作用,从而有效地抑制其活性,进而抑制果蔬的酶促褐变[45]。以上研究表明,PLA可以有效地抑制果蔬中的微生物污染和酶促褐变,进而延长果蔬的货架期。
3.3 苯乳酸在水产品保鲜中的应用
水产品的蛋白质和水分含量较高,在运输、加工和销售等过程中极易受到微生物的污染[46]。Fang等[47]将接种了副溶血性弧菌()的鲜切三文鱼片于6.4 mg/mL的PLA溶液中浸泡20 min。结果表明,PLA对的灭活率高达95.72%。此外,PLA协同其他抑菌剂对水产品也有很好的保鲜效果。于晓倩等[48]将新鲜鲟鱼片浸泡在质量浓度为0.1 mg/mL的壳聚糖−明胶−PLA成膜液中20 min,并于4 ℃下储存10 d,结果表明,在储存第6天时对照组样品的菌落总数高达8.70 lg(CFU/g),而协同处理组样品的菌落总数仅为5.16 lg(CFU/g),且对照组鲟鱼片中的挥发性盐基氮含量达到了277.6 mg/kg,而壳聚糖−明胶−PLA协同处理组的挥发性盐基氮含量仅为144.7 mg/kg,且这种趋势一直延续至第10天。以上结果表明,PLA能够有效抑制水产品表面微生物的生长,并延长产品的货架期。
3.4 苯乳酸在其他食品保鲜中的应用
PLA不仅可以延长肉制品、果蔬、水产品的保质期,也可以应用于其他食品的保鲜。Liu等[26]在接种了木糖葡萄球菌()的巴氏杀菌牛奶中单独或联合添加质量浓度为0.1 mg/L的PLA和Nisin溶液,并于4 ℃下储存9 h。结果表明,与未处理组相比,Nisin单独处理组样品中的数量未显著降低,而Nisin+PLA协同处理组和PLA单独处理组样品中数量分别降低了约2 lg(CFU/mL)和1 lg (CFU/mL)。以上结果表明,Nisin与PLA协同使用可以有效地灭活牛奶中的微生物。此外,Bustos等[49]研究发现,将质量分数为0.3%的丙酸钙和乳酸片球菌(CRL 1753)发酵液联用,作为制作面包的生物保鲜剂,并在面包制作完成后于30 ℃条件下储存18 d。结果表明,在18 d的储存期中单独使用丙酸钙处理的面包约有70%发生了霉变,而协同处理组面包未出现霉菌。综上所述,PLA在食品保鲜中的应用广泛,且有很大的应用前景。
4 结语
PLA对细菌和真菌显示出广谱的抑菌活性,在食品保鲜领域具有巨大的应用前景。目前,大多数菌株自身合成PLA的能力较弱,导致PLA的产量较低,生产成本较高,制约了它在食品领域的实际应用。在今后的工作中,应综合运用结构生物学、酶工程和代谢工程等策略,来提高微生物合成PLA的转化率和产量。同时,应对PLA在人体的代谢模式进行安全性评价,从而不断推动PLA在食品工业中的应用。
[1] EL-SABER B G, HUSSEIN D E, ALGAMMAL A M, et al. Application of Natural Antimicrobials in Food Preservation: Recent Views[J]. Food Control, 2021, 126: 108066.
[2] STONEHOUSE G G, EVANS J A. The Use of Supercooling for Fresh Foods: A Review[J]. Journal of Food Engineering, 2015, 148: 74-79.
[3] 邓廷山, 武国干, 孙宇, 等. 苯乳酸生物合成的研究进展[J]. 中国生物工程杂志, 2020, 40(9): 62-68.
DENG Ting-shan, WU Guo-gan, SUN Yu, et al. Advances in Biosynthesis of Phenyllactic Acid[J]. China Biotechnology, 2020, 40(9): 62-68.
[4] SINGH V P. Recent Approaches in Food Bio-Preservation - a Review[J]. Open Veterinary Journal, 2018, 8(1): 104-111.
[5] ZHANG Jian-ming, ZHANG Cheng-cheng, LEI Peng, et al. Isolation, Purification, Identification, and Discovery of the Antibacterial Mechanism of Ld[J]. Food Control, 2022, 132: 108490.
[6] QIAO Nan-zhen, YU Lei-lei, ZHANG Cheng-cheng, et al. A Comparison of the Inhibitory Activities ofandAgainstand an Analysis of Potential Antifungal Metabolites[J]. FEMS Microbiology Letters, 2020, 367(18): 1-10.
[7] MAO Yin, ZHANG Xiao-juan, XU Zheng-hong. Identification of Antibacterial Substances ofDY-6 for Bacteriostatic Action[J]. Food Science & Nutrition, 2020, 8(6): 2854-2863.
[8] LIU Fang, SUN Zhi-lan, WANG Feng-ting, et al. Inhibition of Biofilm Formation and Exopolysaccharide Synthesis ofby Phenyllactic Acid[J]. Food Microbiology, 2020, 86: 103344.
[9] CORTÉS-ZAVALETA O, LÓPEZ-MALO A, HERNÁNDEZ-MENDOZA A, et al. Antifungal Activity of Lactobacilli and Its Relationship with 3-Phenyllactic Acid Production[J]. International Journal of Food Microbiology, 2014, 173: 30-35.
[10] SORRENTINO E, TREMONTE P, SUCCI M, et al. Detection of Antilisterial Activity of 3-Phenyllactic Acid Usingas a Model[J]. Frontiers in Microbiology, 2018, 9: 1373.
[11] LIU Fang, WANG Feng-ting, DU Li-hui, et al. Antibacterial and Antibiofilm Activity of Phenyllactic Acid Against[J]. Food Control, 2018, 84: 442-448.
[12] ZHU Yi-bo, WANG Ying, XU J, et al. Enantioselective Biosynthesis of L-Phenyllactic Acid by Whole Cells of Recombinant[J]. Molecules, 2017, 22(11): 1966.
[13] DRAANEN N A, HENGST S. The Conversion of L-Phenylalanine to (S)-2-Hydroxy-3-Phenylpropanoic Acid: A Simple, Visual Example of a Stereospecific S(N)2 Reaction[J]. Journal of Chemical Education, 2010, 87(6): 623-624.
[14] WU Wen-yu, DENG Gang, LIU Chen-jian, et al. Optimization and Multiomic Basis of Phenyllactic Acid Overproduction by[J]. Journal of Agricultural and Food Chemistry, 2020, 68(6): 1741-1749.
[15] JUNG S, HWANG H, LEE J H. Effect of Lactic Acid Bacteria on Phenyllactic Acid Production in Kimchi[J]. Food Control, 2019, 106: 106701.
[16] ZHENG Zhao-juan, MA Cui-qing, GAO Chao, et al. Efficient Conversion of Phenylpyruvic Acid to Phenyllactic Acid by Using Whole Cells ofSDM[J]. PLoS One, 2011, 6(4): e19030.
[17] DIEULEVEUX V, VAN DER PYL D, CHATAUD J, et al. Purification and Characterization of Anti-Compounds Produced by[J]. Applied and Environmental Microbiology, 1998, 64(2): 800-803.
[18] VALERIO F, LAVERMICOCCA P, PASCALE M, et al. Production of Phenyllactic Acid by Lactic Acid Bacteria: An Approach to the Selection of Strains Contributing to Food Quality and Preservation[J]. FEMS Microbiology Letters, 2004, 233(2): 289-295.
[19] 王海宽, 高雪芹, 张淑丽, 等. 底物对凝结芽孢杆菌TQ33产苯乳酸的影响[J]. 天津科技大学学报, 2014, 29(6): 11-15.
WANG Hai-kuan, GAO Xue-qin, ZHANG Shu-li, et al. Effect of Substrates on the Production of Phenyllactic Acid ofTQ33[J]. Journal of Tianjin University of Science & Technology, 2014, 29(6): 11-15.
[20] VALERIO F, DI BIASE M, LATTANZIO V M T, et al. Improvement of the Antifungal Activity of Lactic Acid Bacteria by Addition to the Growth Medium of Phenylpyruvic Acid, a Precursor of Phenyllactic Acid[J]. International Journal of Food Microbiology, 2016, 222: 1-7.
[21] LI Xing-feng, JIANG Bo, PAN Bei-lei. Biotransformation of Phenylpyruvic Acid to Phenyllactic Acid by Growing and Resting Cells of aSp[J]. Biotechnology Letters, 2007, 29(4): 593-597.
[22] LUO Xi, ZHANG Ying-ying, YIN Long-fei, et al. Efficient Synthesis of D-Phenyllactic Acid by a Whole-Cell Biocatalyst Co-Expressing Glucose Dehydrogenase and a Novel D-Lactate Dehydrogenase from[J]. 3 Biotech, 2020, 10(1): 14.
[23] 倪正, 关今韬, 沈绍传, 等. 苯乳酸的微生物合成及分离研究进展[J]. 化工进展, 2016, 35(11): 3627-3633.
NI Zheng, GUAN Jin-tao, SHEN Shao-chuan, et al. An Overview of Recent Advances in Microbial Synthesis and Separation of Phenyllactic Acid[J]. Chemical Industry and Engineering Progress, 2016, 35(11): 3627-3633.
[24] 郭明, 胡昌华. 生物转化——从全细胞催化到代谢工程[J]. 中国生物工程杂志, 2010, 30(4): 110-115.
GUO Ming, HU Chang-hua. Bioconversion—From Whole Cell Biocatalysis to Metabolic Engineering[J]. China Biotechnology, 2010, 30(4): 110-115.
[25] 王秀婷. 重组大肠杆菌全细胞转化L‒苯丙氨酸合成苯乳酸的研究[D]. 无锡: 江南大学, 2018: 45-49.
WANG Xiu-ting. Study of Biosynthesis of Phenyllactic Acid by RecombinantWhole-Cell Biotransformation of L-Phenylalanine[D]. Wuxi: Jiangnan University, 2018: 45-49.
[26] LIU Jia-heng, HUANG Rong-rong, SONG Qian-qian, et al. Combinational Antibacterial Activity of Nisin and 3-Phenyllactic Acid and Their Co-Production by Engineered[J]. Frontiers in Bioengineering and Biotechnology, 2021, 9: 612105.
[27] WANG Feng-ting, WU Hai-hong, JIN Pan-pan, et al. Antimicrobial Activity of Phenyllactic Acid Againstand Its Effect on Cell Membrane[J]. Foodborne Pathogens and Disease, 2018, 15(10): 645-652.
[28] 宁亚维, 付浴男, 何建卓, 等. 苯乳酸和醋酸联用对单核细胞增生李斯特菌的协同抑菌机理[J]. 食品科学, 2020, 41(23): 70-76.
NING Ya-wei, FU Yu-nan, HE Jian-zhuo, et al. Synergistic Antibacterial Mechanism of Phenyllactic Acid Combined with Acetic Acid Against Listeria[J]. Food Science, 2020, 41(23): 70-76.
[29] 宁亚维, 付浴男, 何建卓, 等. 苯乳酸和醋酸联用对大肠杆菌的抑菌机理[J]. 食品科学, 2021, 42(3): 77-84.
NING Ya-wei, FU Yu-nan, HE Jian-zhuo, et al. Antibacterial Mechanism of Phenyllactic Acid Combined with Acetic Acid on[J]. Food Science, 2021, 42(3): 77-84.
[30] NING Ya-wei, FU Yu-nan, HOU Lin-lin, et al. ITRAQ-Based Quantitative Proteomic Analysis of Synergistic Antibacterial Mechanism of Phenyllactic Acid and Lactic Acid Against[J]. Food Research International, 2021, 139: 109562.
[31] 刘韵昕. 苯乳酸的抑菌活性及抑菌机理研究[D]. 临汾: 山西师范大学, 2017: 9-17.
LIU Yun-xin. Antibacterial Activity and Mechanism of Action of Phenyllactic Acid[D]. Linfen: Shanxi Normal University, 2017: 9-17.
[32] LAVERMICOCCA P, VALERIO F, VISCONTI A. Antifungal Activity of Phenyllactic Acid Against Molds Isolated from Bakery Products[J]. Applied and Environmental Microbiology, 2003, 69(1): 634-640.
[33] GARCIA-RUBIO R, OLIVEIRA H C, RIVERA J, et al. The Fungal Cell Wall:,, andSpecies[J]. Frontiers in Microbiology, 2020, 10: 2993.
[34] NING Ya-wei, YAN Ai-hong, YANG Kun, et al. Antibacterial Activity of Phenyllactic Acid Againstandby Dual Mechanisms[J]. Food Chemistry, 2017, 228: 533-540.
[35] 史云娇. 藏羊肉优势腐败菌的分离、成膜特性及其控制技术研究[D]. 扬州: 扬州大学, 2019: 40-55.
SHI Yun-jiao. Study on Isolation, Film Formation and Control Technology of Dominant Putrid Bacteria in Tibetan Mutton[D]. Yangzhou: Yangzhou University, 2019: 40-55.
[36] LIU Fang, TANG Chun, WANG De-bao, et al. The Synergistic Effects of Phenyllactic Acid and Slightly Acid Electrolyzed Water to Effectively InactivatePlanktonic and Biofilm Cells[J]. Food Control, 2021, 125: 107804.
[37] 宁亚维, 侯琳琳, 于同月, 等. 中国食醋中苯乳酸的检测、鉴定及其与醋酸的联合抑菌作用[J]. 食品科学, 2021, 42(12): 233-241.
NING Ya-wei, HOU Lin-lin, YU Tong-yue, et al. Detection and Identification of Phenyllactic Acid in Chinese Vinegar and Its Combined Bacteriostatic Effect with Acetic Acid[J]. Food Science, 2021, 42(12): 233-241.
[38] SANTOS J C P, SOUSA R C S, OTONI C G, et al. Nisin and other Antimicrobial Peptides: Production, Mechanisms of Action, and Application in Active Food Packaging[J]. Innovative Food Science & Emerging Technologies, 2018, 48: 179-194.
[39] 郑维君. 食品中苯乳酸的研究[J]. 食品研究与开发, 2017, 38(7): 217-220.
ZHENG Wei-jun. Study on Phenyllactic Acid in Food[J]. Food Research and Development, 2017, 38(7): 217-220.
[40] MUNEKATA P E S, ROCCHETTI G, PATEIRO M, et al. Addition of Plant Extracts to Meat and Meat Products to Extend Shelf-Life and Health-Promoting Attributes: An Overview[J]. Current Opinion in Food Science, 2020, 31: 81-87.
[41] 邓林, 刘延岭. 苯乳酸菌发酵液在牛肉保鲜中的应用研究[J]. 食品与发酵科技, 2017, 53(2): 24-28.
DENG Lin, LIU Yan-ling. Study on the Application of Lactobacillus Fermentation Broth in Beef Preservation[J]. Food and Fermentation Sciences & Technology, 2017, 53(2): 24-28.
[42] 刘绍鹏, 曹秀娟, 贺峰. 苯乳酸复合保鲜剂在鸡肉保鲜中的应用[J]. 肉类工业, 2019(6): 46-50.
LIU Shao-peng, CAO Xiu-juan, HE Feng. Application of Phenyllactic Acid Compound Preservative in Chicken Preservation[J]. Meat Industry, 2019(6): 46-50.
[43] AMIT S K, UDDIN M M, RAHMAN R, et al. A Review on Mechanisms and Commercial Aspects of Food Preservation and Processing[J]. Agriculture & Food Security, 2017, 6(1): 51.
[44] 赵珊, 贡汉生, 田亚晨, 等. 苯乳酸-海藻酸钠涂膜保鲜剂的制备及其在甜樱桃保鲜中的应用[J]. 食品科学, 2018, 39(11): 221-226.
ZHAO Shan, GONG Han-sheng, TIAN Ya-chen, et al. Preparation of PLA/SA Composite Coating and Its Application in Quality Preservation of Sweet Cherries[J]. Food Science, 2018, 39(11): 221-226.
[45] REN Hai-wei, DU Na-na, NIU Xiao-qian, et al. Inhibitory Effects of L-3-Phenyllacitc Acid on the Activity of Mushnroom Pholyphenol Oxidase[J]. Food Science and Technology, 2021, 41(S1): 343-351.
[46] DEHGHANI S, HOSSEINI S V, REGENSTEIN J M. Edible Films and Coatings in Seafood Preservation: A Review[J]. Food Chemistry, 2018, 240: 505-513.
[47] FANG Mei-mei, WANG Rui-fei, AGYEKUMWAA A K, et al. Antibacterial Effect of Phenyllactic Acid Againstand Its Application on Raw Salmon Fillets[J]. LWT, 2022, 154: 112586.
[48] 于晓倩, 张成林, 李晴, 等. 苯乳酸纳米粒保鲜膜对冷藏鲟鱼保鲜效果研究[J]. 包装工程, 2020, 41(9): 17-22.
YU Xiao-qian, ZHANG Cheng-lin, LI Qing, et al. Effect of G-C-NanoPLA Films on the Preservation of Froze Sturgeon[J]. Packaging Engineering, 2020, 41(9): 17-22.
[49] BUSTOS A Y, FONT DE VALDEZ G, GEREZ C L. Optimization of Phenyllactic Acid Production byCRL 1753. Application of the Formulated Bio-Preserver Culture in Bread[J]. Biological Control, 2018, 123: 137-143.
Application and Research Progress of Phenyllactic Acid in Food Preservation
LI Boa,b, ZHENG Kai-xia, HUANGFU Lu-lua, MA Yun-fanga
(a. School of Food and Bioengineering b. Henan Key Laboratory of Cold Chain Food Quality and Safety Control, Zhengzhou University of Light Industry, Zhengzhou 450001, China)
The work aims to introduce theantibacterial mechanism of phenyllactic acid (PLA) and its synergistic antibacterial action with slightly acidic electrolytic water, acetic acid and nisin, so as to provide ideas and basis for the application of PLA in food preservation. The physicochemical properties and preparation methods of PLA as well as its antibacterial activity and antibacterial mechanism against different kinds of microorganisms were summarized. Then, the application of PLA in preservation of meat products, fruits and vegetables and aquatic products was reviewed. In addition, limitations of existing research and future research directions were also discussed in detail. PLA could inhibit the growth of microorganisms by destroying cell structure and interfering with DNA synthesis and protein synthesis. Synergistic treatment of PLA with slightly acidic electrolytic water, acetic acid and nisin could significantly enhance the bacteriostatic effect. PLA can inhibit bacteria and fungi extensively and has synergistic effect with other bacteriostats, which has a broad application prospect in food preservation.
phenyllactic acid; antibacterial mechanisms; food preservation; synergistic effect
TS205.9
A
1001-3563(2022)15-0129-08
10.19554/j.cnki.1001-3563.2022.15.015
2021–11–18
河南省高等学校重点科研项目(22A550018);郑州轻工业大学博士科研启动项目(13501050069)
李波(1986—),博士,讲师,主要研究方向为食品包装安全与质量控制。
责任编辑:彭颋

