DLC1缺失可通过减少肿瘤免疫促进膀胱上皮细胞癌进展
杨博,杨中华,张奇峰,张瀚,韦羽,王胜
(1.桂林市人民医院泌尿外科,广西 桂林 541002;2.桂林市人民医院麻醉科手术室,广西 桂林 541002)
0 引言
膀胱癌是泌尿系统最常见的恶性肿瘤,研究表明美国每年约有84000个新发病例和17,000人死亡[1]。2020年世界卫生组织报告显示全球膀胱癌每年新增约60万病例和21万死亡病例,在新发病率总人数中排名第11位,每年癌症死亡率方面排名第14位[2]。此外调查显示2020年膀胱癌在中国男性新发病例数中排名第七位(66242),占总新发癌症病例的2.7%[3]。膀胱尿路上皮癌(bladder urothelial carcinoma, MIBUC)是膀胱癌中发病率最高的一种,虽然近年来新的靶向治疗方法提高了MIBUC患者的生存率,但患者的预后仍不尽如人意,5年生存率仍低于22.07/100000[2]。目前MIBUC发病机制并不明确,因此进一步研究不同分期肿(特别是早期)瘤组织中相关基因或蛋白的变化,有助于进一步明确MIBUC的发病机制可能为早期诊断和治疗提供新的思路。
RHO家族的RAS相关GTP酶(包括CDC42、RAC和RHO)可调节各种细胞增殖、细胞骨架和粘附功能[4-5],多项研究表明RHO活性在多种晚期肿瘤中增加[6]。尽管RAS-GTP酶在肿瘤中经常因突变而被激活[7-8],但这种变化在RHO家族GTP酶中却不太常见[9-10]。相反,其激活剂--RHO特异性鸟嘌呤核苷酸交换因子(GEFs)功能的增加,和/或其失活剂--Rho鸟嘌呤核苷酸解离抑制剂(GDIs)和RHO特异性GTP酶加速蛋白(GAPs)功能的降低可维持RHO家族GTP酶活性[5,11,12]。研究发现GAPs将活性Rho-GTP的γ磷酸酯水解为非活性Rho-GDP[10]。人类基因组中的69个RHO特异性GEFs中,只有少数几个与肿瘤的发生有关。然而,在64个RHO特异性GAPs中,肝癌删除(Deleted in Liver Cancer, DLC)家族的Rho-GAPs成员在癌症中表达减少[13-14]。这个家族由三个密切相关的基因组成。DLC1(也被称为Rho GTPase-activating protein 7, ARHGAP7),DLC2,和DLC3。它们编码的Rho-GAP活性强烈地水解Rho-GTP, 进而导致RAS相关GTP酶失活[15]。一个或多个DLC基因的下调可能与肝癌、肺癌、结肠直肠癌、前列腺癌和乳腺癌相关[16-17]。DLC1是最先发现的Rho-GAPs成员,多项临床和实验研究表明其是一个真正的肿瘤抑制基因。DLC1过量表达可显著抑制肿瘤生长[17],而内源性DLC1的失活与其他基因和/或表观遗传学变化一起,可导致细胞转化和肿瘤形成[18]。然而,DLC1在肿瘤进展和肿瘤免疫学中的潜在功能和机制仍不清楚,且目前DLC1在MIBUC中的表达及临床意义尚未见报道。因此进一步探究DLC1在MIBUC的发病机制,可能为今后临床诊断及治疗提供新思路。
在这项研究中,我们旨在利用TCGA RNA测序数据,并结合生物信息学和统计方法,包括差异表达基因(DEG)分析、基因本体(GO)术语分析、KEGG通路或疾病分析、基因集富集分析(GSEA),以及Logistic & Cox回归分析系统地分析DLC1在MIBUC中的重要性。
1 方法和材料
1.1 数据来源与处理
NCBI网 站Gene Expression Omnibus (GEO)数据库下载数据集GSE52519相关资料,其中包含3例正常膀胱组织及9例膀胱癌组织的RNA测序数据。使用R语言impute和limma包分别进行标准化处理及基因差异性分析。
基因表达数据与临床信息来自TCGA-BLCA项目(癌旁19,膀胱上皮癌414例,数据库:The Cancer Genome Atlas(TCGA),平台:RNASeq,格式:TPM)。通过R语言limma包提取MIBUC表达数据。
1.2 差异行基因分析
GSE52519 RNA数据进行差异性分析后,选取调整后P值(adjusted P value)<0.05及 Log2 fold change (Log2FC)>1.5的基因定义为差异性基因。利用ggplot2和ComplexHeatmap包进行火山图和热图分析。
1.3 DLC1在TCGA-BLCA项目中的表达
非配对样本使用R语言ggplot2进行正态性分布检验及Mann-Whitney U检验(Wilcoxon rank sum test),并绘制DLC1表达箱图。配对样本使用ggplot2进行正态性分布检验后,选择配对样本T检验进行统计分析,并绘制DLC1配对表达差异图。
1.4 免疫细胞浸润的功能富集和分析
GSEA从DLC1差异表达矩阵入手并分析DLC1高表达组和低表达组之间信号通路的差异,以预测与DSEA相关的表型和信号通路。调整后的P<0.05和FDR<0.25被确定为显著的相关通路。使用R软件包clusterProfiler(3.8.0)进行统计分析和绘图。
通过ssGSEA对24种免疫细胞的相对肿瘤浸润水平进行量化,检测各种免疫细胞标志性基因的表达水平[19]。为了进一步探讨DLC1与免疫细胞浸润水平之间的相关性,以及免疫细胞浸润与DLC1不同表达组之间的关系,我们采用了Wilcoxon秩和检验和Spearman相关性分析。
1.5 临床病理特征相关性分析
所有的统计分析都在R包(V3.6.2)中进行。临床病理特征和DLC1之间的关系用Wilcoxon符号秩和检验和逻辑回归进行分析。多变量Cox分析比较了DLC1表达对生存的影响,以及其他临床特征(分期、淋巴结状态、远处转移状态、年龄等)。DLC1表达的临界值是是由其中位数决定的。P<0.05被认为差异有统计学意义。
1.6 MIBUC中DLC1低表达组和高表达组差异性基因分析
使用DESeq2(1.26.0版本)对DLC1低表达组(0-50 %)和高表达组(50%-100%)进行差异性基因分析。调整后的基因P值小于0.05且绝对FC值大于1.5的基因被认为差异有统计学意义。
2 结果
2.1 DLC1在MIBUC中低表达
为探索膀胱尿路上皮癌的潜在机制,我们使用已发表的数据集(GSE52519)分析3例正常膀胱组织和9例膀胱癌组织差异性表达基因(DEGs)。结果显示满足adjusted P value<0.05且 Log2FC>1.0 共有25个基因(图1A),15个显著差异性基因(adjusted P value<0.05及 Log2FC>1.5),其中上调的基因1个,下调基因14个(图1B)。为更好地了解DEGs和膀胱瘤尿路上皮癌之间的关系,我们进一步分析TCGA数据库中的TCGA-BLCA项目(癌旁19列,膀胱上皮癌414例),并分别比较了GSE52519前10个差异性基因在TCGA-BLCA项目中的表达情况(图1C)。与GSE52519变化一致的是DLC1, PRAC1, PLPPR4, ANKDD1A在肿瘤组织中显著下调。鉴于DLC1Log2FC绝对均大于上述其他3个差异性基因,我们选择DLC1做为靶基因以进一步研究,其与MIBUC之间的关系。
接着我们进一步分析DLC1在TCGABLCA项 目 中 非 配 对 样 本(癌 旁:3.92±0.97,肿 瘤:2.45±0.97,P=0.007)及 配 对 样 本(t=-4.990,P<0.001)中的表达情况,结果显示肿瘤组织DLC1表达均显著低于癌旁组织(图1D, 1E)。据此我们想了解DLC1下调是否可以作为MIBUC的一个指标。进一步行诊断性研究中的ROC曲线分析发现DLC1(癌旁 vs 肿瘤,曲线下面积:0.865,置信区间:0.776-0.954)(图1F),该结果表明DLC1下调可作为诊断MIBUC的参考指标。
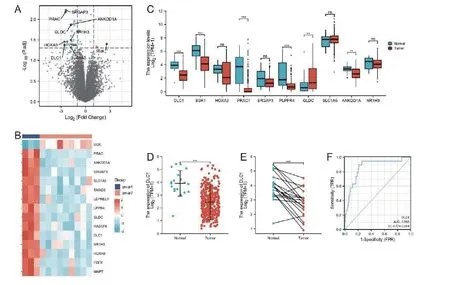
图1 DLC1表达情况分析(A) GSEA52519基因火山图分析。 (B) GSEA52519中15个显著性差异性基因热图。(C)GSEA52519前10个显著差异性基因表达情况。(D-E)TCGA-BLCA项目中DLC1差异性表达情况,(D)非配对样本,(E)配对样本。(F)诊断性研究中的ROC曲线分析
2.2 DLC1基因表达与MIBUC患者临床病理特征相关性分析
为进一步探究DLC1与MIBUC患者临床病理特征间得关系,我们分别对TCGA-BLCA数据中MIBUC患者进行分别进行T、N、M临床分期分析,结果表明正常组织与T1分期中DLC1的表达并无明显差异,但T2、T3、T4期DLC1出现显著下降(图2A)。同样我们观察到N0、N1、N2及N3肿瘤组织中DLC1表达较对照组下调(图2B),M0、M1中DLC1表达也明显低于对照组(图2C)。另外我们还注意到Ⅰ期肿瘤组织DLC1下降不显著,但DLC1的表达明显高于Ⅱ、Ⅲ、Ⅳ期,然而当DLC1下降到一定程度后它的表达并不随着肿瘤分期的增加而改变(图2D)。有趣的是DLC1在中瘤组织中显著下调,且与吸烟、性别、年龄、治疗无关(图2E-H)。为探究DLC1的表达情况是否会影响MIBUC患者生存时间,我们将患者分为高表达DLC1组和低表达DLC1组(表1),并对着两组患者进行生存分析。研究发现总生存期(Overall survival,OS)在DLC1高表达患者和低表达患者中差异有统计学意义(图2I)。
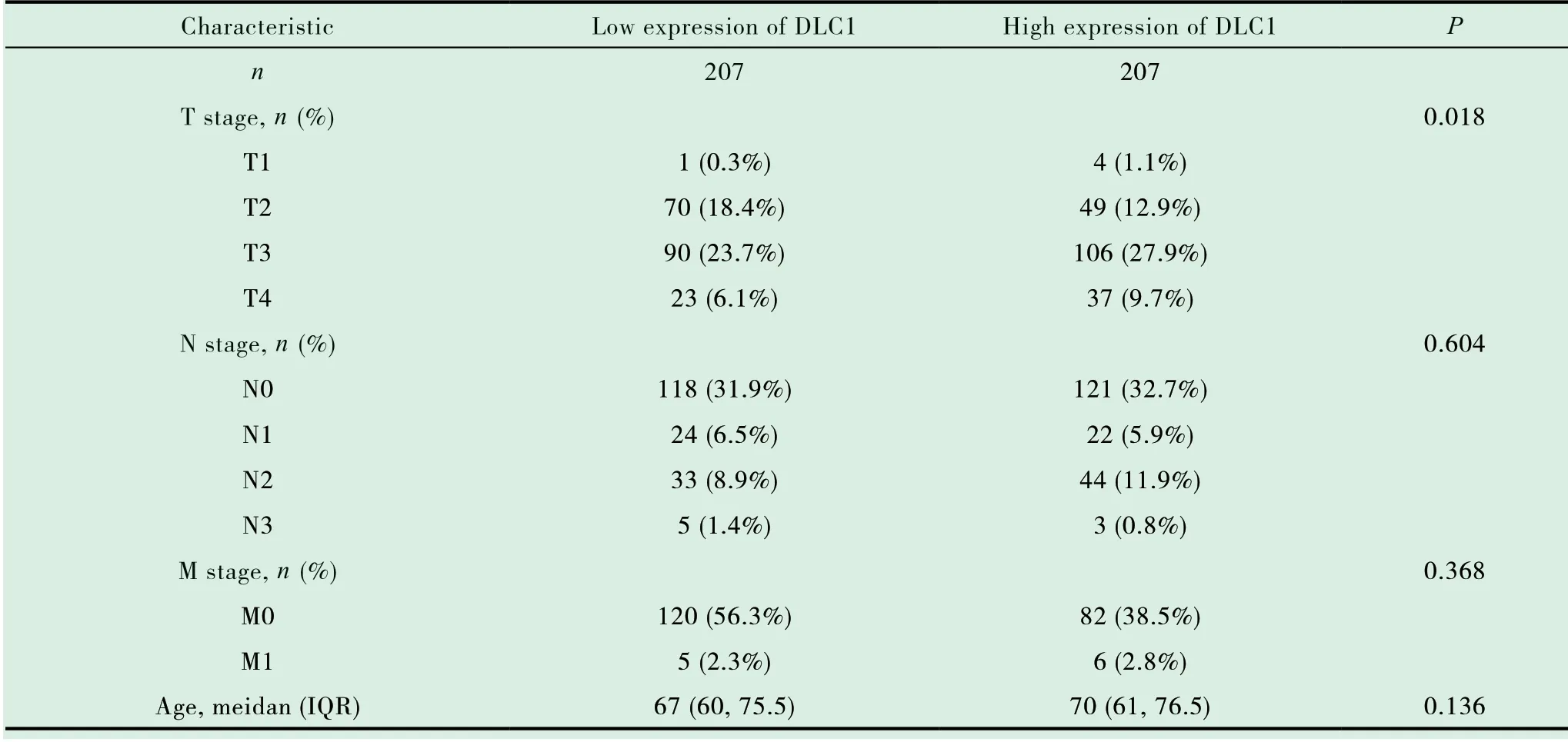
表1 DLC1的表达与临床病理特征相关(逻辑回归)
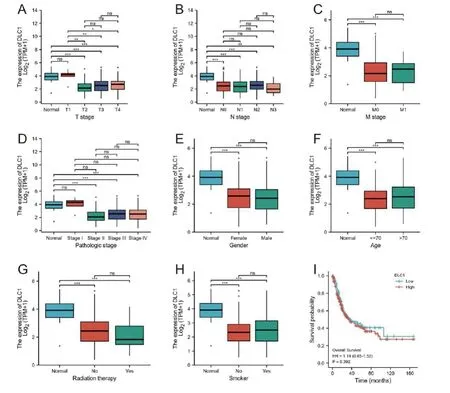
图2 DLC1表达和临床病理特征的关系,包括(A)T分期,(B)N分期,(C)M分期,(D)病理阶段,(E)性别,(F)年龄,(G)治疗,(H)吸烟,(I)生存曲线分析(总生存期 OS)。
2.3 DLC1在可能参与MIBUC的发生发展
既往研究发现,DLC1在肝癌、肺癌中表达下调,因此我们猜测DLC1表达下调可能与肿瘤有关。为证实该猜想,我们进一步分析了DLC1在泛癌中的表达情况。与我们猜测一致的是DLC1在绝大多数肿瘤中低表达(图3A)。接着我们进一步将TCGA-BLCA项目中MIBUC患者分为DLC1高表达组和低表达组并行基因差异性分析。结果显示共有910个差异性基因,我们进一步行GSEA分析发现差异性基因在肿瘤相关通路路上显著富集(NSE>1.5,False discovery rate (FDR)<0.25且p.adjust<0.05)(图3B-E)。另外我们还发现凋亡相关也被显著富集。既往研究表明凋亡减少可导致中瘤细胞增殖,是肿瘤发生发展的重要机制[20]。据此我们近一步猜测DLC1的下调参与MIBUC发病的病理分子机制。
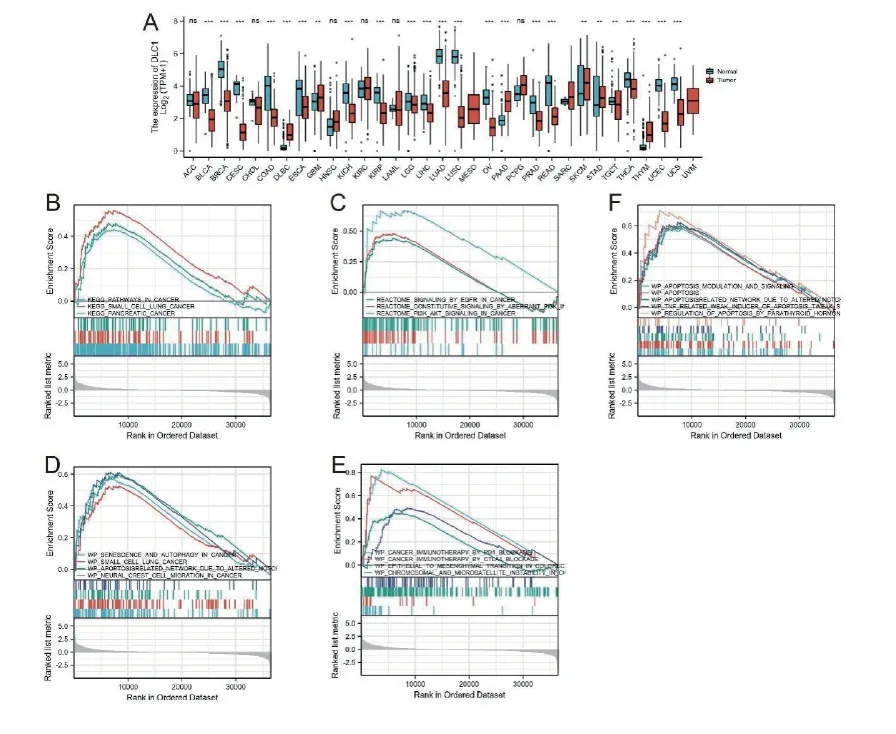
图3 DLC1高表达组与低表达组差异性基因GSEA富集分析。(A)DLC1基因在多种肿瘤中下调。DLC1高表达组与低表达组差异性基因GSEA富集分析,(B-F)差异性基因在肿瘤相关通路显著富集。
2.4 下调DLC1可能减少MIBUC肿瘤组织免疫浸润
最后我们想进一步了解DLC1下调引起肿瘤的发病的可能机制。因此,我们对DLC1高表达组和地表达组间差异性基因进行GO和功能富集分析发现免疫相关通路被显著富集。进一步在TCGA-BLCA项目中分析DLC1与免疫细胞浸润情况,我们发现DLC1与肿瘤组织中多种细胞免疫浸润有关(图4A-B),其中T淋巴细胞、B淋巴细胞、CD8T淋巴细胞、DC细胞、巨噬细胞、NK细胞、T辅助细胞、Th1、Th17细胞在DLC1高表达组显著富集(图4C),且DLC1分别予T淋巴细胞、B淋巴细胞、DC细胞、NK细胞、中性粒细胞、巨噬细胞呈正相关关系(图4D-I)。考虑到DLC1与上述免疫细胞有关,而MIBUC患者肿瘤组织中DLC1显著下调。据此,我们猜测MIBUC发病可能与中瘤细胞DLC1下调后导致免疫细胞浸润减少有关。
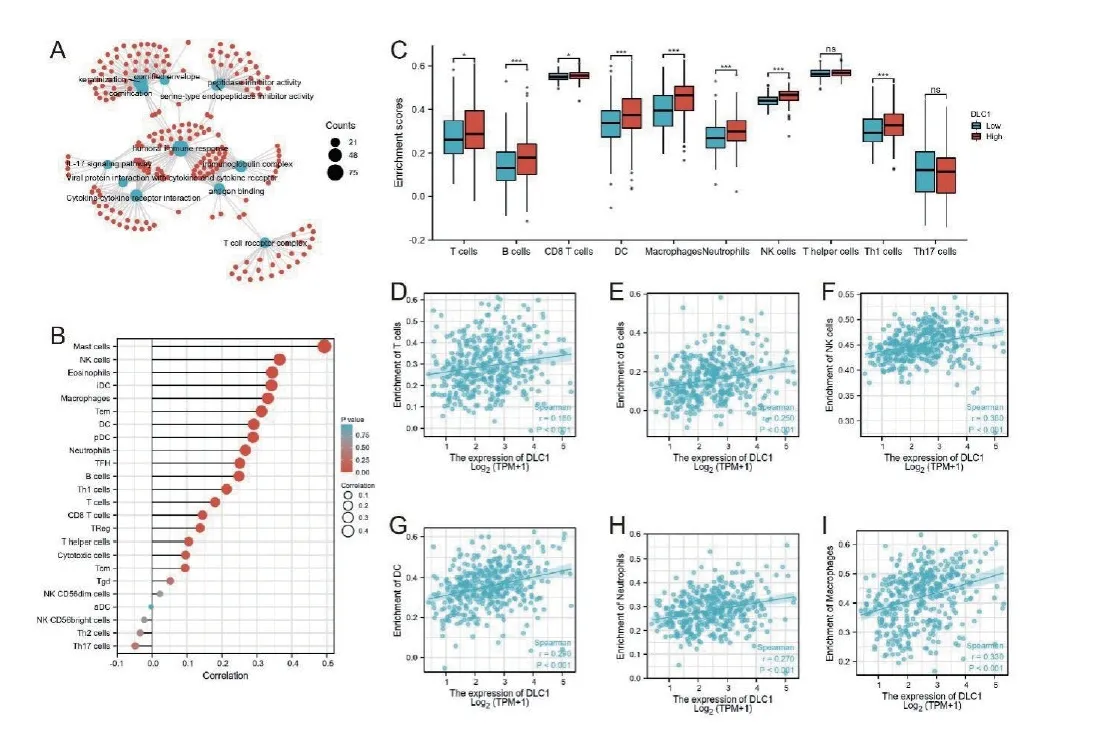
图4 DLG1的表达水平与肿瘤微环境中的免疫浸润有关。(A)DLC1相关差异性基因在免疫相关通路富集。(B)24种免疫细胞的相对丰度与DLC1表达水平之间的相关性。(C-I)箱线图和相关性图显示DLC1高组和低组之间T淋巴细胞、B淋巴细胞、NK细胞、巨噬细胞、树突状细胞、中性粒细胞和Th17细胞浸润水平的差异。
3 讨论
目前DLC1在MIBUC中的表达情况及对MIBUC的影响尚未见相关报道。同时考虑到DLC1在多项肿瘤组织中表达下调,可能与肿瘤的发病有关[16],在这项研究中我们将分析DLC1在MIBUC中的作用。我们通过对GEO数据库及TCGA数据库相关RNA测序数据发现DLC1下调可能是MIBUC的一个重要的发病机制及诊断指标。
DLC1在抑制实体瘤发展方面起着不可或缺的作用[21]。DLC1可通过抑制Rho信号通路抑制肿瘤细胞迁移及侵袭[22]当DLC1下调可导致DLC1-RhoARock1信号激活进而促进肿瘤细胞迁移及侵袭[22-23]。在该项目中,无论是GSE52519数据集,还是TCGABLCA项目,DLC1在MIBUC肿瘤组织的表达均显著低于癌旁组织,且TCGA-BLCA项目中DLC1高表达组与低表达组间的差异性基因在肿瘤相关的通路中显著富集。上述结果表明DLC1表达下调可能通过PD1信号通路、EGFR信号通路、CTLA4信号通路及PI3K等肿瘤相关信号通路促进MIBUC发病。
另外多项研究表明DLC1具有促进细胞凋亡[24],抑制肿瘤细胞增殖的作用[25]。沉默DLC1可抑制胆囊癌细胞凋亡,然而在过表达DLC1的胆囊癌细胞中DLC1可通过促进线粒体向细胞质释放细胞色素C,激活的凋亡信号通路,促进Bax和裂解的caspase-3/8/9的表达,并抑制Bcl-2[24]。另外在肝细胞肝癌HCC细胞系中,过表达DLC1导致RhoA水平明显下降,最终诱导HCC凋亡增加[26]。同样在该项研究中我们发现抑制凋亡相关蛋白在DLC1低表达组显著富集,提示MIBUC发病可能与DLC1下调导致的促凋亡功能障碍有关。
最后,我们的研究发现DLC1可能具有免疫促进的作用,虽然目前尚未见相关文章报道DLC1与肿瘤免疫之间的关系。但在本研究中,我们发现DLC1与多种免疫细胞,如T淋巴细胞、B淋巴细胞、NK细胞、中性粒细胞、DC细胞等成正相关关系。据此我们推测DLC1可能通过促进多种淋巴细胞浸润,抑制肿瘤形成。而DLC1表达将低,可导致异型(异常)细胞清除减少,最终导致中瘤细胞形成及增殖。因此关于DLC1促进肿瘤免疫的研究需进一步实验及临床证实。
这项研究中,我们发现DLC1在MIBUC肿瘤组织中显著下调,它可能通过促进肿瘤细胞增殖、迁移,抑制细胞凋亡促进肿瘤的发生发展,同时中瘤组织中下调的DLC1无法促进免疫细胞向肿瘤组织浸润,进而导致肿瘤免疫抑制,进一步促进肿瘤发生发展。据此我们可以认为DLC1具有肿瘤抑制作用,尽管具体的机制需要通过实验深入研究。

