基于UPLC-Q-Orbitrap/MS 技术对非酒精性脂肪性肝病患者的血清脂质组学研究
田继云 杜晟楠 高静静 袁乙富 曹 勤 蒋元烨
上海市普陀区中心医院消化内科,上海 200062
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是在无酒精和其他明确肝损伤因素的前提下,病理表现为肝细胞内脂肪过度积累所导致的一类慢性肝病,是一种与环境和遗传因素密切相关的代谢类疾病[1]。“二次打击”假说中[2],肝细胞中甘油三酯和胆固醇酯的过多累积会导致线粒体功能损伤,同时引起内质网应激,分泌炎症因子、炎症细胞浸润,从而引发肝细胞的炎症反应、坏死,甚至肝纤维化,损伤肝功能,使单纯性脂肪肝(nonalcoholic fatty liver,NAFL)向非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)发展,最终导致肝纤维化甚至肝癌[3]。此外,NAFLD 与2 型糖尿病和动脉粥样硬化的发病也有着密切的关系[4-5],对人类健康的危害巨大。但其具体发病机制目前尚未完全清楚,脂质组学是基于LC-MS、GC-MS 等高通量的分析技术,对机体不同状态下的脂质水平进行测定,并对其整体脂质成分及与其存在相互作用的分子和基因的表达进行系统性分析,通过脂质代谢及其代谢调控的比较,进而揭示脂质代谢与机体生理、病理过程之间关系的一门学科[6-7]。自2003 年脂质组学这一概念被提出以后,给NAFLD 的发展机制提供了新的解读思路[8],本研究采用UPLC-Q-Orbitrap/MS 分析了NAFLD 患者和正常人群血清脂质组学状况,筛选表征NAFLD 的生物标志物,并对NAFLD 患者脂质代谢的特点进行探讨。
1 资料与方法
1.1 一般资料
选择2020 年1 月至2021 年1 月上海市普陀区中心医院(以下简称“我院”)消化内科诊断为NAFLD的患者30 例为NAFLD 组,另选择同期我院30 名体检确定为身体健康的志愿者作为对照组。记录并统计受试者身高、体重、体重指数、肝功能、肾功能、血脂代谢等临床数据。本研究方案经我院伦理委员会审批(PTEC-R-2020-29-1),受试者均签署知情同意书。
1.2 诊断标准
根据《非酒精性脂肪性肝病中西医结合诊疗共识意见(2017 年)》[9]规定的NAFLD 临床诊断标准,明确NAFLD 诊断需符合以下三项:①无饮酒史或折合成乙醇量,男性<210 g/周、女性<70 g/周;②除病毒性肝炎、药物性肝病、全胃肠外营养、肝豆状核变性、自身免疫性肝病等外可导致脂肪肝的特定疾病。③肝活检组织学改变符合脂肪性肝病的病理学诊断标准。鉴于肝组织学诊断难以获得,NAFLD 定义为:①肝脏影像学表现符合弥漫性脂肪肝的诊断标准且无其他原因可供解释;②有代谢综合征相关表现的患者出现不明原因的血清丙氨酸转氨酶(alanine aminotransferase,ALT)和/或天冬氨酸转氨酶(aspartate aminotransferase,AST)、谷氨酰转肽酶持续升高半年以上。减肥和改善胰岛素抵抗(insulin resistance,IR)后,异常酶谱和影像学脂肪肝改善甚至恢复正常者可明确NAFLD 的诊断。
1.3 纳入标准
①年龄16~75 岁,性别不限;②符合NAFLD 西医诊断标准[10];③各项资料信息、生化及标本采集信息完整可靠;④签署知情同意书。
1.4 排除标准
①合并肝外纤维化疾病包括系统性红斑狼疮、风湿类疾病、肾功能衰竭、慢性阻塞性肺疾病、糖尿病、高血压病、冠心病等;②合并心脑血管、泌尿系统、肾脏、造血系统等原发性疾病,恶性肿瘤、其他严重合并症或精神病;③合并甲状腺疾病,包括甲亢、甲减、亚临床甲减、桥本甲状腺炎。
1.5 仪器与试剂
超高效液相色谱(Ultimate 3000,Thermo);高分辨质谱(Orbitrap Elite,Thermo);冷冻高速离心机(1730R,德国GENE 有限公司);纯水仪(Milli-Q,上海默瑞生物科技有限公司);多管涡旋振荡器(VX-Ⅱ,北京踏锦科技有限公司);甲醇(质谱纯,国药集团化学试剂有限公司,批号:O0621152);甲基叔丁基醚(国药集团化学试剂有限公司,批号:20210227);甲酸(色谱纯,上海安谱科学仪器有限公司,批号:D1290265);乙酸铵(色谱纯,上海安谱科学仪器有限公司,批号:BCBR1129V);异丙醇(色谱纯,上海安谱科学仪器有限公司,批号:V589K144);乙腈(色谱纯,上海安谱科学仪器有限公司,批号:K3021728)。
1.6 血清样本前处理
分别取两组晨间空腹静脉血10 ml,在4℃环境中静置2 h 后1000 g 离心15 min(离心半径为7 cm),取上清液,用于临床血清生化及血脂检测,剩余血清样本分装后于-80℃冰箱冻存。取分装后的血清60 μl,分别加入1000 μl 甲基叔丁基醚、300 μl 甲醇和290 μl纯水,振荡混匀1 min 后,于1000 g、4℃条件下离心10 min,取上层溶液置于新离心管中冷冻干燥,待干燥后加入100 μl 复溶液(异丙醇∶甲醇为1∶1),振荡1 min 后,再以10 000 g、4℃条件离心10 min,取上清液80 μl 转移至进样小瓶待测。
1.7 检测条件
1.7.1 色谱条件 采用Waters ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.8 μm)液相色谱柱;流动相A:乙腈∶水(6∶4,V/V)+乙酸铵(10 mmol/L)+0.1%甲酸,B:乙腈∶异丙醇(1∶1,V/V)+乙酸铵(10 mmol/L)+0.1%甲酸;流速0.3 ml/min;进样量2 μl;柱温45℃。流动相梯度洗脱程序:0 min,30%B;0~2.0 min,30%→43%B;2.0~2.1 min,43%→55%B;2.1~12.0 min,55%→65%B;12.0~18.0 min,65→85%B;18.0~20.0 min,85%→100%B;20.0~25.0 min,100%B;25.0~25.1 min,100%→30%B;25.1~30.0 min,30%B。
1.7.2 质谱条件 质量分析器为静电场轨道离子阱。正负离子模式,以氮气作为鞘气和辅助气,质荷比(m/z)扫描范围为50~1000。正离子模式:加热器温度300℃;鞘气流速:45 psi;辅助气流速:5 L/min;尾气流速:0.3 L/min;电喷雾电压:3.0 kV;毛细管温度:350℃;S-Lens RF Level,30%。负离子模式:加热器温度300℃;鞘气流速:45 psi;辅助气流速:5 L/min;尾气流速:0.3 L/min;电喷雾电压:3.2 kV;毛细管温度:350℃;S-Lens RF Level,60%。
1.8 统计学方法
采用LC-MS 软件进行峰对齐、保留时间校正及峰面积校正,采用LipidSearch 软件鉴定脂质代谢产物。使用主成分分析法(principal component analysis,PCA)和正交偏最小二乘法判别分析(orthogonal partial least squares discrimination analysis,OPLS-DA)对数据进行多维统计分析。其他数据采用SPSS 25.0 统计学软件进行数据处理,符合正态分布的计量资料用均数±标准差()表示,两组间比较采用t 检验;不符合正态分布的采用中位数(M)和四分位数(P25,P75)表示,两组间比较采用秩和检验。以P <0.05 为差异有统计学意义。
2 结果与分析
2.1 两组一般资料及临床生化指标比较
NAFLD 组BMI、AKP、TP、CHE、尿素、TG 高于对照组(P <0.05)。两组年龄、性别、TB、DB、ALB、γ-GT、ALT、AST、总胆汁酸、肌酐、尿酸、GFR、HDL-C、LDL-C、TC 比较,差异无统计学意义(P >0.05)。见表1。
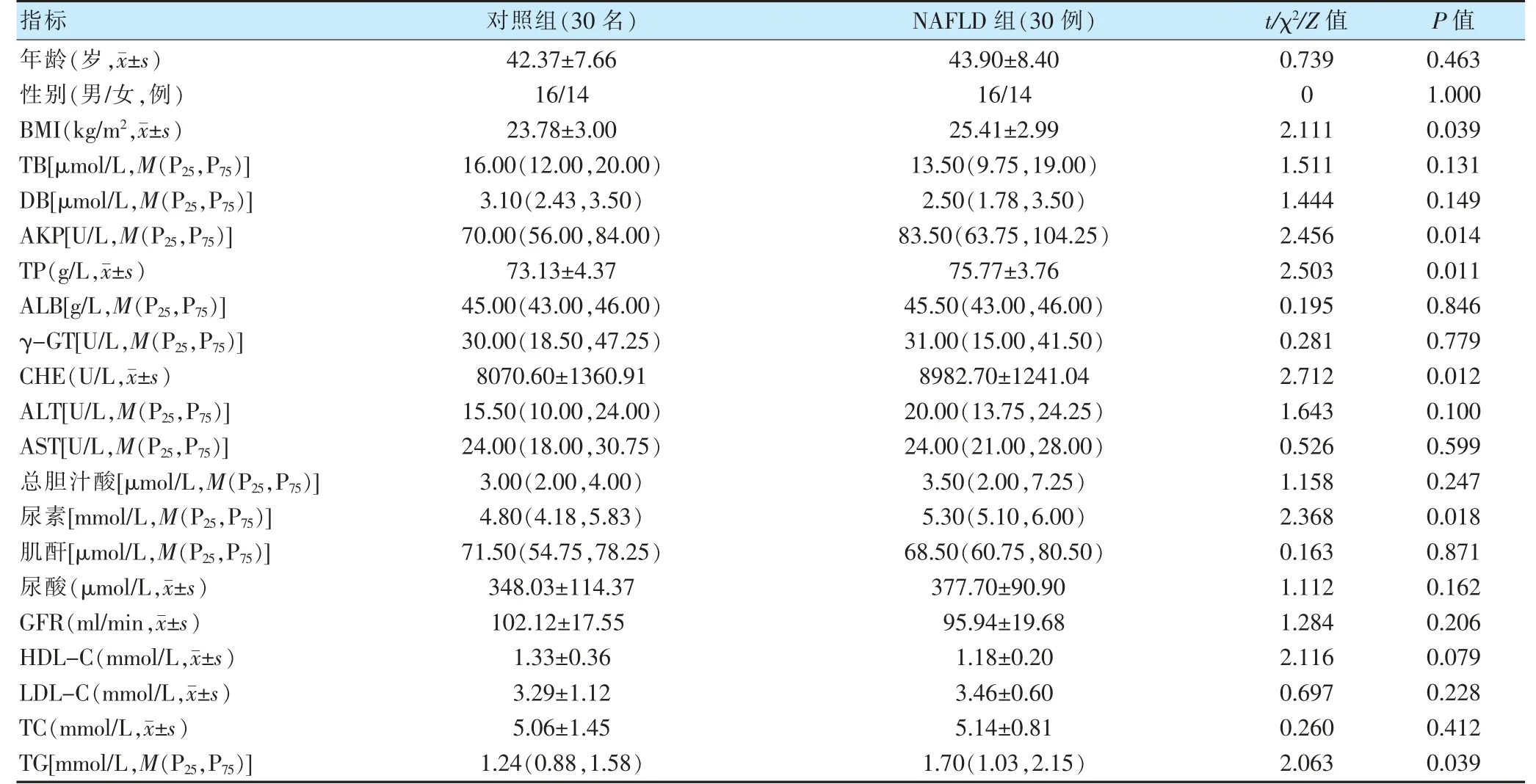
表1 两组一般资料及临床生化指标比较
2.2 两组PCA 结果
将两组正负离子模式下采集的血清样本数据分别进行PCA 分析,得到PCA 图。如图1 所示,在两种扫描模式下,两组样本得到较为完全的分离,提示NAFLD 患者发生代谢紊乱。正离子模式下R2X 和Q2为0.879 和0.798;负离子模式下R2X 和Q2为0.768 和0.854,提示模型良好。
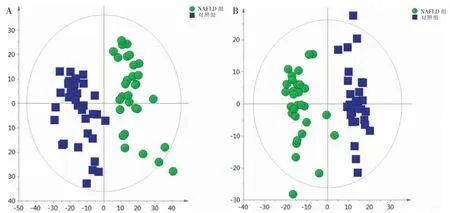
图1 两组样本PCA 图
2.3 两组OPLS-DA 结果
为了寻找可能的差异代谢物,进一步行OPLSDA 分析。如图2 所示,在两种扫描模式下,两组样本完全分离。正离子模式下R2Y 和Q2为0.985 和0.937;负离子模式下R2Y 和Q2为0.913 和0.948,提示该模型拟合度和预判能力良好。
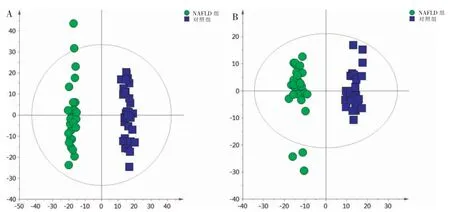
图2 两组样本OPLS-DA 图
2.4 两组差异性脂质生物标志物结果
根据OPLS-DA 结果,筛选出VIP 值>1 及P<0.05 的脂质类差异性代谢物181 个,包括甘油三酯(triglyceride,TG)、甘油二酯(diacylglycerol,DG)、单硬脂酸甘油酯(monoglyceride,MG)、鞘磷脂(sphingomyelin,SM)、磷脂酰肌醇(phosphatidyl inositol,PI)、磷脂酰甘油(phosphatidylglycerol,PG)、磷脂酰乙醇胺(phosphatidylethanolamine,PE)、O-酰基-ω-羟基脂肪酸(O-acyl-ω-hydroxy fatty acids,OAHFA)、溶血磷脂酰肌醇(lysophosphatidyl inositol,LPI)、溶血磷脂酰甘油(lysophosphatidylglycerol,LPG)、溶血磷脂乙醇胺(lysophosphatidylethanolamine,LPE)、溶血磷脂酰胆碱(lysophosphatidylcholine,LPC)、神经酰胺(ceramide,Cer)、磷脂酰丝氨酸(phosphatidylserine,PS)及磷脂酰胆碱(phosphatidylcholine,PC)等。具体数据见表2。
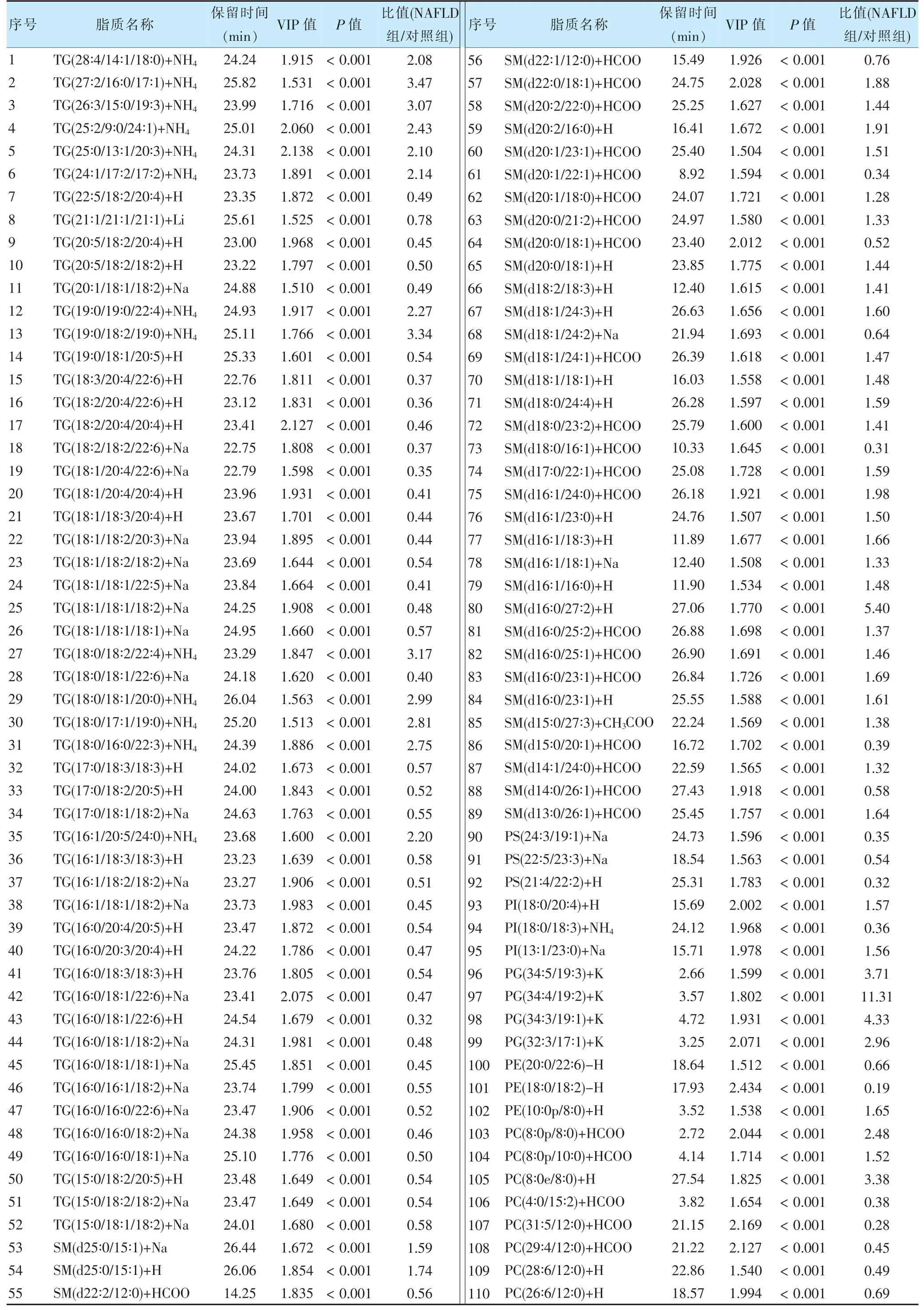
表2 两组差异性脂质生物标志物结果

续表2
3 讨论
肝脏是人体重要的代谢器官,与蛋白质、糖类和脂类的合成代谢有密切的关系,主要参与内源性脂肪的合成与转运[11]。NAFLD 是肝细胞内脂肪堆积过多而引起的病变,已有研究证实,脂质代谢紊乱是NAFLD的重要特征,NAFLD 患者肝脏及血清中TG、DG、游离脂肪酸、脂质氧化产物、鞘脂及多种磷脂类成分与肝的DNL 过程、氧化应激、线粒体和过氧化酶功能异常相关[12-14],脂质分子的种类和水平可能提示NAFLD 的病程和发展趋势[15]。
Puri 等[16]对正常人、NAFL 及NASH 患者肝脏脂质组学分析发现,NAFL 及NASH 组较正常组TG、DG水平明显升高,游离脂肪酸含量不变,TG/DG 值随肝损伤的加重呈逐渐升高趋势。Gorden 等[17]研究结果显示,正常人及脂肪肝病变患者DG 存在显著差异,表明DG 转移酶在NAFLD 的发生发展中发挥作用,并认为DG 的显著增加是NAFLD 的标志。同时,LPE 的含量与肝脏恶化程度呈负相关,NASH 患者LPE 水平较NAFL 患者更低。NAFL 及NASH 患者肝脏总PC水平低于正常人,认为与DG 的合成增加有关。DG 参与NAFLD 时TG、PC、PE 等脂类水平的改变,可能是推动NAFLD 发展的重要信号。Anjani 等[18]在肥胖NASH 妇女循环血液中也发现PC、PE、PI、PG、LPC水平升高,认为在NAFLD 中肝脏及血清的甘油磷脂改变提示了疾病状态下肝脏合成代谢及酶体的异常。
有研究推断,血液中TG 增多时,脂肪酸的合成转换增加,导致肝中乙酰辅酶A 积聚,继而导致酰基胆碱等底物增加,诱导血清胆碱酯酶活性升高[19-20]。血清AKP 的含量增加可能是因为肝脏上皮层受损及胆管内压力增高,导致AKP 大量进入血清,提示了肝纤维化和肝硬化的病理进程[21-22]。
鞘脂是构成生物膜的重要组成部分,SM 可以被鞘磷脂酶水解,生成Cer 等代谢产物,可阻断胰岛素信号传导,诱发IR 和炎症反应[23]。杨蕊旭等[24]研究发现,NAFLD 组血清Cer 含量增加,而在慢性乙型肝炎患者中Cer 水平是降低的。Tu 等[25]也证实在NAFLD小鼠的肝脏及血浆中Cer 及SM 均增加。
由此可见,脂质成分在NAFLD 的发生发展中发挥了重要的作用,多种脂类及其相关的酶参与和改变了NAFLD 的发展[26],脂质组学在NAFLD 的研究中起着重要的作用,深入探讨脂质代谢与NAFLD 的关系意义重大。本研究采用UPLC-Q-Orbitrap/MS 对NAFLD患者和正常人群的血清进行脂质组学研究,发现NAFLD患者较正常人的脂质代谢发生了显著改变,鉴定的181 个脂质生物标志物包括甘油脂类、甘油磷脂、鞘脂类、脂肪酸等多种脂质信号分子,或可作为潜在的NAFLD 的新靶标。但是本研究仍然存在着局限,本研究结果虽已呈现了181 个潜在的脂质生物标志物,但仍缺乏后续更加深入的机制的探索,同时,本研究是单中心研究,患者来源较单一,是否有更进一步的临床转化价值仍然值得深入探索。

