肾脏超声造影对脓毒症急性肾损伤预测价值的前瞻性队列研究
潘思梦 林世龙 宋洁琼 钟鸣 吴威
2016年美国与欧洲重症医学会联合发布脓毒症3.0定义,即机体对感染反应失调而造成的器官功能障碍[1]。一旦并发脏器功能不全,脓毒症患者的死亡率极高。2017年全球约报道4 890万脓毒症病例,其中1 100万例死亡,约占当年全球死亡人口的19.7%[2]。肾脏由于其高氧耗、低摄氧及血流丰富的特点[3],在机体发生脓毒症时相较其他器官更易受到影响[4-5]。约40%~50%的脓毒症患者会发生不同程度的急性肾损伤(AKI),其院内死亡率相比无AKI患者增加6~8倍[6]。临床上长期使用血肌酐水平作为AKI的标记物,但由于其时效的滞后性及易受多种因素影响,并非一种理想的指标[7]。我们通过对肾脏进行普通二维超声及超声造影,对脓毒症患者早期肾功能不全作出筛查,并评价肾脏超声造影对预测脓毒症相关AKI的临床意义。
对象与方法
1.对象:纳入2021年1月~2021年12月于我科接受治疗的脓毒症成年患者93例,均符合脓毒症3.0定义,且患者被诊断为脓毒症的时间<24 h。排除标准:(1)既往有慢性肾功能不全病史或合并肾移植术后、肾脏良恶性肿瘤、肾血管疾病(如肾动脉狭窄、肾动脉纤维肌性发育不良等);(2)有明确非脓毒症诱因(如药物性、尿道梗阻等)。根据改善全球肾脏病预后组织(KDIGO)标准中关于AKI的诊断标准[8],将患者分为AKI组53例和非AKI组40例。48 h内血肌酐升高超过26.5 μmol/L或7 d内增加值超过基线水平的50%或尿量<0.5 ml·kg-1·h-1持续6 h诊断为AKI。本研究已通过我院伦理委员会审核批准(B2021-046R),所有患者或其直系亲属均知情同意。
2.方法
(1)临床资料收集:包括患者年龄、性别、BMI、基础疾病及脓毒症感染来源等基线信息。患者入组后即启动脓毒症集束化治疗,并记录患者入组时急性生理与慢性健康(APACHEⅡ)评分、血压、入组时去甲肾上腺素使用剂量、是否接受肾脏替代治疗、ICU住院时间、总住院时间及28天死亡率。
(2)实验室检查:检测患者入组24 h内(即基线)血肌酐水平,计算估算的肾小球滤过率(eGFR),此后每日随访血肌酐水平至第7天。收集患者入组24 h内尿液检测尿渗透压。
(3)肾脏超声检查:于脓毒症起病后首个24 h内使用Philips CX50彩色多普勒超声仪的凸阵探头(频率为3.5 MHZ)对患者双侧肾脏血流进行半定量分级以评估血流灌注情况,共分为4级[9]:0级:无可见血流;1级:肾门附近可见少量血流;2级:叶间动脉可见血流;3级:弓状动脉可见血流,并测量以肾小叶间动脉为主的血管阻力指数(RI)。进一步选取超声造影模式,并静脉推注含有15 mg六氟化硫微泡的超声造影剂,进行同步动态图像采集。通过QLAB 13.0软件在肾脏皮质、髓质区域分别选取3处同等大小的关注区域(ROI),并分析区域内时间-强度曲线(TIC),主要依据随时间轴推移,ROI内回声强度的变化来计算相关参数,包括上升斜率(WIS)、峰值强度(PI)、平均通过时间(MTT)、上升时间(RT)、达峰时间(TTP)。取3个ROI的平均值作为结果以减少测量误差。

结 果
1.两组患者基线资料比较:AKI组患者入组时APACHEⅡ评分、去甲肾上腺素使用剂量均高于非AKI组,入组时平均动脉压低于非AKI组(P<0.05),而两组患者其余指标比较差异均无统计学意义(P>0.05)。见表1。

表1 两组患者基线资料比较
2.两组患者临床结局比较:AKI组需要接受肾脏替代治疗患者比例和28天死亡率均高于非AKI组(P<0.001),而两组患者ICU住院时间及总住院时间比较差异均无统计学意义(P>0.05)。见表2。

表2 两组患者临床结局比较[M(P25,P75)]
3.两组患者实验室检查结果比较:AKI组患者基线血肌酐水平高于非AKI组[78.0(62.0,107.5)μmol/L比64.0(46.5,80.5)μmol/L,Z=2.701,P=0.007],eGFR及尿渗透压均低于非AKI组[(52.9±31.1)ml·min-1·(1.73 m2)-1比(87.5±25.0)ml·min-1·(1.73m2)-1,t=5.770,P<0.001;(359.3±102.5)mOsm/kg比(469.6±147.3)mOsm/kg,t=3.724,P<0.001]。
4.两组患者肾脏超声检查结果比较:非AKI组左肾及右肾血流半定量分级为3级患者比例均高于AKI
组(P<0.05),而两组患者肾脏RI及其余血流半定量分级比较差异均无统计学意义(P>0.05)。见表3。肾脏皮质区域超声造影中的TIC见图1。不论在肾脏皮质或髓质取样分析,AKI组WIS和PI均低于非AKI
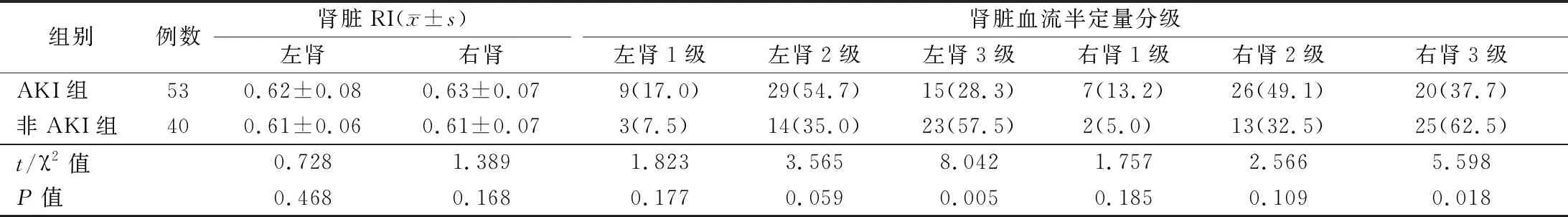
表3 两组患者肾脏超声检查结果比较[例,(%)]


图1 肾脏皮质区域超声造影中的TIC(A:非AKI组;B:AKI组)
组,而RT、TTP及MTT均高于非AKI组(P<0.05),见表4。93例患者肾脏髓质MTT和WIS均低于皮质[(32.4±11.5)s比(27.9±10.5)s,t=2.783,P=0.006;11.0±6.3比13.2±7.7,t=2.066,P=0.040],而肾脏髓质与皮质PI、RT、TTP比较差异均无统计学意义[93.2±25.6比97.8±27.4,t=1.205,P=0.230;(8.8±4.5)s比(7.8±4.5)s,t=1.395,P=0.165;(22.9±9.6)s比(21.7±9.5)s,t=0.899,P=0.370]。

表4 两组患者肾脏超声造影的TIC相关参数比较[M(P25,P75)]
5.基线血肌酐与肾脏超声造影的TIC相关参数对脓毒症AKI的预测价值比较:ROC曲线分析结果显示,肾脏皮质的WIS、TTP及肾脏髓质的RT、WIS、TTP预测脓毒症AKI的AUC、敏感度及特异度均高于基线血肌酐(P<0.05)。见表5。

表5 基线血肌酐与肾脏超声造影的TIC相关参数对脓毒症AKI的预测价值比较
讨 论
脓毒症并发AKI患者院内死亡风险更高,并伴有更长的住院时间[10-11]。本研究发现,AKI组患者28天死亡率高于非AKI组。因此早期识别肾损伤的发生可使临床医师采取一定肾保护措施,避免使用肾毒性药物等导致肾功能进一步恶化,并导致不良预后[12]。
血肌酐作为AKI的标志物具有滞后性,初次变化一般在AKI发生后的24~48 h,且在肾小球滤过率下降达到基础值的50%后才会出现明显上升[7]。肌酐和肾小球滤过率的非线性关系导致其不能较灵敏地提示早期肾损伤[13]。而脓毒症患者存在诸多干扰血肌酐水平的因素,如肌肉消耗导致肌酐生成减少、液体复苏造成的血液稀释又掩盖了血肌酐实际水平的上升[14]等,因此,某个时间点的单次血肌酐意义有限。虽然KDIGO的诊断标准是目前诊断AKI的金标准,但其主要依靠在一段时间内动态监测血肌酐水平的变化,早期识别能力有限。
床旁超声因其无创、便捷、可重复性高的特点在重症领域得到广泛应用。肾脏血流半定量分级及肾脏血管RI获取简单,可作为肾功能初筛的指标。但研究发现其测量精度有限,影响因素众多,会导致敏感度和特异度降低[15]。超声造影借助直径<10 pm的微气泡造影剂,并追踪其在血管内的强度来可视化微循环、量化血流,达到肾脏灌注的准确评估[16]。PI为局部区域内TIC最高点所对应的强度值,其降低表明ROI内的平均血容量减少。RT是指从峰值强度的10%上升至90%所需要的时间,其增加提示微循环灌注恶化。WIS为ROI内TIC上升支的倾斜角度,斜率越小提示肾脏灌注越差,可能存在微血管床局部堵塞。TTP为灌注强度上升至峰值所需的时间,其延长表明局部肾脏灌注速度减慢。MTT为造影剂到达ROI后灌注强度下降为峰值强度的50%所需的时间,反映了肾脏局部清除造影剂的速度,同样提示肾脏微循环是否存在血流缓慢、微循环障碍。本研究结果显示,AKI组患者脓毒症起病24 h内的TIC相关参数即出现明显恶化,其肾脏微循环灌注显著劣于非AKI组患者。本研究还发现,脓毒症患者起病24 h内肾髓质的MTT较肾皮质下降,提示肾脏髓质灌注更早受到损伤。这可能缘于不同的供血分布决定髓质较皮质更容易发生微循环障碍[17]。
本研究结果显示,脓毒症起病24 h内超声造影的TIC指数特别是WIS和TTP较基线血肌酐更有优势,同时具备更好的敏感度和特异度。再次提示血肌酐作为早期预警指标效能欠佳;同时也说明肾脏超声造影利用实时的微循环可视化技术,实现了肾脏灌注的精确测量[16],可在脓毒症早期提示临床医师及时采取预防措施,保护肾功能。
本研究表明,超声造影技术可有效预警脓毒症早期出现的肾脏微循环障碍,进一步预示后续肾功能不全的可能。本研究尚存在不足:作为一项单中心研究,纳入的病例数量有限,可能存在偏差,后续应继续扩大研究样本量;超声技术是一项主观因素较强的检查手段,不同的操作人员可能得到不尽相同的测量结果,如何建立标准化的操作流程以尽量减少系统性误差需要进一步探索。

