基于促进心肌能量代谢的复苏策略对家兔失血性心跳骤停效果的初步观察
张 琳,于 蕊,宗兆文,叶 钊,钟 鑫,贾益君,蒋仁庆,周小林,杨昊洋,杜文琼
400038 重庆,陆军军医大学(第三军医大学)陆军卫勤训练基地战救技能训练教研室/创伤、烧伤与复合伤国家重点实验室1;050083 石家庄,陆军军医大学士官学校战术卫勤系2;400037 重庆,陆军军医大学(第三军医大学)第二附属医院骨科3
大出血及出血性休克是战场上导致可预防性死亡的最常见原因,占所有创伤性伤亡的40%以上。死亡的主要机制是失血性休克引发心脏骤停,被称为失血引发的创伤性心跳骤停(hemorrhage-induce traumatic cardiac arrest, HiTCA)。HiTCA的救治成功率非常低,一度被认为对其进行心肺复苏是徒劳的。后经临床实践和研究表明,使用全血和血液制品及时进行复苏可促进自主循环恢复(return of spontaneous circulation, ROSC),成功率接近内科性心跳骤停(medical cardiac arrest, MCA)。创伤和失血后出现的高血糖、高血钾、酸中毒等病理变化,对创伤性心跳骤停(traumatic cardiac arrest, TCA)复律和脏器功能可能有重要的影响。其中,血糖和血钾变化是失血后常见的变化,对心肌能量代谢和TCA后的复律有明显影响。目前尚末有针对上述病理变化的救治策略的研究。假设通过补充三磷酸腺苷(adenosine triphosphate,ATP)和使用改进的极化液(glucose-insulin-potassium, GIK)方法促进心肌能量代谢,可改善HiTCA后的ROSC和脏器功能恢复,本文针对这一假设进行验证。
1 材料与方法
1.1 实验材料
三磷酸腺苷、胰岛素、氯化钾、葡萄糖购自重庆医药公司;酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒购自美国Signalway Antibody LLC公司;手持式血气分析仪购自新加坡Flextronics公司;BC-5180 CRP型全自动全血细胞计数仪购自中国深圳迈瑞公司;HB-P01全自动干式生化分析仪购自光宝医疗器械常州有限公司;rac-030自动凝血分析仪购自中国深圳雷诺生命科学有限公司;微孔板光密度仪(MR-96A)购自中国深圳迈瑞公司。
1.2 动物分组和制模
20只家兔[实验动物生产许可证号为SCXK(渝)20170002,使用许可证号为(渝)20170002]。本实验已获陆军军医大学校伦理委员会许可(AMUWEC 20192178),雌雄不拘,质量(2.82±0.43)kg,(9.5±0.45)月龄,通过随机数字分组法分为A、B两组(n
=10),通过控制性失血法制备HiTCA模型。制模前,1%戊巴比妥钠以5 mL·kg的剂量腹腔注射麻醉家兔,然后左侧颈总动脉置管用于持续监测平均动脉压(mean arterial pressure, MAP)、收缩压、舒张压和心率以及采集动脉血做血气分析。右侧颈内静脉置三通管用于采集血样,检测血常规、常规凝血象和血生化以及用于输注复苏液体。左侧股动脉置管,用于控制性抽取血液降压。完成上述工作后,从股动脉置管中以2 mL/(kg·min)的速度抽取血液,直至收缩压<20 mmHg,且持续20 s以上;此时,判定HiTCA动物模型制备成功。抽取的血液用柠檬酸磷酸葡萄糖储存,室温20 ℃下保存,用于下述的复苏策略。1.3 复苏策略
制模成功后10 min内,2组动物分别接受全血回输和全血回输+三磷酸腺苷+改进GIK治疗。两组均回输抽取的全血,输注速度均为3 mL·kg·min。上述时间点的选择模拟我军《战伤救治规则》中规定,即战现场急救在伤后10 min内完成。改进的GIK方法为:根据测量的葡萄糖和钾浓度应用GIK疗法,即根据测量的葡萄糖和钾浓度调整胰岛素、葡萄糖与钾离子之间的比例:如果葡萄糖水平>6.0 mml/L,钾离子浓度>5.5 mmol/L,则胰岛素剂量为0.1 U/kg在5 min内泵入,不补充氯化钾;如果葡萄糖水平在3.0~6.0 mml/L之间,钾离子浓度在3.5~5.5 mmol/L之间,则使用相同剂量胰岛素的标准GIK方案(200 g/L葡萄糖、50 U/L胰岛素和80 mmol/L氯化钾)。如果钾离子浓度<3.5 mmol/L且葡萄糖水平<3.0 mml/L(大出血后非常罕见),则使用高糖和适当体积的氯化钾调整GIK;如果只有血糖或钾水平异常,则相应地调整GIK治疗。ATP使用方法:每小时每只动物静推0.1 mL。
收缩压恢复至50 mmHg、维持1 min以上且可触及颈总动脉搏动判定为ROSC。从复苏结束至恢复ROSC计时,各组间进行比较。ROSC后,持续监测MAP和心率,TCA后1 h内每隔20 min记录1次MAP和心率,1~4 h每隔1 h记录1次MAP和心率,4~8 h每隔2 h记录1次MAP和心率,8~24 h每隔4 h记录1次MAP和心率。
1.4 实验室检测指标和方法
麻醉后制模前(0 h)、制模后1、4、8、24 h取血检测各项实验室指标。使用手持式血气分析仪测定动脉血气,记录乳酸和血氧饱和度(SaO)。使用全自动全血细胞计数仪计数血细胞,记录红细胞和血小板数量。各时相点1.5 mL静脉血低速离心后取血浆使用HB-P01全自动干式生化分析仪检测血糖、钾离子、肌酐、尿素氮、谷丙转氨酶、谷草转氨酶、肌酸激酶同工酶-MB的浓度;使用rac-030自动凝血分析仪检测常规凝血象,记录国际标准化比值(international ratio, INR)。
制模后24 h,所有血液标本收集后,以过量氯化钾溶液静推致死动物。如果在实验终点前动物发生死亡,其各项测量指标统计至其死亡前一时相点。死亡判断标准:收缩压为0 mmHg,无自主呼吸,持续时间>3 min。
1.5 ELISA检测
ELISA检测指标包括S100β蛋白, C反应蛋白(C-reaction protein, CRP)和Syndecan-1。1.5 mL血液低速离心后取血浆按照说明书进行ELISA检测,方法简述如下:将100 μL各稀释液(标准、空白和样品)添加到适当的孔中,并用平板密封剂覆盖平板,在37 ℃下培养2 h。然后从每个孔中取出液体,将100 μL检测试剂A工作溶液添加到每个孔中,然后在37 ℃下将培养皿再培养1 h。孵育后,吸入溶液,并用300 μL洗涤液洗涤孔3次。随后,向每个孔中添加100 μL检测试剂B工作溶液,并在37 ℃下培养1 h。培养后,再次清洗孔,然后向每个孔中添加90 μL底物溶液,并将平板再培养15 min。最后,向每个孔中添加50 μL终止液,并通过轻敲板的侧面进行混合。从平板底部去除所有水滴和指纹,并确认液体表面没有气泡,然后立即用微孔板光密度仪在450 nm处测量吸光度来测量上述标记物的浓度。
1.6 统计学分析
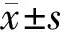
2 结果
2.1 ROSC、生存率和生理指标变化情况
各组动物达到HiTCA制模成功时的失血量之间无显著性差异,分别为(67.4±5.87)mL和(62.6±8.06)mL(P
>0.05)。2组家兔自主循环恢复率均为100%,从复苏至获得ROSC时间分别为(104±7.52)s和(98±6.03)s,无显著差异(P
>0.05)。恢复ROSC后,A组和B组动物MAP在1 h输注血液后趋于稳定,波动在(64.6±6.22)~(86.8±7.43)mmHg之间,B组动物稍高于A组,但无显著性差异(P
>0.05,图1A)。心率在HiTCA后处于最高值,约为150~160次/min,然后逐渐降低并趋于平稳,波动在88~115次/min左右,两组之间无显著差异(P
>0.05,图 1B)。两组动物SaO在0 h最高,为100%;HiTCA后各个时相点波动在91.4%~96.7%,B组数值略高于A组,但两组之间无显著差异(P
>0.05,图1C)。
A:两组平均动脉压变化情况;B:两组心率变化情况;C:两组血氧饱和度变化情况
A组8~24 h内死亡2只动物,B组动物24 h内无死亡发生。
上述结果可见,全血回输基础上增加ATP和极化液后心率等生理指标稍好于全血输注,并可一定程度减少死亡率。
2.2 实验室检测指标变化
与基础值相比,HiTCA后葡萄糖和钾离子浓度显著升高(P
<0.05,表1);与A组相比,接受GIK治疗的B组的葡萄糖和钾浓度显著降低(P
<0.05,表1)。A组和B组的红细胞计数、血小板计数显著低于基础值(P
<0.05,表1),且随着时间延长,和基础值相差越大;2组之间红细胞计数、血小板计数无显著差异(P
>0.05,表1)。在0 h和1 h的时间点,2组间乳酸、肌酐、尿素氮、谷丙转氨酶、谷草转氨酶和肌酸激酶同工酶-MB的浓度无统计学差异(P
>0.05,表1)。HiTCA后4 h,B组乳酸、肌酐、尿素氮、谷丙转氨酶、谷草转氨酶和肌酸激酶同工酶-MB的浓度显著低于A组(P
<0.05,表1)。这些数据表明ATP和GIK治疗对心脏、肾脏和肝功能有保护作用。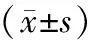
表1 各组动物实验室检测指标变化情况
与基础值相比,2组的INR值显著增加,呈创伤凝血病的表现。在0 h和1 h的时间点,两组间INR无显著差异(P
>0.05,图2),而在4 h后的各个时相点,B组的INR值低于A组(P
<0.05,图2)。这一结果表明,ATP和GIK治疗可改善HiTCA后的凝血功能障碍。
a: P<0.05,与A组比较
2.3 ELISA检测结果
在HiTCA后4 h的各个时相点,B组CRP浓度低于A组(图3A),这一结果表明ATP和GIK治疗有助于减轻HiTCA后的炎性反应。

a: P<0.05,与A组比较
与基线值相比,各组的Syndecan-1浓度均明显升高(图3B)。从HiTCA后4 h的各个时相点,B组Syndecan-1浓度明显低于A组(P
<0.05)。因为Syndecan-1具有肝素效应的内皮糖萼成分,可能导致凝血病,因而B组中syndecan-1低于A组与B组INR值低于A组有关,表明ATP和GIK治疗有助于减轻HiTCA后凝血病的严重程度。S100β是脑损伤的有效标志物。在HiTCA后8 h和24 h两个时相点,B组S100β浓度低于A组(P
<0.05)。这表明全血复合ATP、GIK治疗对HiTCA后脑组织有保护作用(图3C)。3 讨论
HiTCA后会发生高血钾、高血糖等病理生理改变,目前研究结果显示高血钾对创伤修复是负向作用,但高血糖在HiTCA中的作用尚存一定的争议。
创伤后的急性高血糖主要是由应激引起的下丘脑-肾上腺低生理应激反应引起的,应激反应受创伤严重程度、休克发生率和年龄的调节。失血性休克是哺乳动物中最强烈的应激源,可引发最高水平的皮质醇和儿茶酚胺,进而诱发显著的高血糖。既往研究显示,高血糖对创伤患者预后既有负面影响,也有正面的影响,TCA患者也是如此。一些研究支持高血糖在心跳骤停期间有益的假设。相反,RUSSO等发现,心跳骤停患者入院后96 h内平均血糖水平升高与死亡率增加和严重神经功能障碍相关。由于使用全血复苏本身促进ROSC的概率较高,因而本文研究发现,使用ATP和改进后的GIK治疗没有明显提高ROSC的概率,但这种治疗方法却明显改善了乳酸浓度、血压、凝血等指标,并最终减轻了心脏、肝脏、肾脏和脑的功能损伤。
本研究表明,TCA后结局的关键是心脏能否有效利用葡萄糖,并满足产生力量的能量需求。一方面,基于实际葡萄糖和钾浓度的GIK治疗可能增加心脏和其他脏器的葡萄糖利用率,ATP进一步提供了脏器能量代谢所需物质,这些有助于促进ROSC和维持其他脏器功能;另一方面,它可以减少高血糖的负面影响。结果发现,ATP和GIK治疗后CRP浓度显著降低,表明GIK治疗可减轻HiTCA的炎症反应。此外,发现GIK治疗后凝血各项指标有所改善。研究结果显示,急性高血糖会加剧创伤诱导的内皮细胞和糖萼损伤,因此,ATP和GIK疗法对凝血功能的改善可能是由对内皮细胞的保护作用引起的。Syndecan-1是具有肝素效应的内皮糖萼的一种成分,已证明较高水平的Syndecan-1可能导致凝血病。ATP和GIK治疗后血小板活化的降低也可能有助于凝血功能提高,如血小板计数和MA值升高。GIK降低酸中毒水平可进一步改善凝血功能。凝血功能的改善可能会提高ROSC的获得率和关键器官的整体功能。同时,改进后的GIK治疗明显降低了HiTCA后的血钾水平,其可能对维护内皮细胞功能有重要作用,进而可进一步减轻HiTCA后凝血病的严重程度,减轻各脏器损伤的严重程度。同时,GIK和ATP治疗后的乳酸水平降低、能量利用增加和血钾浓度降低对心脏、肝脏、肾脏和脑组织等有直接的保护作用,进而减轻HiTCA导致的损伤。
本研究尚存在一定的局限性。一是本研究选用家兔作为研究对象,既往研究多以猪或狗作为研究对象,结果的可比性需要进一步验证。选择家兔作为研究对象的主要原因是市场上针对家兔的抗体、ELISA等试剂盒明显多于猪和狗,有利于进行机制研究;次要原因是家兔的凝血系统同人比较接近,而狗或猪与人相比呈现高凝特性。二是本研究和其他研究一样,使用单纯失血制造HiTCA模型(因其操作方便,易于制备标准化动物模型),与真实创伤中很少有单纯失血导致HiTCA的情形。在以后的研究中,将验证ATP+GIK治疗对创伤合并大出血所致TCA 中的效果。三是本研究未观察心肺复苏对ROSC和脏器功能的效果,主要原因是许多研究证明心肺复苏对HiTCA的结局是有害的。

