脐带间充质干细胞来源的外泌体对大鼠创伤性胰腺炎损伤的修复
韩 丽,陈思平,赵治戎,周世波,周黎晨,吉 华,唐 政,谭 震,王 涛,戴睿武
610031 成都,西南交通大学医学院临床医学系1;610083 成都,西部战区总医院普通外科2
创伤性胰腺炎作为急性胰腺炎的一种特殊类型,因其发生后伤情严重,伤后死亡率较高,所以在腹部战创伤救治中占重要的地位。由于胰腺是腹腔内富含消化酶的实质性脏器。胰腺损伤后,胰腺及周围组织发生自身消化,进一步加重胰腺损伤,同时还可能遭受急性胰腺炎样的“二次打击”,进而诱发全身性炎症。其次,胰腺创伤后,因胰腺组织修复缓慢甚至停滞,极易出现胰腺及胰周组织坏死等严重的局部/全身并发症,常危及患者生命。目前对于胰腺创伤的治疗主要集中于相应症状的基础治疗以及1期手术治疗,仅限于早期挽救生命、控制伤情,但对胰腺毁损组织的修复以及胰酶渗漏后引发的炎症反应及其后续内分泌细胞损伤尚无有效的抑制措施。
脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)作为间充质干细胞中的一种类型,拥有获取方便、免疫原性低、细胞原始性高等明显优势效应。近年来研究报道hUC-MSCs主要通过以旁分泌方式产生外泌体从而发挥生物学效应。脐带间充质干细胞来源的外泌体(human umbilical cord mesenchymal stem cells exosome,hUCMSC-Ex)是细胞内吞作用产生的能够分泌到细胞外参与细胞通讯功能的囊泡。外泌体内含有多种成分,包括蛋白质、RNA等,主要存在于血液、尿液、唾液和腹水中,可在mRNA水平上影响基因表达,从而参与调控损伤后的炎症反应、血管生成、细胞保护、生物发育和表观遗传调控、免疫调节、肿瘤发生进展等生理和病理过程。既往研究证实hUCMSC-Ex在组织损伤修复,控制炎症反应、治疗缺血性疾病等方面有着丰富的应用空间。本研究利用西部战区总医院前期自行研发的小动物多功能撞击仪建立基于损伤范围控制的大鼠胰腺创伤模型,探究 hUCMSC-Ex对大鼠创伤性胰腺炎损伤后的修复作用,并探讨其安全性与有效性,为胰腺创伤的临床救治提供理论依据和新的治疗方向。
1 材料与方法
1.1 实验材料
研究采用成年雄性健康SD大鼠60只,体质量200~250 g,购自成都达硕实验动物有限公司[动物许可证号:SCXK(川)2020-030]。多功能动物撞击仪已获授权专利(专利号:ZL2016 1 0347341.5)。动物麻醉机和麻醉异氟醚由深圳瑞沃德生命科技有限公司提供。超速离心机型号:CP100MX。透射电镜型号:HT-7700。hUC-MSCs由成都康静生物细胞制备中心提供(批号:B06200407);血清淀粉酶、脂肪酶以及大鼠 IL-6、IL-10、TGF-β、TNF-α的ELISA试剂盒均购自上海茁彩生物科技有限公司;CD9抗体,TSG101抗体购自Abcam公司;Bax抗体购自proteintech公司;Caspase-3抗体和β-tubulin抗体购自Affinity公司。
1.2 方法
1.2.1 外泌体的提取与鉴定
1.2.1.1 hUC-MSCs的传代培养 冻存hUC-MSCs置于37 ℃水浴锅中解冻,加入DMEM/F12培养基;在37 ℃、饱和湿度、5% CO培养箱中培养,每2~3天换液1次。倒置显微镜观察细胞生长,密度达到80%-90%时用0.25% EDTA胰酶消化,1∶3传代。选取第3~5代进行后续实验。采用流式分析仪鉴定hUC-MSCs的表面特异性抗原(CD29、CD44、CD45、CD34)。
1.2.1.2 hUC-MSCs来源的外泌体的提取与鉴定 将第3代hUC-MSCs移至新的离心管内,2 000×g
、4 ℃离心30 min。取上清液,10 000×g
、4 ℃离心45 min,以去除较大的囊泡。取上清,0.45 μm滤膜过滤,收集过滤液。将过滤液4 ℃、100 000×g
离心70 min。去除上清,用10 mL预冷的1×PBS重悬后,4 ℃、100 000×g
再次离心70 min。去除上清,用200 μL预冷的1×PBS重悬。取40 μL电镜观察、50 μL提取蛋白、10 μL无菌检测,剩余外泌体于-80 ℃保存。取10 μL外泌体滴加于铜网上沉淀1 min,吸去浮液。醋酸双氧铀10 μL滴加于铜网上沉淀1 min,吸去浮液,常温干燥数分钟,电镜检测并拍照。使用BCA蛋白质检测试剂盒测量蛋白质浓度。通过凝胶电泳分离等量变性蛋白质,然后进行转膜上,一抗孵育(Bax 1∶5 000;Bcl-2 1∶2 000;Caspase-3 1∶2 000;β-tubulin 1∶2 000)孵育12 h,然后在室温下用孵育二抗。最后在化学发光凝胶成像系统中曝光成像,检测外泌体组特异性表面蛋白CD9的表达。1.2.2 动物建模与分组 将大鼠随机分为4组(n
=15):①对照组(control组:异氟烷麻醉后开腹,用无菌棉签翻动胰腺几次,关腹。经尾静脉注射生理盐水约1 mL)。②创伤性胰腺炎组(TP组:开腹后分离出胰腺组织。将多功能撞击仪的挤压参数设为3 cm/10 kg对胰腺组织进行冲击和挤压,随后常规逐层关腹,经大鼠尾静脉注射生理盐水约1 mL)。③TP+hUC-MSCs组(建模后经大鼠尾静脉注射hUC-MSCs 2×10/100 g)。④TP+hUCMSC-Ex组(建模后经大鼠尾静脉注射hUCMSC-Ex 10 μg/100 g)。建模成功的大鼠均禁食12 h,自由饮水。建模24 h后,对照组无大鼠死亡(成功率:100%),TP组3只死亡(成功率:80%),TP+hUC-MSCs组和TP+hUCMSC-Ex组各有1只死亡(成功率:93%)。所有存活大鼠于术后24 h经腹主动脉取血、处死,留取血清与胰腺组织进行后续实验检测。1.2.3 胰腺组织病理学观察 各组胰腺组织均用甲醛固定,脱水,切片,行HE染色。并在光镜下观察其病理形态学。两名病理学家设盲,根据文献[19]标准对胰腺水肿、出血、细胞坏死和炎症细胞浸润的程度进行评分,以10个高倍视野的平均得分作为每个切片的最终得分。
1.2.4 ELISA法检测血清淀粉酶、脂肪酶以及炎症因子表达水平 室温解冻血清后,按照试剂盒说明书中描述的步骤,采用ELISA法检测淀粉酶、脂肪酶和炎症因子(IL-6、TNF-α、IL-10、TGF-β)的表达水平。
1.2.5 TUNEL检测细胞凋亡 固定胰腺组织经全自动脱水机脱水、包埋、切片、脱蜡至水。分别浸泡于:二甲苯Ⅰ 5~10 min、二甲苯Ⅱ 5~10 min、无水乙醇Ⅰ5 min、无水乙醇Ⅱ5 min、95%酒精5 min、85%酒精5 min、75%酒精5 min、UP水5 min。柠檬酸微波修复8 min,PBS洗3次、每次5 min;暗处配制荧光TUNEL孵育液(A∶B=1∶30)、37 ℃孵育1 h;PBS洗3次,每次5 min;加DAPI染核15 min,PBS 冲洗,甘油明胶封片,-20 ℃保存(试剂现配现用,均在暗处进行)。以上标本均按病理检验SOP程序进行脱水、修剪、包埋、切片、染色、封片、镜检。
1.2.6 Western blot检测凋亡蛋白表达水平 将胰腺组织取出放入2 mL研磨管中,然后向每管加入3 mm钢珠及RIPA裂解液(质量比样本∶裂解液=1∶10)。置于高速低温组织研磨仪内,-20 ℃研磨4次,每次60 s。取出放入4 ℃冰箱进行裂解;30 min后取出,4 ℃、12 000 ×g
离心10 min;取上清液,用BCA蛋白定量试剂盒测定蛋白浓度。各组取50 μL,按4∶1比例加入5× Loding buffer,混匀后热循环仪95 ℃,15 min,-80 ℃保存。一抗浓度:Bax 1∶5 000,Bcl-2 1∶2 000,Caspase-3 1∶2 000,β-tubulin 1∶2 000。轻摇后4 ℃孵育过夜;用TBST将PVDF膜洗3次,每次5 min。将PVDF膜放入二抗(稀释浓度:1∶5 000)中,轻摇后室温孵育2~3 h;用TBST将PVDF膜洗3次,每次10 min。将PVDF膜平铺到曝光板上,将ECL发光液的A、B两种试剂混合后滴加,反应1 min;将放有膜的曝光板放入暗室,根据信号的强弱调整曝光时间、曝光。1.3 统计学分析
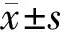
2 结果
2.1 hUC-MSCs培养、鉴定及hUCMSC-Ex的提取与鉴定
2.1.1 hUC-MSCs表面抗原鉴定结果 流式细胞技术检测结果(图1)显示:hUC-MSCs表面抗原CD29、CD44为阳性(>70%);CD45、CD34为阴性(<5%)。可以确认该细胞为hUC-MSCs。

A:CD29(+);B:CD44(+);C:CD45(-);D:CD34(-)
2.1.2 hUC-MSCs来源的外泌体鉴定结果 透射电镜下可见呈圆形或椭圆形的膜性小囊泡,囊泡外周包绕膜性结构,囊泡中央为低密度成分。Western blot检测结果显示所得外泌体有特征性膜蛋白CD9表达(图2)。

A:hUCMSC-Ex电镜观察;B:hUCMSC-Ex的Western blot检测结果 M1~M3:分别为脐带间充质干细胞重复对照组;Ex:外泌体鉴定组
2.2 各组大鼠胰腺组织HE染色观察结果
2.2.1 形态学改变 对照组:胰腺组织无炎性细胞浸润,腺泡无明显萎缩、变性、坏死。TP组:部分腺泡上皮细胞变性坏死,坏死细胞肿胀、结构模糊;细胞质空泡化,细胞核固缩或溶解,边界不清晰;坏死区域和间质伴有炎性细胞浸润,主要为杆状核中性粒细胞;提示建模24 h后大鼠出现炎症反应;亦见少量纤维组织增生,且部分间质亦见水肿,间隙增大。TP+hUC-MSCs组:胰腺组织的部分轮廓尚存,胰腺小叶结构没有完全破坏,外分泌细胞的正常结构可以看到损伤区域,炎症细胞的浸润明显减少。TP+hUCMSC-Ex组:胰腺组织被膜由薄层纤维组织构成,分叶较清晰;胰岛和腺泡结构完整,胰腺水肿的程度小于TP组,间质伴有少量中性粒细胞浸润,其中部分亦见少量核呈长梭形的纤维细胞(图3A)。
2.2.2 胰腺病理评分结果 与TP组相比,TP+hUC-MSCs组、TP+hUCMSC-Ex 组病理学评分显著降低(P
<0.05)。TP+hUC-MSCs组与TP+hUCMSC-Ex 组之间差异无统计学意义(P
>0.05,图3B)。
a:P<0.05,与TP组比较; 1: Control组;2:TP组;3:TP+hUC-MSCs组;4:TP+hUCMSC-Ex组
2.3 血清淀粉酶、脂肪酶和炎症因子检测结果
TP组在术后24 h的血清淀粉酶和脂肪酶浓度均高于对照组(P
<0.05),与TP组比较,TP+hUC-MSCs组、TP+hUCMSC-Ex 组在术后24 h的血清淀粉酶和脂肪酶水平显著下降(P
<0.05)。TP+hUC-MSCs组与TP+hUCMSC-Ex 组之间差异无统计学意义(P
>0.05)。见图4。
a:P<0.05,与TP组比较
血清炎症因子检测显示:TP组的IL-6、TNF-α显著高于对照组,IL-10、TGF-β显著低于对照组(P
<0.05)。与TP组比较,TP+hUC-MSCs组、TP+hUCMSC-Ex 组大鼠血清中IL-6、TNF-α浓度降低,而IL-10、TGF-β浓度升高(P
<0.05)。TP+hUC-MSCs组与TP+hUCMSC-Ex 组之间差异无统计学意义(P
>0.05)。见图5。上述结果提示,建模24 h后大鼠的炎症反应较为明显。
a:P<0.05,与TP组比较; 1: Control组;2:TP组;3:TP+hUC-MSCs组;4:TP+hUCMSC-Ex组
2.4 细胞凋亡检测结果
2.4.1 胰腺细胞凋亡情况 在TP组可观察到凋亡的腺泡细胞,且TP组腺泡细胞的凋亡指数明显高于对照组(P
<0.05);TP+hUC-MSCs组和TP+hUCMSC-Ex组腺泡细胞凋亡指数显著低于TP组(P
<0.05)。TP+hUC-MSCs组和TP+hUCMSC-Ex 组间相比,无明显差异(P
>0.05)。见图6。
↑:示凋亡细胞 a:P<0.05,与TP组比较
2.4.2 凋亡蛋白的表达变化 Control组凋亡蛋白Bax、Caspase-3的表达较低,与TP组相比,TP+hUC-MSCs组、TP+hUCMSC-Ex 组术后24 h胰腺细胞凋亡蛋白Bax、Caspas-3表达水平明显降低(P
<0.05,图7)。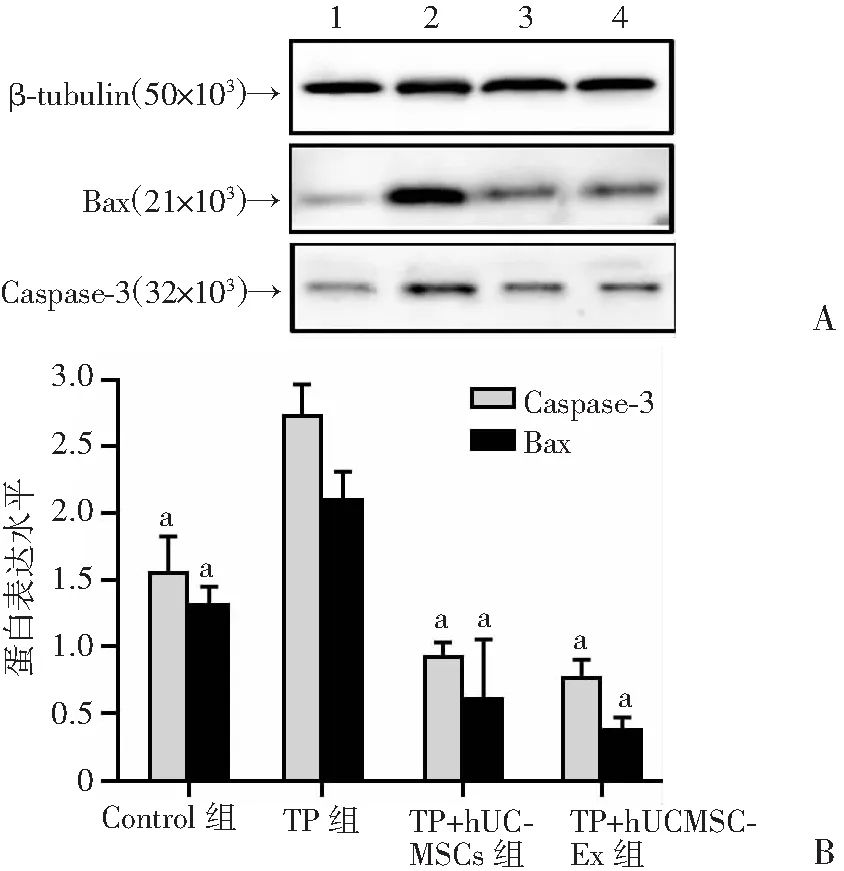
a:P<0.05,与TP组比较; 1: Control组;2:TP组;3:TP+hUC-MSCs组;4:TP+hUCMSC-Ex组
3 讨论
3.1 创伤性胰腺炎的诊疗现状
创伤性胰腺炎常由胰腺外伤引起,其临床症状与急性胰腺炎症状相似,主要表现为腹部器官损伤、严重的腹部感染等相关症状。近年来,随着交通、建筑等领域的快速发展,车祸以及意外事故发生率增加,导致腹部创伤性疾病越来越普遍,创伤性胰腺炎的发病率逐渐增加。创伤性胰腺炎的发生发展过程可分为损伤期、感染期和并发症期。各时期的主要治疗理念一般都是基于手术控制创伤以及渐进式分期管理的原则。在临床实践中,创伤性胰腺炎的治疗应根据胰管的完整性、胰腺实质损伤的位置和程度、血流动力学和周围其他器官的损伤程度进行个体化治疗。治疗方法在病程的不同时期也有不同的侧重点,应在疾病的早期及时治疗,避免更严重的后果。创伤性胰腺炎中后期常伴有胰液漏出,引起全身炎症反应。此外,漏出的胰液可直接腐蚀和刺激腹膜、腹部器官和大血管,可导致腹膜炎、腹腔脓肿、大出血等可怕的并发症。因此,早期疾病控制已成为创伤性胰腺炎治疗的关键环节。
3.2 脐带间充质干细胞及其来源的外泌体的效应研究
随着再生医学以及组织工程技术的发展,具有独特免疫调节能力的间充质干细胞逐渐走入人们的视野,并被广泛应用于组织损伤的修复、组织功能的再生和重建等领域。其中,hUC-MSCs因其不表达主要的组织相容性复合物Ⅱ(MHCⅡ)和共刺激分子而具有低免疫原性这一巨大优势。YANG等通过逆行胰管注射牛磺胆酸钠建立大鼠重症急性胰腺炎模型并经大鼠尾静脉注射hUC-MSCs,验证了hUC-MSCs的移植治疗可以有效降低血清淀粉酶及肿瘤坏死因子-α和干扰素-γ的产生。此外,他们还验证了hUC-MSCs以时间和剂量依赖性方式显著降低了SAP引起的胰腺损伤。KONG等的研究提示hUC-MSCs不仅能抑制炎性细胞因子的分泌和胰腺星状细胞的活化,还显著抑制了慢性胰腺炎胰腺组织中的磷脂酰肌醇-3-激酶(PI3K)通路,从而抑制腺泡细胞的凋亡。然而,在细胞及分子层面的研究中进一步发现hUC-MSCs可能通过旁分泌作用产生的细胞外囊泡发挥其治疗作用。而且,hUCMSC-Ex便于提取、储存和运输,免疫原性较低,生物相容性较好。目前,已有相关研究证实了hUCMSC-Ex可以在肝脏疾病、肺疾病、肾损伤、糖尿病以及其他疾病中发挥重要的保护作用。ZHANG等报道hUCMSC-Ex通过降低血尿素氮(BUN)、血清肌酐(SCR)、尿白蛋白肌酐(ACR)和8-异前列烷的水平改善了肾脏和肾小球的萎缩,并且通过改善全身炎症来减轻肾脏炎症和氧化应激,从而改善肾功能。CHEN等将hUCMSC-Ex用于治疗狼疮弥漫性肺泡出血(DAH)小鼠,发现小鼠肺泡损伤和炎症反应减弱,M2 巨噬细胞比例增加,从而发现了hUCMSC-Ex通过调节巨噬细胞极化减弱了DAH诱导的炎症反应和肺泡出血。
3.3 创伤性胰腺炎的病损特征
胰腺创伤后,一些胰腺组织坏死且不活跃。如果胰管有破裂,大量的胰液就会溢出。胰液中的消化酶也能消化胰腺组织,导致更多的胰腺组织和周围组织进一步坏死。不仅如此,当胰腺创伤发生后,胰腺实质的节段性或弥漫性炎症可导致胰腺坏死、纤维化、腺泡细胞和胰岛细胞萎缩和消失,导致胰腺结构损伤和胰腺内分泌和外分泌功能障碍。因此,加强血管的形成,改善胰腺微循环,有助于延缓创伤后坏死,促进胰腺组织的再生和修复。外泌体可以通过其自身产生的免疫活性分子调节免疫细胞的状态,发挥了强大的免疫调节作用。同时,可以上调血管生成相关分子表达,发挥促血管生作用。此外,还可以刺激细胞增殖、诱导细胞活化,发挥修复胰腺损伤组织作用。
3.4 脐带间充质干细胞及其来源的外泌体在创伤性胰腺炎治疗中的效应验证
本研究采用多功能动物撞击仪建立的大鼠胰腺创伤模型,伤情稳定、操作便捷、能够较好的模拟胰腺组织发生创伤后的病理生理变化、为后续实验奠定了研究基础。大鼠胰腺创伤模型建立好后,经大鼠尾静脉注射注hUC-MSCs或hUCMSC-Ex后,胰腺水肿程度较TP组减轻,部分损伤区域的胰腺组织轮廓尚存,胰腺小叶结构未完全破坏,损伤区域可见正常外分泌细胞结构,间质中炎症细胞浸润明显较少;经hUC-MSCs或hUCMSC-Ex干预治疗后的大鼠血清中的促炎因子TNF-α、IL-6 表达水平显著降低,抑炎因子 IL-10、TGF-β的表达水平明显升高,表明hUCMSC-Ex可以通过调控创伤性胰腺炎大鼠体内炎症因子的表达对大鼠损伤的胰腺组织发挥修复作用,其作用效果同hUC-MSCs基本一致。此外,研究结果显示经hUC-MSCs和hUCMSC-Ex治疗的创伤性胰腺炎的大鼠体内凋亡蛋白Bax、Csapase-3下调,呈现抑制凋亡的趋势。同样,TUNEL染色结果也提示hUCMSC-Ex对胰腺创伤后毁损组织的修复可通过抑制大鼠胰腺细胞的凋亡发挥作用。由此可以得出hUCMSC-Ex 或hUC-MSCs对大鼠创伤性胰腺炎的治疗具有相同的作用,但hUCMSC-Ex比其亲本细胞更小、复杂程度更低、更易于生产和储存,没有肿瘤形成的风险,并且由于其膜结合蛋白含量较低,免疫原性也比其亲本低。因此,能够为后续创伤性胰腺炎的基于无细胞的“干细胞”替代性治疗奠定理论基础。
综上所述,hUCMSC-Ex可以通过控制全身性的炎症反应,抑制大鼠腺泡细胞凋亡,从而减轻大鼠创伤性胰腺炎胰腺组织的损伤,加快其修复。然而,hUCMSC-Ex发挥作用的具体分子机制尚未可知,在未来的临床应用之前,还需要大量的深入研究。

