曲美他嗪对重症肺炎大鼠的肺保护作用及其机制研究*
范晓航,刘丽琴,胡伊瑶,赵雪红,李泉,王颖
[1.湖北文理学院 医学部,湖北 襄阳 441053;2.湖北文理学院附属医院(襄阳市中心医院)肿瘤科,湖北 襄阳 441021;3.海南省人民医院(海南医学院附属海南医院)麻醉科,海南 海口570311]
重症肺炎是常见的进展性呼吸系统危重疾病,除低氧血症及进行性呼吸困难等表现外,还可发展至全身性感染,甚至危及生命[1]。曲美他嗪(Trimetazidine,TMZ)是一种代谢调节剂,常作为抗心肌缺血、改善心肌代谢药物使用,可用于慢性肺源性心脏病的治疗[2]。有研究显示,TMZ 联合中药方剂治疗心力衰竭合并肺部感染的有效率达96.67%,推测其具有肺保护作用[3]。然而,目前关于TMZ 治疗重症肺炎的疗效及机制研究尚少。本研究通过复制重症肺炎大鼠模型,观察TMZ 的肺保护作用,并探讨其可能机制,为临床用药提供实验基础。
1 材料与方法
1.1 实验动物
45 只SD 雄性大鼠,6 周龄,体重(200±20)g,购自上海昇敞生物科技有限公司[实验动物生产许可证号:SCXK(沪)2021-0002],饲养于湖北奥菲生物科技有限公司[实验动物使用许可证号:SYXK(鄂)2019-0109]。
1.2 菌株
肺炎克雷伯菌标准株购自苏州达麦迪生物医学科技有限公司。
1.3 主要试剂及仪器
1.3.1 主要试剂盐酸TMZ 片(南京恒生制药有限公司,国药准字H20073969),哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)激活剂磷脂酸(phosphatidic acid,PA)(上海甄准生物科技有限公司),CD4+抗体、白细胞介素17(Interleukin-17,IL-17)抗体(上海研晶生物科技有限公司),白细胞介素1β(Interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒(上海酶研生物科技有限公司),兔抗大鼠蛋白激酶B(protein kinase B,Akt)、p-Akt、mTOR、p-mTOR 一抗(美国R&D 公司)。
1.3.2 仪器CytoFLEX 流式细胞仪(美国Beckman Coulter 公司),SAR-830 小动物呼吸机(美国CWE 公司),DM500 光学显微镜(德国徕卡微系统有限公司),DYCZ-24 电泳仪(北京六一生物科技有限公司)。
1.4 方法
1.4.1 重症肺炎模型的复制及分组模型复制前1 天制备细菌混悬液。将肺炎克雷伯菌株ATCC700603 接种至琼脂糖平板,标准条件下培养24 h 后收集细菌,采用比浊法经无菌生理盐水稀释至含有400 个麦氏浊度单位的混悬液(1 个麦氏浊度单位为3×1011CFU/L)。45 只SD 大鼠中随机抽取35 只,戊巴比妥钠麻醉大鼠,颈部消毒备皮,暴露并切开大鼠上段气管。采用24 G Y 型静脉留置针气管插管,拔除针芯后保持导管完全置入气管,经导管注入细菌混悬液0.35 mL(含有400 个麦氏浊度单位肺炎克雷伯菌),立起固定台后缓慢注射,期间左右旋转固定台2 次,注射完成后缝合切口,常规消毒。模型复制成功标准:术后72 h 大鼠反应迟钝、呆滞;呼吸急促,双侧胸廓明显运动;X 射线可观察到两肺有弥漫性渗出阴影;动脉血氧分压≤60 mmHg 或动脉血氧饱和度<90%[4]。35 只大鼠死亡5 只,模型复制成功30 只,随机分为重症肺炎(SP)组、TMZ 组、TMZ 联合PA 组,每组10 只。余10 只注射无菌生理盐水0.35 mL,设为对照组。
1.4.2 干预方式模型复制成功后,TMZ 组灌胃TMZ 生理盐水溶液5 mL,剂量20 mg/kg,尾静脉注射生理盐水1 mL;TMZ 联合PA 组灌胃TMZ 生理盐水溶液5 mL,剂量20 mg/kg,尾静脉注射PA 生理盐水溶液1 mL,剂量1 mg/kg;对照组、SP 组分别灌胃、尾静脉注射等体积生理盐水[5]。各组1 次/d,连续干预6 d。
1.4.3 外周血辅助性T 细胞17(T helper cell 17,Th17)和调节性T 细胞(regulatory T cell,Treg)检测末次给药后,禁食不禁水24 h。戊巴比妥钠麻醉后抽取大鼠腹主动脉血5 mL,转移至加有肝素的抗凝管中,等比例混合PBS 缓冲液,梯度离心,分离淋巴细胞,洗涤后调整细胞密度至1×107个/mL。取96 孔板,每孔加入淋巴细胞悬液100 μL 和刺激剂0.5 μL,每组设置同型对照,培养箱孵育1 h 后采用阻断剂阻断,继续孵育12 h,转移细胞悬液至流式管中,加入CD4 抗体0.5 μL,常温遮光孵育20 min,PBS 洗涤后离心弃上清液,PBS 100 μL 重悬,加入固定破膜工作液,振荡5 s,4℃遮光孵育35 min,加入破膜缓冲工作液2 mL,离心弃上清液,加入PBS 缓冲液至100 μL,重悬。在测定管中加入IL-17 抗体0.7 μL(检测Th17 细胞)或Foxp3 抗体5 μL(检测Treg 细胞),将等量、同型对照抗体加入对照管中,4℃遮光孵育40 min,洗涤后弃上清液,加入4%多聚甲醛重悬,4℃遮光保存,24 h 内使用流式细胞仪检测Th17、Treg[6]。
1.4.4 肺功能指标检测抽取大鼠腹主动脉血5 mL后取大鼠颈部正中切口,在第3 与第4 气管环中进行倒T 型切口插管,采用手术线系紧气管插管,将大鼠置入体描箱,与呼吸机连接,通过AniRes 2005软件记录其肺容积变换量、静息通气量[7]。
1.4.5 ELISA 检测肺泡灌洗液(bronchoalveolar lavage fluid,BALF)IL-1β、TNF-α水平肺功能指标检测完成后颈椎脱臼处死大鼠,迅速逐层分离颈部皮肤,暴露气管取肺,手术线结扎、固定右肺;左肺经37℃生理盐水2 mL 灌洗3 次,回收后(回收率>80%)离心收集BALF 上清液。采用ELISA 检测BALF 中IL-1β、TNF-α 水平,实验流程严格按照试剂盒说明书设计,采用酶标仪测定570 nm 波长处的吸光度值,根据标准曲线计算IL-1β、TNF-α 水平[8]。
1.4.6 苏木精-伊红(hematoxylin-eosin,HE)染色观察肺组织病理学变化取结扎未经灌洗的右肺,分成2 份,一份用4%多聚甲醛固定,另一份在-80℃条件下保存。取4%多聚甲醛固定48 h 的肺组织,流水冲洗30 min,乙醇梯度脱水,石蜡包埋,病理切片机切成4 μm 厚切片,HE 染色后用显微镜观察肺组织病理学变化[9]。
1.4.7 Western blotting 检测肺组织Akt、p-Akt、mTOR、p-mTOR 蛋白的表达取-80℃保存的肺组织,RIPA 细胞裂解液裂解,冰上离心取上清液,BCA 法测定蛋白含量。取50 μg 待测蛋白,按1∶5 与样品缓冲液混合,金属浴煮沸5 min,离心取上清液,上样电泳,湿转至PVDF 膜,5%脱脂牛奶室温摇床封 闭2 h,TBST 清洗,加入兔抗大鼠Akt、p-Akt、mTOR、p-mTOR 一抗(1∶500),4℃摇床孵育2 h,TBST 清洗,加入山羊抗兔IgG 二抗(1∶2 000),室温孵育2 h,TBST 清洗,ECL 发光液显色,置于暗室曝光,采用一体式凝胶成像系统分析,以Akt、p-Akt、mTOR、p-mTOR 蛋白与内参GAPDH 灰度值的比值表示蛋白相对表达量[10]。
1.5 统计学方法
数据分析采用SPSS 24.0 统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,进一步两两比较用LSD-t检验。P<0.05 差异有统计学意义。
2 结果
2.1 各组大鼠外周血Th17、Treg、Th17/Treg比较
对照组、SP 组、TMZ 组、TMZ 联合PA 组外周血Th17、Treg、Th17/Treg 比较,经方差分析,差异有统计学意义(F=57.766、16.254 和239.835,均P=0.000)。进一步两两比较结果:与对照组比较,SP组外周血Th17 和Th17/Treg 升高(P<0.05),Treg 降低(P<0.05);与SP 组比较,TMZ 组外周血Th17 和Th17/Treg 降低(P<0.05),Treg 升高(P<0.05);与TMZ 组比较,TMZ 联合PA 组外周血Th17 和Th17/Treg 降低(P<0.05),Treg 升高(P<0.05)。见表1。
表1 各组大鼠外周血Th17、Treg、Th17/Treg比较(n=10,±s)
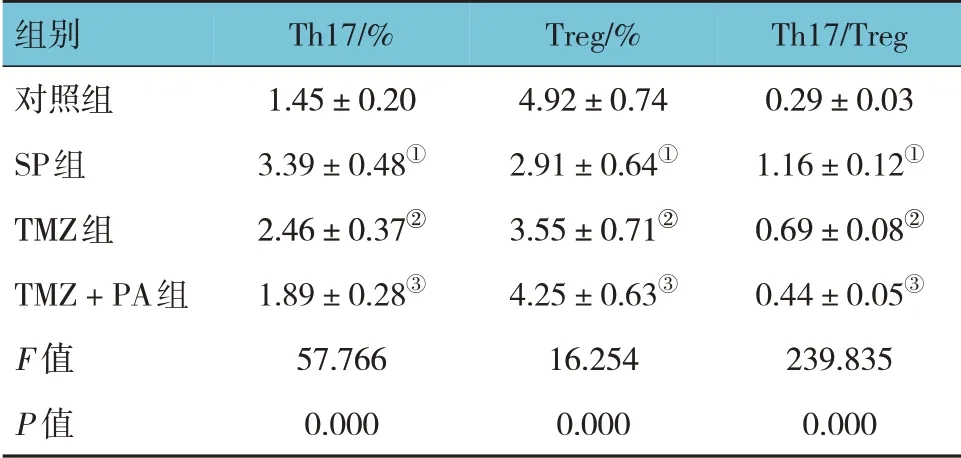
表1 各组大鼠外周血Th17、Treg、Th17/Treg比较(n=10,±s)
注:①与对照组比较,P<0.05;②与SP 组比较,P<0.05;③与TMZ组比较,P<0.05。
Th17/Treg 0.29±0.03 1.16±0.12①0.69±0.08②0.44±0.05③239.835 0.000组别对照组SP组TMZ组TMZ+PA组F 值P 值Th17/%1.45±0.20 3.39±0.48①2.46±0.37②1.89±0.28③57.766 0.000 Treg/%4.92±0.74 2.91±0.64①3.55±0.71②4.25±0.63③16.254 0.000
2.2 各组大鼠肺功能比较
对照组、SP 组、TMZ 组、TMZ 联合PA 组肺容积变换量、静息通气量比较,经方差分析,差异有统计学意义(F=85.960 和47.149,均P=0.000)。进一步两两比较结果:与对照组比较,SP 组肺容积变换量、静息通气量减少(P<0.05);与SP 组比较,TMZ 组肺容积变换量、静息通气量增加(P<0.05);与TMZ 组比较,TMZ 联合PA 组肺容积变换量、静息通气量减少(P<0.05)。见表2。
表2 各组大鼠肺功能指标比较 (n=10,±s)
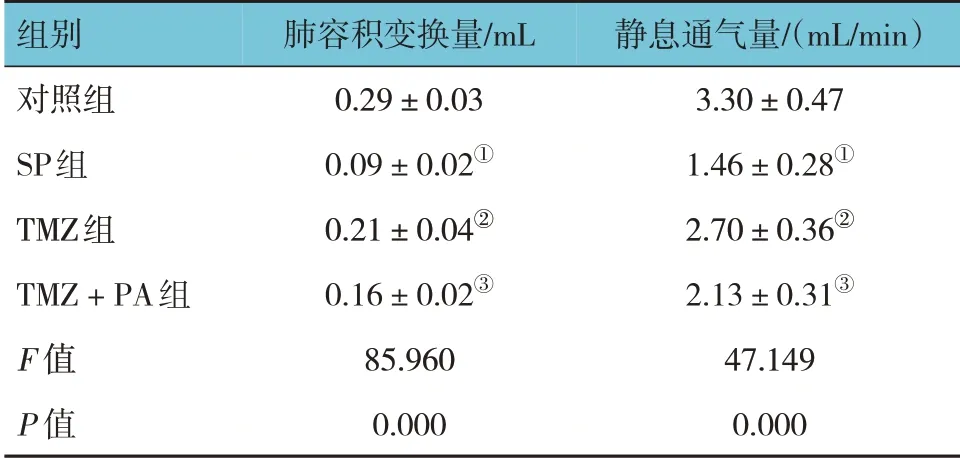
表2 各组大鼠肺功能指标比较 (n=10,±s)
注:①与对照组比较,P<0.05;②与SP 组比较,P<0.05;③与TMZ组比较,P<0.05。
组别对照组SP组TMZ组TMZ+PA组F 值P 值肺容积变换量/mL 0.29±0.03 0.09±0.02①0.21±0.04②0.16±0.02③85.960 0.000静息通气量/(mL/min)3.30±0.47 1.46±0.28①2.70±0.36②2.13±0.31③47.149 0.000
2.3 各组大鼠BALF中IL-1β、TNF-α水平比较
对照组、SP 组、TMZ 组、TMZ 联合PA 组BALF中IL-1β、TNF-α 水平比较,经方差分析,差异有统计学意义(F=186.449 和230.659,均P=0.000)。进一步两两比较结果:与对照组比较,SP 组BALF中IL-1β、TNF-α 水平升高(P<0.05);与SP 组比较,TMZ 组BALF 中IL-1β、TNF-α 水平降低(P<0.05);与TMZ 组比较,TMZ 联合PA 组BALF 中IL-1β、TNF-α 水平升高(P<0.05)。见表3。
表3 各组大鼠BALF中IL-1β、TNF-α水平比较(n=10,pg/mL,±s)
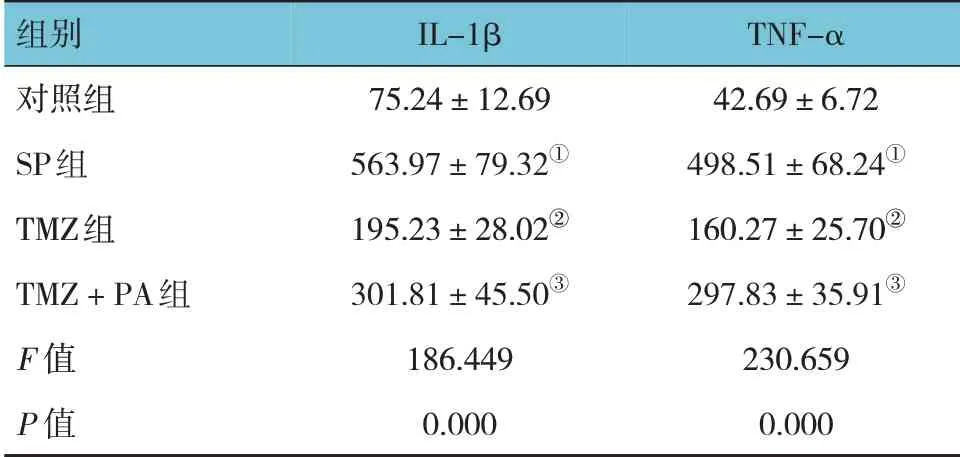
表3 各组大鼠BALF中IL-1β、TNF-α水平比较(n=10,pg/mL,±s)
注:①与对照组比较,P<0.05;②与SP 组比较,P<0.05;③与TMZ组比较,P<0.05。
TNF-α 42.69±6.72 498.51±68.24①160.27±25.70②297.83±35.91③230.659 0.000组别对照组SP组TMZ组TMZ+PA组F 值P 值IL-1β 75.24±12.69 563.97±79.32①195.23±28.02②301.81±45.50③186.449 0.000
2.4 肺组织病理学变化
HE 染色结果显示,对照组肺泡结构及支气管壁清晰、完整,未观察到明显的炎症浸润;SP 组肺泡结构被破坏,肺泡间隔扩大,支气管壁厚度明显增加,可观察到大量炎症细胞浸润;TMZ 组、TMZ 联合PA 组较SP 组肺泡间隔缩小,支气管壁厚度变小,炎症细胞浸润减少,其中TMZ 组病理变化改善程度优于TMZ 联合PA 组。见图1。
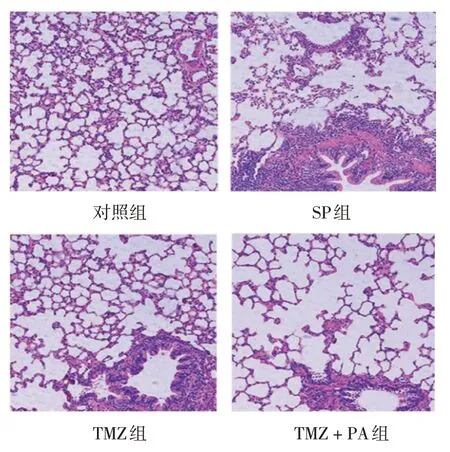
图1 各组大鼠肺组织病理学变化 (HE染色×200)
2.5 各组大鼠肺组织p-Akt/Akt、p-mTOR/mTOR比较
对照组、SP 组、TMZ 组、TMZ 联合PA 组肺组织p-Akt/Akt、p-mTOR/mTOR 比较,经方差分析,差异有统计学意义(F=128.429 和246.000,均P=0.000)。进一步两两比较结果:与对照组比较,SP组p-Akt/Akt、p-mTOR/mTOR 升高(P<0.05);与SP组比较,TMZ 组p-Akt/Akt、p-mTOR/mTOR 降低(P<0.05);与TMZ 组比较,TMZ 联合PA 组p-Akt/Akt、p-mTOR/mTOR升高(P<0.05)。见表4和图2。

图2 各组大鼠肺组织p-Akt、Akt、p-mTOR、mTOR蛋白的表达
表4 各组大鼠肺组织p-Akt/Akt、p-mTOR/mTOR比较(n=10,±s)
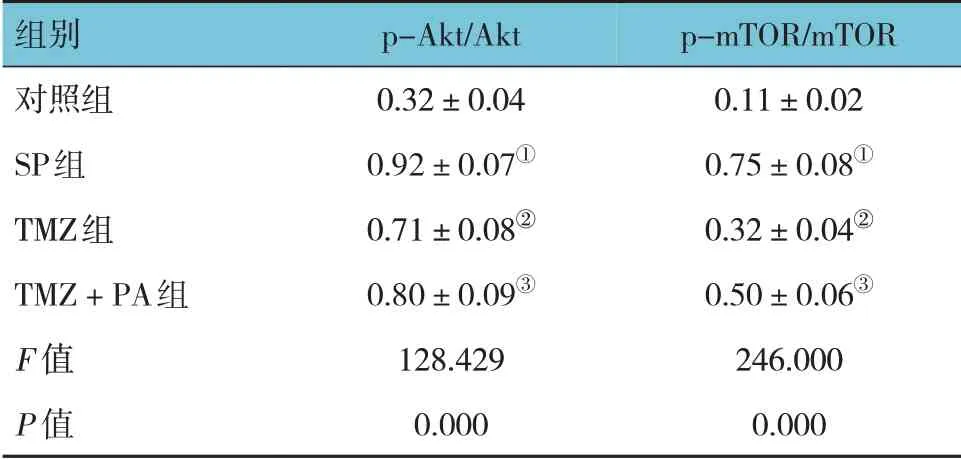
表4 各组大鼠肺组织p-Akt/Akt、p-mTOR/mTOR比较(n=10,±s)
注:①与对照组比较,P<0.05;②与SP 组比较,P<0.05;③与TMZ组比较,P<0.05。
p-mTOR/mTOR 0.11±0.02 0.75±0.08①0.32±0.04②0.50±0.06③246.000 0.000组别对照组SP组TMZ组TMZ+PA组F 值P 值p-Akt/Akt 0.32±0.04 0.92±0.07①0.71±0.08②0.80±0.09③128.429 0.000
3 讨论
目前肺炎仍是感染性疾病死亡的重要病因之一。统计资料显示,重症肺炎占肺炎的10%~20%,且病死率高达30%~50%[11]。有报道显示,重症肺炎不仅是病原菌与毒素直接损伤所致,而且与机体被病原体感染后炎症反应失控关系密切[12]。重症肺炎发生时淋巴细胞、中性粒细胞等炎症细胞释放大量炎性介质聚集于肺,形成“瀑布样”炎症级联反应,导致免疫功能紊乱。因此,抑制重症肺炎炎症反应、改善免疫失衡是治疗该病的重要思路。
本研究采用TMZ 干预重症肺炎大鼠后发现,其外周血Th17、Th17/Treg 降低,Treg 升高,肺容积变换量、静息通气量增加,且BALF 中IL-1β、TNF-α水平降低,提示TMZ 可改善肺功能及Th17/Treg 平衡,减轻肺部炎症反应。Th17 细胞是一种经核转录因子维甲酸相关孤儿受体γt 调控的CD4+T 细胞,主要通过释放炎症因子IL-17 促进炎症反应,在重症肺炎中异常高表达[13]。Treg 细胞可抑制抗原呈递细胞及T 细胞功能,减少炎症细胞因子及抗体产生,减轻炎症对机体的损伤。TMZ 可促进葡萄糖发生有氧氧化,同时抑制脂肪酸β 氧化,减少ATP 生成过程中耗氧量;清除氧自由基、提高细胞膜稳定性;降低炎症因子水平,维持自身免疫耐受及免疫内环境平衡。COSGUN 等[14]研究发现,TMZ 离体给药供体肺,可降低支气管肺泡灌洗样本中的硫代巴比妥酸水平及髓过氧化物酶活性,显著改善移植后肺功能,提示TMZ 具有肺保护功能,与本研究结论相似。
本研究结果显示,与SP 组比较,TMZ 组p-Akt/Akt、p-mTOR/mTOR 降低,且TMZ 与PA 联用可减少TMZ 对重症肺炎大鼠的肺功能保护作用,推测TMZ 对大鼠的治疗作用可能通过抑制PI3K/Akt 信号通路来实现。有研究发现,PI3K/Akt 信号通路的激活或抑制与多种病原体在宿主机体中增殖、致病过程密切相关。Akt、mTOR 是PI3K 下游关键效应分子[15]。PI3K 活化生成mPIP3,可诱导Akt、mTOR 磷酸化,进而抑制或激活一系列下游底物调节细胞分化、增殖、迁移等行为。mTOR 是介导淋巴细胞激活PI3K/Akt 信号通路的重要蛋白激酶,在调控细胞增殖、分化及Th17/Treg 平衡中起到重要作用。ROSTAMZADEH 等[16]认为mTOR 是负 向 调节Treg 细胞分化、扩增的关键因子,抑制mTOR 活性可阻断CD4+T 细胞向Th17 细胞的分化进程,同时促进Treg细胞分化。PA 是mTOR 的强效激活剂,可通过与mTOR 的结构域FRB 竞争性结合激活mTOR1,从而增强PI3K/Akt 信号通路活性。
TMZ 治疗重症肺炎的机制研究弥补了以往研究的不足,具有一定创新性,为临床重症肺炎的治疗提供了理论依据,并为该病的靶向治疗药物研究奠定基础。

