线粒体转录终止因子3 在甲状腺癌中的表达及预后意义
孙美涛,赵恒宇,李晓燕,冯琛卓,熊 伟
(1.杭州医学院基础医学与法医学院,浙江,杭州 310053;2.杭州医学院临床医学院,浙江,杭州 310053;3.大理大学基础医学院,云南,大理 671000)
甲状腺癌(Thyroid Carcinoma,THCA)严重威胁人类健康,已成为威胁中国女性健康的第五大癌症,并且是儿童最常见的内分泌肿瘤[1-2]。全世界约有4%的女性肿瘤病例和11%的青少年肿瘤病例为甲状腺癌[3]。据有关报道,甲状腺结节检出率高达20%到76%,并且该结果已经得到了尸检的验证[4]。检出甲状腺结节的人群中,约有7%~15%的人患有甲状腺癌[5]。目前,针对甲状腺结节人群,临床上多使用超声引导下细针穿刺活检的方法,但该方法在不同医疗机构操作方法差异较大,有较多的禁忌症,故仍有局限性[5]。而甲状腺癌的治疗方法主要为手术治疗、放射性碘治疗、促甲状腺激素抑制疗法等,但上述治疗方法缺乏可靠的临床证据,仍存在一定的争议[6-7]。因此,甲状腺癌仍缺乏特异性强的分子标志物供临床诊断与治疗使用。目前,寻找甲状腺癌特异分子标志和靶标是医学研究亟待解决的问题。
细胞线粒体转录终止因子3(Mitochondrial transcription termination factor 3,MTERF3)是细胞内线粒体转录终止因子(Mitochondrial transcription termination factor,MTERF)家族成员之一,是核基因编码并依赖高迁移蛋白转移到线粒体的蛋白质,该基因定位于8q22.1,是结合于线粒体DNA启动子区域的负调控因子,抑制线粒体DNA 复制、转录、翻译的功能,对细胞能量代谢和氧化应激有着重要作用[8-10]。Park 等[9]的研究表明,MTERF3是胚胎发育中不可或缺的基因,敲除MTERF3 将引起小鼠胚胎死亡。MTERF3 蛋白表达异常与多种肿瘤发生和发展都密切相关[11]。目前该基因的异常表达与甲状腺癌发生、发展、预后的相关性研究报道较少。
本研究分析MTERF3 在甲状腺癌与癌旁组织中表达差异,构建蛋白互作模型分析其生物学功能,分析其表达异常对于肿瘤免疫浸润的影响,探究MTERF3 表达异常对于患者生存的影响,分析临床基线资料明确其临床意义,旨在为甲状腺癌诊疗领域提供一定的参考依据。
1 材料与方法
1.1 数据处理
我们研究组使用TCGA 的THCA 项目中level 3 HTSeq-FPKM 格式的转录组数据,并将FPKM 格式转化为了TPM 格式,随后进行了log2 转换。同时使用UCSC XENA(https://xenabrowser.net/datapages)处理后的TCGA 和GTEx 中TPM 的转录组数据,并对其进行log2 转换[12]。本研究使用的R 软件版本为3.6.3,生存分析Cutoff 设定为50%,P<0.05被考虑为差异具有统计学意义。
1.2 MTERF3 细胞定位及功能分析
使用Protter 数据库以明确MTERF3 在细胞内外的定位[13]。从HPA 数据库中下载EFO-21、HEL、U-2 OS 细胞的细胞核、微管、MTERF3 免疫荧光染色图片,以精确MTERF3 的亚细胞定位[14-16]。使用GPS-Prot 筛选与MTERF3 相关的40 个基因以探究MTERF3 的功能,并使用R 软件的clusterProfiler包进行富集分析[17-18]。
1.3 MTERF3 表达差异与免疫细胞浸润的关系分析
使用R 软件的ggplot2 对TCGA 中MTERF3 表达数据进行分析,如样本不服从正态分布,则使用Mann-Whitney U 检验。同时使用ONCOMINE 数据库中收录的Huiling He 等[19]的研究结果进行论证。
使用TIMER 在线工具分析MTERF3 表达高低对B 细胞、CD8+T 细胞、CD4+T 细胞、树突状细胞、中性粒细胞、巨噬细胞的浸润程度的影响,分析MTERF3 臂删除和臂增益变化对上述免疫细胞浸润程度造成的影响[20-21]。
1.4 MTERF3 表达差异与生存预后、患者相关特征的关系
使用GEPIA 数据库分析MTERF3 表达差异对患者总生存期和无病生存期的影响[22]。用R 软件的survival 包和surviminer 包对TCGA 数据库中甲状腺癌的临床信息进行统计分析[23]。如服从正态分布,则使用卡方(x2)检验。
2 结果
2.1 MTERF3 在细胞内表达并参与线粒体基因表达调控
MTERF3 拓扑结构显示其定位于胞内(如图1A)。对免疫荧光图片进行分析可知MTERF3 在EFO-21、HEL、U-2 OS 细胞的细胞质和线粒体中均有分布,且MTERF3 抗体的荧光不与细胞核和微管重叠(图1E 和1B)。该基因在肺鳞癌、弥漫性大B 细胞淋巴瘤、睾丸癌等肿瘤中都存在异常表达的情况。通过对MTERF3 及其相关蛋白进行富集分析,可知其主要参与核糖体大亚基组装及线粒体基因表达等生物过程(图1C 和1D)。
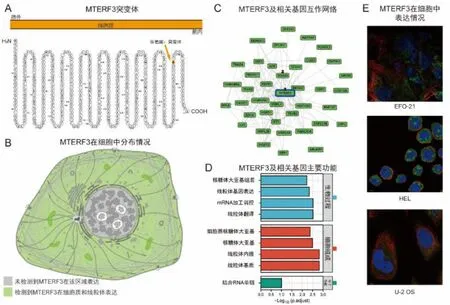
图1 MTERF3 的细胞定位、蛋白互作及主要功能Fig.1 Cell localization,protein interaction and main functions of MTERF3
2.2 MTERF3 在甲状腺癌与癌旁组织中表达差异及预后意义
通过使用TCGA 和GTEx 数据库中的数据以及ONCOMINE 数据库,Huiling He 等[19]研究也同样表明MTERF3 转录组在甲状腺癌组织中表达低于癌旁组织(P<0.05)(如图2A、2B、2C)。
MTERF3 在甲状腺癌中表达与患者预后具有相关性,甲状腺癌组织中MTERF3 低表达提示患者预后不良。肿瘤组织中MTERF3 低表达甲状腺癌患者无病生存期(disease free survival,DFS)和无进展生存期(progression free survival,PFS)与高表达的患者的差异存在统计学意义(P<0.05)(图2D和2E),但其总生存期(overall survival,OS)差异无统计学意义(P>0.05)(图2F)。因此,甲状腺癌组织MTERF3 低表达提示患者预后不良。
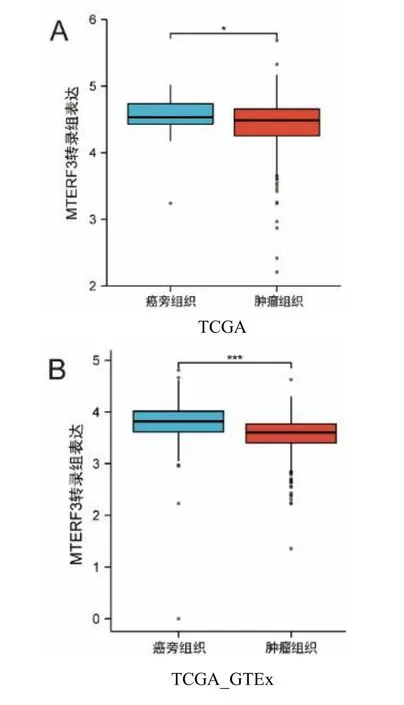
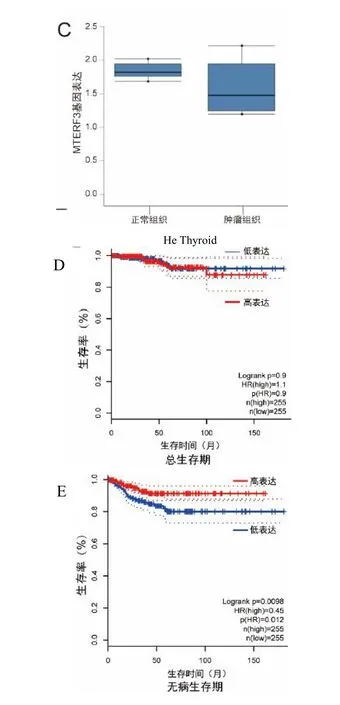

图2 MTERF3 在甲状腺癌中的表达差异和生存分析Fig.2 Expression difference and survival analysis of MTERF3 in Thyroid Carcinoma
2.3 MTERF3 表达差异与免疫细胞浸润密切相关
MTERF3 表达水平与B 细胞、CD8+T 细胞、CD4+T 细胞、巨噬细胞、中性粒细胞和树突状细胞浸润水平负相关(P<0.05)(如图3A)。MTERF3臂删除使B 细胞、CD4+T 细胞、巨噬细胞、中性粒细胞和树突状细胞浸润水平显著降低(P<0.01)(图3B)。

图3 MTERF3 表达与免疫细胞浸润情况相关性Fig.3 Correlation between MTERF3 expression and immune cell infiltration
2.4 MTERF3 表达与甲状腺癌患者特征关联性
MTERF3 的表达与T 分期(P=0.035)、年龄(P=0.025)、甲状腺外延展情况(P=0.006)、PFS(P=0.013)明显相关。而与N 分期、性别、甲状腺疾病史及OS 无关(P>0.05),如表1 所示。

表1 基线资料表Table 1 Baseline data sheet
3 讨论
甲状腺癌已成为世界上最常见的内分泌肿瘤之一,并且已成为我国发病增长率最高的内分泌恶性肿瘤[24]。根据病理组织类型分型,甲状腺癌可分为甲状腺乳头状癌、甲状腺滤泡状癌、未分化型甲状腺癌等[24]。目前,甲状腺癌发生的分子机制尚未阐明,较多学者研究认为,促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路和磷脂酰肌醇通路(PI3K-Akt signaling pathway)与甲状腺癌的发生与进展密切相关[25-26]。有研究表明,受体酪氨酸激酶(receptor tyrosine kinase,RTK)突变也与甲状腺癌的发生密切相关,RTK 突变后可活化下游通路从而导致细胞异常增殖[25]。癌症基因组图谱研究网络的学者认为,甲状腺乳头状癌是一种MAPK 驱动的肿瘤,MAPK 信号通路可以促进正常的甲状腺滤泡上皮细胞的癌化[27-28]。RAS 是一种与鸟嘌呤结合的蛋白,它的功能类似于分子开关,它在RAS-GTP 和RAS-GDP 两种结合形式中转化,进而调控下游PI3K-Akt 等信号通路[29-30]。RAS 突变在甲状腺癌中较常见,在甲状腺癌各亚型中占比可达10% ~50%,RAS 突变能够激活PI3K-Akt 信号通路,导致该信号通路的分子异常表达,从而促进甲状腺癌的发展[31,26]。
随着现代分子测序技术的发展,非编码RNA在甲状腺癌发生和发展中的作用也逐渐受到学界重视。李勇等[32]认为小RNA(MicroRNA,miRNA)在甲状腺癌患者的体液和外泌体中存在表达差异,在甲状腺癌发生、转移和耐药等过程中发挥重要作用。朱楚梦等[33]学者认为,长链非编码RNA(LncRNA)也在甲状腺癌发生、发展中起到了重要作用。LncRNA 能够调节自噬、凋亡、PI3K-Akt等信号通路[33]。LncRNA 可以作为miRNA 的前体分子调节miRNA 的表达,调控编码基因的启动子影响基因表达,能与特定蛋白结合从而调节蛋白活性[33]。刘长路等[34]研究表明,摄碘不足、电离辐射、激素和遗传等因素与甲状腺癌的发生相关。虽然甲状腺癌病死率低,但其发病率极高,并且在女性中的发病率高于男性[35]。在体检触诊中,甲状腺结节的检出率极高,引起人们的高度关注[4,36]。近年来,多种新型检查技术的运用显著提高了甲状腺癌的确诊率,但有创的检查存在禁忌症和潜在的不良反应,从而对患者造成负面影响。有研究报道,使用蛋白组学数据寻找甲状腺癌的核心蛋白,对甲状腺癌的确诊有较高的预测效率[37]。此外,放化疗对甲状腺癌患者疗效较差[38]。因此,明确甲状腺癌的分子诊断标记和寻找靶向药物治疗是亟待解决的问题。在医学临床上,对甲状腺癌患者多采用手术治疗,并联合放射性碘治疗[39]。但随着临床技术的提高,热消融、免疫治疗和分子靶向治疗也成为了辅助治疗甲状腺癌患者的手段[39-41]。
MTERF 是一个比较保守的蛋白家族,目前已发现该家族由4 个成员组成(MTERF1~MTERF4),存在于动、植物的细胞中,定位于植物的叶绿体和动、植物的线粒体,与线粒体DNA 结合,从而影响线粒体的功能[11,42]。该家族成员调控线粒体DNA转录,介导线粒体RNA 甲基转移酶(NOP2/Sun RNA methyltransferase 4,NSUN4)靶向线粒体核糖体大亚基,从而在调节线粒体基因的翻译中发挥重要作用[43-46]。MTERF3 是MTERF 蛋白家族的重要成员,结合于线粒体DNA 转录起始区域,抑制线粒体DNA 的转录,从而抑制细胞能量的产生[11]。据相关研究报道,MTERF3 在线粒体DNA 的转录中起到负调控的作用,该基因与线粒体DNA 的启动子区域相结合,对线粒体DNA 的基因表达发挥其抑制作用[9]。
有诸多学者研究表明,该基因对肿瘤、线粒体相关疾病、神经退行性疾病的诊疗有潜在的价值[47-48]。该基因在胃癌、非小细胞肺癌、子宫颈癌、大肠腺癌、肝细胞癌、脑胶质瘤等多种肿瘤组织中表达水平显著高于正常组织[49-55]。有研究报道,MTERF3 在结直肠癌细胞中上调白介素6 和白介素11,从而促进结直肠癌的进展[56]。原因可能是MTERF3高表达抑制了线粒体DNA 的复制和转录,造成线粒体呼吸酶活性降低,从而细胞内ATP 合成减少[11,52]。然而,本研究发现MTERF3 在甲状腺癌中的表达显著低于正常甲状腺组织,与胃癌、肺癌、子宫颈癌等肿瘤组织的表达情况不同。因此,后续研究应注重阐明该基因在甲状腺癌中异常表达的原因。
本研究分析多组学数据可知,MTERF3 定位于线粒体,与线粒体和核糖体的结构和功能密切相关,它通过影响线粒体基因转录、线粒体核糖体大亚基装配从而对线粒体基因表达产生影响;该基因在甲状腺癌组织中表达显著低于癌旁组织;该基因低表达的患者无进展生存期更短,提示患者预后较差;该基因低表达有着较高的免疫细胞浸润水平;该基因表达情况与患者的疾病分期、甲状腺是否外延伸及患者的预后有一定的相关性。
本研究针对MTERF3 在甲状腺癌中的表达及预后情况进行了相对全面的生物信息学分析。学术界普遍认为,甲状腺癌的发生和发展并不是由单一的基因起决定性作用,目前已有研究者对甲状腺癌相关的基因集通路进行分析,以期待为甲状腺癌诊断、预后、靶向治疗提供可靠的生物标记物[42,57]。本研究也发现,MTERF3 低表达的甲状腺癌患者的预后较差。也有研究报道,MTERF3 表达降低会促进线粒体DNA 转录,并阻碍线粒体中核糖体大亚基的组装[11,58]。因此,MTERF3 在甲状腺癌患者中表达较低的原因可能为,MTERF3 低表达的患者有较少数量的MTERF3 与线粒体DNA 转录起始区域结合,从而对线粒体DNA 的负性调控作用较弱,线粒体DNA 的基因表达增加,同时影响线粒体中核糖体的功能,促进ATP 合成,使得MTERF3 低表达的患者肿瘤细胞能量代谢更为旺盛,有利于甲状腺癌细胞的增殖[11,55,58]。尽管本研究通过多组学数据和临床基线资料初步得出MTERF3 低表达与甲状腺癌进展有关联的结论,但仍缺乏实验验证来明确其具体的机制。在后续研究中,我们将使用小干扰RNA 在甲状腺癌细胞内构建MTERF3 基因沉默模型,明确MTERF3 低表达对甲状腺癌细胞增殖的影响,探究MTERF3 低表达对于甲状腺癌细胞能量代谢和线粒体功能的影响及相关机制,从而为甲状腺癌诊疗领域提供理论参考。

