基因表达与直肠癌免疫治疗效果的关系
史昊,李小丽,杨玉丹,马青青,侯一丹,高明
(郑州大学第一附属医院 肿瘤科,河南 郑州 450000)
消化道肿瘤是在世界范围内流行的疾病,在前十位发病率的肿瘤中占据4席[1]。其中结直肠癌(colorectal cancer,CRC)排第3位,是导致全球癌症相关死亡的第四大原因[2]。直肠癌约占CRC的30%,局部晚期直肠癌的标准治疗是新辅助放化疗,再行全直肠系膜切除术[3-4]。基于5-Fu联合铂类的化疗方案是早中期直肠癌新辅助或辅助治疗的标准方案,主要包括输注氟尿嘧啶及亚叶酸,或每日口服卡培他滨、替吉奥[5-6]。基因测序是肿瘤治疗过程中的重要检查手段,在靶向治疗中最核心的一环就是通过基因检测获得靶向治疗的间接指导和预测信息[7],以寻求最佳治疗方案,如KRAS基因,试验证明FOLFIRI方案联合针对表皮生长因子受体(epidermal growth factor receptor,EGFR)的单克隆抗体西妥昔单抗已被证明可降低KRAS野生型患者的进展风险[8]。
肿瘤突变负荷(tumor mutational burden,TMB)是通过测序非同义体细胞基因突变的数量获得的,更高的TMB意味着肿瘤可能会产生更多的新抗原,诱导特异性T细胞参与反应,并进一步增强抗肿瘤免疫。除了一些特定的基因改变外,我们认为绝大多数肿瘤DNA的改变与靶向治疗的反应有关。TMB已用作体细胞突变积累的替代测量。许多临床研究强化了TMB作为预测靶向治疗结果的独立生物标志物的概念。与高TMB患者相比,TMB较低的患者的反应率和生存率较差[9-14]。
非小细胞肺癌免疫治疗中的预测性生物标志物包括程序性死亡蛋白配体1(programmed cell death-ligand 1,PD-L1)状态、TMB、错配修复缺陷(mismatch repair deficiency,dMMR)和微卫星不稳定性(microsatellite instability,MSI)等[15]。对于CRC患者,除了程序性死亡蛋白1(programmed cell death protein 1,PD-1)抑制剂单药一线治疗MSI-H/dMMR晚期CRC的地位不可动摇,已作为最高级别的Ⅰ类推荐写进中国抗癌协会临床肿瘤学协作专业委员会(Chinese Society of Clinical Oncology,CSCO)指南,余标志物是否在CRC免疫治疗中扮演类似角色尚不确定[16]。本文目的在于探究部分基因的表达是否可作为新的生物标志物,对直肠癌患者免疫治疗有指导意义。
1 资料与方法
1.1 一般资料回顾性分析2015年1月至2021年10月郑州大学第一附属医院收治的102例直肠恶性肿瘤患者,肿瘤病理类型均为腺癌,患者均接受过基于二代测序(next generation sequencing,NGS)法的基因检测及至少2周期的抗PD-1免疫治疗,患者及家属在接受治疗前均签署知情同意书。直肠癌患者共有102例,包含男56例,女46例;年龄<55岁50例,≥55岁52例;有吸烟饮酒史21例;Ⅲ期肿瘤15例,Ⅳ期肿瘤87例;以下各组年龄、性别、吸烟饮酒史、肿瘤分期差异均无统计学意义(P>0.05)。
1.2 选取标准
1.2.1纳入标准 (1)在治疗前接受过基因检测且能准确查询到基因检测报告;(2)在二线治疗方案失败后通过影像学确认病灶进展后开始接受正规规律免疫治疗;(3)至少接受过2周期正规抗PD-1免疫治疗后定期复查;(4)根据实体瘤疗效评价标准(RECIST1.1)[17]评估至少含1个可测量病灶;(5)美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状况评分为0~1分;(6)年龄≥18岁,性别不限;(7)规律随访,依从性良好,临床资料完整;(8)对治疗有较好的耐受性,无严重不良反应。
1.2.2排除标准 (1)接受免疫治疗小于2周期;(2)虽接受免疫治疗至少2周期,但未行影像学确认病灶进展即改变治疗方案;(3)免疫治疗使病灶缓解后又行局部手术或介入治疗;(4)治疗过程中出现严重不良反应而停止治疗;(5)有神经疾病或精神疾病史;(6)已知具有严重或未能控制的基础疾病;(7)存在治疗禁忌证。
1.3 治疗方法在患者二线方案治疗失败后(影像学确认病灶进展),给予患者抗PD-1受体抑制剂应用,包括卡瑞利珠单抗(江苏恒瑞医药有限公司,国药准字S20190027)、特瑞普利单抗(上海骏实生物科技有限公司,国药准字S20180015)、信迪利单抗[信达生物(苏州)有限公司,国药准字S20180016],3种抗PD-1受体抑制剂疗效差异无统计学意义(P>0.05)。卡瑞利珠单抗每次每支200 mg配入100 mL 9 g·L-1的氯化钠溶液中静脉滴注,每个治疗周期1次;特瑞普利单抗每次每支240 mg配入9 g·L-1的氯化钠溶液100 mL中静脉滴注,每个治疗周期1次;信迪利单抗每次每支200 mg配入9 g·L-1的氯化钠溶液100 mL中静脉滴注,每个治疗周期1次,14~21 d为1个周期,直至患者不能耐受或因疾病进展而终止治疗或死亡,观察评价临床疗效。
1.4 疗效观察收集患者每个周期治疗前的基线资料,采用胸及全腹部增强CT、脑部MRI及全身骨扫描等评估全身病灶,采用实体肿瘤疗效评价标准(RECIST1.1)[17]评价疗效,包括完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。客观缓解率(objective response rate,ORR)为CR率与PR率之和;临床获益率(clinical benefit rate,CBR)为CR率、PR率、SD率之和。随访记录无进展生存期(progression free survival,PFS)和不良反应。免疫治疗过程中的常见不良反应包括皮疹、胃肠道反应、骨髓抑制、肝功能损伤等(1~2级不良反应为轻度;≥3级不良反应为重度),患者治疗过程中各组无治疗相关死亡出现。至少接受免疫治疗2个周期后采用影像学检查评估临床疗效。每周期治疗前1 d、第4天复查血常规及肝、肾功能评估不良反应。通过在院观察及电话随访获得患者的相关资料。随访记录至患者不能耐受或因疾病进展而终止治疗或死亡,随访截止至2021年12月31日。研究终点:主要终点为中位PFS,次要终点为ORR及CBR。
1.5 统计学方法采用SPSS 26.0统计软件处理数据。组间比较采用校正χ2检验、Fisher确切概率法等,通过Kaplan-Meier法绘制生存曲线,采用log-rank检验比较生存率。P<0.05为差异有统计学意义。
2 结果
2.1 突变基因影响采用基于NGS法的基因检测对符合条件的102例患者的肿瘤组织进行突变基因检测(其中12例患者仅行K-RAS、N-RAS、BRAF、PIK3CA4项基因检测;3例患者仅行K-RAS、N-RAS、BRAF3项基因检测),记录突变基因的名字及突变数量(部分基因的突变人数过少,未列出)。见表1。其中K-RAS、SMAD4、TP53、APC、MYC阳性或阴性例数均不少于20例,可用于后续统计分析;余基因阳性或阴性突变例数相差较大,不予分析。

表1 突变基因及对应例数
2.1.1K-RAS基因 根据K-RAS基因突变情况分为两组,ORR及CBR在K-RAS(﹢)和K-RAS(-)的患者中比较,差异无统计学意义(P>0.05)。见表2。若以PFS考量两组的差异性,K-RAS(﹢)患者中位PFS为3.5个月(95% CI:2.27~4.73),K-RAS(-)患者中位PFS为4.0个月(95% CI:2.91~5.09),差异无统计学意义(P=0.469)。见图1。
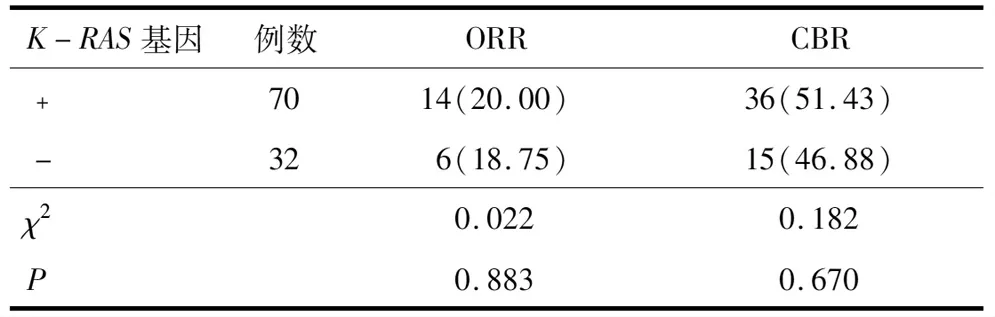
表2 K-RAS基因突变对ORR及CBR的影响比较[n(%)]

图1 K-RAS基因突变中位PFS比较
2.1.2SMAD4基因 根据SMAD4基因突变情况分为两组,ORR及CBR在SMAD4(+)和SMAD4(-)的患者中比较,差异无统计学意义(P>0.05)。见表3。若以PFS考量两组的差异性,SMAD4(+)患者中位PFS为3.5个月(95% CI:2.40~4.60),SMAD4(-)患者中位PFS为3.0个月(95% CI:2.20~3.81),差异无统计学意义(P=0.458)。见图2。
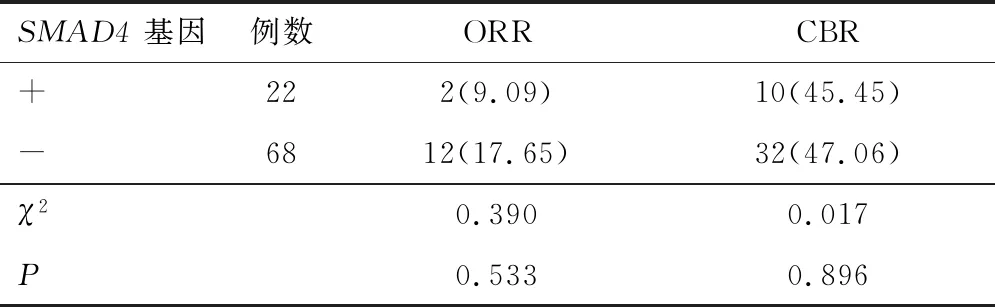
表3 SMAD4基因突变对ORR及CBR的影响比较[n(%)]
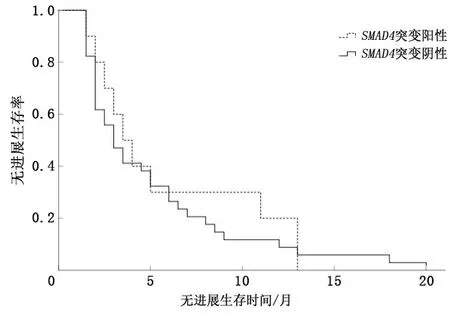
图2 SMAD4基因突变中位PFS比较
2.1.3TP53基因 根据TP53基因突变情况分为两组,TP53(+)和TP53(-)患者ORR及CBR比较,差异无统计学意义(P>0.05)。见表4。若以PFS考量两组的差异性,TP53(+)患者中位PFS为3.5个月(95% CI:2.83~4.17),TP53(-)患者中位PFS为2.0个月(95% CI:0.356~3.64),差异无统计学意义(P=0.589)。见图3。
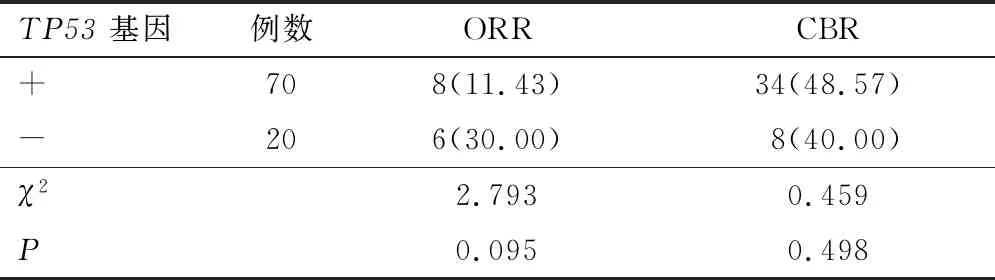
表4 TP53基因突变对CBR影响对比[n(%)]
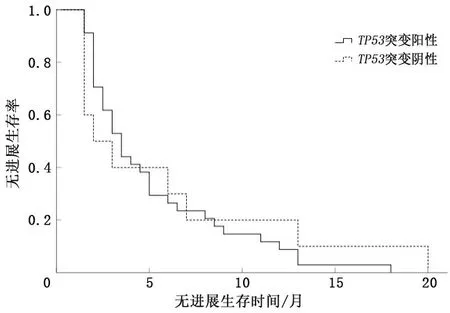
图3 TP53基因突变中位PFS比较
2.1.4APC基因 根据APC基因突变情况分为两组,APC(+)和APC(-)患者的ORR及CBR比较,差异无统计学意义(P>0.05)。见表5。若以PFS考量两组的差异性,APC(+)患者中位PFS为3.0个月(95% CI:1.96~4.04),APC(-)患者中位PFS为3.5个月(95% CI:2.29~4.70),差异无统计学意义(P=0.860)。见图4。
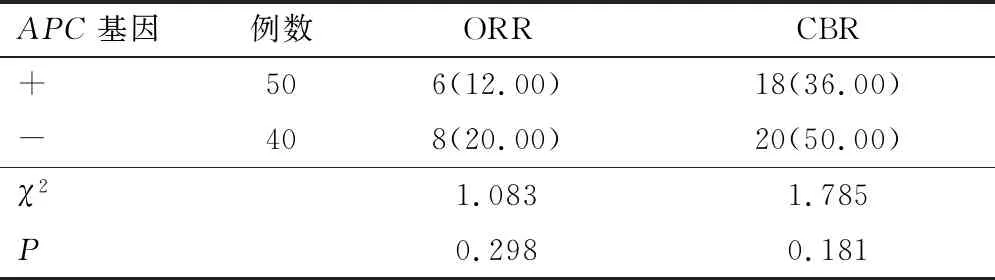
表5 APC基因突变对CBR影响对比[n(%)]
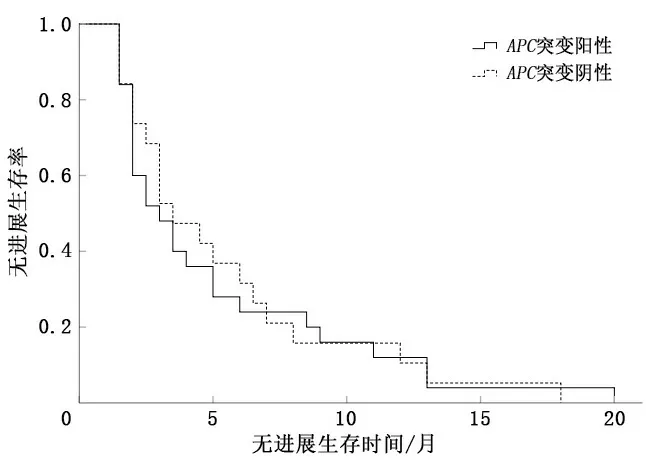
图4 APC基因突变中位PFS比较
2.1.5MYC基因 根据MYC基因突变情况分为两组,MYC(+)和MYC(-)患者ORR及CBR比较,差异无统计学意义(P>0.05)。见表6。若以PFS考量两组的差异性,MYC(+)患者中位PFS为2.5个月(95% CI:1.40~3.60),MYC(-)患者中位PFS为3.5个月(95% CI:2.83~4.17),差异无统计学意义(P=0.120)。见图5。
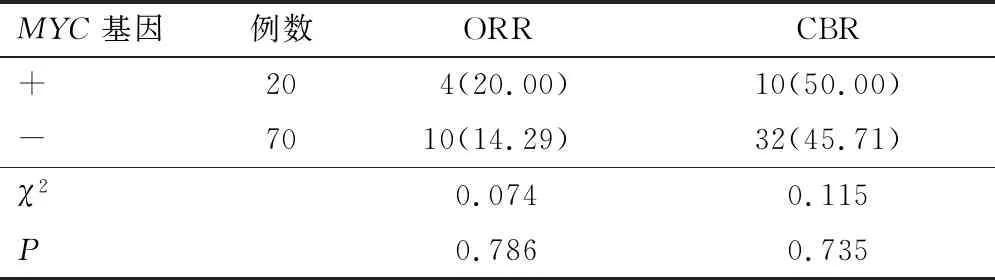
表6 MYC基因突变对CBR影响对比[n(%)]

图5 MYC基因突变中位PFS比较
2.2 TMB影响采用基于NGS法基因检测的符合条件的102例患者,对87例患者的肿瘤组织进行了TMB的检测,记录每个肿瘤的TMB值,根据TMB突变量分为两组(突变量<8为一组,突变量≥8为另一组)。低TMB组和高TMB组患者ORR比较,差异无统计学意义(P>0.05);两组CBR比较,差异有统计学意义(P<0.05)。见表7。PFS分布见图6。若以PFS考量两组的差异性,高TMB患者中位PFS为5.0个月(95% CI:3.12~6.88),低TMB患者中位PFS为3.0个月(95% CI:1.80~4.20),差异有统计学意义(P<0.001)。见图7。
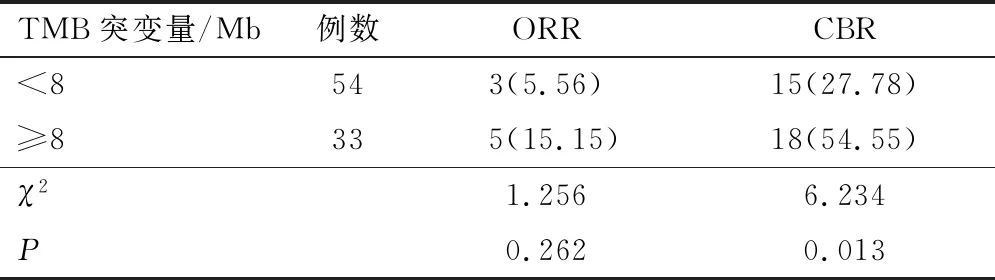
表7 TMB突变量对CBR影响对比[n(%)]
2.3 不良反应各组不良反应发生率比较,其中APC(+)与APC(-)、SMAD4(+)与SMAD4(-)患者间肝功能损伤比较差异有统计学意义,APC(-)患者肝功能损伤发生率较APC(+)患者高(χ2=9.000,P=0.003),SMAD4(+)患者肝功能损伤发生率较SMAD4(-)患者高(χ2=5.896,P=0.015);MYC(+)与MYC(-)患者间的轻度骨髓抑制出现率差异有统计学意义,MYC(+)患者轻度骨髓抑制发生率较MYC(-)患者高(χ2=11.358,P<0.001);余各组之间比较差异无统计学意义(P>0.05)。见表8。

图6 PFS分布散点图

图7 高TMB组和低TMB组的中位PFS比较

表8 各组不良反应发生率比较
3 讨论
近年来,免疫疗法的引入作为癌症治疗的突破口。免疫检查点抑制剂(immune checkpoint inhibitor,ICI)疗法,包括抗PD-1、抗PD-L1和抗CTLA-4疗法,在增强有效T细胞的活性和抑制肿瘤微环境生长方面发挥了作用[18-19]。多数人认为免疫疗法是一种前途光明的治疗方法,已进行了数年的研究。尽管一些研究表明直肠癌患者对免疫疗法很敏感,但在临床实践中只取得了很小的获益。目前通过抑制免疫检查点途径取得的成功,尤其是PD-1途径,是免疫治疗的一个突破。肿瘤细胞表面的PD-L1与T细胞上的PD-1结合,抑制T细胞的抗肿瘤功能,导致效应期免疫逃逸及免疫循环。考虑到药物有效率,需要预测性生物标志物来确定更有可能对ICI产生反应的患者,并确定对ICI有抵抗力并需要联合治疗或改变治疗的患者[20]。
根据分析结果,直肠癌高TMB患者较低TMB患者接受免疫治疗而言,呈现出更长的PFS和CBR,Goodman等[21]的研究结果表明通过基于杂交捕获的NGS检测1.2 Mb基因组测量的TMB可以预测除黑色素瘤和非小细胞肺癌之外的许多类型的抗PD-1/PD-L1免疫治疗的结果,他们验证了与较低的患者相比,TMB高的患者有着更高的缓解率、更长的PFS和总生存期(overall survival,OS),并且TMB与结果之间的相关性呈线性关系。但这是基于所有肿瘤类型而言的,当排除黑色素瘤和非小细胞肺癌患者时,较高的TMB与较好的缓解率和PFS之间的关联仍然显著,OS却失去了意义。本文的研究对象为直肠癌患者,也同样证实了高TMB预示了更好的PFS和CBR,这点与Goodman等[21]结论一致,但ORR差异无统计学意义,可能与临床数据过少有关。TMB可作为直肠癌PD-1/PD-L1治疗反应的预测指标之一,但它并不是完美的,高TMB组仍有个别病例PFS短于6个月;低TMB组也存在PFS高于高TMB组(图6)。
而突变基因结果显示K-RAS、SMAD4、TP53、APC、MYC基因突变与否和直肠癌免疫治疗预后无关,虽然ORR、CBR、PFS均无统计学意义,但部分基因ORR和CBR的结果与PFS的结果似乎产生了矛盾,例如K-RAS(+)组ORR、CBR虽稍高于K-RAS(-)组,但中位PFS却稍低于后者,可能与两组样本量差距较大以及评价疗效时主观性带来的误差有关,虽然存在矛盾,但两组间差异无统计学意义,所以这种矛盾也失去了意义。突变谱系是非常庞大的,而每名患者的突变基因具有随机性,个别基因的突变又是极其罕见的,所以迫切需要更多的数据来论证。虽然Stockton等[22]的研究发现在肿瘤治疗前组织中可检测出丰富的PIK3CA和FBXW7基因,并且在治疗后仍丰富,这意味着它们可能是反应性差的生物标志物。但此项研究涉及的治疗手段太多,不限于免疫治疗,所以这些基因对于免疫治疗的反应性仍有待考据。
可能成为直肠癌免疫治疗疗效的靶点还有很多,其中包含了PD-L1表达量、微卫星稳定性(microsatellite stability,MSS)等,但本文收集数据过程中,并未发现过多患者在治疗前检测PD-L1表达量,且超过95%的患者微卫星稳定。据Devaraj等[23]调查,直肠癌患者中的MSI很少见,迄今为止,人们对直肠癌的MSI子集的表达知之甚少,本文数据收集也与此相符,所以未对MSS的差异进行探讨。关于PD-L1,学界存在争议,既有Ozawa等[24]论证了PD-L1在肿瘤组织中的高表达;又有Jomrich等[25]未在转移肿瘤组织中检出高表达的PD-L1。由于预测CRC免疫治疗疗效的标志物太少,现如今直肠癌的免疫治疗仍不作为主流选择。
本文研究仍有一些局限性。首先,它是回顾性的;其次,用于回顾的患者数量过少,代表性不强;第三,评估疗效上存在一定的主观性;第四,癌症不是静止的,并且可以随着它们的进化而获得突变。NGS通常在旧的活检标本上进行,因此测试的样本可能无法准确反映肿瘤当前的状态。
综上所述,本研究表明直肠癌高TMB患者相比低TMB患者接受免疫治疗而言,呈现出更长的PFS和CBR,TMB作为直肠癌预后指标有一定意义;K-RAS、SMAD4、TP53、APC、MYC基因突变与否和直肠癌免疫治疗预后无关,为进一步论证,还需要更大规模的研究。

