乳腺包裹性乳头状癌的超声特征分析
王璐,刘佳,李茂桐,晏丹,张建兴
1.广州中医药大学第二附属医院 超声影像科,广东 广州 510120;2.广州中医药大学第一附属医院 影像科,广东 广州 510120
引言
乳腺导管内乳头状病变是一种独特的组织病理学类型,具有不同的临床表现、组织学和放射学特征。2012版《WHO乳腺肿瘤分类》[1]将乳头状肿瘤分为五类:导管内乳头状瘤、乳头状导管原位癌、包裹性乳头状癌(Encapsulated Papillary Carcinoma,EPC)、实性乳头状癌和浸润性乳头状癌。EPC是一个罕见的乳腺恶性肿瘤[2],约占所有乳腺癌病例的0.5%~1.0%[3]。它可以发生在妇女的任何年龄阶段,主要是绝经后。其病理学主要特征是一种囊性病变,周围有纤维包膜和乳头状生长[4-5]。EPC被认为是一种自限性的惰性乳头状癌[6-7]。单纯EPC生长缓慢,预后极好,较少复发,转移率低,很少累及区域淋巴结。伴浸润或导管原位癌(Ductal Carcinoma in Situ,DCIS)复发及转移概率增大[8-9],临床治疗原则亦有所不同。目前,EPC的病例数量有限,有关乳腺EPC的临床研究较少,缺乏总结性研究,影像科医师对其影像学特征不甚熟悉,尤其是超声影像,本文旨在探讨不同类型EPC的超声声像图改变,鉴别分析不同类型EPC的声像图特征,总结其超声学特点,提高超声学诊断EPC的可靠性和准确性,为临床医生的术前诊断提供有效依据。
1 资料与方法
1.1 一般资料
回顾性分析我院2017年1月至2021年5月经组织病理确诊的EPC患者51例,均为女性,年龄24~84岁,左乳24例、右乳27例,51例均行乳腺超声检查。所有患者均因自觉发现乳腺肿块而入院检查,查体均发现乳腺肿块,部分区域质软韧,部分质硬,活动度欠佳,双乳酒窝征(-)、橘皮征(-),腋下及双侧锁骨上下均未触及明显的肿大淋巴结。
纳入标准:① 手术及病理证实为EPC患者;② 临床和影像学资料完整者。
排除标准:① 在彩超检查前患侧做过手术者;② 在彩超检查前患侧做过新辅助化疗者;③ 临床及病理资料缺失者。
1.2 仪器与方法
超声检查:使用GE LOGIQ E9超声诊断仪,探头频率为7.5~13.0 MHz。患者一般取仰卧位,双臂上举,使乳腺固定,充分暴露乳腺和腋下,当乳腺较为大或为特殊部位病灶时,可适当调整体位,采取不同角度的侧卧位。彩超检查时以乳头为中心,探头从多个切面扫查,观察病灶位置、大小、形态、边缘、内部回声、方位、后方回声、钙化等情况。然后用彩色多普勒观察肿瘤内的血流情况,血流判断标准[10]:Adler 0,肿物内无血流信号;Adler Ⅰ,少量血流,可见1~2处点状或短棒状血流;Adler Ⅱ,中等血流,可见3~4处点状血流或1条管壁清晰的血管;Adler Ⅲ,丰富血流,可见4处以上点状血流或2条以上管壁清晰的血管。
1.3 病理诊断
常规的病理取材、脱水、包埋、切片,进行常规苏木精-伊红(HE)染色及免疫组化染色。参照2012版《WHO乳腺肿瘤分类》[1]进行诊断。浸润灶表现为普通类型浸润癌,出现于EPC病变的纤维被膜之外。
1.4 观察指标
对比分析不同类型EPC(单纯EPC、EPC伴浸润或DCIS)的二维超声声像特征(如肿瘤最大直径、形态、肿瘤边缘、回声类型、肿瘤方位、瘤内钙化等)及彩色多普勒超声血流信号分布。
1.5 统计学分析
所有数据采用SPSS 23.0软件统计,符合正态分布的计量资料,用±s表示,组间比较采用两独立样本t检验;不符合正态分布采用[M(P25,P75)],采用秩和检验;计数资料用n (%)表示,采用χ2检验或Mann-WhitneyU检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
单纯EPC组与伴浸润或DCIS组的平均发病年龄比较差异无统计学意义(t=0.032,P=0.975)。两组临床体征均可触及乳腺肿块,两组肿块的位置差异无统计学意义(χ2=2.699,P=0.100),见表 1。

表1 两组一般资料对比
2.2 病理结果
51例EPC根据病理分类分为两组,单纯EPC组21例,EPC伴浸润或DCIS组30例(图1)。单纯EPC多为扩张囊腔内见质嫩易碎包块,镜下为厚纤维被膜包绕的乳头状增生性病变,肿瘤上皮形态单一,具有异型性。肿瘤被厚壁纤维囊包裹,呈筛孔、乳头状、实性排列。EPC伴浸润或DCIS其周边纤维包膜内可见浸润性癌,其中病变纤维血管乳头周围及囊腔周围有无肌上皮细胞是鉴别要点。
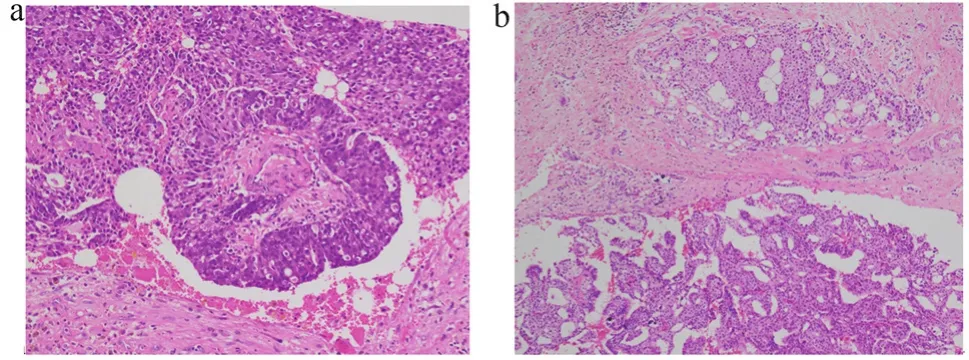
图1 包裹性乳头状癌病理图
2.3 二维超声检查结果
本组病例中,单纯EPC组肿瘤最大直径范围为6~110 mm,30.15(14.54,87.56)mm;EPC伴浸润或DCIS 组最大直径为 9~96 mm,31.64(13.82,85.54)mm。两组直径的差异无统计学意义(U=0.050,P=0.892)。
单纯EPC大多数表现为形态规则,呈椭圆形(81.0%,17/21)(图2),EPC伴浸润或DCIS大多数表现为形态不规则(63.3%,19/30)(图3),两组在肿瘤形态方面比较差异有统计学意义(χ2=9.785,P=0.002)。单纯EPC以边缘光整(61.9%,13/21)多见,EPC伴浸润或DCIS则以边缘模糊(26.7%,8/30)和微小分叶(30.0%,9/30)多见,两组在肿瘤边缘方面比较差异有统计学意义(χ2=17.460,P=0.002)。
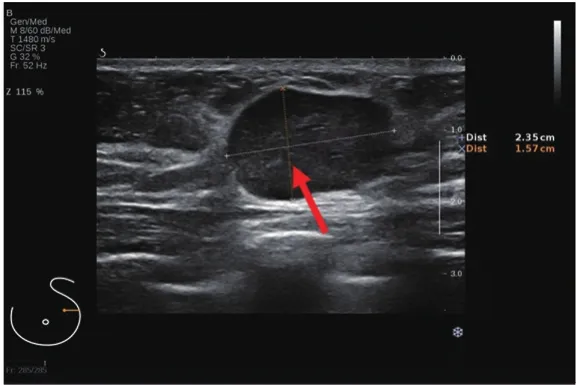
图2 单纯型EPC超声声像图表现
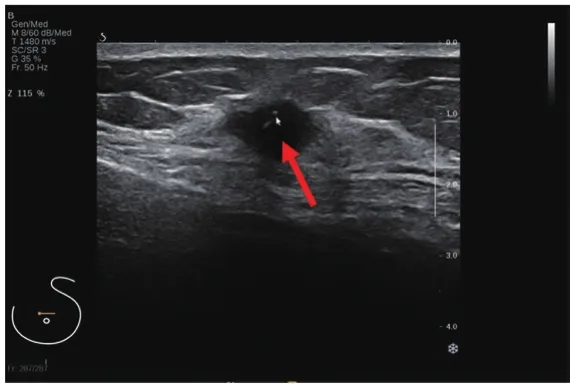
图3 EPC伴浸润超声声像图表现
单纯EPC和EPC伴浸或DCIS病灶均多表现为囊实混合回声[单纯EPC组71.4%(15/21),伴浸润或DCIS组56.7%(17/30)]和不均匀回声[单纯EPC组28.6%(6/21),伴浸润或DCIS组40.0%(12/30)],两组病灶内部回声差异无统计学意义(χ2=1.586,P=0.452),但均以囊实混合回声多见。
单纯EPC大多无瘤内钙化(90.5%,19/21),EPC伴浸润或DCIS病灶瘤内钙化10例(33.3%,10/30),两组病灶在瘤内钙化方面比较差异有统计学意义(χ2=3.892,P=0.049)。
单纯EPC组与EPC伴浸润或DCIS组在病灶方位、后方回声方面比较,差异均无统计学意义(P=0.368、0.127),见表2。
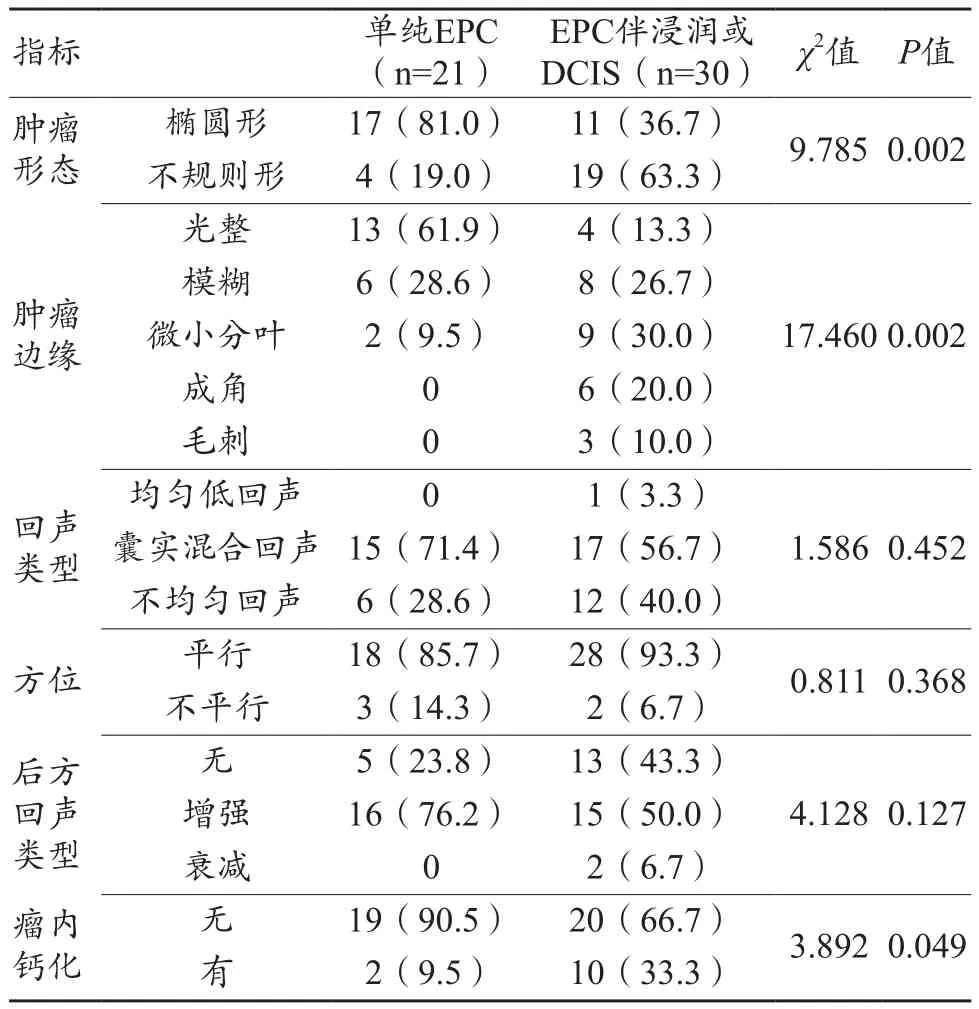
表2 单纯EPC及EPC伴浸润或DCIS常规超声表现[n(%)]
2.4 彩色多普勒超声检查结果
51例乳腺包裹性乳头状癌病例中,44例(86.3%,44/51)可检出不同程度的血流信号(图4)。单纯EPC组6例(37.5%,6/16)可见Ⅲ级血流信号。EPC伴浸润或DCIS组12例(42.9%,12/28)可见Ⅲ级血流信号。两组血流信号差异无统计学意义(P=0.365),但两组均以Ⅲ级血流信号多见,见表3。
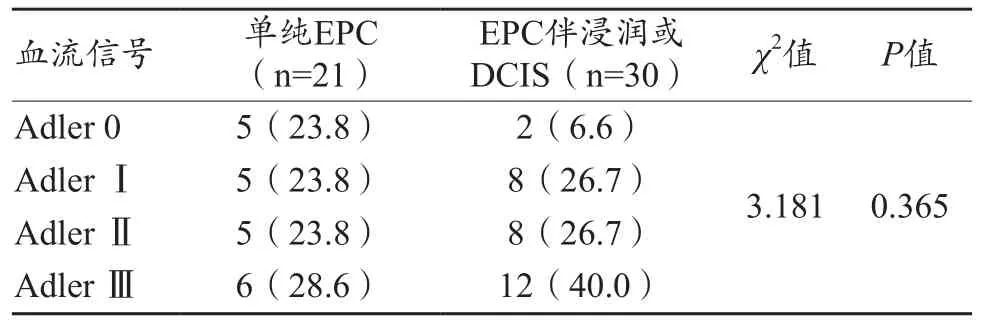
表3 单纯EPC及EPC伴浸润或DCIS血流信号分布情况[n(%)]
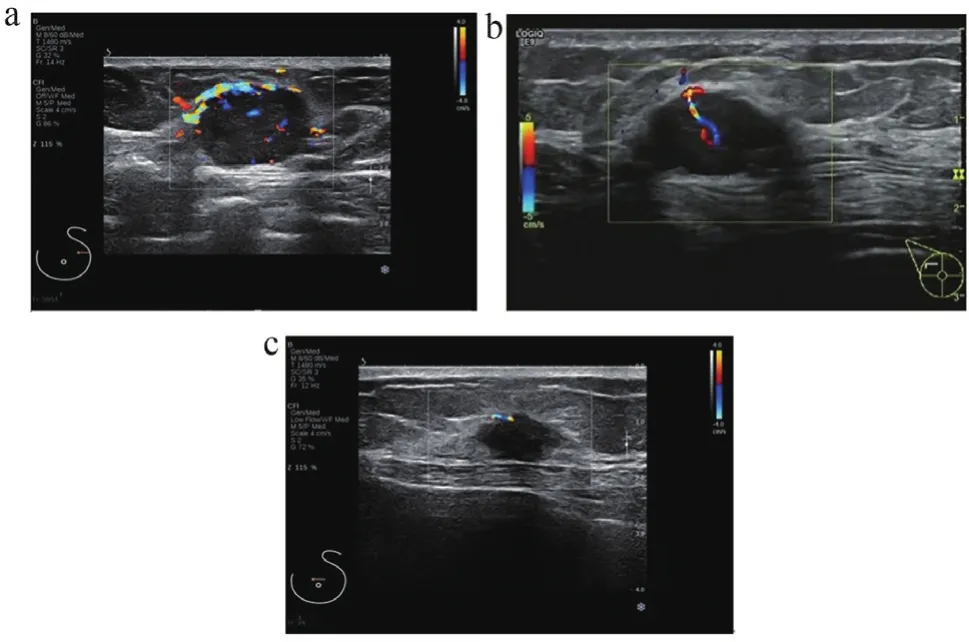
图4 EPC彩色多普勒(CDFI)图像
3 讨论
EPC是一种较罕见的乳腺恶性肿瘤,主要发生在绝经后妇女,偶可见于男性,预后相对好[11]。本组病例均为女性,单纯EPC患者平均年龄(60.3±14.0)岁,EPC伴浸润或DCIS组患者平均年龄(60.5±14.4)岁,与Rodríguez等[12]报道相符,两组患者的发病年龄无显著差异。在行乳腺彩超检查时,如遇到年龄较大的老年患者,应着重观察肿块的形态、边缘、内部回声、血流特点,以防漏诊、误诊。EPC查体均可触及乳腺肿块,并伴有乳腺疼痛,伴或不伴乳头溢液,边界欠清,部分区域质软韧,部分质硬,活动度欠佳。本研究病例中,51例患者均发现乳腺肿块,25例肿块逐渐增大,30例伴乳腺疼痛,18例发现乳头溢液。本研究病例中单纯EPC组肿瘤直径为6~110 mm;EPC伴浸润或DCIS组直径为9~96 mm。统计分析结果表明不同类型EPC肿瘤直径的差异无统计学意义。
EPC的基本病理特点是它具有乳头状结构,通常被厚薄不一的纤维包膜所包围[13]。包膜厚2~6 mm,与周围的乳腺组织之间的边界是清晰的,乳头表面排列着低-中核级别的单一肿瘤类型上皮细胞[14]。大体检查,EPC呈囊实性,质地柔软,可以看到囊腔的形成,在囊腔内可见血性液体[15-16]。这是此类肿瘤影像学表现的基础。
单纯EPC组多表现为形态规则,呈椭圆形(81.0%,17/21),边缘光整(61.9%,13/21),EPC伴浸润或DCIS组多表现为形态不规则(63.3%,19/30),以边缘模糊(26.7%,8/30)和微小分叶(30.0%,9/30)多见,少数可见成角和毛刺,形态学表现倾向恶性。本研究结果显示,在单纯EPC组和EPC伴浸润或DCIS组病例中,肿瘤形态及边缘差异均有统计学意义(P<0.05)。EPC的病理特点决定了其超声表现具有一些良性特征,尤其是单纯EPC,边缘较多表现为光整,呈椭圆形。如遇到高龄、边缘光整的肿块时需要警惕。形态不规则、边缘模糊或呈微小分叶的病灶伴浸润可能性大。在术前评估时应注意鉴别诊断,为临床医生的治疗方案提供有效依据。在EPC病变内,较少表现为均匀低回声(2.0%,1/51),而更多表现为囊实混合回声[单纯EPC组71.4%(15/21),伴浸润或DCIS组56.7%(17/30)]或不均匀回声[单纯EPC组28.6%(6/21),伴浸润或 DCIS组40.0%(12/30)],不同类型乳腺包裹性乳头状癌内部回声差异无统计学意义,但均以囊实混合回声多见,与病理所见相符。在检查过程中如遇到囊实混合回声肿块,要警惕存在一定的恶性风险。
良性肿瘤的超声特征一般表现为肿瘤后方回声增强,本研究中,大部分EPC患者肿瘤表现为后方回声增强,这也是EPC易误诊为良性肿瘤的原因之一。单纯EPC组多表现为后方回声增强(76.2%,16/21),而EPC伴浸润或DCIS组肿瘤后方回声增强(50.0%,15/30)和无改变(43.3%,13/30)占有较大的比例,还有2例伴有肿瘤后方回声衰减,后方回声衰减多提示恶性肿瘤的征象,一般较易诊断。
用彩色多普勒检测肿瘤内部血流情况,44例(86.3%,44/51)可检出不同程度的血流信号。EPC更多表现为丰富血供,可见Ⅲ级血流信号。其病理机制可能是包膜内血管丰富[17-18]。Deng等[19]研究报道,伴浸润的EPC血流更丰富,本研究在肿瘤内部血供方面,两组比较没有显著差异。原因可能是本研究病例数量相对较少,需加大样本数量进行进一步对比和研究。
EPC与其他乳腺癌一样,肿瘤可出现点状钙化,但钙化不是其特征性表现。本研究病例中,12例肿瘤内出现钙化(23.5%,12/51),钙化较少见,与王泽坤等[20]报道基本一致。单纯EPC组2例可见钙化(9.5%,2/21),EPC伴浸润或DCIS组10例可见钙化(33.3%,10/30),两组间差异无统计学意义。
EPC需与乳腺其他肿块型病变相鉴别:① 三阴性乳腺癌,低分化的三阴性乳腺癌因内部坏死而成囊性暗区,表现为囊实性肿块,需与EPC相鉴别。三阴性乳腺癌的液化坏死多呈不规则型,且多发生于绝经前女性,与EPC有所不同;② 导管内乳头状瘤,同为导管内病变,导管内乳头状瘤也可表现为囊实性肿块,二者需要鉴别,一般EPC好发年龄较大,囊内肿块稍大,且血流信号稍丰富,导管内乳头状瘤非高龄发病,且多伴有导管扩张;③ 黏液癌,均好发于老年女性,黏液癌血流不如EPC丰富,且好发于乳腺周边,而EPC好发于乳晕周围,二者可进行鉴别;④ 纤维腺瘤,呈低回声的EPC需与纤维腺瘤相鉴别,纤维腺瘤好发于年轻女性,且血流不丰富或无血流信号,而EPC多为丰富血流信号。
综上所述,超声术前检查可为EPC的诊断及鉴别诊断提供重要的参考依据,单纯EPC超声多见囊实混合回声、呈椭圆形、边缘光整等良性征象。若病变形态不规则、边缘模糊或呈微小分叶,有成角或毛刺,则要警惕存在很高的恶性风险。应进一步行组织学检查以排除相关的 DCIS和侵入性成分,为临床合理治疗提供依据。由于EPC较少见,本研究病例数量有限,没有进一步分析EPC伴浸润和EPC伴DCIS的差异,有待积累更多病例,将EPC分为3组进行比较和分析,当样本量较大时,可联合多模态影像学方法对该病进行诊断及鉴别诊断。

