比率型近红外荧光探针检测小鼠体内半胱氨酸
毕文强,段 钎,李 贞
湖北大学化学化工学院/有机化工新材料湖北省协同创新中心/有机功能分子合成与应用教育部重点实验室,湖北武汉430062
0 引 言
半胱氨酸(cysteine, Cys)是20 种天然氨基酸中唯一含有还原性硫醇基团的氨基酸,在许多生理和病理过程中起着关键作用[1~4]。正常水平的Cys(30~200 μmol/L)能维持各种蛋白质和抗氧化剂谷胱甘肽(GSH)的合成[5],同时也是人类新陈代谢中硫化物的来源[6,7]。然而,过量的Cys 与许多疾病息息相关,如类风湿性关节炎、帕金森病、阿尔茨海默症等疾病[8,9]。同时,有报道称缺乏Cys 会导致生长缓慢、水肿、肝脏损伤、皮肤病变等。Cys 被认为是早期诊断和治疗以及疾病监测最重要的生物标志物之一,开发有效手段对生物体系中的Cys 进行分析检测具有巨大的应用前景。
传统的Cys 检测方法包括高效液相色谱法、质谱法、毛细管电泳法和电化学方法等[10~17]。但这些方法具有成本高、时间长、预处理复杂等缺点,在生物体系中的应用受到限制。荧光探针因其高效、快速、成本低和灵敏度高等优点被应用于生物体系中Cys 的检测[18,19],一些基于萘酰亚胺、荧光素、咔唑、氨基喹啉或香豆素等荧光团的Cys 探针相继出现[20~24]。但由于探针在体内分布不均以及生物体环境差异,导致其成像结果不够准确。比率型荧光探针能够有效消除上述因素所带来的干扰,显著提高成像结果的准确性[25]。目前可应用于特异性检测Cys 的比率型荧光探针较少,亟需设计构建新型的Cys 比率型荧光探针。
基于此,我们设计并合成了一种可特异性检测Cys 的比率型近红外荧光探针Cy-B。该探针在近红外光激发下,发射位于808 nm 的荧光信号;而当其与Cys 反应后,产物能够在635 nm 处产生荧光信号,且随着Cys 浓度增加,808 nm 处的荧光信号逐渐减弱,635 nm 处的荧光信号逐渐增强。利用荧光发射的双通道信号,可构建比率型探针,实现体内Cys 的高准确度分析检测。
1 实验部分
1.1 仪器和试剂
试剂:3,3′-双十八烷基氧碳花菁高氯酸盐(DiOC18(3))、N-甲基马来酰亚胺(NMM)、N-乙基马来酰亚胺(NEM)、二硫苏糖醇(DTT)、丙烯酰氯、溴-十一酸等试剂购于上海阿拉丁试剂公司;其他化学试剂和溶剂均为分析纯级,购自国药集团化学试剂有限公司或阿拉丁试剂公司;实验用水均为电阻率18.2 MΩ·cm 的超纯水。
仪器:Avance Neo 400 型磁共振仪(Bruker 公司),6224 TOF 液质联用仪(Agilent公司),RF-6000型荧光光谱仪(Shimadzu 公司),UH-4150 型紫外-可见近红外吸收光谱仪(Hitachi公司),Multiskan FC 型酶标仪(美国Thermo Scientific 公司)LSM-880 型多光子共聚焦荧光显微镜(Zeiss 公司),IVIS Lumina LT 型小动物活体成像仪(PerkinElmer公司)。
1.2 实验方法
1.2.1 探针Cy-B 的合成方法
探针Cy-B 的合成路线如图1 所示。
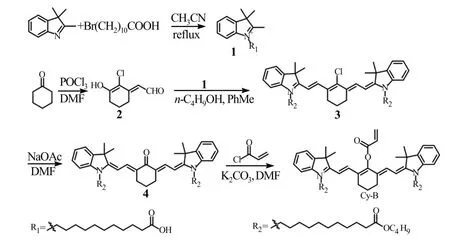
图1 Cy-B 的合成路线Fig.1 Synthesis route of Cy-B
其中化合物1~4 参照文献方法合成[25,26]。终产物Cy-B 的合成步骤如下:将化合物4(918 mg,1 mmol)和K2CO3(280 mg,2 mmol)溶 于20 mLN,N-二甲基甲酰胺(DMF)中,室温下搅拌30 min后,将丙烯酰氯(136 mg,1.5 mmol)溶于10 mL DMF 后缓慢加入上述体系,室温搅拌6 h。反应完成后,首先将反应液用乙酸乙酯和水(80 mL,体积比20∶1)混合溶液萃取,有机相用无水Na2SO4干燥后减压蒸馏得到粗产物。最后将粗产物采用硅胶柱层析法(淋洗剂为二氯甲烷/甲醇,体积比20∶1)分离提纯,得到绿色固体产物Cy-B。产物的磁共振氢谱1H NMR (400 MHz,DMSO-d6)化学位移δ:7.61(t,J=9.3 Hz, 4H),7.42(d,J=3.2 Hz,4H),7.33~7.18(m,2H), 6.85(d,J=17.1 Hz,1H), 6.72(dd,J=17.2,10.3 Hz,1H),6.45(d,J=10.2 Hz,1H),6.24(d,J=14.1 Hz,2H),4.18(t,J=6.1 Hz,4H),3.99(t,J=6.5 Hz,4H),2.67(s, 4H),2.26(t,J=7.3 Hz, 4H), 1.93~1.81(m, 2H), 1.71(t,J=6.3 Hz, 4H), 1.53(s, 12H), 1.42~1.26(m, 16H),1.23(m,20H),0.87(t,J=7.4 Hz,6H);磁共振碳谱13C NMR(101 MHz,DMSO)δ:14.00,19.09,20.98,24.14,24.95,26.49,27.31,27.91,28.89,29.08,29.22,29.25,30.68,33.97,39.43,44.05,49.22,63.79,101.26,111.89,121.27,122.99,125.48,127.09,129.09,129.98,131.17,136.55,139.67,141.41,142.53,158.75,163.76,172.03,173.38。高分辨质谱(HRMS,m/z):[M]+理论值为971.687 2,实测值为971.684 9。
1.2.2 缓冲溶液中Cys 的检测
考察缓冲溶液中探针Cy-B 的响应性能。探针Cy-B 溶于二甲基亚砜(DMSO)制备成10 mmol/L储备液。测试时,使用4-羟乙基哌嗪乙磺酸(HEPES)缓冲溶液(EtOH/HEPES 体积比1∶4,pH 7.4)将探针储备液稀释至5 μmol/L,加入不同浓度(0~150 μmol/L)的Cys,反应30 min,测试体系在720 nm 光激发下808 nm 处的荧光发射光谱及520 nm 光激发下635 nm 处的荧光发射光谱。
考察探针Cy-B 对Cys 响应的特异性。在Cy-B(5 μmol/L)溶液中加入150 μmol/L 的活性氧或活性氮类(H2O2、HClO、·OH、HNO、NO2-、ONOO-)、活性硫类(NaHS、Na2SO4、Na2S2O3、H2Sn)、金属离子(NaCl、Fe2+、KCl、Cu2+)以及生物分子(葡萄糖(Glucose)、牛血清白蛋白(BSA)、半胱氨酸(Hcy)、谷胱甘肽(GSH))等干扰物,反应30 min,分别测试在720 nm 光激发下808 nm 处及520 nm 光激发下635 nm 处的荧光发射强度变化。
考察探针的pH 稳定性。配制不同pH 值的EtOH/HEPES 缓冲溶液,将Cy-B 稀释至5 μmol/L,测定在不同pH 值缓冲溶液中Cy-B 的荧光强度。
1.2.3 细胞毒性
采用CCK-8 法[27]考察探针的细胞毒性。将HeLa 细胞(湖南丰晖生物公司)接种于96 孔板中,使用含10%胎牛血清和1%青霉素/链霉素的DMEM为培养基,37 °C 培养24 h;加入含不同浓度Cy-B 探针(0、5、10、15、20、25、30 μmol/L)的新鲜培养基继续培养24 h;每孔再加入10 μL CCK-8 溶液继续培养4 h。采用酶标仪测定体系在450 nm 处的吸光度,计算细胞存活率:细胞存活率=(加入Cy-B 组的平均吸光度/对照组的平均吸光度)×100%。
1.2.4 细胞共定位成像
将HeLa 细胞接种于直径35 mm 的玻璃底培养皿中,每皿中加入1 mL DMEM 培养基,细胞接种密度为1×105个,于37 ℃培养箱中生长24 h。移去培养基,加入细胞膜定位染料DiOC18(3),随后加入含Cy-B 的培养基,培养30 min,用10 mmol/L PBS(pH 7.4)清洗细胞3 次去除培养基多余的Cy-B,使用激光共聚焦荧光显微镜(CLSM)进行细胞成像。
1.2.5 细胞内Cys 成像
细胞外源性Cys 成像:参考文献方法[28],将HeLa 细胞接种于直径35 mm 的玻璃底培养皿中,每皿加入1 mL DMEM 培养基,细胞接种密度为1×105个,于37 ℃培养箱中生长24 h。移去培养基,加入含不同浓度Cys(100、200 μmol/L)的新鲜培养基培养30 min,再加入含Cy-B 的培养基,确保每皿Cy-B 终浓度为5 μmol/L,继续培养30 min,用PBS缓冲溶液清洗细胞3 次,使用CLSM 进行细胞成像。
细胞内源性Cys 成像:将HeLa 细胞接种于直径为35 mm 的玻璃底培养皿中,每皿加入1 mL DMEM 培养基,细胞接种密度为1×105个,于37 ℃培养箱中培养24 h,移去培养基。空白组:加入含Cy-B(5 μmol/L)的培养基。实验组1:先加入1 mmol/L NEM(巯基清除剂,用于消耗细胞内源Cys),再加入5 μmol/L Cy-B,培养30 min。实验组2:先加入1 mmol/L NEM,再加入1 mmol/L DTT(用于诱导细胞产生内源性Cys)培养30 min,最后加入5 μmol/L Cy-B。上述处理组用PBS 缓冲溶液清洗3 次,再使用CLSM 进行细胞成像。
1.2.6 活体内Cys 成像
所有动物实验均按照《实验动物饲养管理和使用指南》进行,并经湖北大学动物伦理与福利委员会批准。
Balb/c 小鼠(雌性,(20±2)g)由湖北贝恩特生物科技有限公司提供。实验组:将小鼠麻醉后脱毛,在小鼠的左侧皮下注射Cys(20 μL,1 mmol/L)和Cy-B(20 μL,1 mmol/L),在其右侧相同位置注射等量Cy-B。对照组:在小鼠的左侧皮下注射NMM(巯基清除剂,清除Cys)、Cys 和Cy-B(剂量均为20 μL,1 mmol/L),右侧相同位置注射等量的Cy-B。30 min 后,对两只小鼠进行活体成像(I635nm通道激 发 波 长λex=545 nm,发 射 波 长λem=(635±10)nm;I808nm通道λex=600 nm,λem=(810±10)nm)。
2 结果与讨论
2.1 探针Cy-B 的设计原理
以近红外花菁染料为母体,基于丙烯酸酯与Cys 的特异性识别反应构建了比率型Cys 近红外荧光探针Cy-B。该探针与Cys 反应后游离出羟基,进而触发分子内重排反应,使荧光团母体从花菁结构转变为酮菁结构Cy-O(图2)。Cy-B 分子中的疏水链十一酸正丁酯可嵌入细胞膜的磷脂双分子层内,使其具有细胞膜定位功能。随着Cys 含量升高,归属于花菁染料808 nm 左右的荧光发射峰强度(I808nm)减弱,归属于酮菁染料的635 nm 左右荧光发射峰强度(I635nm)增强,同时二者间比值(I635nm/I808nm)增大,由此可实现对Cys 的检测。
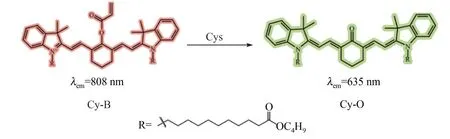
图2 探针Cy-B 响应Cys 的设计原理Fig.2 Design principle of the Cys probe Cy-B
2.2 探针Cy-B 对Cys 的响应性能
考察了探针Cy-B 在缓冲溶液中对Cys 的响应性能。首先优化了反应的时间。由Cy-B 与150 μmol/L Cys 的反应动力学实验可知,比率荧光信号(I635nm/I808nm)随着反应时间的延长而逐渐增加,并在25 min 左右趋于稳定。因此,在后续实验中将Cy-B 与Cys 的孵育时间确定为30 min,以保证反应完全。
在含5 μmol/L Cy-B 的EtOH/HEPES(体积比1∶4)缓冲溶液中加入不同浓度(0~150 μmol/L)的Cys,孵育30 min 后,检测体系的荧光发射光谱。如图3(a)~(c)所示,在0~150 μmol/L 范围内,随着Cys浓度的增加,Cy-B 在808 nm 处的荧光强度逐渐降低,同时,在635 nm 处的荧光强度逐渐增强;比率荧光信号(I635nm/I808nm)在该范围内与Cys 浓度呈良好的线性关系(R2=0.993),检出限为0.76 μmol/L。此外,由图3(d) Cy-B 的紫外-可见吸收光谱可知,Cy-B 与Cys 反应后,位于780 nm 左右的吸收峰强度减弱,550 nm 左右的吸收峰强度变强,与对应的荧光光谱变化结果相符。计算得到反应前Cy-B 的量子产率为0.5%,Cy-B 与Cys 反应后所得Cy-O的量子产率为0.2%。
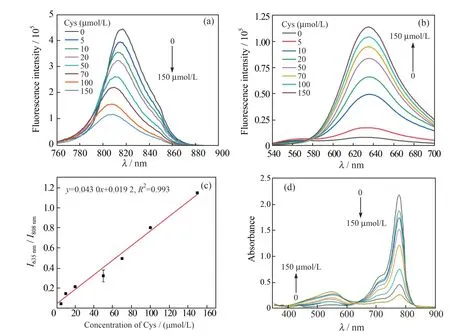
图3 CyB 与不同浓度Cys 反应后在808 nm 左右(a)及635 nm 左右(b)的荧光光谱;(c)比率荧光信号与Cys 浓度的线性关系;(d)Cy-B 的紫外-可见吸收光谱Fig.3 Fluorescence spectra of Cy-B around 808 nm (a)and 635 nm (b)after reaction with different concentrations of Cys;(c)the linear relationship between ratio signal and Cys concentration;(d)UV-visible absorption spectra of Cy-B
为了实现在生物体系中的应用,探针需具备良好的特异性和稳定性。在相同的条件下测试其他干扰物对探针荧光信号的影响,以考察Cy-B 对Cys响应的特异性。如图4 所示,浓度为150 μmol/L 的活性氧、活性氮、活性硫、金属离子以及生物分子等物质对探针的比率荧光信号干扰较小,由此说明探针识别Cys 的特异性较强。将探针及其与Cys 响应后的产物在pH 4.0~8.0 的EtOH/HEPES(体积比1∶4)缓冲溶液内孵育时,Cy-B 与Cys 反应前后的比率荧光信号(I635nm/I808nm)均无明显变化(图5)。这说明探针具有良好的pH 稳定性。上述结果表明探针Cy-B 对Cys 具有良好的响应性能以及优异的选择性和稳定性,适合应用于复杂生物环境中特异性检测Cys。
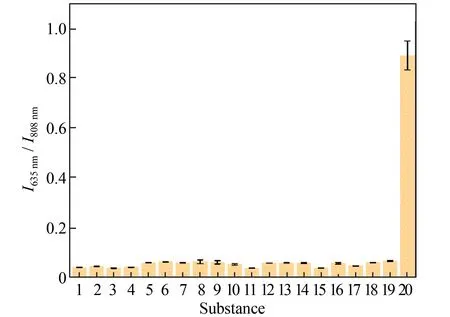
图4 探针Cy-B(5 μmol/L)对Cys(150 μmol/L)响应的特异性Fig.4 Selectivity of Cy-B (5 μmol/L)to Cys (150 μmol/L)against other disruptors

图5 不同pH 值缓冲溶液条件下探针Cy-B 的荧光强度以及Cy-B 与Cys 反应后产物的荧光强度Fig.5 Fluorescence intensity of Cy-B and the product of Cy-B reacted with Cys in buffer solution with different pH value
2.3 细胞内Cys 检测
在将Cy-B 应用于细胞成像之前,先采用CCK-8 法对其细胞毒性进行了考察。将HeLa 细胞与不同浓度的探针溶液孵育24 h 后,细胞的存活率没有明显变化,表明探针的细胞毒性较低,适用于细胞成像。
进一步考察了探针定位细胞膜的能力。图6 为染料Cy-B 和DiOC18(3)对HeLa 细胞的共定位成像。由图6 可知,Cy-B 的荧光分布与商品化细胞膜定位染料DiOC18(3)在活细胞中的荧光分布一致,Pearson 系数为0.94,表明Cy-B 可成功定位于细胞膜。
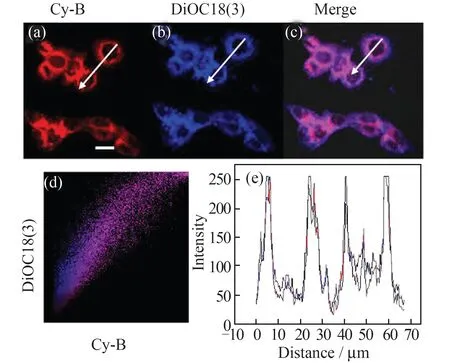
图6 Cy-B 和DiOC18(3)对HeLa 细胞的共定位成像(a)Cy-B 的红色通道(λex=600 nm,λem=700~760 nm);(b)DiOC18(3)的蓝色通道(λex=488 nm,λem=490~540 nm);(c)(a),(b)的叠加图像;(d)两个通道强度的散点图;(e)红色通道和蓝色通道中细胞的ROI 强度分布图。比例尺为20 μmFig.6 Co-localization imaging of HeLa cells incubated with Cy-B and DiOC18(3)(a)The red channel of Cy-B (λex=600 nm, λem=700-760 nm);(b)the blue channel of DiOC18(3)(λex=488 nm, λem=490-540 nm);(c)the merged image of (a)and (b);(d)fluorescence intensity scatter plots of the two channels;(e)ROI intensity distribution of both red channel and blue channel in cells.Scale bar:20 μm
接下来,考察了Cy-B 在细胞内对外源性Cys 的响应能力。如图7 所示,随着外加Cys 浓度的增加,细胞内红色通道荧光信号(λex=600 nm,λem=700~760 nm)逐渐减弱。该结果与溶液中结果一致(见图8)。而此时,绿色通道荧光信号(λex=543 nm,λem=610~680 nm)逐渐增强,比率荧光信号(Igreen/Ired)随着加入Cys浓度的增加而逐渐增强。上述结果说明,探针Cy-B 可以检测细胞外源性Cys 的浓度变化。

图7 (a)HeLa 细胞内外源性Cys 的共聚焦荧光成像红色通道(λex=600 nm,λem=700~760 nm)、绿色通道(λex=543 nm,λem=610~680 nm);(b)(a)图中绿色和红色两个通道的荧光信号平均强度的比值Igreen/IredFig.7 (a)Confocal fluorescence imaging of exogenous Cys in HeLa cells;red channel(λex=600 nm,λem=700-760 nm), green channel(λex=543 nm, λem=610-680 nm);(b)the ratio signal Igreen/Ired of the average fluorescence intensities for the green and red channels in the figure (a)

图8 CyB 与不同浓度Cys 反应后,在700~760 nm 范围内的荧光光谱(λex=600 nm)Fig.8 Fluorescence spectra of Cy-B in the range of 700-760 nm after reaction with different concentrations of Cys (λex=600 nm)
最后,利用Cy-B 对细胞内源性产生的Cys 进行检测。从图9 HeLa 细胞内源性Cys CLSM 成像结果可以看出,加入NEM 的细胞相较于空白组几乎观察不到绿色通道荧光信号(Igreen),说明细胞内的Cys 被NEM 消耗完全。而当进一步加入DTT 后,Igreen信号和比率信号Igreen/Ired信号均增加,这证实了Cy-B 可成功检测细胞内源性Cys。

图9 (a)HeLa 细胞内源性Cys 共聚焦成像;(b)(a)图中两个通道比率荧光信号Igreen/Ired强度Fig.9 (a)Confocal imaging of endogenous Cys in HeLa cells;(b)the ratio signal Igreen/Ired for the two channels in (a)
2.4 活体内检测Cys
在活细胞中成功实现了对Cys 的检测之后,将探针Cy-B 应用于活体内Cys 检测。如图10(a)所示,当小鼠在右侧皮下注射Cy-B 时,可观察到较强的808 nm 通道荧光和较弱的635 nm 通道荧光,说明小鼠体内含低浓度Cys;当向该小鼠左侧相同位置注射Cys 后,635 nm 通道荧光显著增强,808 nm通道荧光显著减弱,同时比率荧光信号(I635nm/I808nm)升高了1.73 倍。为证实该信号变化源自Cy-B 与Cys 的特异性反应,我们设计了一个对照组。在小鼠注射Cys 前,在同一部位皮下注射NMM,观察到较强的808 nm 通道荧光和较弱的635 nm 通道荧光,且比率荧光信号(I635nm/I808nm)与仅注射Cy-B 时相当(图10(b))。值得注意的是,两组小鼠仅注射Cy-B 时比率荧光信号值相近,说明比率探针能够有效克服由于探针分布不均、生理环境不同所带来的干扰,提供更为准确的检测结果。

图10 Cy-B 检测小鼠体内Cys 的比率荧光信号(a)实验组;(b)对照组Fig.10 The ratiometric fluorescence signals of Cys detected by Cy-B in living mice(a)experimental group;(b)control group
3 结 语
本工作利用近红外花菁染料为母体,修饰可特异性识别Cys 的丙烯酸酯及细胞膜定位基团,构建了检测Cys 的比率型荧光探针Cy-B。该探针在808 nm 处有较强的荧光信号,当与Cys 反应后,808 nm 处荧光强度逐渐减弱,同时在635 nm 处产生荧光信号且随Cys 浓度增加逐渐增强。两个通道荧光信号的比值与Cys 浓度线性相关,从而可实现对Cys 的比率型检测。该探针不仅可以成功定位于细胞膜并检测细胞内外源性及内源性Cys 的浓度变化,而且能够克服活体内由于探针分布及生物环境等因素对成像结果造成的干扰,实现对体内Cys 的检测。本文的工作为研究Cys 在生物体系中的作用机制提供了一种可靠的方法。

