高灵敏过氧亚硝酸根双光子荧光探针的构建与应用
王旭梅,高明昱,孙 琦,宋新建,†
1. 湖北民族大学生物资源保护与利用湖北省重点实验室,湖北恩施445000;2. 湖北民族大学化学与环境工程学院,湖北恩施445000
0 引 言
过氧亚硝酸根(peroxynitrite,ONOO-)是一种细胞内源性活性氧物种(reactive oxygen species,ROS),由生物系统中超氧阴离子自由基(O2•-)和一氧化氮(NO)快速反应形成,具有抗菌活性和信号传导作用[1]。体内ONOO-浓度过高时,会氧化破坏DNA、蛋白质和脂质的结构,引起炎症反应导致细胞死亡。ONOO-还可以硝化酪氨酸、半胱氨酸和蛋氨酸,从而影响细胞的正常生长[2~4]。因此,揭示细胞内ONOO-的分布与浓度波动对于了解ONOO-在不同生理或病理过程中的作用至关重要。
双光子激光共聚焦成像是一种重要的荧光成像工具[5~7],其较长的激发波长可以减少生物背景荧光,提高信噪比[8];对生物样品的损伤较小,适于生物样品的长时间成像观测;其焦点激发的方式可避免焦点以外的光漂白,从而提高空间分辨率[9];其近红外激发可实现深度组织成像[10~12]。这些优势都为实时、原位检测生物体中ONOO-的分布与水平变化提供了支持。然而,目前用于检测ONOO-的大多数双光子荧光探针缺乏大的双光子荧光活性截面(δΦ),很难利用双光子激光共聚焦成像技术实现ONOO-的荧光成像分析。
6-羟基-2,3,4,4a-四氢-1H-氧杂蒽-1-酮(GCTPOC)是Yuan 课题组[13]2013 年合成的一种双光子荧光团。与绿色荧光蛋白(green fluorescent protein,GFP)及其刚性类似物相比,GCTPOC 表现出如下优势:1) 从化学结构上看,GCTPOC 使用氧桥将荧光团单元锁定成刚性平面结构,类似于GFP发色团的Z-异构体,以防止芳基-烯烃的自由旋转和双键的E/Z 异构化;2) GFP 生色团咪唑啉酮环中的两个氮原子被替换为碳原子,发色团中的酰胺官能团在GCTPOC 中转变成羰基,具有更强的吸电子能力。可见,GCTPOC 具有更有效的推-拉结构,因而具有更大的双光子荧光活性截面。
为此,本工作以GCTPOC 为双光子荧光团、以1-甲基吲哚啉-2,3-二酮为ONOO-的识别基团,设计并合成了一种用于检测过氧亚硝酸根的双光子荧光探针GCT-ONOO(图1),可特异性识别并检测细胞内ONOO-。该探针对ONOO-具有较短的反应时间(35 min),可应用于监测细胞外源性和内源性ONOO-含量的变化,并可实现细胞炎症过程中对ONOO-的高灵敏成像分析。

图1 GCT-ONOO 探针对细胞内ONOO-的响应机理Fig.1 Response mechanism of GCT-ONOO probe to intracellular ONOO-
1 实验部分
1.1 主要试剂与仪器
试剂:SIN-1(5-氨基-3-(4-吗啉基)-1,2,3-噁二唑盐酸盐)购自Cayman Chemical 公司;DMEM细胞培养基购自Gibco 公司;合成及细胞实验使用药品均购自上海阿拉丁生化科技股份有限公司;所有溶剂均购自上海国药集团;所有试剂均为分析纯或更高纯级,使用前未经进一步纯化;实验所需溶液均使用超纯水配制。
仪器:UV-2550 型紫外-可见分光光度计(UVVis,Shimadzu 公司),RF-6000 型荧光分光光度计(Shimadzu 公司),LSM780 NLO 型双光子激光共聚焦显微镜(Carl Zeiss 公司),6230 TOF 型电喷雾-高分辨时间质谱仪(ESI-TOF,Agilent 公司),Ascend 400 型核磁共振仪(Bruker 公司),Multiskan FC 型酶标仪(ThermoFisher Scientific 公司)。
1.2 探针GCT-ONOO 的合成
GCTPOC 和化合物1 分别根据文献[14]和[15]方法合成。
GCT-ONOO 的合成路线如图2 所示。取300 mg GCTPOC(1.39 mmol)、525 mg 5-溴甲基-1-甲基吲哚啉-2,3-二酮(化合物1)(2.08 mmol)、60 mg NaOH(1.39 mmol)和20 mL 无水乙腈于50 mL圆底烧瓶中,室温条件下搅拌反应8 h,采用薄层色谱法(TLC)监测反应过程。待反应完全后,用二氯甲烷萃取,再经柱层析分离(石油醚/乙酸乙酯体积比1∶1)得到橙色固体,即为GCT-ONOO,产率33.2%。产物的磁共振氢谱(1H NMR,400 MHz,DMSO-d6)化学位移值δ:7.75(d,J=8.1 Hz,1H),7.61(s,1H),7.34(d,J=8.6 Hz,2H),7.16(d,J=8.1 Hz, 1H), 6.71~6.55(m, 2H), 5.11(s, 2H), 5.03~4.94(m,1H),3.14(s,3H),2.40~2.35(m,2H),1.92(t,J=13.6 Hz,2H),1.67(t,J=9.7 Hz,1H),1.23(s,1H);磁共振碳谱(13C NMR,100 MHz,DMSO-d6)δ:196.68, 183.72, 161.83, 158.77, 157.44,151.54,138.16,132.05,131.71,130.71,128.19,125.42,117.94,115.83,111.05,109.99,102.43,75.01,69.01,38.69,29.46,26.56,17.80;高分辨质谱(HR-MS,ESI-TOF)数据:C23H20NO5+[M+H]+理论值390.134 1;实验值390.135 6。
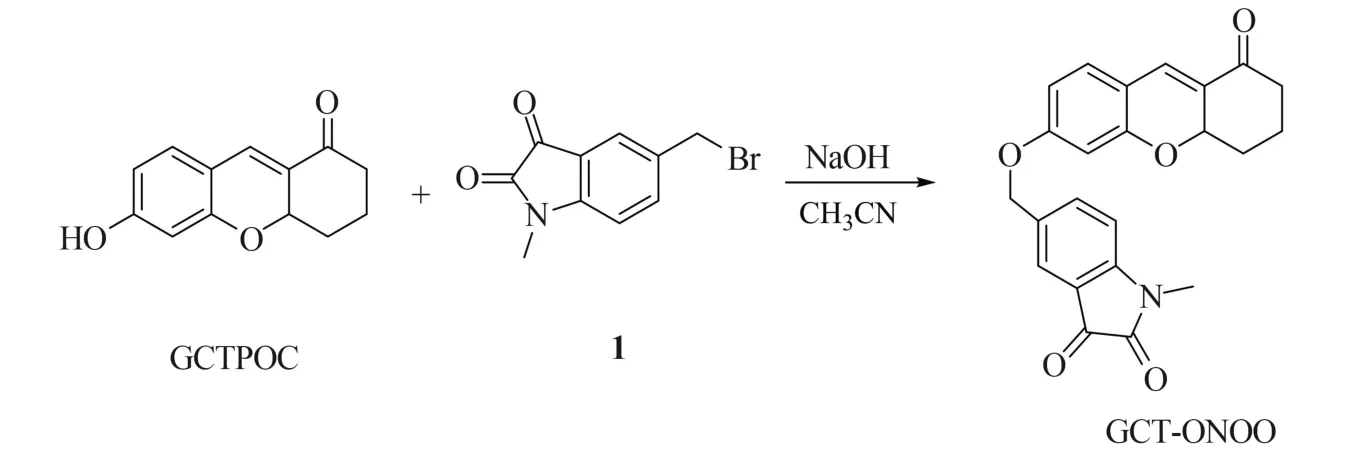
图2 GCT-ONOO 的合成路线Fig.2 Synthetic route of probe GCT-ONOO
1.3 探针GCT-ONOO 的性能测试
1.3.1 水溶性
配制不同浓度(0.25、5、10、15、20 和25 μmol/L)的GCT-ONOO 溶液,分别与300 μmol/L ONOO-(由供体SIN-1 产生)在37 ℃、170 r/min 条件下反应35 min,然后测试体系的紫外-可见(UV-Vis)吸收光谱,观测体系在385 nm 处吸光度的变化,考察GCT-ONOO 的水溶性,并绘制标准曲线。
1.3.2 双光子荧光活性截面
采用双光子诱导荧光法测定GCT-ONOO 于反应前后的双光子吸收截面[16]。
首先,以10 μmol/L 罗丹明B 乙醇溶液为参比溶液,测得探针GCT-ONOO 及GCTPOC 在甲醇溶液中的荧光量子产率Φs。计算公式如下

其中,A代表最大吸收波长的吸光度(A≤0.05);Φ代表量子产率,n代表溶剂的折射率;F代表利用最大吸收波长激发后的荧光光谱积分面积;下标s、r分别代表待测样品和参比溶液。此处,Φr为罗丹明B 溶液的量子产率(0.71)。
以罗丹明6G 的甲醇溶液(5 μmol/L)为参比溶液,测定GCT-ONOO 在甲醇溶液中反应前后的双光子吸收截面δ(激发波长:760~900 nm),再通过δΦ计算双光子荧光活性截面。双光子吸收截面δ的计算公式如下:

其中,S为双光子荧光光谱积分面积,c为溶液浓度;δr为罗丹明6G 溶液的双光子吸收截面(70 GM,1 GM=1×10-50cm4·s·photons-1·molecule-1)。
1.3.3 光物理性质
配 制 含10 μmol/L GCT-ONOO,SIN-1 分 别为0、80 μmol/L 的磷酸盐(PBS)缓冲液(pH 7.4,含10% DMSO(二甲基亚砜)),于37 ℃、170 r/min 恒温振荡反应35 min,检测两种反应液的紫外-可见吸收光谱和荧光发射光谱,考察GCT-ONOO 的光物理性质。
1.3.4 荧光发射光谱
配 制 含10 μmol/L GCT-ONOO、SIN-1 分 别为0、0.5、2、4、6、8、10、12、15、20、30、40、50、60、70、80 μmol/L 的 PBS 缓冲液(pH 7.4,含 10%DMSO),于37 ℃、170 r/min 恒温振荡反应35 min。在激发波长为400 nm、激发和发射狭缝宽度均为5 nm 条件下,扫描体系的荧光发射光谱。
1.3.5 时间依赖性
准确配制浓度为10 μmol/L 的GCT-ONOO 检测液(pH 7.4,含10% DMSO),测试该溶液分别与0、30、60 μmol/L SIN-1 反应0、2、5、10、15、20、25、30、35、40、45、50、55、60 min 时的荧光发射光谱,并以每个时间点相应的荧光强度对时间作图。
1.3.6 pH 稳定性
配制含10 μmol/L GCT-ONOO 的检测液,在不同pH 值的PBS 缓冲液(pH 值分别为5.0、5.4、5.8、6.2、6.6、7.0、7.4、8.0、8.4,含10% DMSO)中,分别与0、60 μmol/L SIN-1 溶液于37 ℃、170 r/min 恒温振荡反应35 min,测试体系的荧光发射光谱,并以荧光强度对pH 值作图。
1.3.7 选择性
向10 μmol/L 的GCT-ONOO 溶 液 中,分 别 加入生物分子(1.0 mmol/L 同型半胱氨酸(Hcy)、谷胱甘肽(GSH)和半胱氨酸(Cys))、活性氧(100 μmol/L 过氧化氢(H2O2)、超氧阴离子(O2•-)和次氯酸(HClO))、活性氮(100 μmol/L 一氧化氮(NO)、亚硝酸根离子(NO2-))、活性硫(H2S)、金属离子(20 μmol/L Fe3+、Ca2+、Mg2+、Zn2+)和ONOO-(60 μmol/L)的PBS 缓 冲 液(10 mmol/L, pH 7.4,含10% DMSO),于37 ℃、200 r/min 恒温振荡反应35 min,测试体系的荧光发射光谱。
1.3.8 探针GCT-ONOO 的检出限
GCT-ONOO 对ONOO-的检出限(LOD)根据LOD=3σ/k计算。其中,σ表 示11 组GCT-ONOO(10 μmol/L)溶液在520 nm 处的荧光强度标准偏差,k表示GCT-ONOO 在线性范围内的斜率。
1.4 探针GCT-ONOO 的细胞实验
1.4.1 细胞培养
将处于对数生长期的肾上腺嗜铬细胞瘤细胞(PC12 细胞,购自武汉尚恩生物技术有限公司,细胞数大于5×105cells/mL)置于含1%青霉素、1%链霉素和10%胎牛血清的DMEM 培养液中,于37 °C培养箱(5% CO2、95%空气)中培养。成像前一天将细胞转移至玻底培养皿(直径35 mm)中使其贴壁生长到合适密度。在与药物或刺激物共同孵育前,先用37 °C 预热过的PBS 缓冲溶液将细胞清洗两次,除去液体,置于含有药物或刺激物的新鲜培养基中继续孵育。细胞成像前将PC12 细胞用PBS缓冲液清洗两次,成像时双光子激发波长为860 nm,荧光收集范围为480~580 nm(绿色通道)。
1.4.2 细胞毒性实验
采用MTT(噻唑蓝)法测定GCT-ONOO 的细胞毒性。将PC12 细胞接种于96 孔板中,将0、5、10、20、30 μmol/L GCT-ONOO 分 别 加 入 到 含10%DMSO 溶液的100 μL DMEM 培养基中(每个浓度设置3 组平行实验)。将上述用不同浓度GCTONOO 标记的PC12 细胞孵育24 h 后,在每孔中加入20 μL 5 mg/mL MTT 溶液,继续培育4 h,除去上清液,再加入150 μL DMSO 溶液,低速振荡10 min,用酶标仪测试各体系在490 nm 处的吸光度。根据GCT-ONOO 标记组和对照组的吸光度计算细胞存活率。
2 结果与讨论
2.1 探针GCT-ONOO 的水溶性
首先考察了GCT-ONOO 与ONOO-反应后的水溶性。图3 为不同浓度(0.25~25 μmol/L)GCTONOO 与300 μmol/L ONOO-反应后的紫外-可见(UV-Vis)吸收光谱。由图3 可知,体系最大吸收峰(385 nm)处的吸光度值与GCT-ONOO 浓度呈现出良好的正比例关系,相关系数R2=0.996;在GCT-ONOO 浓度达到25 μmol/L 时,最大吸光度仍在上升,说明GCT-ONOO 具有良好的水溶性。这为GCT-ONOO 用于水溶液检测和细胞成像奠定了基础。

图3 (a)不同浓度GCT-ONOO 与ONOO-反应后的UV-Vis 光谱;(b)体系385 nm 处吸光度与GCT-ONOO 浓度的关系曲线Fig.3 (a)UV-Vis absorption spectra of different concentrations of GCT-ONOO reacted with ONOO-;(b)the relationship between the absorbance at 385 nm of the system and the concentration of GCT-ONOO
2.2 探针GCT-ONOO 的双光子荧光活性截面
通过双光子诱导荧光法测定并计算GCTONOO(5 μmol/L)与ONOO-(80 μmol/L)反应前后的双光子荧光活性截面,结果如图4 所示。实验结果表明,在760~900 nm 范围内,GCT-ONOO与ONOO-反应前双光子荧光活性截面很小,而反应后在860 nm 处出现最大的双光子荧光活性截面(262 GM),表明该荧光染料具有良好的双光子性能,可应用于双光子共聚焦成像。
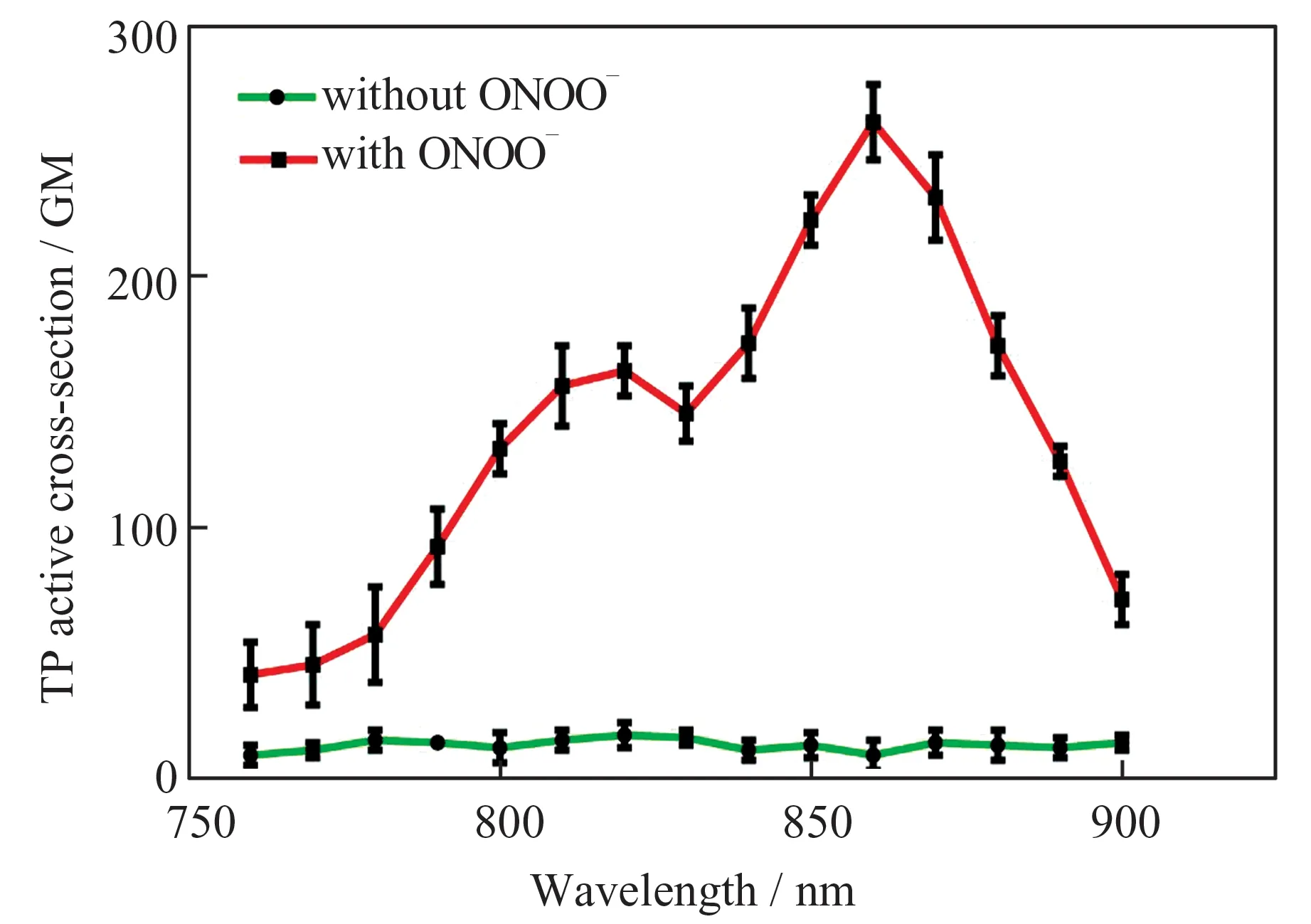
图4 GCT-ONOO 与ONOO-反应前后在不同激发波长下的双光子荧光活性截面Fig.4 Two-photon fluorescence active cross section of GCT-ONOO probe reacting with or without ONOOat different exciting wavelengths
2.3 探针GCT-ONOO 的光物理性质
进一步测试了GCT-ONOO(10 μmol/L)与ONOO-(80 μmol/L)反应前后的UV-Vis 光谱和荧光发射光谱。由图5(a)可以看出,GCT-ONOO 反应前的吸收峰强度可忽略不计,而与ONOO-反应后在385 nm 处荧光强度显著增强,出现强吸收峰。由图5(b)可以看出,反应前探针背景荧光强度很低,反应后在520 nm 处出现强吸收峰,Stokes 位移达到135 nm。
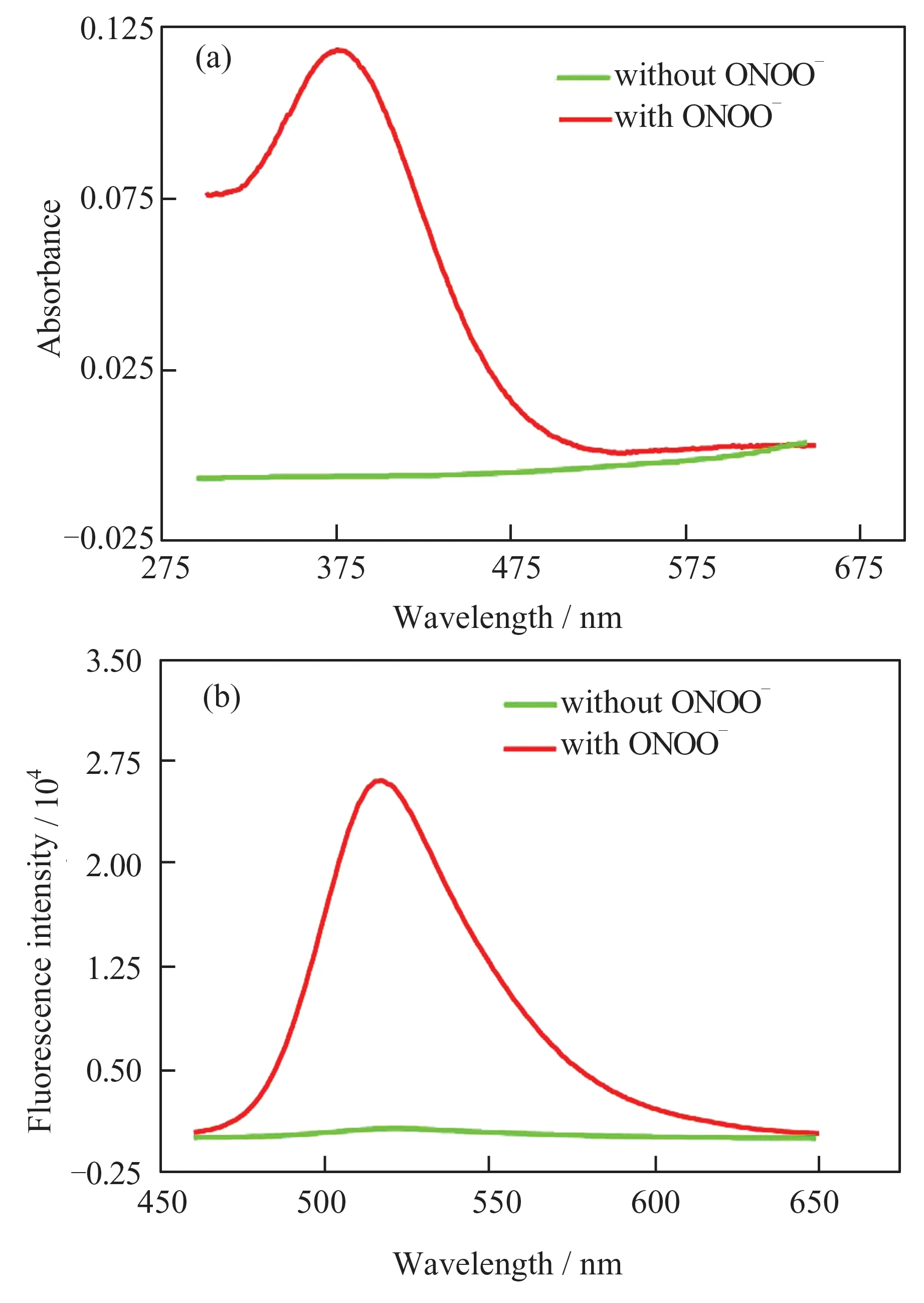
图5 GCT-ONOO 与ONOO-反应前后的UV-Vis 光谱(a)和荧光发射光谱(b)Fig.5 UV-Vis spectra (a)and fluorescence emission spectra (b)of probe GCT-ONOO reacting with or without ONOO-
2.4 探针GCT-ONOO 的荧光响应
探 究 了GCT-ONOO(10 μmol/L, pH 7.4,含10% DMSO)对不同浓度ONOO-(0~80 μmol/L)反应35 min 后的浓度依赖关系。如图6(a)所示,随着ONOO-浓度的不断增加,反应体系在520 nm 处的荧光强度不断增强,加入ONOO-(80 μmol/L)比未加ONOO-的反应体系荧光强度增加了34.6 倍。图6(b)为520 nm 处荧光强度与ONOO-浓度的关系曲线。图6(c)显示,在0.5~60 μmol/L 之间,GCTONOO 溶液的荧光强度与ONOO-浓度之间存在良好的线性关系,相关系数达0.996,由3σ/k(σ表示11组GCT-ONOO 溶液(10 μmol/L)在520 nm 处的荧光强度标准偏差,k表示GCT-ONOO 滴定光谱曲线在线性范围内的斜率)计算得到检出限LOD 为13.5 nmol/L,说明该探针的灵敏度高。图6(d)显示,探 针GCT-ONOO 与ONOO-(30、60 μmol/L)可在35 min 内反应完全,之后随着时间延长体系荧光强度基本保持不变,表明该探针对ONOO-的响应较快。对GCT-ONOO 与ONOO-(60 μmol/L)在不同pH 值的PBS 缓冲液中的荧光响应进行了考察。如图6(e)所示,pH 值对未加入ONOO-的GCT-ONOO 荧光强度几乎无影响,而对加入ONOO-(60 μmol/L)后的体系荧光强度影响较大;pH 5.0~5.8 范围内,GCT-ONOO 与ONOO-反应后荧光强度基本没有变化,而pH 5.8~8.4 范围内,体系的荧光强度随着pH 值的增加逐渐增强。这是因为在碱性条件下,GCT-ONOO 与ONOO-反应产物中的羟基变为氧负离子,给电子能力增强而发出更强的荧光。本文还探讨了GCT-ONOO(10 μmol/L)对13种不同干扰物的响应情况(1.0 mmol/L Hcy、GSH、Cys,100 μmol/L H2O2、O2•-、HClO、NO、NO2-、H2S 和20 μmol/L Fe3+、Ca2+、Mg2+、Zn2+)。如图6(f)所示,除ONOO-外,干扰物分子均未使探针GCT-ONOO 的荧光强度发生明显变化,显示该探针对ONOO-具有高度的选择性。

图6 (a)GCT-ONOO 与不同浓度ONOO-反应的荧光发射光谱;(b)荧光强度和ONOO-浓度的关系曲线;(c)GCT-ONOO荧光强度与ONOO-浓度的线性拟合曲线;(d)GCT-ONOO 与ONOO-反应不同时间的荧光强度;(e)pH 值对GCT-ONOO与ONOO-体系荧光强度的影响;(f)GCT-ONOO 对ONOO-的选择性Fig.6 (a)Fluorescence emission spectra of the reaction between GCT-ONOO and different concentrations of ONOO-;(b)the relationship curve between fluorescence intensity and ONOO- concentration;(c)the linear fitting curve of fluorescence intensity and ONOO- concentration;(d)the fluorescence intensity of GCT-ONOO and ONOO- at different time;(e)the effect of pH value on fluorescence intensity of GCT-ONOO and ONOO- systems;(f)selectivity of GCT-ONOO to ONOO-1~16 in(a):ONOO- 0,0.5,2,4,6,8,10,12,15,20,30,40,50,60,70,80 μmol/L
2.5 探针GCT-ONOO 的细胞毒性
为了考察GCT-ONOO 能否用于细胞内ONOO-的检测,采用MTT(噻唑蓝)法评估GCTONOO 的细胞毒性。结果显示,PC12 细胞与不同浓度(0~30 μmol/L)的GCT-ONOO 共孵育24 h,细胞存活率仍达到93%以上,说明该探针细胞毒性低,可用于后续的细胞成像分析。
2.6 细胞外/内源性ONOO-的检测
先考察GCT-ONOO 对细胞外源性ONOO-的荧光成像。 在PC12 细胞中加入不同浓度的ONOO-释放剂SIN-1(0、5、10、30 μmol/L)孵育30 min 后,再加入GCT-ONOO(10 μmol/L)继续孵育20 min,然后进行细胞成像。从图7 结果可知,体系荧光强度随ONOO-浓度的增加而增强,表明该探针可实现对外源性ONOO-的检测。

图7 (a)GCT-ONOO 与不同浓度SIN-1(0, 5, 10, 30 μmol/L)在细胞中的双光子激光共聚焦成像;(b)(a)图中各组细胞的相对荧光强度Fig.7 (a)Two-photon laser confocal imaging of GCT-ONOO and different concentrations of SIN-1(0,5,10,30 μmol/L)in cells;(b)the relative fluorescence intensity of the corresponding cells in figure (a)λex=860 nm,λgreen=480-580 nm;the scale is 40 μm
SIN-1 之所以可释放ONOO-是因为它可同时释放NO 和O2•-,随即反应生成ONOO-[17]。因此,为了排除其他干扰物如活性氧及活性氮存在的潜在干扰,在体系中分别加入HClO 及ONOO-清除剂Minocycline(二甲胺四环素)、O2•-清除剂TEMPO(四甲基哌啶氮氧化物)和NO 合成酶抑制剂AG(氨基胍)3 种试剂,设置了6 组细胞实验:a 组将PC12细胞用GCT-ONOO(10 μmol/L)孵育20 min 建立Sham 组;b 组 中 加 入30 μmol/L HClO 孵 育30 min后,再加入GCT-ONOO(10 μmol/L)孵育20 min;c 组将PC12 细胞置于30 μmol/L SIN-1 孵育30 min后,再加入GCT-ONOO(10 μmol/L)孵育20 min 建立对照组;d~f 组在加入30 μmol/L SIN-1 孵育30 min 后,再分别加入5 μg/mL Minocycline、TEMPO和AG,然后加入GCT-ONOO(10 μmol/L)孵育20 min。如图8 所示,加入SIN-1 后体系荧光强度显著增加,而加入3种抑制剂及HClO 后,荧光强度相对于对照组几乎可忽略,进一步表明GCT-ONOO 在细胞中可灵敏且特异性地识别ONOO-。

图8 (a)各组细胞(a-f)的双光子激光共聚焦成像;(b)(a)图中各组细胞的相对荧光强度Fig.8 (a)Two-photon laser confocal imaging in each group of cells (a-f);(b)the relative fluorescence intensity of each group of cells in figure (a)λex=860 nm,λgreen=480-580 nm;the scale is 40 μm
进一步考察了GCT-ONOO 对细胞内源性ONOO-的荧光成像。设计了5 组实验:a 组为Sham组;b 组加入1 μg/mL 脂多糖(LPS)、100 ng/mLγ-干扰素(IFN-γ)和10 ng/mL 佛波酯(PMA)进行预处理以刺激细胞发生炎症并产生内源性ONOO-,再加入GCT-ONOO(10 μmol/L)孵育20 min 建立对照组;c~e 组在加入与b 组等量的LPS、IFN-γ和PMA 后,分别加入20 μg/mL Minocycline、TEMPO和AG 三种试剂孵育30 min,再加入GCT-ONOO(10 μmol/L)继续孵育20 min。如图9 所示,只加LPS、IFN-γ和PMA 三种刺激剂时,体系绿色荧光显著增强(b 组),而加入Minocycline、TEMPO 和AG 后(c-e 组),却只显示很微弱的荧光。结果表明,GCT-ONOO 可用于检测细胞内源性ONOO-。
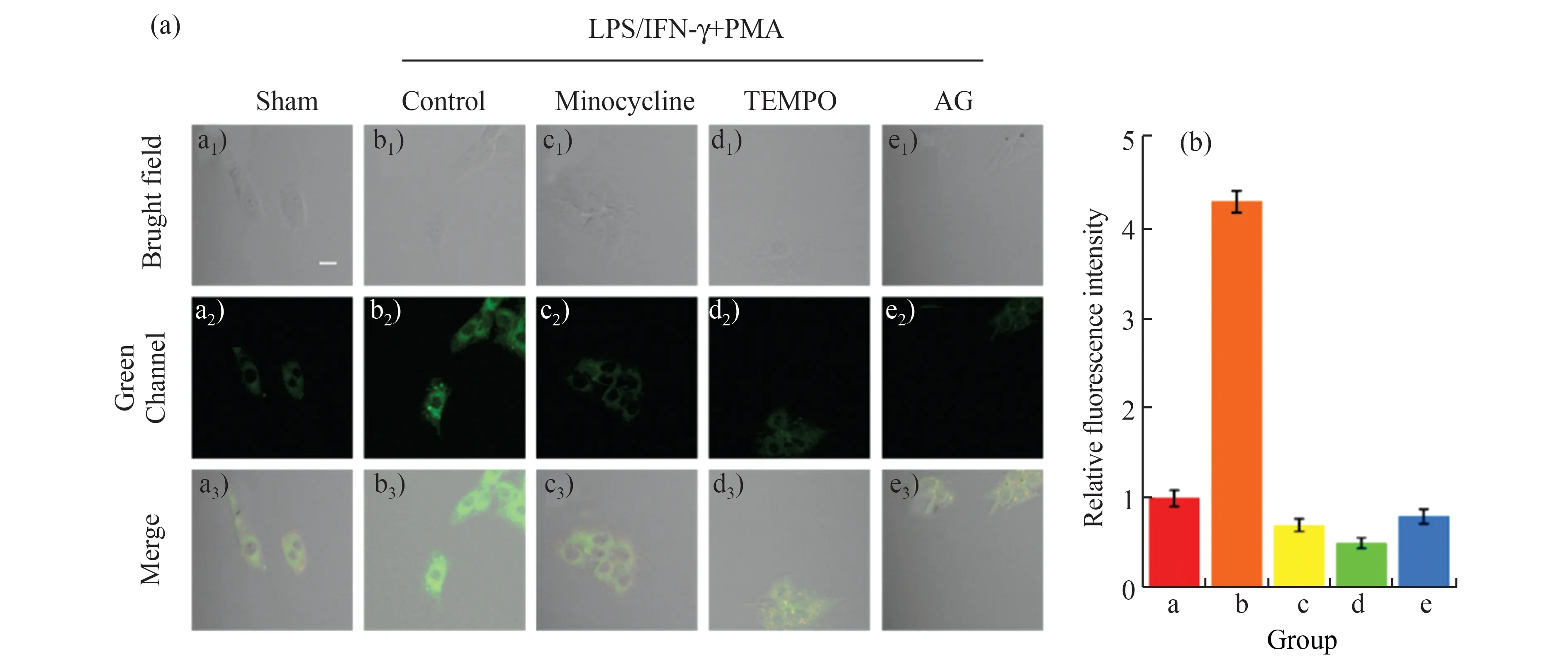
图9 (a)GCT-ONOO 与细胞内源性ONOO-的双光子激光共聚焦成像;(b)(a)图中各细胞组的相对荧光强度Fig.9 (a)Two-photon laser confocal imaging of GCT-ONOO and cellular endogenous ONOO-;(b)the relative fluorescence intensity of the corresponding cells in figure (a)λex=860 nm,λgreen=480-580 nm;the scale is 40 μm
3 结 语
本文采用具有优异双光子荧光活性截面的GCTPOC 为双光子荧光团、以1-甲基吲哚啉-2,3-二酮为ONOO-的识别基团,设计并合成了一种ONOO-双光子荧光探针GCT-ONOO。该探针水溶性较好,荧光响应倍数较高(荧光强度增加34.6倍)、响应速度较快(35 min)、灵敏度好(检出限低至13.5 nmol/L)、Stokes 位移大(135 nm),选择性好,且可用于检测细胞外源性ONOO-,并成功应用于细胞炎症模型中ONOO-的荧光成像分析。

