中国人群肝癌筛查指南(2022,北京)
赫 捷, 陈万青, 沈洪兵, 李 霓, 曲春枫, 石菊芳, 孙 凤, 姜 晶, 曹广文,庄贵华, 彭 绩, 中国人群肝癌筛查指南制定专家组,中国人群肝癌筛查指南制定工作组
1 国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院, 北京 100021; 2 南京医科大学公共卫生学院 肿瘤个体化医学省部共建协同创新中心, 南京 211166; 3 北京大学公共卫生学院, 北京 100191;4 吉林大学第一医院, 长春 130021; 5 海军军医大学 流行病学教研室, 上海 200433; 6 西安交通大学医学部 公共卫生学院, 西安 710061; 7 深圳市慢性病防治中心, 深圳 518020
1 引言
肝癌是我国常见恶性肿瘤之一,2016年我国肝癌发病数和死亡数分别为38.9万例和33.6万例,男性发病和死亡病例数均约为女性的3倍[1]。归因于对乙型肝炎病毒(hepatitis B virus,HBV)感染、黄曲霉毒素食品污染等因素的有效控制,过去数十年我国肝癌发病率和死亡率呈现下降趋势[2],但肝癌患者5年生存率仍然仅为12.1%(2015年)[3]。此外,目前我国肝癌所致的伤残寿命年仍然占全球肝癌负担的近半[2]。如何进一步有效降低我国肝癌疾病负担,仍是我国公共卫生和慢性病防控领域亟待解决的重大问题。
我国肝癌筛查从2006年农村癌症早诊早治项目个别项目点开始[4],后陆续被淮河流域癌症早诊早治项目(2007年)和城市癌症早诊早治项目(2012年)两个国家重大公共卫生服务项目纳入[5-10]。然而,相比结直肠癌等筛查更为成熟的癌种,肝癌筛查对肝癌死亡率的下降效果相对较低或存在争议,肝癌的筛查人群覆盖率仍相对较低[11],因此,肝癌筛查工作仍处于持续探索中。考虑到肝癌筛查服务的可获得性、肝癌发生发展特点以及肝癌预后等因素,目前肝癌预防实践仍然需要普通人群筛查与高风险人群监测并重。
近年来国内团体推出多部肝癌防控相关指南共识,包括中华预防医学会肝胆胰疾病预防与控制专业委员会等的《原发性肝癌的分层筛查与监测指南(2020版)》[12]、中华医学会肝病学分会的《原发性肝癌二级预防共识(2021年版)》[13]以及全国多中心前瞻性肝癌极早期预警筛查项目(PreCar)专家组的《中国肝癌早筛策略专家共识》[14]等,为我国肝癌防控提供了重要推荐,也分别提出了具体尚待研究和解决的问题,为后续工作提供了重要方向。同时,我们比较各指南共识也注意到整体而言有以下现象:针对肝癌一般风险人群的界定信息有限,高风险人群界定存在差别,多未明确区分筛查和监测的概念,筛查方案及筛查时间间隔推荐有差异,缺少系统的卫生经济学评价证据推荐,筛查质控推荐有限等。
为了响应《“健康中国2030”规划纲要》中强化慢性病筛查和早期发现、针对高发地区重点癌症开展早诊早治工作的要求,受国家卫生健康委员会疾病预防控制局委托,国家癌症中心牵头组织多学科专家和工作团队,应用国际规范的指南制定方法,基于最新研究证据和我国国情,关注关口前移,制定《中国人群肝癌筛查指南(2022,北京)》,以期为我国人群肝癌筛查与早诊早治工作的规范开展提供参考,提升我国肝癌防控效果。
2 指南形成方法
2.1 指南发起机构与专家组成员 本指南制定受国家卫生健康委员会疾病预防控制局委托,由国家癌症中心发起。专家组成员涵盖流行病学、循证医学、卫生经济及政策研究、健康管理、基础医学、临床检验学、病理学、影像/介入医学、外科学、内科学等多学科专家。指南制定工作于2021年7月启动,于2022年7月定稿。
2.2 指南工作组 本指南成立了多学科工作组,涵盖上述相关交叉学科团队。证据检索和评价由国家癌症中心、北京大学医学部、海军军医大学、吉林大学第一医院、西安交通大学医学部合作完成。所有工作组成员均填写了利益冲突声明,不存在与本指南直接的利益冲突。
2.3 指南使用者与应用目标人群 本指南适用于各级医疗机构和管理机构组织开展肝癌筛查工作。本指南的使用者包括但不限于各级医疗机构肝癌筛查诊治相关医务工作者、人群筛查项目决策组织实施工作者等。指南推荐意见的应用目标人群为有意向或适宜接受肝癌筛查的受检者。
2.4 关键问题遴选与确定 通过系统检索肝癌筛查领域已发表的指南、共识、综述类文献以及部分专家访谈,工作组初拟了包含7大类关键问题的框架,涵盖具体关键问题27个;采用德尔菲法函询所列问题的重要性,第1轮次咨询共收到47人反馈意见,进一步遴选出本指南拟解决的关键问题25个。
2.5 证据检索 指南制定工作组成立了证据检索与评价小组,针对最终纳入的关键问题,按照人群、干预、对照和结局原则进行文献检索,文献数据库包括PubMed、Embase、Clinicaltrial.org、Cochrane Library、Web of Science、中国知网、万方知识服务平台、维普资讯网和中国生物医学文献数据库。此外,工作组也对肝癌筛查相关综述指南的参考文献进行滚雪球检索。证据检索截止日期为2021年6月30日。
2.6 证据评价与分级 证据检索与评价小组对于纳入的随机对照试验(randomized controlled trial,RCT)研究采用Cochrane Reviewer’s Handbook 5.0.1标准进行评价[15],对于纳入的队列研究采用纽卡斯尔-渥太华量表进行评价[16],对于诊断准确性研究采用QUADAS-2进行评价[17],对于病例系列研究采用英国国立临床优化研究所评价工具进行评价[18]。评价过程由2个人独立完成,若存在分歧,则共同讨论或咨询第三方解决。使用推荐意见分级的评估、制订及评价(Grading of Recommendations Assessment,Development and Evaluation,GRADE)方法对证据质量和推荐意见进行分级[19],见表1。

表1 GRADE证据质量与推荐强度分级
2.7 推荐意见形成 专家组基于证据评价小组提供的国内外证据,同时考虑我国筛查目标人群的偏好和价值观、干预措施的成本和利弊后,初步拟定了肝癌筛查关键问题的推荐意见。2022年2—3月开展了新一轮次的德尔菲函询,向30位专家发出邀请,对初拟推荐意见进行反馈,最终根据具体反馈并考虑实际检索证据的可获得性、问题设置逻辑关系确认等,在该轮次咨询后对初拟推荐意见进行了修改,并将关键问题合并凝练为21个。整合更新版本于2022年3月30日通过面对面线上会进行评议,会后整理形成最终定稿指南并于2022年8月发布。
2.8 指南传播、实施与更新 指南发布后,指南工作组将主要通过以下方式对指南进行传播和推广:(1)在相关学术会议中对指南进行解读;(2)有计划地在中国部分省(市、自治区)组织指南推广专场会议,确保基层的恶性肿瘤筛查工作人员充分了解并正确应用本指南;(3)通过学术期刊和书籍出版社公开发表本指南;(4)通过媒体等进行宣传推广。指南工作组将综合临床实践的需求与证据产生的进展,并参考更新指南报告清单,对本指南进行更新。计划每3年对本指南的推荐意见进行更新。
3 关键问题及推荐意见
3.1 流行病学问题
问题1:我国人群的肝癌疾病负担
(A)肝癌是全球和我国导致恶性肿瘤死亡的常见原因;
(B)我国肝癌发病率和死亡率均呈下降趋势,且具有地区和性别差异;
(C)肝癌患者5年生存率近年来略有提升,但仍显著低于胃癌、食管癌及结直肠癌等大部分消化系统肿瘤患者的生存率;
(D)肝癌所致经济负担较为严重且呈增加趋势。
肝癌即起源于肝脏的恶性肿瘤,是全球常见的恶性肿瘤之一,居恶性肿瘤发病顺位的第6位,据GLOBOCAN 2020估算,2020年全球肝癌发病例数为90.6万例,年龄标化发病率为9.5/10万[20]。肝癌发病率前5位的地区是东亚、北非、密克罗尼西亚、东南亚和美拉尼西亚,肝癌发病率依次为17.8/10万、15.2/10万、14.6/10万、13.7/10万和11.4/10万[20]。肝癌预后差,居全球常见恶性肿瘤死因第3位,2020年全球肝癌死亡数为83.0万例,年龄标化死亡率为8.7/10万[20]。肝癌死亡率前5位的地区是东亚、北非、东南亚、密克罗尼西亚和美拉尼西亚,肝癌死亡率依次为16.1/10万、14.5/10万、13.2/10万、12.0/10万和11.5/10万[20]。
(1) 发病率:全国肿瘤登记中心数据显示,2015年我国肝癌发病人数为37.0万例,占同期全国恶性肿瘤发病的9.4%,男性和女性发病人数分别为27.4万例和9.6万例[21]。肝癌发病粗率、中标率和世标率分别为26.9/10万、17.6/10万和17.4/10万;男性世标率(26.2/10万)明显高于女性(8.5/10万)[22]。不同地区的肝癌发病率有较大差异,农村地区世标率(19.7/10万)高于城市地区(15.7/10万),西部地区发病率最高(20.2/10万),东部地区发病率最低(14.5/10万)[21,23]。近年来,肝癌平均发病年龄有所增加,男性肝癌平均发病年龄由2000年的58.8岁增加至2014年的62.4岁(可能与抗病毒治疗等因素有关);女性中,肝癌平均发病年龄由2000年的64.0岁增加至2014年的69.0岁;城市地区和农村地区肝癌的平均年龄也呈逐年增加趋势[24]。2000年—2011年,我国肝癌发病率呈明显下降趋势,平均每年下降1.8%;肝癌发病率在男性和女性中也均呈下降趋势,其中男性肝癌标准化发病率每年以1.8%的速度下降;女性标准化发病率在2009年之前,以1.6%的速度下降,2009年—2011年,下降速度加快,平均每年下降6.1%[25]。
(2)死亡率:全国肿瘤登记中心数据显示,2015年,中国肝癌死亡病例数为32.6万例,其中男性死亡人数(24.2万例)明显高于女性(8.4万例)[21]。全国肝癌死亡率为23.7/10万,中标率为15.3/10万,世标率为15.1/10万;男性肝癌死亡率(34.3/10万)显著大于女性(12.6/10万);经世界人口标准化后,男性死亡率(22.9/10万)仍高于女性(7.4/10万)[22]。不同地区比较,农村地区肝癌死亡率(16.7/10万)高于城市地区(13.8/10万),东部地区肝癌死亡率最低(13.1/10万),而西部地区肝癌死亡率最高(17.2/10万)[21,23]。2000年—2011年肝癌标准化死亡率平均每年下降2.3%;肝癌标准化死亡率在男性和女性中也均呈下降趋势,其中男性肝癌标准化死亡率平均每年下降2.2%;女性标准化死亡率在2008年之前以每年2.0%的速度下降,2008年—2011年下降速度加快,以每年4.7%的速度下降[26]。
(3)患病率:基于全球疾病负担项目公开的数据显示,2019年中国肝癌患病总人数为29.0万例,男女性分别为22.8万例和6.2万例;总患病率为20.4/10万(标化率为14.4/10万),男性为女性的3.5倍,分别为31.5/10万和8.9/10万[27]。
(4)生存率:根据2003年—2015年全国17个肿瘤登记地区的数据显示,肝癌年龄标化5年相对生存率从10.1%增加至12.1%,显著低于全国所有恶性肿瘤合计5年相对生存率(40.5%);男性和女性2015年肝癌标化5年相对生存率分别为12.2%和13.1%,城市和农村地区分别为14.0%和11.2%[3]。
(5)经济负担:基于个体的研究显示,2002年—2011年我国肝癌例均诊治费用成倍增长[28]并且不同临床分期患者的诊治费用差异无统计学意义[29],系统评价也显示,经济负担呈现时间上的上升趋势[30]。针对全国人群层面的分析显示,肝癌所致住院医疗费用从2011年的49.3亿元增至2015年的74.8亿元[31];模型分析估算,当同时考虑直接的医疗和非医疗费用以及伤残和早死所致的间接成本,我国人群肝癌所致经济负担在2019年约为767.0亿元[32]。
问题2:肝细胞癌(hepatocellularcarcinoma,HCC)的病因、相关危险因素及其在我国人群中的暴露水平
(A)HBV和丙型肝炎病毒(hepatitisCvirus,HCV)是导致HCC的主要感染性因素,黄曲霉毒素暴露增加HBV感染者的HCC发生风险;
(B)慢性HBV感染者抗病毒治疗获得持续病毒学应答(sustainedvirologicresponse,SVR)后,可显著降低但不能消除进展为HCC的风险;
(C)发生肝硬化的HCV感染者在抗病毒治疗根除病毒感染后,可显著降低但不能消除进展为HCC的风险;
(D)多种原因导致的肝硬化是HCC发生的重要环节,特别是慢性HBV及HCV感染所致的肝硬化;
(E)酒精性肝病、代谢相关脂肪性肝病均增加HBV及HCV感染者的HCC发生风险;
(F)慢性肝炎病毒感染所致肝癌占比逐渐减少。
肝癌根据其病理类型可分为HCC、胆管细胞癌以及混合性肝细胞癌和胆管细胞癌,其中HCC是肝癌最常见的病理类型,占全球所有原发性肝癌的75%~85%[33];在中国,HCC占所有原发性肝癌的93.0%,其中 84.4%的 HCC 患者乙型肝炎表面抗原(hepatitis B surface antigen, HBsAg) 和(或) HBV DNA阳性,HBV相关HCC比HCV相关HCC早发病12年,而且预后更差[34]。因此本指南重点呈现HCC相关证据。
(1)慢性HBV感染:HBV感染肝细胞后可整合到宿主基因组。HBV携带者中有10%~25%可发生HCC[35]。全球范围内,慢性HBV感染是HCC的首要病因,尤其是在东亚和非洲国家[36]。通过对全国肿瘤登记中心收集的不同地区人群肝癌发病数据的审核、整理与分析,结果显示,我国农村地区肝癌发病率明显高于城市地区,每年有83.2%的肝癌死亡患者归因于已知危险因素,其中77.7%~88.0%由HBV和(或)HCV感染所致[34,37-38]。我国国家癌症中心对病理学确定的1823例HCC患者病毒感染标志物的分析结果显示,HBV感染占比为86.0%,HBV和HCV混合感染占比为6.7%[38]。在我国,随着乙型肝炎疫苗于1992年被纳入儿童计划免疫管理,2002年被纳入免疫规划,低年龄组人群的HBsAg流行率明显降低,2014年全国乙型肝炎血清流行病学调查结果显示,1~4岁、5~14岁和15~29岁人群HBsAg流行率分别为0.32%、0.94%和4.38%[39]。
目前,我国成年人群HBsAg流行率为5%~6%[40]。HBsAg阳性者发生HCC的风险较非HBsAg阳性感染者增加,并受到多种因素的影响,包括病毒载量[41-42]、伴随疾病[43]以及是否接受抗病毒治疗[44]等。HBsAg阴性的隐匿性HBV感染者仍有HCC发生风险,荟萃分析显示,HBsAg阴性的隐匿性HBV感染者HCC发生风险为非HBV感染者的2.86倍[相对危险度(relative risk,RR)=2.86,95%CI:1.59~4.13][45]。在未接受抗病毒治疗的HBV感染者中,乙型肝炎e抗原(hepatitis B e antigen,HBeAg)状态、外周血HBV DNA载量、饮酒、罹患糖尿病等代谢相关性肝病等与HCC发生风险有关[41-43]。我国台湾地区的一项研究纳入了11 893例30~65岁男性,随访10年,研究结果显示,HBsAg和HBeAg均为阴性的男性HCC发病率为39.1/10万(95%CI:26.2/10万~56.1/10万),HBsAg阳性但HBeAg阴性的男性HCC发病率为324.1/10万(95%CI:240.1/10万~427.5/10万),HBsAg和HBeAg双阳性的男性HCC发病率为1 169.4/10万(95%CI:799.9/10万~1 650.9/10万)[42]。未进行抗病毒治疗的HBV感染者HCC发生率与HBV DNA水平并非呈线性正相关,HBV DNA载量为104~106拷贝/mL者,发生HCC的风险比(hazard ratio,HR)值最高,而当HBV DNA>106拷贝/mL时,HR值反而有所下降[41]。对于HBeAg阴性,HBV DNA在2000~20 000 IU/mL者,HBV核心相关抗原≥10 kU/mL时,HCC发生风险显著增加[46]。对于HBeAg阴性、HBV DNA<2000 IU/mL但HBsAg≥1000 IU/mL者,HCC发生风险较HBsAg<1000 IU/mL者增加13.7倍(95%CI:4.8~39.7)[47]。但在50岁后,即使HBsAg消失的HBV感染者,HCC发生的风险仍较高。HBV感染合并代谢异常导致HCC的风险显著升高,一项对我国台湾地区成年男性随访19年的研究显示,1690例HBV感染者中158例发生了HCC,其中不伴有或伴有轻度代谢异常者,其10年的HCC累积发病率为4.83%,而伴随有3个或以上代谢指标异常者,其10年的HCC累积发病率为13.6%,调整后的HR为2.32(95%CI:1.18~4.54),吸烟进一步增加HBV感染合并代谢异常男性的HCC风险,其10年的HCC累积发病率达到25.0%,调整后的HR为5.06(95%CI:2.23~11.47)[43]。然而,无HBV及HCV感染的1289例同龄男性中,随访19年间仅有5例HCC发生[43]。具有肝癌家族史的HBV感染者有更高的HCC风险,一项对22 472名我国台湾地区居民随访(16.12±2.89)年的研究显示,在HBsAg阴性人群中,无肝癌家族史的人群HCC累积发病率为0.62%,伴肝癌家族史的人群为0.65%;但在HBsAg阳性人群中,伴肝癌家族史人群中HCC累积发病率高达15.8%,显著高于无肝癌家族史人群(7.5%,P<0.001)[48]。
在抗病毒治疗时代,核苷(酸)类似物[nucleos(t)ide analogues,NAs]恩替卡韦、富马酸替诺福韦二吡呋酯及富马酸丙酚替诺福韦酯等已被我国肝病学界推荐为一线乙型肝炎药物应用,改善了患者肝脏功能,显著降低了HBV DNA水平;获得SVR抗病毒治疗者的肝硬化进展及5~10年的HCC风险也显著下降[44,49]。另一类抗病毒药干扰素α(interferon α,IFNα)也可降低慢性HBV感染者进展为HCC的风险[50]。但是,无论NAs或IFNα治疗后,均不能完全消除慢性HBV感染进展为HCC的风险。
(2)慢性HCV感染:我国现有慢性HCV感染者约1000万人(0.72%)[51]。HCV感染肝细胞后通过细胞死亡-修复引起肝硬化而增加HCC风险,HCV本身不整合于细胞基因组[35]。在我国HCC患者中,HCV感染标志阳性者占比仅为1.7%~2.5%,HCV合并HBV感染者占比为6.7%[38]。在北美,59%(95%CI:3%~79%)的HCC归因于HCV感染;北欧地区为28%(95%CI:10%~55%),欧洲其他地区为40%(95%CI:32%~49%),非洲中北部为79%(95%CI:69%~86%)[36]。在HCV感染者中,HCC风险增加的因素包括男性、年龄较大、合并人类免疫缺陷病毒或HBV感染、糖尿病和长期饮酒等[52-53]。肝癌家族史也能增加HCV感染者的HCC发病风险,一项对西方人群进行的荟萃分析显示,在HBsAg和抗HCV抗体双阴性人群中,具有肝癌家族史的HCC风险比值比(odds ratio,OR)值为2.94(95%CI:0.94~9.21),但在HBV或(和)HCV感染阳性人群中,具有肝癌家族史人群的HCC风险OR值为72.48(95%CI:21.92~239.73)[54]。IFNα和直接抗病毒药物治疗均能降低HCV相关肝硬化及HCC的发生风险,治疗后的SVR者HCC风险分别下降约76%和72%[55]。
(3)酒精性肝病与代谢相关脂肪性肝病(metabolic dysfunction-associated fatty liver disease,MAFLD):一项病例对照研究显示,单纯酒精性肝硬化、HCV或HBV肝硬化进展为HCC风险的OR值分别为4.5(95%CI:1.4~14.8)、15.3(95%CI:4.3~54.4)和12.6(95%CI:2.5~63.1),而酒精肝伴有慢性HCV或慢性HBV感染等2个或以上因素者OR值高达53.9(95%CI:7.0~415.7);吸烟、肥胖和糖尿病等与酒精之间存在交互增强HCC风险的关系,特别是在病毒性肝炎的基础上[43,53]。MAFLD是目前全球最常见的肝脏疾病,正在成为HCC的重要病因[56]。有研究表明,目前我国40岁以上人群中MAFLD患病率高达40.3%[57]。一项涉及欧洲4个队列约13万代谢异常相关肝病患者的研究显示,其HCC风险较普通人群提高了3.51倍(95%CI:1.72~7.16),在没有肝硬化背景的HCC患者中,MAFLD患者比例高达26.3%[58]。然而,对我国某工厂总计13 032例人群11年的随访研究显示,非HBV及非HCV感染的代谢相关脂肪性肝病患者,主要进展为糖尿病、高血压与高血脂,尚无HCC确诊,所有HCC均发生在HBV感染背景下[59]。由于HCC只发生在有慢性炎症损伤的肝脏中,部分MAFLD同时也合并酒精性肝病,MAFLD对中国人群HCC的确切风险度还有待进一步明确。
(4)致癌物暴露:饮食中黄曲霉毒素B1(aflatoxin B1,AFB1)暴露是造成撒哈拉以南的非洲、东南亚和中国部分农村地区HCC高发的重要原因,世界卫生组织国际癌症研究署(International Agency for Research on Cancer,IARC)于1987年将AFB1列为Ⅰ类致癌物。AFB1本身的直接致癌作用存在争议,但研究显示,AFB1与HBV感染之间存在很强的交互作用[60-61]。一项病例对照研究显示,在HBsAg阴性人群中,单纯AFB1暴露增加HCC的风险为非暴露者的1.9倍(95%CI:0.5~7.5),当叠加慢性HBV感染时,HCC风险可增高至60.1倍(95%CI:6.4~561.8)[60]。随着我国政府改水改粮措施的实施,AFB1在我国肝癌高发区人群中的暴露水平已有显著下降,在我国HCC病因学中的归因占比也正在逐渐减弱[61]。然而,通过AFB1暴露所致HCC的分子指纹分析(癌症基因组图谱数据库和国际肿瘤基因组协作组数据库中世界不同地区共1072例HCC患者基因组数据),结果显示,我国HCC患者中因隐性AFB1暴露导致HCC的患者占比高达10%,远高于其他国家地区(0.4%~3.5%)[62]。隐性环境致癌物暴露所导致HCC比预期的更多见,需引起重视[63]。马兜铃酸(aristolochic acid,AA)存在于马兜铃属及细辛属等植物中,是很多中草药方的常见成分,2012年AA被IARC列为Ⅰ类致癌物。对HCC的基因组特征分析结果显示,亚洲HCC患者中具有AA特征性突变的比例远高于欧美,尤其是我国台湾地区高达78%[64]。在乙型肝炎患者中,AA暴露与HCC风险之间存在剂量反应关系,表明AA可能与HBV协同致癌[65]。但是在我国非恶性肿瘤死亡的老年人肝组织测序发现了AA突变比例较高,需要进一步应用队列研究确定AA对HCC的病因作用。
(5)肝硬化:世界范围内85%~95%的HCC具有肝硬化背景,多种原因导致的肝硬化是HCC发生过程中的重要环节[35]。我国约有700万例肝硬化患者[66],HBV相关肝硬化占比77.22%,肝硬化是我国HCC的首要病因[67]。HBV、HCV相关肝硬化患者HCC年发生率为3%~6%[40]和2%~4%[68]。肝硬化进展为HCC的风险受年龄、性别、病因、肝癌家族史及罹患其他疾病如糖尿病等多种因素影响。当前,我国肝病学界专家与国际相关专家立场一致,将因代谢异常如Ⅱ型糖尿病、肥胖等所导致的慢性肝病采用MAFLD替代原非酒精性脂肪性肝病[69]。一项由多病因组成的2079例肝硬化患者随访10年的队列研究显示,HBV所致肝硬化患者的10年HCC累积发病率为23.2%,发病率为26.2/1000人年;HCV所致肝硬化患者的10年HCC累积发病率为21.1%,其中,对直接抗病毒药物治疗后而获得SVR者,其HCC的10年累积发病率降低为7%,而无应答者则仍高达24.6%,获得SVR者和未获得SVR者HCC发病率分别为7.0/1000人年和27.0/1000人年;而酒精性肝病、MAFLD及其他原因所致肝硬化者10年HCC累积发病率分别为17.7%、12.8%和8.0%,发病率依次为18.4/1000人年(95%CI:11.9/1000人年~28.5/1000人年)、14.4/1000人年(95%CI:7.2/1000人年~28.8/1000人年)和10.1/1000人年(95%CI:5.6/1000人年~18.3/1000人年)。原发性硬化性胆管炎、原发性胆汁性胆管炎和自身免疫性肝炎相关肝硬化患者的HCC发病率则依次为7.2/1000人年(95%CI:1.8/1000人年~28.9/1000人年)、5.5/1000人年(95%CI:2.0/1000人年~14.6/1000人年)和1.3/1000人年(95%CI:0.2/1000人年~9.4/1000人年)[70]。肝硬化患者年龄大、男性、合并血小板计数低(<100×109/L)和食管静脉曲张,发生HCC的风险更高[70]。已有研究表明,HCC发生率与门静脉压力或通过瞬时弹性成像测定的肝脏硬度指数呈正相关[49]。HBV和HCV相关肝硬化患者抗病毒治疗后获得SVR者,其发生肝癌的风险均显著降低[44,49,55]。
(6)HCC病因的变迁:随着新生儿乙型肝炎疫苗的预防接种和致癌物黄曲霉毒素暴露的有效控制,青壮年人群中HBV所致HCC发病显著下降[61,71-72]。当前,我国制定的《慢性乙型肝炎防治指南(2019年版)》放宽了抗病毒治疗的适应证[40],《丙型肝炎防治指南(2019年版)》指出,积极筛查、对检查发现抗HCV阳性者提供必要的确诊及抗病毒治疗等[68]。预计我国因HBV和HCV所致HCC的风险将逐渐减弱,HBV和HCV相关HCC比例逐渐下降[34,73]。慢性肝病的病因变化引起全世界范围HCC的病因也逐渐发生变迁,根据全球疾病负担数据结果显示,酒精导致的HCC比例下降,慢性非酒精性肝病发病上升导致HCC比例增加[27]。
3.2 结局事件
问题3:肝癌病理分型、分期与分子特征
(A)肝癌的病理学类型主要包括HCC、胆管细胞癌以及混合性肝细胞癌和胆管细胞癌等;
(B)肝癌临床分期常用系统包括TNM分期、中国肝癌分期(Chinalivercancerstaging,CNLC)及巴塞罗那分期(Barcelonacliniclivercancer,BCLC);
(C)不同病因所致HCC具有相对独特的分子特征,HBV所致HCC的分子特征和临床表现与HCV及其他相关因素所致HCC有所不同。
(1)肝癌病理学类型:肝癌病理学类型主要分为HCC、胆管细胞癌以及混合性肝细胞癌和胆管细胞癌[74]。
(2)常用临床分期系统
1)TNM分期:美国癌症联合委员会(American Joint Committee on Cancer,AJCC)TNM分期系统(第8版)将肝癌分为Ⅰ~Ⅳ期,其分期细化定义如下,①原发肿瘤(T):pTx:原发肿瘤不能评估;pT0:无原发肿瘤的证据;pT1:单个肿瘤长径≤2 cm或单个肿瘤长径>2 cm无血管侵犯(T1a:单个肿瘤长径≤2 cm;T1b:单个肿瘤长径>2 cm无血管侵犯);pT2:单个肿瘤长径>2 cm伴有血管侵犯;或多个肿瘤长径均≤5 cm;pT3:多个肿瘤,至少1个肿瘤长径>5 cm;pT4:任何大小单个或多个肿瘤侵犯门静脉或肝静脉的主支(左、右门脉,左、中、右肝静脉),或肿瘤直接侵犯除胆囊外的其他邻近器官,或穿透脏层腹膜。②区域淋巴结(N):NX:区域淋巴结无法评估;N0:无区域淋巴结转移;N1:区域淋巴结转移(肝门、肝十二指肠韧带、膈下、腔静脉淋巴结转移,出现即Ⅳ期)。③远处转移(M):M0:无远处转移;Mx:远处转移无法评估;M1:远处转移[75]。详见表2。
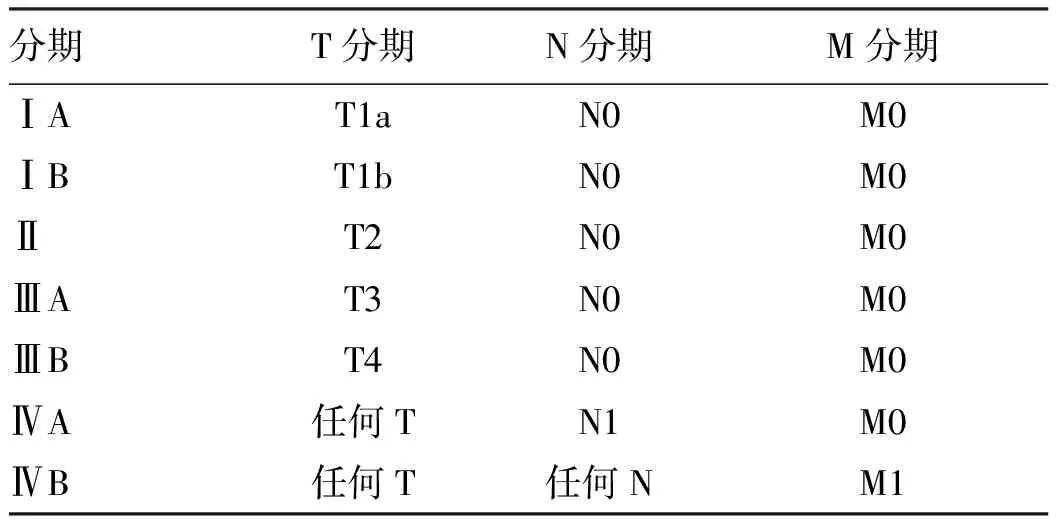
表2 TNM肝癌临床分期Table 2 Tumor-node-metastasis (TNM) classification for staging of liver cancer
2)CNLC:国家卫生健康委员会2022年发布的《原发性肝癌诊疗指南(2022年版)》结合中国的具体国情及实践积累,依据患者体力活动状态、肝肿瘤及肝功能情况等,制定了CNLC,将肝癌分为Ⅰ~Ⅳ期[76],详见表3。
3)BCLC:BCLC肝癌临床分期系统最早于1999年提出,后经美国肝病研究协会不断进行修改,2022版BCLC将肝癌分为极早期、早期、中期、晚期和终末期[77-78],详见表4。
(3)分子特征:HCC起源于肝细胞,在基因组水平上累积了多种遗传学与表观遗传学的改变。具有特定DNA突变特征的分子指纹可反映出HCC的相关危险因素,提供了HCC致癌机制、病因学、流行病学的生物学证据[79-82],如确认烟草致HCC的作用[79],黄曲霉毒素暴露所致的HCC分布特征[62,80],草药中AA在HCC病因学中潜在的作用[81],此外,DNA的突变特征还可作为指导HCC精准治疗的生物标志物[82]。HCC基因组中的大多数DNA基因突变为非驱动突变,不参与致癌过程,仅2~6个突变目前被认为是功能性的“驱动”突变,改变了细胞关键信号通路而获得生长优势[83]。这些突变基因归类于6条主要的生物学途径:1)端粒维持;2)Wnt/β-连环蛋白(β-catenin)通路;3)TP53失活引起的相关细胞周期改变;4)AKT/mTOR通路;5)MAP激酶通路;6)表观遗传修饰和氧化应激[83]。HCC常见的突变基因包括TERT启动子、TP53、CTNNB1、AXIN1、ARID1A和ARID2[83]。表观遗传失调也参与HCC的发生过程,包括DNA甲基化、组蛋白与染色质重塑及microRNA和长非编码RNA水平改变等[83]。HCC细胞中通常存在着遗传学和表观遗传学改变之间的相互作用,如基因启动子CpG岛的广泛高甲基化与CTNNB1突变有关,CDKN2A启动子的甲基化则与TERT启动子突变有关,而全基因组的低甲基化与基因组不稳定性有关[83]。与其他肿瘤一样,HCC也存在异质性。HCC的主要驱动基因CTNNB1、TP53和TERT是主干突变;HCC中还存在着空间异质性,与肝硬化背景下的新发肿瘤或发生肿瘤的肝内转移有关,有的两者兼具[83]。近年来,世界范围内开展的HCC多组学分析结合临床、病原学和组织病理学特征的相关研究,改进了HCC的分类与分子分型。

表3 中国肝癌分期Table 3 China liver cancer staging (CNLC) system
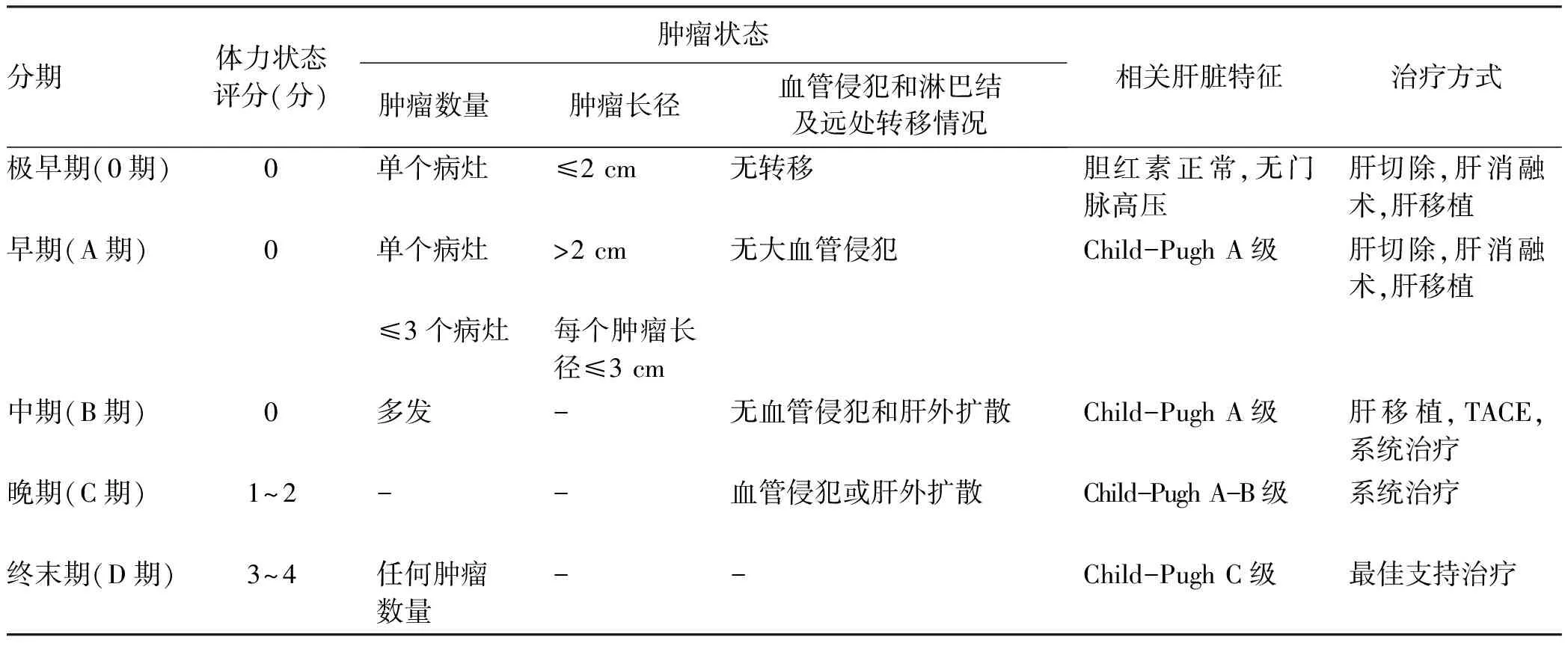
表4 巴塞罗那肝癌临床分期Table 4 Barcelona clinic liver cancer staging system
目前HCC分为两大类,一类为增殖型,另一类为非增殖型[83]。每一类HCC均整合了数个研究中的相关分类亚型[84-87]。HCC的分类与分型如下,1)增殖型HCC:病因学上与HBV相关,患者血清中甲胎蛋白(α-fetoprotein, AFP)含量高;肿瘤侵袭性高、分化差、常伴有血管侵犯;存在高频TP53失活突变,FGF19和CCND1基因扩增;表现为染色质的不稳定性、DNA的低甲基化水平;细胞周期、RAS-MAPK、MET等促生存信号通路激活及mTOR通路的RPS6的过磷酸化。增殖型HCC可进一步分为2个亚型:祖细胞亚型和TGFβ/Wnt亚型。祖细胞亚型HCC的特征是肿瘤细胞高表达肝脏干细胞标志物,存在RPS6KA3和AXIN1的失活突变,存在ERK过磷酸化;IGF1R通路和AKT通路激活;TGFβ/Wnt亚型HCC的特征是存在着TGFβ通路和Wnt通路的激活,肿瘤表现为免疫耗竭状态。TGFβ/Wnt亚型还包括一类肿瘤侵袭更强、具有“粗梁型”的特定组织学表型的HCC,其存在TSC1和TSC2基因突变、FGF19/CCND1基因扩增更显著、细胞周期和核孔相关基因的过度表达。2)非增殖型HCC:肿瘤的异质性更强,病因学上与HCV、酒精相关,患者血清中AFP含量低;肿瘤的侵袭性相对较低,分化程度高,保留有肝细胞样特征,染色质稳定,进一步可分为至少2个亚型,分别为CTNNB1突变亚型和G4亚型。CTNNB1突变亚型存在β-catenin通路激活,常见TERT启动子突变及CDKN2A和CDH1启动子的高甲基化,肿瘤中有胆汁淤积、很少有免疫细胞浸润,细胞核质存在β-catenin的累积,谷氨酰胺合成酶免疫组化染色呈阳性。目前对G4亚型的定义尚不完全,肿瘤细胞通常具有脂肪变,并呈现出IL6/JAK-STAT通路的激活,C-反应蛋白免疫组化染色呈阳性。G4亚型还包含了染色体多倍体组和干扰素组,染色体多倍体组的HCC在7号染色体上呈多倍体,干扰素组的HCC高表达干扰素刺激基因,呈免疫激活状态。
问题4:HCC癌前病变的定义
(A)HCC癌前病变包括低级别不典型增生结节(low-gradedysplasticnodules,LGDN)、高级别不典型增生结节(high-gradedysplasticnodules,HGDN)和β-catenin高表达的肝细胞腺瘤;
(B)肝硬化基础上出现的不典型增生结节,尤其是HGDN具有非常高的恶变风险。
癌前病变是指某些可能发生癌变的良性病变,包括细胞形态分化异常的病变、组织结构异型性的病变等,癌前病变比正常组织或良性病变更容易发生癌变,形成侵袭性癌[88]。目前HCC癌前病变的诊断主要依靠病理学及分子诊断技术,大部分在术后切除标本中明确诊断,实际检出率较低。我国HCC发生过程大多遵循乙型肝炎-肝硬化-肝癌三部曲模式,发生在肝硬化背景下的HCC癌前病变具有较强的恶变潜能[88-89]。《肝细胞癌癌前病变的诊断和治疗多学科专家共识(2020版)》阐述了目前病理学上对HCC癌前病变的认识,在慢性乙型肝炎等肝病背景下,肝组织出现一定的组织结构和细胞形态上的异型性,形成具有潜在恶变风险的异型增生结节[88]。HCC癌前病变的常见病理类型包括长径<1.0 mm的异型肝细胞微小病灶(异型增生灶)和长径>1.0 cm的非HCC的异型增生结节,大多在1.0~2.0 cm[88]。根据细胞的异型程度,异型增生结节进一步分为LGDN和HGDN,两者的恶变风险依次增加[88]。
(1) LGDN:以大细胞异型增生成分为主,细胞密度轻微增加,轻度异型性,存在汇管区结构,罕见孤立性动脉和假腺管[90]。
(2)HGDN:以小细胞异型增生成分为主,细胞密度较周围组织增加1.5~2.0倍,核质比高,胞质嗜碱性强,核轮廓不规则[90],存在不同数量的门管区,假腺管,弥漫性脂肪变及不同数量的孤立动脉,可观察到局部癌变(结节中结节)[91]。日本学者对154例肝硬化患者中位随访2.8年的研究表明,HGDN在1年、2~3年和5年内发展为HCC的转化率分别为46.2%、61.5%和80.8%;LGDN在1年、2~3年和5年内发展为HCC的转化率分别为2.6%、30.2%和36.6%[90,92]。对具有肝脏小结节的非HCC患者的多项长期观察研究发现均表明,HGDN具有更高发展为HCC的风险,在平均随访33个月期间,HGDN发生HCC的HR为2.4[90,93]。在基因组水平上,端粒酶逆转录酶(TERT)启动子突变频率在LGDN中为6%,HGDN中为19%,早期HCC中为61%[94]。进行磷脂酰肌醇蛋白聚糖-3、热休克蛋白70、谷氨酰胺合成酶及毛细血管化程度(CD34染色强度)等免疫组化染色有助于鉴别HGDN与早期HCC[91,95]。
(3) 肝细胞腺瘤:肝细胞腺瘤是肝细胞的良性单克隆增生,多见于成年女性,与口服避孕药有密切关系[83]。有学者在一项系统评价中指出,肝细胞腺瘤发展为HCC的总风险为4.2%[96]。长期使用类固醇治疗、男性、肥胖以及携带β-catenin突变的肝细胞腺瘤是恶性转化的高危因素[83,96]。
癌前病变及疾病的恶变风险较高,对癌前病变疾病的认识与诊断有助于识别早期HCC,当前在基因组水平上的研究为癌前病变的分子诊断进行了有益探索,详见《肝细胞癌癌前病变的诊断和治疗多学科专家共识(2020版)》[88]。
问题5:肝癌筛查技术的准确性
筛查技术准确性评价常用指标有灵敏度和特异度。
与其他筛查技术评价一样,肝癌筛查技术的准确性(真实性)评价常用的指标同样是灵敏度和特异度,灵敏度是筛检技术将实际患病的人正确判断为阳性的百分比,特异度是筛查技术将实际无病的人正确判断为阴性的百分比;将二者结合体现的常用指标还有受试者工作特征(receiver operating characteristic,ROC)曲线,ROC曲线是以筛查技术的灵敏度为纵坐标,1-特异度为横坐标,各点连接而成的曲线,曲线下面积最大者真实性最佳[97]。此外,相关应用较多的指标还包括可靠性评价,常用指标有符合率(筛检试验正确判断患者与非患者之和占总受检人数的比例)和Kappa值[(观察符合率-机遇符合率)/(100%-机遇符合率)]等,以及多用于评价筛查诊断技术诊断价值的预测值,具体包括阳性预测值(筛查技术检出阳性者中真正患目标疾病者所占的百分比)和阴性预测值(筛查技术检出阴性者中真正非患者所占的百分比)[97]。
问题6:肝癌筛查相关干预的不良结局事件
现有文献报道的肝癌筛查相关干预的不良结局事件包括辐射暴露、不必要的活检等生理伤害,心理焦虑等心理伤害以及过度诊断。
(1)生理伤害:筛查过程中因为假阳性或筛查结果不确定性而进一步通过CT、肝脏活检等确诊的过程中遭受的一定生理伤害(如不必要的辐射暴露、活检)[98]。1)辐射暴露。使用CT作为筛查工具进行筛查或因超声检查(ultrasonography,US)和AFP检测过程中的假阳性、筛查结果不确定性而进一步通过CT等影像学诊断过程中遭受的辐射暴露[98]。2)不必要的活检。筛查过程中因为假阳性或筛查结果不确定性而进一步通过病理学诊断过程中,筛查人群经历肝脏活检,而活检过程中可能会导致出血、感染等情况的发生[98]。
(2)心理焦虑:由于筛查阳性而使患者因为自己患恶性肿瘤而产生心理焦虑等负面情绪。系统检索未检出肝癌筛查导致焦虑相关文献,但美国预防服务工作组的系统综述显示,乳腺癌筛查假阳性的女性比筛查结果正常的女性更容易产生心理焦虑[99],肝癌筛查可能也有类似影响。
(3)过度诊断:过度诊断是指发现临床上无关紧要的疾病,而这些疾病不会影响患者的寿命。过度诊断是任何筛查测试都有可能存在的一种现象。当一种疾病的发病率上升而死亡率没有随之上升时,就应该考虑过度诊断存在的可能性。国外学者于2017年发表的综述中指出,以下3种情况可能会导致肝癌的过度诊断:1)US为亚厘米病变,肝脏活检仅为异常增生结节而不是肝癌;2)筛查检测出的小肝癌,肿瘤倍增时间缓慢,患者最终未死于肝癌;3)在Child-Pugh C级的肝硬化患者中进行肝癌筛查,患者有可能死于肝硬化并发症而不是肝癌[100]。
问题7:肝癌筛查相关干预的可获得性
可获得性主要涉及当地有无相关筛查和(或)监测政策、现行方案、人群覆盖率、参与率和依从率及其影响因素等。
IARC在其发布的系列癌症筛查手册中,对筛查干预技术、方案和效果等进行了综合评估,并将可获得性列为其中重要评价指标之一,其内容主要涉及当地有无相关筛查和(或)监测政策、现有筛查和(或)监测方案、人群覆盖率、筛查参与率和依从率及其影响因素等,同时也涉及到治疗率、接受度等细化指标[101-102]。这一系列评价指标可理解为广义的(卫生服务)可及性及其相关概念范畴,其理论体系仍待进一步系统化。本指南当下参照IARC癌症筛查手册,对其中较多见的可获得性相关指标信息进行汇总整合。
3.3 人群风险分类
问题8:肝癌高风险人群的定义
(A)肝癌高风险人群,符合以下条件之一者:(1)各种原因(包括酒精性肝病、MAFLD)所致的肝硬化患者;(2)HBV或(和)HCV慢性感染且年龄≥40岁者(证据质量:中;推荐强度:强);
(B)一般风险人群:以上定义为肝癌高风险人群以外的人群(证据质量:低;推荐强度:弱)。
国内外指南均将肝硬化作为肝癌风险增加的重要指标,无论年龄、任何病因背景下的肝硬化患者几乎均被定义为高危人群[13,103-108]。我国指南还明确指出,具有肝癌家族史的人群尤其是年龄≥40岁的男性肝癌发生风险更大[103]。全球范围内肝癌患者中,33%归因于HBV慢性感染[人群归因危险度(population attributable fraction,PAF),PAF =33%],30%归因于饮酒(PAF=30%),21%归因于HCV慢性感染(PAF=21%),16%归因于其他原因(PAF=16%)[36]。中国人群>75%的肝癌归因于HBV感染、HCV感染、饮酒、代谢性疾病和黄曲霉毒素污染等可改变的危险因素[109]。根据既往数据,建议对具备上述风险因素的肝病患者定义为高风险人群,对其进行肝癌筛查。国内外肝癌筛查相关指南和共识定义的肝癌高风险人群等信息详见表5。
一般风险人群是指患癌水平处于平均或较低水平的人群。目前各国制定的肝癌相关指南尚无对于一般风险人群的准确定义,且只推荐对肝癌高危人群进行肝癌筛查,未推荐对全人群进行筛查的策略(表5)。本指南将上述定义为肝癌高风险人群以外的人群认为是肝癌一般风险人群。
中国CKB合作组(China Kadoorie Biobank,CKB)利用前瞻性队列中50万例研究对象为期10年的随访数据,首次针对一般社区居民构建了基于社会人口学特征、行为生活方式、个人疾病史、家族疾病史、身体测量指标和血液检测结果共计6个维度、15项指标的肝癌风险预测模型(CKB-PLR模型)。CKB-PLR模型的C统计量为0.80,判别能力良好,以10年肝癌发生的绝对风险≥2%作为风险阈值划分高风险人群,推荐进行肝癌筛查。CKB-PLR模型的灵敏度(28.17%)稍高于目前仅对HBV携带者进行筛查策略的灵敏度(25.96%),特异度相当(分别为97.12%和96.96%),并且能提高筛查净收益[110]。这项研究从个性化筛查角度,提出了既需要对HBsAg血清阳性者进行筛查,也需要对CKB-PLR模型预测的10年肝癌发生绝对风险≥2%的HBsAg血清阴性者给与肝癌筛查的建议,首次以模型评估的形式帮助定义了肝癌高风险人群[110]。
问题9:肝癌高风险人群的风险分层
针对肝癌高风险人群,现有的单一风险分层模型无法覆盖全部肝癌发病人群,建议根据不同高危病因,建立有针对性的筛查模型,并基于中国人群数据进行进一步的各种风险预测模型评估(证据质量:中;推荐强度:弱)。
目前,仅有我国的《原发性肝癌的分层筛查与监测指南(2020版)》[12]推荐了根据不同病因和疾病状态分别利用不同风险评估模型进行高危人群分层,《中国肝癌早筛策略专家共识》[14]和《原发性肝癌二级预防共识(2021年版)》[13]也推荐参考《原发性肝癌的分层筛查与监测指南(2020版)》进行高危人群分层。此外,日本肝病协会发布的指南也建议了根据肝硬化和合并病毒感染与否进行风险辨识的方法[105],具体内容详见表6。在《原发性肝癌的分层筛查与监测指南(2020版)》中推荐的筛查模型分别针对肝硬化患者(THRI模型[127])和HBV感染者(REACH-B模型[41]、PAGE-B模型[128]以及AGED模型[129]),尚无单独针对HCV感染者的风险评估模型。由于HCV感染者主要是在肝硬化背景下才发生肝癌,有学者针对伴有肝硬化或高级别纤维化的HCV感染者构建了GES风险分层模型[130]。2020年,我国研究者利用全球11个前瞻性队列共17 374例患者, 构建了首个跨病因(慢性乙型肝炎、慢性丙型肝炎、非病毒性肝病等)、跨种族(亚洲人、西方人等)针对慢性肝病患者的肝癌风险预测评分aMAP模型[131]。模型由患者年龄、性别、血小板计数、白蛋白和胆红素等5个指标构成,总分为100分,aMAP评分<50分的患者归为低危险组,其HCC年发生率为0~0.2%;aMAP评分50~60分为中危组,其HCC年发生率为0.4%~1.0%;aMAP评分>60分为高危组,其HCC年发生率为1.6%~4.0%[131]。在HBV队列及各种不同肝病队列中,aMAP评分的预测能力均显著高于其他现有HCC风险评分模型,且在慢性乙型肝炎[132]和慢性丙型肝炎[133]人群的外部验证中,aMAP评分均取得了较好的预测能力。推荐模型的适用人群和评估指标等详见表7。在国家卫生健康委员会2022年1月17日发布的《原发性肝癌诊疗指南(2022年版)》中,也推荐了使用aMAP评分进行肝癌高风险人群的分层[76]。但目前尚无aMAP评分针对肝癌高危人群的广泛验证或RCT筛查研究等高质量证据,因此,需要继续以中国人群的肝癌筛查数据为基础,评估aMAP评分模型的作用。

表5 全球筛查指南或共识对肝癌高风险人群的定义Table 5 Summary of definitions of high-risk populations for liver cancer from global screening guidelines or consensus statements

续表5:
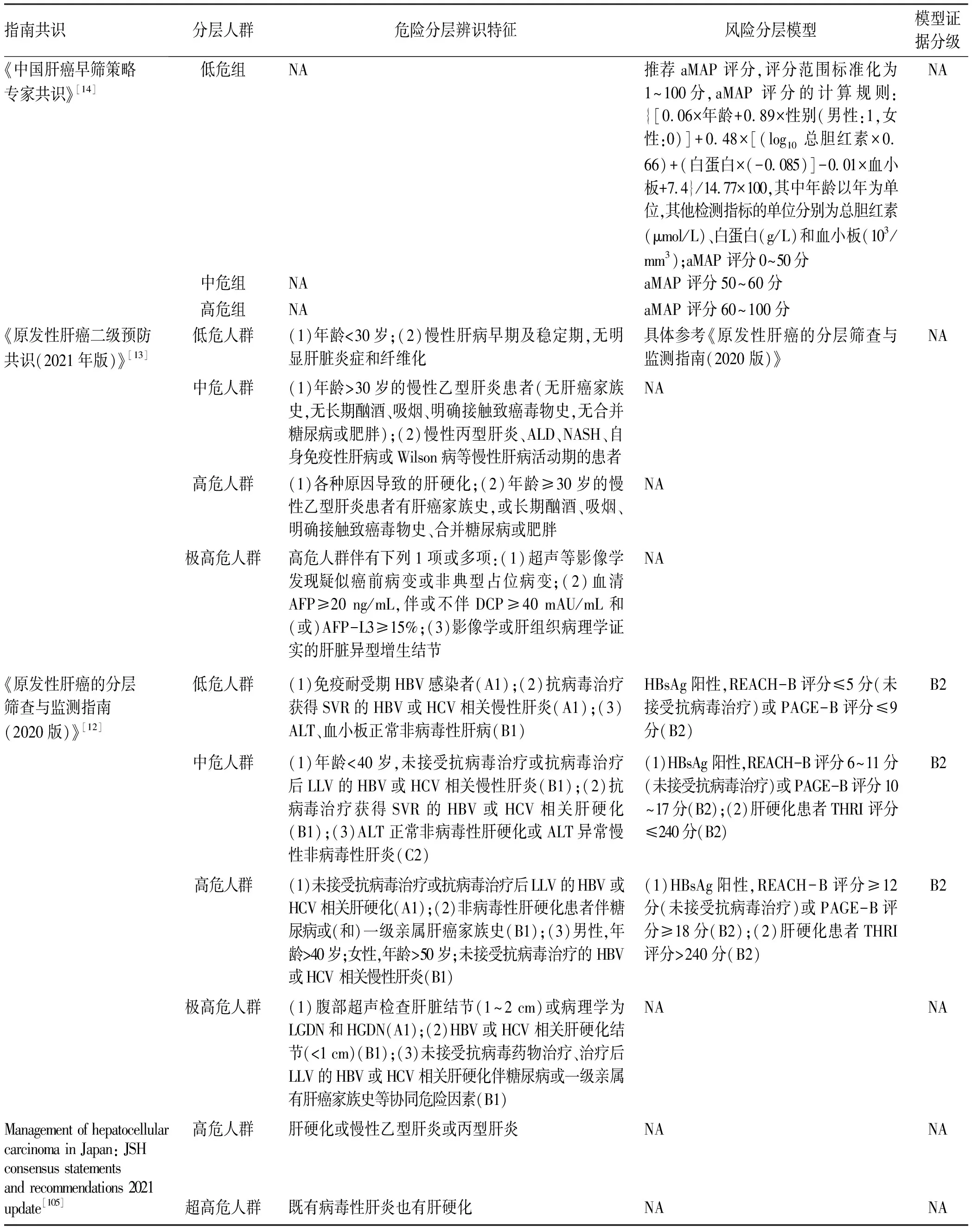
表6 肝癌筛查共识和指南推荐的肝癌辨识特征与风险分层模型Table 6 Consensus- and guideline-recommended risk identification features and risk stratification models of liver cancer
由于我国HCC的男性发病率显著高于女性,并且主要由HBV感染所致,因此,由国家癌症中心领衔,基于社区HBsAg阳性人群队列,针对男性HBsAg阳性者,对其2年内发生肝癌的风险进行了预测,并进行了人群分层,研究纳入3629例35~69岁男性HBsAg阳性者作为训练队列构建肝癌风险评分系统(Male-ABCD),在2524例HBsAg阳性男性中完成外部验证[134]。Male-ABCD评分系统除包括年龄外,还包括AFP、异常凝血酶原(des-gamma-carboxy prothrombin,DCP)、γ-谷氨酰转肽酶、血小板计数、白细胞计数,总计18.3分,当截断值为1.5分时,灵敏度为100%,约有21.52%的男性HBsAg阳性者被识别为肝癌低危人群;截断值为2.5分时,灵敏度为98.68%,约有41.25%的HBsAg阳性者被识别为肝癌低危人群;当截断值升至4.5分时,仅有22.04%的男性HBsAg阳性者被判别为肝癌高危人群,2年HCC阳性预测值为18.22%[134]。上述结果还需要其他筛查研究的高质量证据支持。
3.4 筛查起止年龄
问题10:肝癌高风险人群监测的起止年龄
(A)我国肝癌高风险人群推荐监测起始年龄为40岁,74岁或预期寿命<5年时终止(证据质量:低;推荐强度:弱);
(B)肝硬化患者的肝癌监测起止年龄不限(证据质量:低;推荐强度:弱)。
系统文献未检出特别针对普通人群肝癌筛查或肝癌高风险人群监测最佳起止年龄的报道。
现有指南仅推荐对肝癌高风险人群进行肝癌监测,未推荐全人群筛查策略。各国指南均将慢性乙型肝炎、丙型肝炎患者和肝硬化患者确定为肝癌筛查的高危人群;美国和欧洲的指南对肝硬化患者的Child-Pugh不同分级推荐了不同的筛查策略,Child-Pugh A级和B级肝硬化患者推荐进行肝癌筛查,Child-Pugh C级肝硬化患者如果不进行肝移植不推荐筛查,指南认为肝硬化伴晚期肝功能衰竭(Child-Pugh C级)无法进行有效的肝癌治疗除非进行肝移植[121,135-139]。欧洲肝脏研究学会(European Association for the Study of the Liver,EASL)、中国《原发性肝癌诊疗规范(2019年版)》还把有肝癌家族史的人群确定为肝癌高危人群,推荐对有肝癌家族史的人群也进行肝癌筛查[103,138]。日本肝病协会指南指出,既患肝炎又有肝硬化的人群为超高危人群,对其采取更短的筛查间隔进行筛查[140]。中国指南指出具备肝癌危险因素而且年龄>40岁的男性患肝癌的风险更大,但中国《原发性肝癌诊疗规范(2019年版)》未指出对上述人群是否采取不同的筛查策略[103]。
为了提供一定佐证,我们仍然根据所有文献结果报道的筛查或监测人群的平均年龄进行了总结和亚组分析,以概括相关研究纳入对象的起止年龄以及相关结果,结果如下所示:筛查或监测人群的平均年龄为41.2~74.4岁,本研究以40~49.9岁、50~59.9岁、≥70岁为亚组对不同高风险人群年龄组的筛查或监测有效性进行了亚组分析。
(1)早期肝癌检出率:共有4项RCT研究[141-144]和50项队列研究[145-194]比较了筛查或监测和非筛查或监测组的早期肝癌检出率。4项RCT研究中,仅有3项研究[141-143]报道了筛查或监测平均年龄为41.2~45.6岁。50项队列研究中,仅有35项研究[145-152,160-163,167-168,170,173-178,180-186,188-191,193-194]报道了筛查或监测平均年龄为44.5~74.4岁。亚组分析结果提示,40~49岁、50~59岁、≥70岁各亚组中筛查或监测组与非筛查或监测组的早期肝癌检出率的相对风险差异无统计学意义。有3篇RCT研究[141-143]来自我国,比较了接受筛查或监测和非筛查或监测乙型肝炎人群的早期肝癌检出率,结果显示,筛查或监测组早期肝癌检出率高于非筛查或监测组,乙型肝炎人群的平均年龄为41.2~45.6岁,提示在我国41.2~45.6岁的乙型肝炎人群进行肝癌筛查或监测,具有筛查或监测效果。
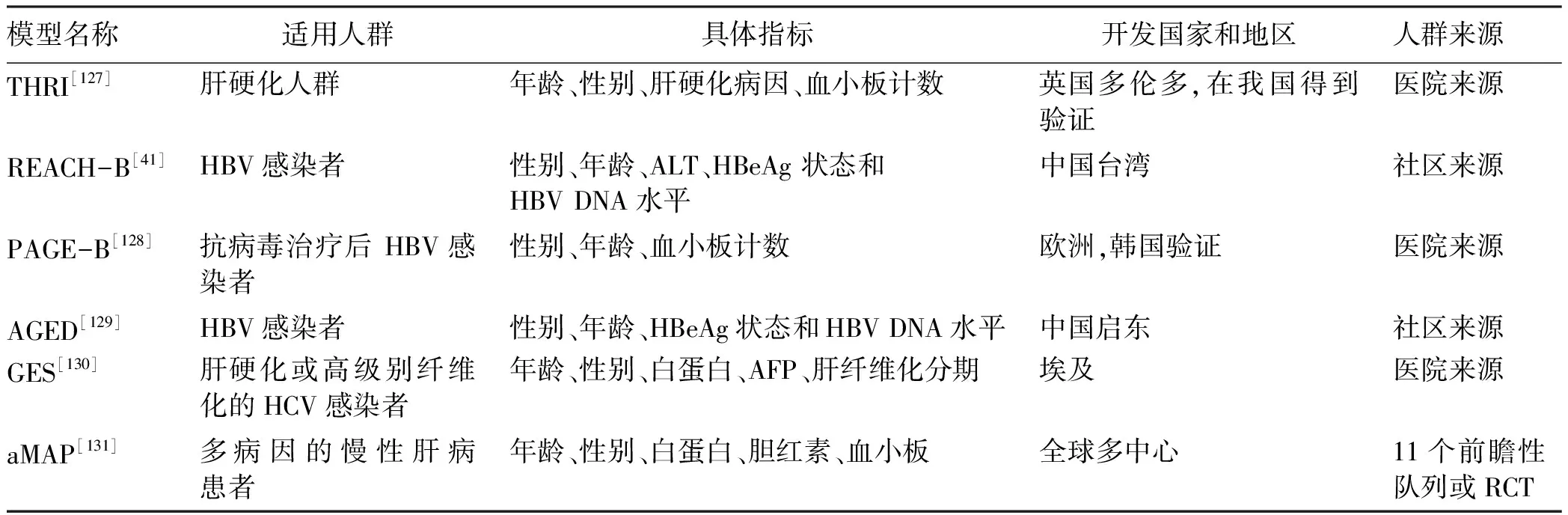
表7 肝癌筛查共识指南所涉肝癌风险评估模型的适用人群及具体指标Table 7 Applicable populations and specific indicators of the liver cancer risk assessment models involved by theconsensus statements and guidelines for liver cancer screening
(2)肝癌生存率
1)1年生存率:共有4项RCT研究[141-144]和22项队列研究[150,152-153,157,168,175,180-181,185-188,191,195-203]比较了筛查或监测和非筛查或监测组的肝癌患者1年生存率。4项RCT研究仅有3项[141-143]报道了筛查或监测平均年龄为41.2~45.6岁;22项队列研究中,仅有16项[150,152,168,175,180-181,185,187-188,191,195-196,198-201,203]报道了筛查或监测平均年龄为47.0~71.3岁。亚组分析结果显示,40~49岁、50~59岁、≥70岁各亚组中筛查或监测组与非筛查或监测组肝癌患者1年生存率RR差异无统计学意义。3篇RCT研究(来自我国)比较了接受筛查或监测和非筛查或监测的乙型肝炎人群肝癌患者1年生存率,结果显示,筛查或监测组人群的1年生存率高于非筛查或监测组,乙型肝炎人群的平均年龄为41.2~44.5岁。2篇队列研究(来自我国)比较了接受筛查或监测和非筛查或监测的乙型肝炎人群肝癌患者1年生存率,结果显示,筛查或监测组人群的1年生存率高于非筛查或监测组,乙型肝炎人群的平均年龄分别为47.0和59.5岁[195,203],提示在我国对41.2~44.5岁的乙型肝炎人群进行肝癌筛查或监测均有肝癌筛查或监测效果。
2)3年生存率:3项RCT研究[141-143]和26项队列研究[145,150,152-153,162-163,168,174,176,178,180-182,185-186,188-189,191,195-196,198-199,202,204-206]比较了筛查或监测和非筛查或监测组肝癌患者3年生存率。3项RCT研究报道的筛查或监测平均年龄为41.2~45.6岁。26项队列研究中,仅有23项研究[145,150,152,162-163,168,174,176,178,180-182,185-186,188-189,191,195-196,198-199,205-206]报道了筛查或监测平均年龄为47.0~71.3岁,亚组分析结果提示,≥70岁年龄组中筛查或监测组与非筛查或监测组的3年生存率RR显著低于其他年龄组。3篇RCT研究[141-143](来自我国)比较了接受筛查或监测和非筛查或监测的乙型肝炎人群肝癌患者3年生存率,结果显示,筛查或监测组人群的3年生存率高于非筛查或监测组,乙型肝炎人群的平均年龄为41.2~44.5岁,提示在我国对41.2~44.5岁的乙型肝炎人群进行肝癌筛查或监测具有肝癌筛查或监测效果。
3)5年生存率:有3项RCT研究[141-143]和12项队列研究[145,157,168,171,178,180-181,185-186,195,198,202]比较了筛查或监测和非筛查或监测组肝癌患者5年生存率。3项RCT研究报道的筛查或监测平均年龄为41.2~45.6岁。12项队列研究中,仅有9项研究[145,168,178,180-181,185-186,195,198]报道了筛查或监测平均年龄为47.0~74.4岁,亚组分析结果提示,40~49岁、50~59岁、≥70岁各亚组中筛查或监测组与非筛查或监测组人群的5年生存率的RR差异无统计学意义。3篇RCT研究(来自我国)比较了接受筛查或监测和非筛查或监测乙型肝炎人群肝癌患者5年生存率,结果显示,筛查或监测组人群的5年生存率高于非筛查或监测组,乙型肝炎人群的平均年龄为41.2~44.5岁[141-143]。
4)中位生存时间:未发现有RCT研究比较筛查或监测组和非筛查或监测组的中位生存时间,仅有24项队列研究[136,147-148,153,157-158,165-166,172,175,178,180,183-185,188-200,202-203,207-210]比较了接受筛查或监测的4648例肝癌患者和未接受筛查或监测的10 593例肝癌患者的中位生存时间。24项队列研究中,仅16项研究[136,147,153,165,172,175,180,183-185,188,199-200,203,207-208]报道了筛查或监测平均年龄为58.4~74.4岁。采用中位生存时间比(median survival ratio,MSR)效应量进行中位生存时间的Meta分析,结果显示,各研究之间存在很大异质性(I2=98.0%),所以我们采用定性描述的方法对筛查或监测组和非筛查或监测组肝癌患者的中位生存时间进行总结,未进行Meta分析合并和亚组分析。但是,各研究均显示,筛查或监测组的中位生存时间高于非筛查或监测组。未发现来自我国的研究比较了筛查或监测人群和非筛查或监测人群肝癌患者的中位生存时间。
(3)肝癌死亡率:关于肝癌筛查或监测死亡率下降效果的证据有限,仅检出2项RCT研究[142-143]和4项队列研究[194,204,211-212],其中仅有1项队列[211]研究对象来自美国,其他5项研究[142-143,194,204,212]均来自我国。江苏省启东市和上海市的2项RCT[142-143]研究对象年龄为30~59岁,广东省中山市的队列[194]研究对象为35~64岁,中国台湾地区的2项队列研究[204,212]中有1项报告了年龄为45~69岁,来自美国的队列研究[211]报告的年龄为62.8岁,但这几项研究设计主要是针对监测和筛查方案整体效果的评价,且高风险人群划定指标定义不一,研究结果不一致,尚不能完全支持肝癌高风险人群最佳监测起止年龄的推论。
3.5 筛查技术
推荐意见:综合肝癌筛查的有效性、安全性、可及性和经济性等多维度证据,推荐在我国人群中使用US联合AFP检测为肝癌筛查技术。
问题11:肝癌筛查常用技术
US联合AFP检测仍是最广泛采用的肝癌筛查技术,CT与磁共振成像(magneticresonanceimaging,MRI),特别是增强CT与结合钆塞酸二钠的MRI是筛查异常人群进行进一步诊断的首选技术,维生素K缺乏症或拮抗剂Ⅱ诱导的蛋白质(proteininducedbyvitaminKabsenceorantagonistⅡ,PIVKA-Ⅱ;又称DCP)等其他血清标志物可作为补充筛查技术,但尚不能完全替代US联合AFP检测(证据质量:中;推荐强度:强)
筛查是通过简单、经济的方法将表面健康但可能有疾病的人群与真正无病的人群区别开来,是一项长期性、周期性、普遍性的工作。因此,筛查技术的选择要综合考虑准确性、操作难度、损伤程度和经济成本等因素,应根据初筛、加强筛查、补充筛查、确定高危人群等不同目的进行筛查技术的选择。本指南通过系统综述、核心文献、既往国内外诊疗指南等渠道,对我国人群开展肝癌筛查的技术选择策略进行整合评估分析。
(1)筛查技术:腹部US和血清AFP技术成熟、价格便宜、设备和人员技术要求低,易于在不同医疗条件地区推广开展,作为常规筛查手段被广泛采用。肝炎病毒感染者、长期饮酒、肝硬化等高危人群推荐每隔6个月进行1次US或AFP检查[213]。US易受操作者技术、经验和受检者肥胖程度的影响。在US设备或相关经验有限的地区,AFP检测可起到早诊断的作用[214]。单独使用US或AFP进行筛查的灵敏度有限,特别是对于早期肿瘤;荟萃分析表明,US联合AFP进行筛查的灵敏度显著高于单独使用其中一种检测技术[98,215-216]。此外,作为初筛技术,两种方法的特异度也受到限制。US结合血流动力学特征仅能判断长径>2 cm结节的良恶性,同时妊娠和胃肠道肿瘤等其他生理或病理性原因也会导致血清AFP的升高[217]。因此,对于US发现结节或(和)血清AFP升高,但尚未达到诊断标准的人群,推荐每隔2~3个月进行加强筛查,主要使用影像学筛查技术[216,218]。
(2)进一步诊断:CT和MRI的设备价格高,难以作为初筛技术进行推广,但对于US和血清AFP筛查异常者是首选的加强筛查方法,特别是增强CT和结合特异性对比剂的增强MRI扫描。在针对肝癌高危人群进行肝癌筛查时,增强MRI优于增强CT;对于长径>2.0 cm的肿瘤,MRI与CT的灵敏度差异无统计学意义;但MRI结合使用钆塞酸二钠对早期肝癌(单个结节长径<2.0 cm)的检出率要高于增强CT[219-221]。CT与MRI结合核医学检测手段(主要指核素显像检查)可以提供更为精确和全面的信息,但是由于操作复杂、设备要求高,不适用于高危人群筛查,而更适用于早期诊断。肝癌早期诊断重要的技术手段包括:1)正电子发射计算机断层扫描(positron emission tomography/computed tomography,PET-CT):通过单次检查全面评估肿瘤分期和转移情况;2)PET-MRI:不仅具有高筛查灵敏度,还可以同时获得解剖与功能信息。
(3)补充筛查技术:除AFP外的其他血清标志物同样具有易操作和低损伤的优点,且区分肝癌的能力更强,可作为补充筛查技术。AFP-L3是AFP岩藻糖基化的变异体,主要出现在肝癌患者体内。而慢性肝炎和肝硬化患者体内的主要亚型为AFP-L1,妊娠期人群主要亚型为AFP-L2。因此,使用AFP-L3与AFP的比值为指标可以进一步排除其他造成AFP上调因素的影响[219-221]。多中心研究和荟萃分析显示,PIVKA-Ⅱ可有效鉴别血清AFP阴性的早期肝癌,可作为AFP的补充检测技术[222]。日本肝病协会已将PIVKA-Ⅱ和AFP-L3与AFP并列为HCC高危人群的常规早筛标志物[223]。其他肝癌筛查的血清蛋白标志物还包括骨桥蛋白、热休克蛋白90α、血清铁蛋白、α-L-岩藻糖苷酶、热激蛋白等,但是这些分子缺乏肝癌特异度,在其他肿瘤或肝脏疾病状态中也会升高,因此多用作辅助或补充筛查指标[224]。此外,体循环中新型标志物的液体活检手段与血清AFP比较也体现出更高的灵敏度和特异度,包括微小核糖核酸(microRNA,miRNA)和循环肿瘤DNA(circulating tumor DNA,ctDNA)等[225-227]。研究证据表明,综合使用各类型标志物,建立基于多组学的联合筛查技术,可提供比US联合AFP更高的灵敏度和特异度,并有望成为贯穿早期HCC筛查与监测HCC诊疗全流程的检测技术,但尚无明确的综合标志物检测方案[228-229]。此外,HBV的C2基因型、病毒载量≥104拷贝/mL、A1762T及G1764A双突变等病毒高危变异均提示肝癌风险增加[230-232],可用于缩小高危人群范围,区分筛查强度,但具体标准有待进一步研究确认。
总之,目前我国的主要初筛技术仍选择US和血清AFP检测,对于发现结节(特别是长径<2.0 cm)和不明原因AFP升高的人群,需进行CT或MRI增强扫描筛查。其余证明有良好筛查价值的血清或ctDNA可作为补充筛查技术,但尚不能完全替代血清AFP检测。
问题12:肝癌筛查技术的有效性
目前针对肝癌筛查准确性较好的技术有US以及US联合AFP检测,US和AFP检测联合应用对所有阶段及早期HCC的灵敏度分别为97%和63%,其余新型标志物及联合方案有待进一步检验(证据质量:高;推荐强度:高)。
筛查技术的准确性,也称为真实性,是指研究结果与客观事实保持一致的程度。准确性最重要的常用基础评价指标包括灵敏度和特异度。提高筛查技术准确性的途径既包括开发新的具有更高预测价值的单一标志物,也包括利用既有技术设计组合筛查方案。本章节通过各大数据库(PubMed、中国知网、万方知识服务平台、维普资讯网等文献库)、实验性研究、指南、系统综述和荟萃分析的证据进行分析,对各筛查技术的准确性进行评估。
(1)单一筛查技术的准确性
目前针对肝癌的单一筛查技术有US、AFP、CT、MRI以及一些新型的分子标志物,如血清标志物DCP(又称PIVKA-Ⅱ)、DNA基因或其突变标记(TP53、DNA甲基化以及HBV基因组A1762T及G1764A双突变和前S区突变等HBV进化特征)以及非编码RNA等。
1)腹部US:腹部US是《美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)肝胆肿瘤临床实践指南》和《原发性肝癌的分层筛查与监测指南(2020版)》的首选筛查技术。腹部US对于早期HCC(单个结节长径<5 cm 或2~3个结节且每个结节长径<3 cm)的灵敏度在不同研究中差异较大,在28%~89%的范围内浮动。综合各国数据的Meta分析显示,腹部US对于所有阶段HCC的整体灵敏度为84%,而对早期HCC的整体灵敏度仅为47%。使用造影剂可以进一步提高US诊断的灵敏度。比如,与传统腹部US比较,使用Kupffer对比增强US在HCV感染相关的肝硬化患者中进行原发性肝癌的筛查,其灵敏度可从65.4%提高至100%[215]。
2)AFP检测:血清AFP水平与肝癌病灶大小及血管侵袭程度有关,对早期肝功能正常及无血管侵袭的肝癌患者灵敏度较低,该项技术的灵敏度为39%~65%,特异度为76%~94%[233-235]。但是,血清AFP的影响因素众多,不仅受到疾病和妊娠等其他生理或病理因素的影响,也直接与肝癌肿瘤体积相关。特别是临床上有30%~40%的肝癌患者属于AFP阴性,因此存在一定的误诊率和漏诊率。在肿瘤长径<3 cm和>3 cm的肝癌患者中,AFP的检测灵敏度分别为25%和52%。可见,对于早期肝癌的灵敏度较低是限制AFP单一指标筛查价值的主要因素。
3)CT和MRI:现有研究显示,CT诊断肝癌的灵敏度为60%~75%,特异度为90%;CT和MRI对肿瘤长径<2 cm的患者,其灵敏度约为48%,肿瘤长径≥2 cm患者的可达到92%[236]。MRI具有较强的软组织分辨力,现已成为肿瘤早期诊断、术前评价及术后复发等方面的首选检查方法。利用MRI可以进行多方位、多参数成像,便于显示体内解剖结构和病变的空间位置及其相互关系,除可显示形态变化外,还能进行功能成像和生化代谢分析,能在分子水平上反映病理情况。美国肝病研究协会综合分析8项临床研究,结果显示,在使用钆塞酸二钠增强剂的情况下,MRI对各阶段肝癌的整体筛查灵敏度为87%,特异度可达94%,且对长径<1 cm的肝癌筛查能力优于增强CT[108]。
4)血清蛋白标志物:DCP(PIVKA-Ⅱ)与传统AFP检测比较具有更高的敏感度(分别为54%和42%)、特异度(分别为86%和83%)和阴性预测值(分别为80%和76%)[237]。因此,DCP(PIVKA-Ⅱ)在部分国家和地区如日本、韩国及印度被批准作为HCC的有效标志物[237]。根据我国多中心队列研究数据,以37.5 mAU/mL为界值时,DCP(PIVKA-Ⅱ)可以有效地从HBV慢性感染者中检出HCC患者,灵敏度和特异度分别为91.78%和96.30%[238]。磷脂酰基醇蛋白聚糖3(glypican 3,GPC-3)是一种存在于细胞膜表面的硫酸乙酰肝素糖蛋白,有研究显示,GPC-3检测肝癌的灵敏度为36%~65%,特异度为65%~100%,尤其对小肝癌的检测方面灵敏度优于AFP[239]。
5)新型分子标志物:新型分子标志物如HBV突变、ctDNA、肿瘤相关甲基化、非编码RNA等。HBV高危突变种类较多,集中在BCP区和preS区,典型的高危突变有BCP区A1762T及G1764A双突变,其灵敏度和特异度分别为80.0%和71.6%;preS区的C3116T,其灵敏度和特异度分别为65.4%和74.4%[240-241]。非编码RNA,包括miRNA和circRNA,在体内具有较高的稳定性,因此有作为血清学标志的潜力。如miR-130b、miR-150和miR-182的灵敏度和特异度均达80%以上,进行血液检测同时配合影像学检查,还能显著提高对包括<2 cm小肝癌在内的各种临床分型肝癌的诊断效能,以此降低漏诊率和误诊率[12]。circ_104075肝癌检测的灵敏度为96.0%,特异度为98.3%,也有可能作为HCC新的诊断生物标志物[242]。虽然新型标志物在单一研究中均体现出较高的准确性,但仍有待进一步大规模、多中心研究的确定。
(2)联合筛查技术的准确性:多种常规筛查技术联合、常规筛查技术与新筛查指标联合以及常规筛查技术与特定病因的特异性筛查技术联合是进一步提高筛查准确性和实现关口前移的有效策略。最基本的常规联合筛查技术是腹部US联合AFP检测[243],不仅保留了简便易行的优点,而且提高了灵敏度,是众多指南推荐的首选筛选技术,其对于所有阶段HCC检测的灵敏度可高达97%,对于早期HCC的灵敏度为63%,均优于单独使用腹部US。但是腹部US联合AFP检测特异度低于单独使用腹部US,对于早期HCC,单独使用腹部US和US联合AFP检测HCC的特异度分别为92%和84%[216]。此外,新型标志物可以联合组成检测标签,进一步提高准确性。基于新型标志物的联合筛查的准确性与传统筛查技术比较,目前尚未具备太大的优势,如由7种miRNA(miR-122、miR-192、miR-21、miR-233、miR-26a、miR-27a和miR-801)组成的HCC筛查试剂,其灵敏度和特异度可分别达到68.6%和90.1%[227]。部分基因组学研究显示了一系列对恶性肿瘤发生有重要作用的体细胞变异或表观遗传修饰事件,但是其重复性较低[225]。为克服这一局限,也可以采用多种标志物联合筛查的方法。一项纳入3793例无症状HBV携带者的前瞻性队列研究显示,与腹部US和AFP常规筛查比较,联合检测外周血液ctDNA突变、HBV整合、AFP和DCP可以提高HCC检出率[225]。在331例验证队列中,外周血液细胞游离DNA和蛋白标志物联合检测筛查早期HCC的灵敏度和特异度分别高达100%和94%[225]。一项基于ctDNA分子标签以测序的手段进行检测,在训练队列中的灵敏度和特异度分别为89.6%和78.9%,在验证队列中的灵敏度和特异度分别为82.7%和76.4%[244]。在同样人群中,基于ctDNA分子标签以测序的手段检测结果优于AFP筛查(AFP筛查的灵敏度和特异度分别为44.8%和76.1%)[244]。此外,通过进一步整合筛查技术,使用临床信息、传统指标以及新型标志物组建筛查模型,同样可显著提高筛查准确性,但是也局限于单一研究。
各筛查技术的准确性与肝脏肿瘤大小、位置以及操作员的技术经验等相关,目前针对肝癌筛查准确性较好的单一筛查技术有腹部US,其灵敏度为80%~90%,特异度为85%~95%,也是2021美国《NCCN肝胆肿瘤临床实践指南(V2)版》[233]和《原发性肝癌的分层筛查与监测指南(2020版)》[12]的首选筛查技术。联合筛查技术有AFP联合腹部US,灵敏度和特异度分别可高达85%~95%和80%~95%,是众多指南推荐的首选筛选技术,如《原发性肝癌诊疗规范(2019年版)》。各筛查技术虽然准确性不一,但在面对不同人群时有着不同的选择,在全人群中,US是一个准确性好且经济可行的简便筛查技术;而在高危人群中,可以进一步选择特异度较高的CT和MRI或联合筛查技术如AFP联合腹部US等。总之,针对肝癌联合筛查技术的准确性优于单一筛查技术,其余新型标志物以及新型联合检测方案仍有待进一步大规模、多中心研究的检验。
(3)肝癌筛查方案对死亡率的影响:有限的几项中有死亡率指标的报道,几乎均是针对肝癌高风险人群进行连续监测,在接受监测和未接受监测人群之间比较,并非一般意义上的基于普通人群的筛查效果(更多信息见肝癌监测方案的有效性)。文献检索显示,我国仅有1篇研究报道了严格意义上的肝癌人群筛查死亡率效果,该研究来自广东省中山市,基线为35~64岁的17 966人提供HBsAg检测,阳性者(2848人)每隔6个月进行US和AFP检测,以未接受肝癌筛查的50 544名入组居民作为对照,从筛查开始随访约5轮共4年后未观察到有统计学意义的肝癌死亡率改变,干预组和非干预组患者的死亡率分别为44.9/10万和36.2/10万(RR=1.04,95%CI:0.68~1.58)[194]。换言之,该研究的效果评价同时包含了对一般适龄人群的筛查(HBsAg检测)和进一步对高风险人群(HBsAg阳性者)的连续监测(每6个月1次的US和AFP检测),属于筛查和监测综合效果的体现;虽然随访时间不长,但已属我国在肝癌筛查效果评价领域少有的证据。
问题13:肝癌筛查技术的安全性
目前关于肝癌筛查安全性的研究较少,有待进一步评价(证据质量:低;推荐强度:弱)。
系统梳理现有证据,目前仅有2项病例系列研究[98,245]和1项RCT研究[144]报道了肝癌筛查的安全性结局,RCT研究报道了筛查组的安全性结局,未对非筛查组的安全性结局进行报道。3项研究均评价了在肝硬化人群中进行肝癌筛查的安全性,这些患者随访期间至少进行1次AFP或US筛查,随访2年或3年后,对筛查过程中因假阳性或筛查结果不确定而进一步通过CT、MRI、肝脏活检等确诊过程中遭受一定生理伤害的发生率进行统计。对3项研究进行Meta分析结果显示,共纳入2293例肝硬化患者,生理伤害发生率为21%(95%CI:8%~33%),各研究之间存在很大异质性(I2=98.5%)[98,144,245]。3项研究的筛查人群、筛查措施、筛查间隔等相同,所以仅以研究国家为分组因素进行亚组分析,异质性显著降低。美国的2个病例系列研究中,其亚组的生理伤害发生率为26%(95%CI:24%~29%,I2=0)[98,245],澳大利亚RCT研究中,生理伤害发生率为9%(95%CI:6%~11%)[144]。提示不同国家可能由于筛查技术、诊断技术等的差异而导致生理伤害发生率不同。未发现来自我国的研究评价了肝癌筛查的安全性结局。
问题14:肝癌筛查在我国人群中的经济性
我国人群开展肝癌筛查的经济学证据仍有限,初步提示AFP或HBsAg检测初筛评估出高风险人群后再行US可能具有成本效果,但整体经济性待进一步明确(证据质量:低;推荐强度:中)。
本指南通过检索PubMed、Ovid、Embase、Web of Science、Scopus、中国知网、万方知识服务平台、维普资讯网、中国生物医学文献数据库,搜集肝癌筛查技术卫生经济学评价研究文献,同时追溯纳入研究的参考文献,以补充获取相关文献,开展系统评价,共纳入了4项肝癌筛查技术卫生经济学评价研究,均为国内研究。经过系统评价,最终纳入4篇[246-249]针对中国一般人群肝癌筛查技术的卫生经济学研究。有2项[247-248]采用US联合AFP检测进行筛查的研究。1项2016年杭州市研究结果显示,每筛出1例阳性者成本为84 078.55元,成本效用比为每获得1个质量调整寿命年花费6 347.95元[247]。2012年金昌市研究显示,每筛出1例可疑肝癌成本为30 211.53元,每筛出1例肝癌癌前病变成本为43 944.04元[248]。有2项[246,249]初筛评估出高危人群后再行US的研究。2012年中山市研究采用ELISA法检测HBsAg作初筛,然后对阳性人群进一步检测AFP及US,结果显示,每筛查1例阳性者成本为43 824.99元;每检出1例肝癌的成本为80 345.81元[246]。2016年我国台湾地区学者运用马尔可夫模型对肝癌高发区人群分别模拟两阶段筛查[利用生物标志物HBsAg、抗HCV抗体、天冬氨酸氨基转移酶、丙氨酸转氨酶(alanine aminotransferase,ALT)和AFP初筛,再对初筛后的高危人群进行1年1次的US筛查]和全人群大规模1年1次的US筛查,结果显示,与不筛查比较,两种筛查技术每增加1个质量调整寿命年的成本分别为49 733美元和39 825美元,两种筛查技术的增量成本效果比均高于台湾人均国民生产总值的2倍(33 000美元);与两阶段筛查比较,大规模US筛查更具成本效果,尤其是初始筛查年龄为50岁,2年1次的方案[249]。综上,目前我国一般人群肝癌筛查的经济学证据很有限,还需要相关的卫生技术经济学评价研究证据,才能得出较为肯定的结论。
问题15:肝癌筛查在我国人群的可获得性
我国人群肝癌筛查的可获得性整体较低,主要体现在筛查覆盖率;筛查参与率存在项目人群间差异且影响因素证据有限,主观接受度尚可提示潜在客观需求(证据质量:中;推荐强度:弱)。
参照IARC对恶性肿瘤筛查可获得性评价涉及的具体内容和指标[101-102],包括当地相关政策方案、覆盖率、筛查参与率及影响因素、接受度、公平性等,通过系统综述方法,结合核心文献或论著、官网、方案报告等渠道,对我国人群肝癌筛查及监测相关指标进行系统整合评估[11]。文献检索最终纳入的报道多为地方性肝癌筛查参与率分析,更多信息来自其他渠道。结果提示,中央财政支持的3项国家级重大公共卫生服务项目(农村癌症早诊早治项目、淮河流域癌症早诊早治项目、城市癌症早诊早治项目)均在特定地区和年龄段有针对一般风险人群的肝癌筛查方案推荐及实践评价[4-10](表8)。筛查覆盖率主要指肝癌筛查(若为串联筛查方案,则指初筛)的人群覆盖率,需明确接受初筛的人数及对应年龄段人口数;上述3项国家级重大公共卫生服务项目提供的组织性筛查在全国2019年35~74岁人群中的覆盖率据估计约为0.09%[11];针对肝癌的个体机会性筛查和单位组织体检等运行形式暂无信息支持。本指南所提及的筛查参与率特指实际参加复筛人数占初筛阳性人数的百分比,在部分研究报告中表示为依从率。分析显示,因项目模式不同,整体筛查参与率(参加复筛人数÷初筛阳性人数×100%)为37.5%~62.3%,系统文献仅纳入1篇影响因素报道。全国大样本分析提示,城市肝癌高危人群对AFP检测联合US筛查的主观接受度为99.3%[250-251]。系统文献未检出公平性相关报道。更多方法学、纳入文献及分析结果见详细报道[11]。总之,与我国其他常见恶性肿瘤比较,肝癌筛查技术服务目前的可获得性整体较低,主要体现在人群覆盖率,可能与肝癌筛查效果的局限性有关,也尚无大规模机会性筛查开展。筛查率存在项目和人群差异,需要更多相关影响因素研究,较高的主观接受度提示潜在的客观需求。
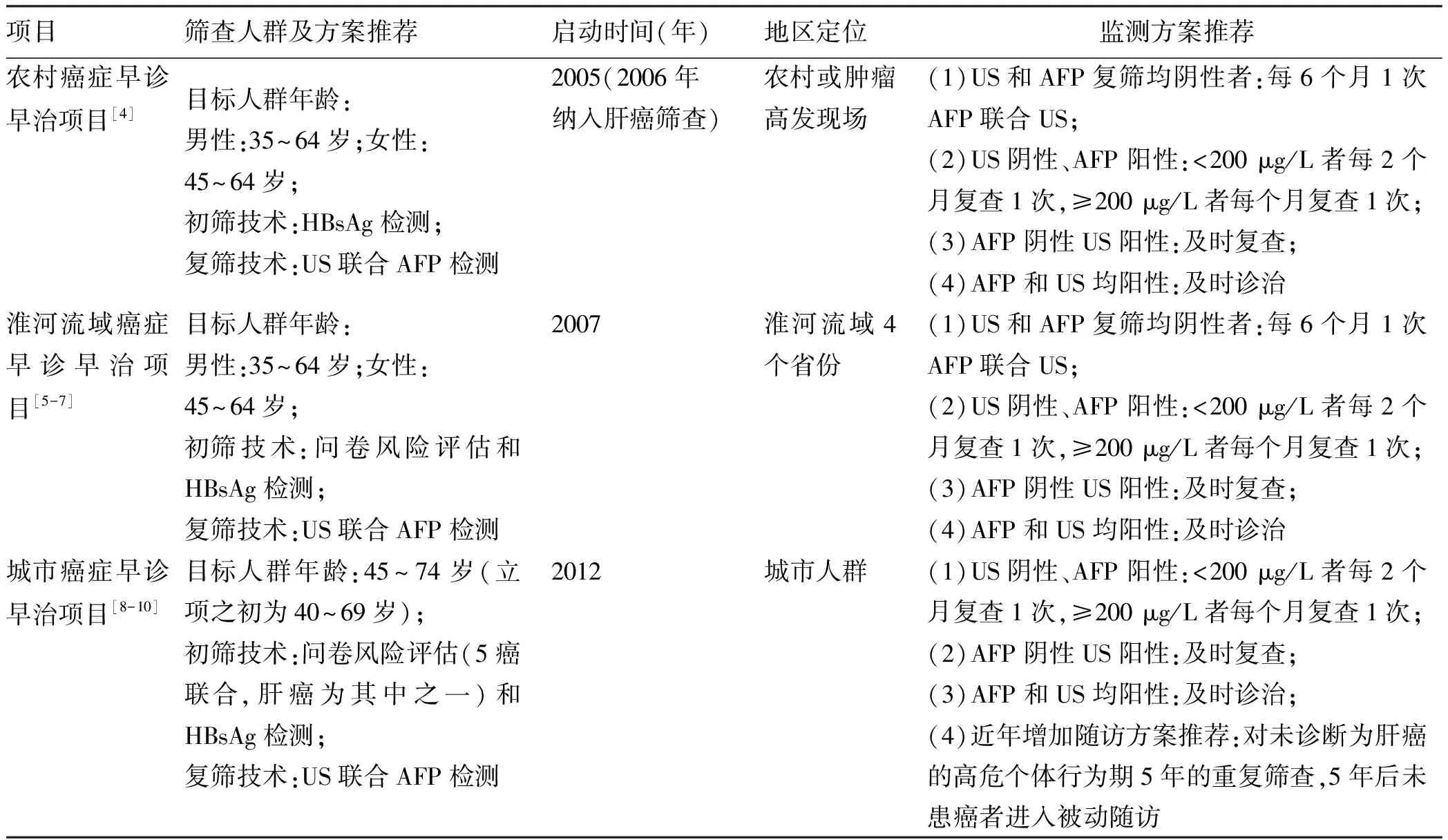
表8 我国人群现行主要肝癌筛查与监测方案推荐Table 8 Current recommended strategies for liver cancer screening and surveillance in populations in China
3.6 监测方案
推荐意见:综合肝癌高风险人群监测的有效性、安全性、可及性和经济性等多维度证据,推荐在我国人群中使用US联合AFP检测作为监测技术,监测间隔12个月,其中对慢性肝病(包括肝硬化、慢性肝炎等)患者推荐监测间隔为6个月。
问题16:肝癌常用监测方案
US、US联合AFP检测为目前常用的肝癌监测技术,对于高风险人群的监测间隔证据较少;其中慢性肝病(包括肝硬化、慢性肝炎等)患者评价监测间隔有6个月、12个月及以上,其中以6个月多见;CT(特别是增强CT)或MRI监测间隔可适当延长(证据质量:中;推荐强度:弱)。
(1)监测目标人群:系统梳理关于肝癌监测有效性的文献,仅有4篇RCT研究[141-144]和52篇队列研究[136,145,147,150-151,153,155-156,158,160-163,167-168,170-171,173-174,176-189,191-195,
197-200,202-209,211-212]比较了监测与非监测的肝癌死亡率、肝癌患者1、3、5年生存率、中位生存时间、早期肝癌检出率。目前的肝癌监测只针对乙型肝炎、丙型肝炎、肝硬化、慢性肝炎、慢性肝病等肝癌高危人群进行监测。不同肝癌高危人群中,分别对比监测效果,未发现差异有统计学意义。综上,目前证据提示对乙型肝炎、丙型肝炎、慢性肝炎、肝硬化、慢性肝病患者进行肝癌监测有一定的检测效果。其中有3篇RCT研究来自我国,筛查人群均为乙型肝炎人群,均显示筛查组患者肝癌1、3、5年生存率高于非筛查组,且筛查组肝癌死亡率低于非筛查组[141-143]。
(2)不同监测间隔比较:系统梳理现有证据,共有8篇文献比较了不同监测间隔的监测效果,包括2篇RCT研究[252-253]和6篇队列研究[254-259],监测措施均为US。RCT研究分别比较了3个月和6个月监测间隔以及4个月和12个月的监测间隔;6篇队列研究中,5篇队列研究[254-255,257-259]比较了6个月和12个月监测间隔的监测效果,1篇队列研究[256]比较了≤12个月和>12个月监测间隔的监测效果。文献发表时间为2002年—2020年,研究主要来自欧洲。按监测人群分类,监测人群为肝硬化的文献占66.7%,慢性肝病(包括肝硬化、慢性肝炎)占22.2%,慢性肝炎(各种原因引起的慢性肝炎患者)占11.1%。按Child-Pugh C级比例分类,Child-Pugh C级比例<10%的文献占44.4%,Child-Pugh C级比例≥10%的占22.2%。男性比例为35.9%~79.26%,平均年龄为37~68岁。1)3个月监测间隔和6个月监测间隔:2011年发表的RCT研究比较了在法国肝硬化人群中进行3个月1次的US监测和6个月1次的US监测的有效性。3个月组纳入640例肝硬化患者,6个月组纳入680例肝硬化患者,随访5年后,3个月组确诊53例肝癌,6个月组确诊70例肝癌,结果显示,两组之间的早期肝癌检出率(RR=1.18,95%CI:0.97~1.42)和肝癌死亡率(RR=0.87,95%CI:0.65~1.18)差异均无统计学意义[252]。此外,来自我国台湾地区的1项RCT研究[253]比较了4个月和12个月监测间隔的效果,纳入人群为40岁以上,血小板计数≤150×109/L,HBsAg阳性或HCV抗体阳性,两组人群分别为387和357人,4年随访结果表明,4个月组和12个月组生存率(分别为61.5%和38.5%)差异无统计学意义(P=0.399)。2)6个月监测间隔和12个月监测间隔:共有5个回顾性队列研究[254-255,257-259]比较了6个月1次的US监测(20 210例肝癌患者)和12个月1次的US监测(6123例肝癌患者)的有效性结局。本指南Meta分析结果显示,6个月组早期肝癌检出率显著高于12个月组(RR=1.17,95%CI:1.08~1.26,I2=0),5年生存率也显著高于12个月组(RR=1.39,95%CI:1.07~1.82,I2=63.8%),中位生存时间显著长于12个月组(MSR=1.30,95%CI:1.28~1.31,I2=0);6个月监测间隔的监测效果优于12个月的监测间隔,提示6个月可能为使用US进行肝癌监测的最佳监测间隔。来自我国的队列研究[254]比较了在慢性肝病患者中使用6个月1次的US监测和12个月1次的US监测早期肝癌检出率,结果显示,6个月间隔组的早期肝癌检出率高于12个月间隔组。3)≤12个月监测间隔和>12个月监测间隔:国外学者在2015年发表的1项队列研究[256]比较了在加拿大肝硬化人群中进行≤12个月1次的US监测(97例肝癌患者)和>12个月1次US监测(38例肝癌患者)的有效性,文章中未提供监测人数,结果显示,≤12个月组早期肝癌比例高于>12个月组(RR=1.53,95%CI:1.26~1.87)。
(3)不同监测措施比较:仅有3篇RCT研究[217,260-261]和2篇队列研究[262-263]对不同监测措施的有效性和安全性进行了比较,研究对象分别来自美国、韩国、日本。由于纳入文献少,不同的文献比较了不同的监测措施,无法进行合并,所以仅进行描述分析。结果如表9所示,来自美国的RCT研究对肝硬化人群进行6个月1次US监测和12个月1次CT监测,两组间肝癌死亡率和早期肝癌检出率差异无统计学意义[260]。来自韩国的RCT研究对肝硬化人群进行6个月1次US监测和6个月1次MRI监测,US监测组的早期肝癌检出率低于MRI组,但未报到肝癌死亡率以及其他结局[261]。日本的RCT研究对肝硬化人群进行4个月1次超声造影(contrast-enhanced US,CEUS)和4个月1次B型US监测,CEUS监测组的早期肝癌检出率略高于B型US组,但未报到肝癌死亡率以及其他结局[217]。来自韩国的2项队列研究分别对肝硬化、乙型肝炎人群进行6个月1次US和6个月1次US联合12个月1次CT监测,联合US和CT监测组的早期肝癌检出率高于US组,但未报道肝癌死亡率以及其他结局[262-263]。
问题17:肝癌监测方案的有效性
采用US或US联合AFP检测,以每6个月或6~12个月为间隔的肝癌监测方案,能提高肝癌高风险人群的早期肝癌检出率和生存率,可能会降低肝癌死亡率,证据有限待进一步评价(证据质量:中;推荐强度:弱)。
共有4篇RCT研究[141-144]和52篇队列研究[136,145,147,150-151,153,155-156,158,160-163,167-168,170-171,173-174,176-189,191-195,197-200,202-209,211-212]比较了肝癌监测与非监测的有效性结局,有效结局包括早期肝癌检出率、肝癌患者1、3、5年生存率和中位生存时间、肝癌死亡率。其中4篇RCT研究[141-143,194]和4篇队列研究[195,203-204,212]比较了我国监测人群和非监测人群的有效性。文献发表时间为1990年—2021年,研究国家和地区主要以美国、欧洲为主,监测措施有单独用US监测、AFP和US联合监测、用AFP或US监测;监测间隔以6个月为主;目前的研究只对乙型肝炎、丙型肝炎、肝硬化、慢性肝炎、慢性肝病等肝癌高危人群进行监测。仅有20.7%的文献调整了领先时间偏倚。按Child-Pugh C级所占比例分类,Child-Pugh C级比例<10%文献的占14.3%,Child-Pugh C级比例≥10%的占10.9%,57.8%的文献未提供肝功能分级情况;监测人群男性占比为25.5%~100%,平均年龄为41.2~80.2岁。
(1)早期肝癌检出率:共有4项RCT研究[141-144]和37项队列研究[145,147,149-151,153,155-156,158,160-163,167-168,170-171,173-174,176-189,191-194]比较了监测和非监测组的早期肝癌检出率。基于纳入RCT研究的Meta分析结果显示,与非监测组比较,监测组早期肝癌检出率高于非监测组(RR=2.39,95%CI:1.58~3.61,I2=57.2%)。队列研究的Meta分析结果显示,监测组患者的早期肝癌检出率高于非监测组(RR=2.28,95%CI:2.08~2.49,I2=81.5%)。RCT研究和队列研究均显示,监测组肝癌患者的早期肝癌检出率高于非监测组,纳入的研究之间存在较大的异质性。3项RCT研究[141-143](来自我国)比较了接受监测和非监测的乙型肝炎人群中早期肝癌检出率,合并的Meta分析结果显示,监测组早期肝癌检出率高于非监测组(RR=2.66,95%CI:1.77~4.06,I2=50.0%)。
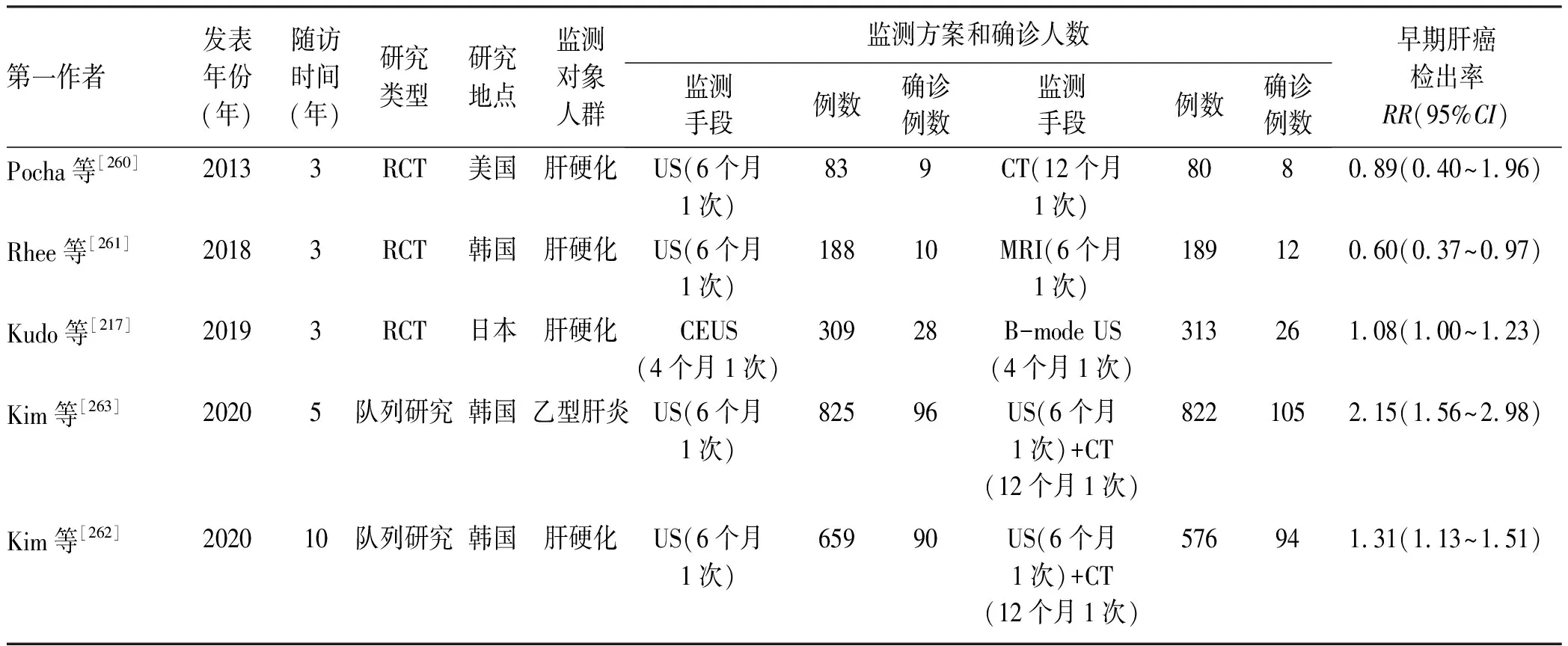
表9 不同肝癌监测方案的早期肝癌检出率效果Table 9 Comparison of the early detection rate of liver cancer among different surveillance strategies
(2)生存率
1)1年生存率:共有4项RCT研究[141-144]和17项队列研究[150,153,168,180-181,185-188,191,195,197-200,202-203]比较了监测和非监测组肝癌患者的1年生存率。RCT研究的Meta分析结果显示,与非监测组比较,监测组肝癌患者1年生存率高于非监测组(RR=1.72,95%CI:1.13~2.61,I2=72.5%)。队列研究的Meta分析结果显示,监测组肝癌患者1年生存率高于非监测组(RR=1.43,95%CI:1.32~1.55,I2=57.3%)。RCT研究和队列研究均显示,监测组肝癌患者1年生存率高于非监测组,研究之间存在一定异质性。3项RCT研究[141-143](来自我国)对乙型肝炎人群进行了监测,Meta分析结果显示,监测组肝癌患者1年生存率高于非监测组(RR=2.01,95%CI:1.54~2.62,I2=0)。2篇队列研究(来自我国)分别比较了乙型肝炎(RR=1.59,95%CI:1.26~2.10)、慢性肝炎患者(RR=1.88,95%CI:1.52~2.31)监测和非监测的1年生存率,结果均显示,监测组患者1年生存率高于非监测组[195,203]。
2)3年生存率:共有3项RCT研究[141-143]和24项队列研究[145,150,153,162-163,168,174,176,178,180-182,185-186,188-189,191,195,198-199,202,204-206]比较了监测和非监测组肝癌患者3年生存率。3项RCT研究均来自我国,RCT研究的Meta分析结果显示,与非监测组比较,监测组肝癌患者3年生存率高于非监测组(RR=2.86,95%CI:1.78~4.58,I2=10.1%)。队列研究的Meta分析结果显示,监测组肝癌患者3年生存率高于非监测组(RR=1.58,95%CI:1.42~1.77,I2=71.4%)。RCT研究和队列研究均显示,监测组肝癌患者3年生存率高于非监测组。有2篇队列研究[195,204](来自我国)分别比较了乙型肝炎(RR=2.49,95%CI:1.60~3.90)、慢性肝炎(RR=1.73,95%CI:1.39~2.16)监测和非监测肝癌患者的3年生存率,结果均显示,监测组3年生存率高于非监测组。但纳入的RCT研究仅3篇,队列研究之间存在较大的异质性。
3)5年生存率:共有3项RCT研究[141-143]和11项队列研究[145,168,171,178,180-181,185-186,195,198,202]比较了监测和非监测组的肝癌患者的5年生存率。3项RCT研究均来自我国,RCT研究的Meta分析结果显示,与非监测组比较,监测组肝癌患者5年生存率高于非监测组(RR=2.76,95%CI:1.37~5.54,I2=28.3%)。队列研究的Meta分析结果显示,监测组肝癌患者5年生存率高于非监测组(RR=1.62,95%CI:1.46~1.80,I2=18.2%)。RCT研究和队列研究均显示,监测组肝癌患者5年生存率高于非监测组,纳入的研究之间异质性较小。
4)中位生存时间:18项队列研究[136,147,153,158,178,180,183-185,188,
199-200,202-203,207-210]比较了接受监测组和非监测组患者的中位生存时间。采用MSR效应量进行中位生存时间的Meta分析,结果显示,监测组肝癌患者中位生存时间长于非监测组(MSR=2.77,95%CI:1.84~2.81,I2=98.7%)。由于各研究间异质性比较大,所以采用定性描述的方法对监测组和非监测组肝癌患者中位生存时间进行总结,结果显示,各个研究监测组与非监测组的MSR均>1,提示虽然各研究之间存在很大的异质性,但监测组肝癌患者的中位生存时间长于非监测组。未发现来自我国的研究比较了监测和非监测组肝癌患者的中位生存时间。
(3) 肝癌死亡率:来自中国人群的有关肝癌监测死亡率下降效果的证据有限,仅检出2项RCT研究[142-143]和3项队列研究[194,204,212]。然而,证据级别较高的2项RCT研究结果不一致,1项评价了每6个月1次的AFP监测方案并随访7年,但结果提示两组人群死亡率相似且差异无统计学意义(RR=0.83,95%CI:0.68~1.03)[142];另1项提示每6个月1次的US联合AFP的监测方案(随访5年)可使肝癌死亡率降低37%(RR=0.63,95%CI:0.41~0.98)[143]。另外3项队列研究中,1项来自广东省中山市的研究是基线使用HBsAg检测,对阳性者每隔6个月行AFP检测和US,与通过肿瘤登记匹配完全无干预的人群比较,随访4年后未观察到有统计学意义的肝癌死亡率改变(RR=1.04,95%CI:0.68~1.58)[194];另外2项研究来自我国台湾地区,采用US对系列血清标志物等指标判断为高风险的个体进行US监测,其中随访7年研究显示,两组间差异无统计学意义(RR=0.59,95%CI:0.29~1.20)[204,212];随访3年但样本量更大的研究显示,US监测可降低31%的肝癌死亡率(RR=0.69,95%CI:0.56~0.84)[212],详见表10。此外,一项美国RCT研究在肝硬化患者中比较了每6个月1次的US和每年1次的CT监测方案,但两组肝癌死亡率的下降差异无统计学意义(P=0.46)[260]。因关于肝癌死亡率的原始研究较少,未进一步进行亚组分析、敏感性分析、发表偏倚分析等。
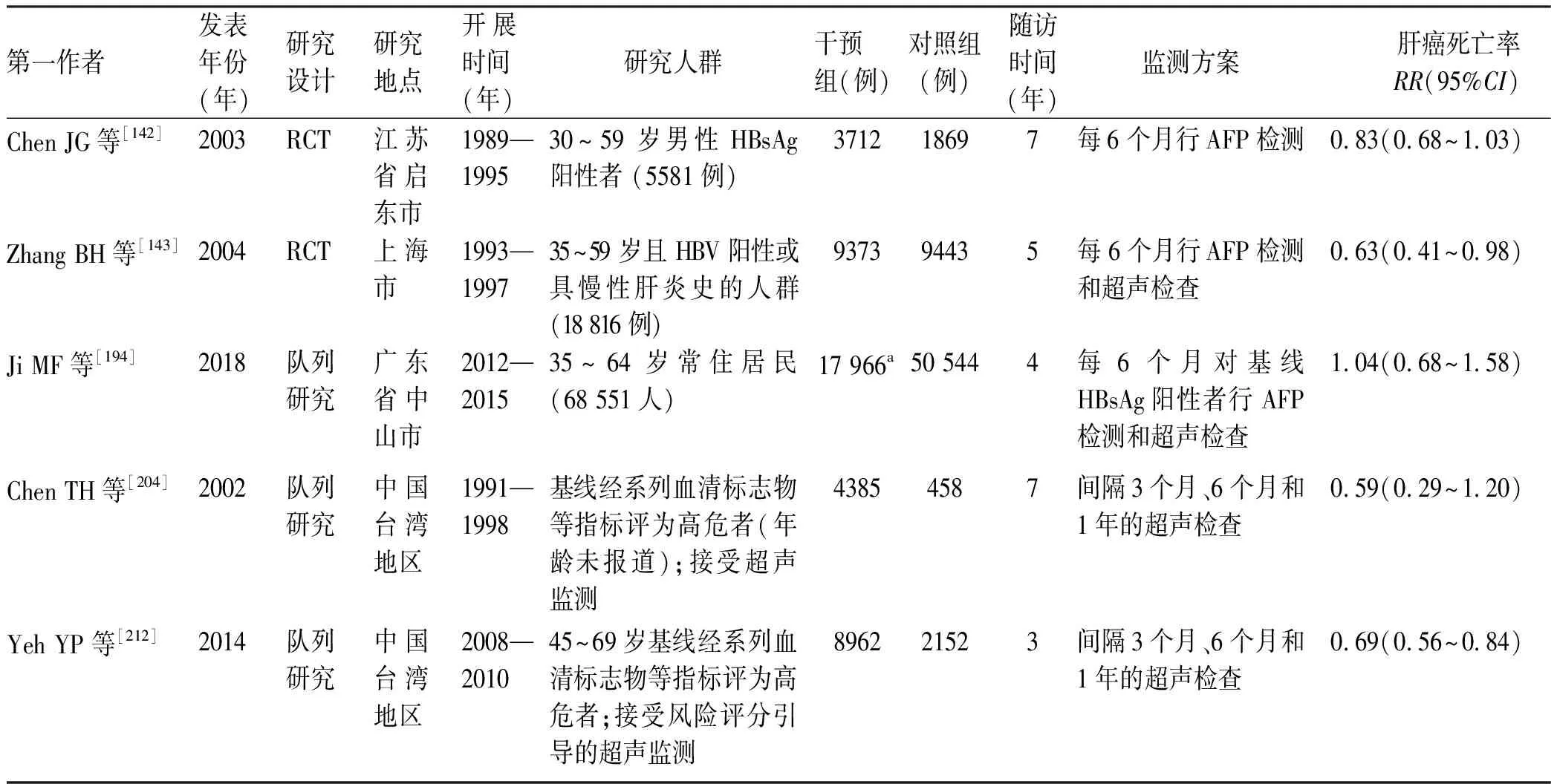
表10 我国人群中开展的肝癌监测效果评价:以肝癌死亡率为指标Table 10 Effectiveness of liver cancer surveillance in the Chinese population: taking mortality rate of liver cancer as an indicator
问题18:肝癌高风险人群监测在我国的可获得性
国家级早诊项目针对肝癌高危个体的监测方案有明确推荐,当前肝癌监测依从率整体不高且差异大,可获得性证据整体仍有限(证据质量:中;推荐强度:弱)。
本指南采用与肝癌筛查可获得性同样的文献检索和信息分析方法[11],参照IARC对癌症监测可获得性评价涉及的当地相关政策方案、监测依从率及影响因素、接受度、公平性等系列指标进行证据整合。系统文献检索最终纳入6篇期刊论文[142,264-268],均为地方性肝癌监测依从率报道,更多信息来自其他渠道。与肝癌筛查可获得性类似,中央财政转移支付支持的3项癌症早诊早治项目均针对筛查发现不同高风险人群有明确的监测方案推荐。监测依从率一般指实际按推荐方案接受监测的高危个体人数占应监测人数的百分比,其在纳入6项研究的中位数[M(Q1,Q3)]为26.9%(23.5%,41.0%),最小值和最大值分别为16.5%和54.2%。农村癌症早诊早治项目、淮河流域癌症早诊早治项目、城市癌症早诊早治项目这三大国家重大公共卫生服务项目未见监测依从率及影响因素报道;上述6篇中仅1篇报道了影响因素,结果提示,医务人员督促对监测依从率有显著影响[266]。影响肝癌监测效果的后续重要环节是肝癌治疗率,特指实际治疗例数占应治疗例数的百分比。文献研究提示,仅农村癌症早诊早治项目常规分析报道肝癌治疗率,经过筛查监测发现并进一步诊断的肝癌患者治疗率在90%以上[269]。系统综述未检出肝癌监测接受度和公平性相关文献。更多肝癌监测可获得性分析方法结果见详细报道[11]。综上,目前我国主要公共卫生服务项目的肝癌早诊早治方案中均有具体高危个体监测方案推荐,散在报道提示监测依从率整体不高且研究间差异大,治疗率较高,但整体相关细化指标报道信息非常有限。
问题19:肝癌高风险人群监测在我国的经济性
我国肝癌高风险人群监测的经济学评价中,以每6个月或每年1次的US联合AFP检测方案最常见,该方案与不监测比较可能具有成本效果(证据质量:中;推荐强度:强)。
本指南通过检索PubMed、Ovid、Embase、Web of Science、中国知网、万方知识服务平台、维普资讯网、中国生物医学文献数据库,查询肝癌高危人群监测策略的经济学评价研究文献,同时追溯纳入研究的参考文献,以补充获取相关文献,开展系统评价。文献检索显示,5项国内研究[270-274]涉及慢性乙型肝炎或丙型肝炎感染者监测方案的经济学评价。张博恒和杨秉辉[270]从卫生决策者角度进行成本效果分析,结果显示,每半年1次US联合AFP监测与不监测相比的增量成本效果比为1775元(小于1993年—1997年人均国内生产总值),具有高的成本效果。邱永莉等[271]研究显示,发现1例肝癌的总成本、间接成本和直接成本分别为575 077、544 556和30 521元。中国台湾地区的一项研究从当地政府角度进行了成本效果和成本效用分析,研究结果显示,与不监测比较,对慢性HBV或HCV携带者进行每半年1次生化检测联合US监测方案具有成本效果[273]。中国香港的一项研究表明,与不监测比较,对慢性HBV携带者进行AFP、US或AFP联合US等监测方案均具有成本效果[272]。中国台湾地区的一项研究从医疗保险角度进行成本效果分析,研究结果显示,与不监测比较,对慢性HBV携带者每年1次US监测也具有成本效果[274-275]。两项国内研究涉及肝硬化患者监测方案的经济学评价[274]。陈琪萍等[275]将每半年1次MRI结合使用钆塞酸二钠监测与每半年1次US监测进行比较,结果显示对于肝硬化患者,每半年1次US监测优于每半年1次MRI监测,且灵敏度分析结果显示当肝癌发病率达到17.8%时,MRI监测和US监测的成本-效果比才趋于相同。我国台湾地区的研究也显示,对肝硬化患者每3个月1次US监测相较于慢性HBV携带者每年1次US监测更具有成本效果[274]。国外研究显示,对于慢性乙型肝炎或丙型肝炎感染者,与不监测比较,每半年1次AFP联合US监测具有成本效果[276-280]。与每半年1次US监测比较,对慢性乙型肝炎患者每半年1次AFP联合US监测更具有成本效果[281-282]。对于肝硬化患者,与不监测比较,每半年1次AFP联合US监测[283-285]和每半年1次US监测[286-288]均具有成本效果。一项美国研究表明,对肝硬化患者每半年1次AFP联合US监测优于每半年1次US监测[289]。一项韩国研究表明,对肝硬化患者每半年1次MRI监测可能比每半年1次US监测更具有成本效果[290],但也有相反研究结果的报道[283,291]。
3.7 实施相关情况
问题20:我国肝癌筛查模式及实施机构
我国现行涉及肝癌筛查的国家公共卫生服务项目均为人群组织性筛查,面向特定范围和(或)区域的适龄社区居民,由中央财政支持。
我国现行的三大国家级重大公共卫生服务项目(农村癌症早诊早治项目、淮河流域癌症早诊早治项目和城市癌症早诊早治项目)均为人群组织性筛查且均包括肝癌筛查,面向特定范围和(或)区域的适龄社区居民,由中央财政经费持续支持,主管单位为国家卫生健康委员会,国家级技术管理单位分别为国家癌症中心、中国医学科学院肿瘤医院(淮河流域癌症早诊早治项目和城市癌症早诊早治项目)、中国癌症基金会(农村癌症早诊早治项目),具体实施单位为各省、直辖市、自治区的省市区县组织网络,各项目现场间会有差异(如具体管理和技术指导单位有地方肿瘤医院也有地方疾控中心)。三大公共卫生服务项目每年有一定的筛查任务量(为考核项目完成度的首要指标),包括首次参加项目者以及前期筛查异常需监测或随访者,随着项目推进,随访者数量整体逐年增加。国家癌症中心组织编写、2021年出版的《中国人群癌症筛查工作指导手册》主要就城市癌症早诊早治项目情况介绍了筛查组织、人群随访、数据样本管理等详情[10]。淮河流域癌症早诊早治项目和农村癌症早诊早治项目的公开信息有限。文献检索未检出针对肝癌的全国性机会性筛查等其他模式报道,但其他更成熟的筛查癌种为肝癌模式发展提供了参考,如子宫颈癌和乳腺癌被纳入国家基本公共卫生服务项目,上消化道癌正在推行的机会性筛查等,预期将在人群覆盖率、筹资模式、机构参与多样性、组织动员灵活性等方面产生不同效果。
问题21:肝癌筛查及监测质量控制
(A)肝脏US应由有经验、培训合格的主治及以上医师进行操作(证据质量:中;推荐等级:强);
(B)应采用标准切面对全肝进行规范扫查(证据质量:中;推荐等级:强);
(C)血液标本采集后应尽快分离血清或血浆上机检测;不能立刻检测的应置2~8℃冰箱冷藏(<24h);不能24h内检测的标本应存于-20℃冰箱;需长期贮存的标本应置于-70℃冰箱(证据质量:中; 推荐强度:中);
(D)实验室应建立质量控制策略及规则,定期参加省级及以上部门组织的室间质量评价;室内质控至少应包括阴性(低值)和阳性[低值阳性和(或)高值阳性]两个水平的质控物(证据质量:中;推荐强度:中);
(E)实验检测人员应具有相应专业资质,接受过培训,熟练掌握检测流程。实验检测设备定期校准,由专人做好维护和保养(证据质量:低;推荐强度:中)。
(1)US:US具有操作者高度依赖性。有研究通过对专科放射医师、非放射医师、非医师执业者留存的肝脏US图像质量进行评估,结果显示,失败率分别为6.4%、20.8%和21.4%;专科放射医师留存的图像质量明显优于非放射医师(P=0.000 1)和非医师执业者(=0.000 4)[292]。实操病例数多的医师检查的完整性优于实操病例数少的医师(P<0.000 1)[293]。一项关于US在肝硬化患者中早期HCC检出效能的Meta分析显示,US检出早期HCC的合并灵敏度仅为63%(95%CI:49%~76%)[234]。然而,另一项包含1432例患者的日本队列研究结果显示,由技术高超的操作医师进行的肝癌监测发现的肿瘤平均长径为(1.6±0.6)cm,仅有不到2%的病灶长径>3 cm[294]。若对基层医师进行专题培训后,通过US筛查发现HCC的比例可由31.6%提升至55%[295]。因此,参考欧洲肝病研究学会和欧洲癌症研究治疗组织联合制定的HCC管理指南,推荐肝癌筛查US应该由经过专业培训的、有经验的专科医师来实施[296]。按标准切面规范扫查能有效地保障探查整个肝脏,最大限度地减少遗漏[292,297]。一项包含155例在定期监测过程中确诊肝癌的回顾性研究显示,当全肝扫查不充分时更易导致筛查结果的失败(分别为50.0%和19.4%,Milan标准P=0.046)[298]。标准切面扫查的重要性虽无临床RCT的支持,但一项关于现场教学对HCC筛查质量的价值研究显示,现场教学前、后的筛查质量评分分别为61.7和82.7分(P<0.001);以标准切面图像的评分提升最为显著(P<0.001),对标准切面认知不足是导致筛查质量不佳的主要原因[299]。
(2)实验室检测:有证据显示标本因素是影响检验质量最重要的因素,包括血液标本的正确采集、血清和血浆的分离以及保存条件等[300-301]。实验室建立完善的质量管理体系,参加室间质评和开展室内质量控制是保证检验结果可靠性的重要环节。检验质量控制的全过程应涵盖人的要素、设备要素以及试剂耗材等要素[300-302]。一项基于我国6大区农村和城市社区,共入组表观健康成年个体18 000人的研究结果显示,不同品牌检测系统所采用的抗体针对肿瘤标志物的抗原靶点不同,抗体来源及包被方式不同,所采用的校准品的溯源性不同以及仪器检测原理等方面的差异等导致肿瘤标志物的检测结果和参考区间在不同检测系统间存在差异[303-304]。
指南制定总顾问:赫捷(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、沈洪兵(南京医科大学公共卫生学院 肿瘤个体化医学省部共建协同创新中心)
指南制定专家组(按姓氏汉语拼音字母排序):毕新宇(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、蔡建强(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、曹广文(海军军医大学)、陈磊(海军军医大学东方肝胆外科医院 国家肝癌科学中心)、陈万青(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、陈煜(首都医科大学附属北京佑安医院)、段钟平(首都医科大学附属北京佑安医院)、高春芳(海军军医大学东方肝胆外科医院)、姜晶(吉林大学第一医院)、李霓(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、李肖(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、刘运泳(中国医学科学院肿瘤医院深圳医院)、娄金丽(首都医科大学附属北京佑安医院)、鲁凤民(北京大学基础医学院)、南月敏(河北医科大学第三医院)、牛俊奇(吉林大学第一医院)、彭绩(深圳市慢性病防治中心)、曲春枫(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、石洁(上海东方肝胆医院)、石素胜(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、宋咏梅(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、孙凤(北京大学公共卫生学院)、孙喜斌(河南省肿瘤医院)、王华明(航天中心医院)、王慜杰(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、王勇(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、吴泓(四川大学华西医院)、徐志坚(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、叶慧义(解放军总医院第一医学中心)、赵景民(解放军总医院第五医学中心)、赵心明(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、庄贵华(西安交通大学医学部公共卫生学院)
指南制定专家组组长:陈万青(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)
指南制定专家组副组长:李霓(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)
指南制定工作组(按姓氏汉语拼音字母排序):曹骥(广西医科大学附属肿瘤医院)、曹毛毛(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、曹梦迪(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、曹素梅(中山大学肿瘤防治中心)、曹巍(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、樊春笋(启东市人民医院 启东肝癌防治研究所 南通大学附属启东医院)、龚继勇(山东第一医科大学附属肿瘤医院 山东省肿瘤医院)、何思怡(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、黄育北(天津医科大学肿瘤医院)、蒋丽娜(解放军总医院第五医学中心)、雷林(深圳市慢性病防治中心)、李贺(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、李纪宾(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、李江(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、李燕婕(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、乔良(四川省肿瘤医院 四川省癌症防治中心)、石菊芳(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、宋冰冰(哈尔滨医科大学肿瘤防治研究所 黑龙江省癌症中心)、宋词(南京医科大学公共卫生学院)、孙殿钦(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、王鑫(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、王宇婷(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、魏志成(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、吴燕华(吉林大学第一医院)、席云峰(内蒙古自治区综合疾病预防控制中心)、夏昌发(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、夏茹意(西安交通大学医学部公共卫生学院)、谢辉(解放军总医院第五医学中心)、严鑫鑫(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、颜仕鹏(湖南省肿瘤医院 中南大学湘雅医学院附属肿瘤医院)、杨继春(北京大学公共卫生学院 中国医学科学院北京协和医学院群医学及公共卫生学院)、杨雷(北京大学肿瘤医院)、殷建华(海军军医大学流行病学教研室)、查振球(安徽省疾病预防控制中心)、张韶凯(郑州大学附属肿瘤医院)、张永贞(山西省肿瘤医院)、赵菲(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、周金意(江苏省疾病预防控制中心)
指南制定工作组组长:石菊芳(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)
执笔人:陈万青(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、李霓(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、曲春枫(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、石菊芳(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院)、孙凤(北京大学公共卫生学院)、姜晶(吉林大学第一医院)、曹广文(海军军医大学)、庄贵华(西安交通大学医学部公共卫生学院)
本指南制定受国家卫生健康委员会疾病预防控制局委托与指导
利益冲突声明:所有作者声明无利益冲突

