羟基红花黄色素A调控miR-20a-5p/TLR4轴抑制人类风湿关节炎成纤维样滑膜细胞凋亡和炎性因子的表达
胡倩 赵嘉英 严宏莉
类风湿关节炎是一种慢性炎症性疾病,其主要病理特征表现为滑膜细胞增殖、炎性细胞浸润及关节软骨破坏等[1]。类风湿关节炎滑膜组织中的成纤维样滑膜细胞是滑膜炎性增生的主要效应细胞,在类风湿关节炎的发生发展中起重要作用[2]。研究显示,抑制类风湿关节炎成纤维样滑膜细胞增生和炎性反应可有效阻碍滑膜炎症及增生,延缓类风湿关节炎的发展进程。羟基红花黄色素A(hydroxysafflor yellow A,HSYA)是中药红花的主要活性成分之一,具有抗炎、镇痛和抗肿瘤等功效[3-5]。研究显示,羟基红花黄色素A可能通过抑制Notch信号通路减少骨关节炎大鼠体内TNF-α、IL-1β和IL-6等炎性因子的表达,减轻软骨损伤[6];羟基红花黄色素A可减轻H2O2诱导的血管内皮细胞氧化应激损伤[7]。然而,羟基红花黄色素A能否影响类风湿关节炎成纤维样滑膜细胞损伤还未知。研究显示,miR-20a-5p在糖尿病性心肌病(DCM)大鼠心肌组织和高糖诱导的心肌细胞H9C2中表达降低,上调miR-20a-5p可改善DCM大鼠心脏功能,减少心肌细胞凋亡,并抑制心肌细胞炎性反应,miR-20a-5p有可能成为DCM治疗的分子靶点[8];miR-20a-5p在卵白蛋白(OVA)诱发的哮喘小鼠肺组织中呈低表达,过表达miR-20a-5p可通过靶向抑制ATG7表达减少哮喘小鼠肺组织细胞凋亡及炎性反应[9]。然而,miR-20a-5p在类风湿关节炎发生发展中的作用还未知。Starbase靶基因在线软件预测显示,Toll样受体4(TLR4)可能是miR-20a-5p的靶基因[10]。因此,本研究建立TNF-α诱导的成纤维样滑膜细胞MH7A损伤模型,以miR-20a-5p/TLR4为切入点,主要探究了羟基红花黄色素A对TNF-α诱导的MH7A细胞凋亡和炎性因子表达的影响。
1 材料与方法
1.1 细胞与试剂 MH7A 细胞系,上海通派生物科技有限公司;HSYA,纯度>98%,上海源叶生物科技有限公司;DMEM培养液、CCK-8试剂盒、双荧光素酶活性检测试剂盒和二喹啉甲酸(BCA)蛋白检测试剂盒,北京索莱宝;LipofectamineTM 2000试剂盒,美国Invitrogen公司;miR-20a-5p模拟物(mimics)、模拟对照序列(miR-NC)、miR-20a-5p抑制剂(anti-miR-20a-5p)和阴性对照序列(anti-miR-NC),上海吉玛制药技术;胎牛血清,杭州四季青;兔抗人TLR4和甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体,美国Santa Cruz公司;miRNA抽提试剂盒、逆转录试剂盒和PCR试剂盒,大连宝生物。
1.2 方法
1.2.1 细胞培养与转染:在超净工作台内将MH7A 细胞复苏,加含10% 胎牛血清的DMEM培养液,置于培养箱中培养。细胞生长密度至90%时,0.25%胰蛋白酶消化,传代培养。将对数期MH7A细胞接种至6孔板中(2.5×105个/孔),培养12 h后,弃培养基。用LipofectamineTM 2000脂质体法,分别将miR-20a-5p mimics、miR-NC、anti-miR-20a-5p和anti-miR-NC转染至MH7A细胞。转染6 h后,弃培养液,重新加含10% 胎牛血清的DMEM培养液。再培养24 h,RT-qPCR检测细胞中miR-20a-5p表达验证转染效果,并收集细胞用于后续实验。
1.2.2 CCK-8法检测细胞增殖:将MH7A细胞及转染miR-20a-5p mimics、miR-NC、anti-miR-20a-5p和anti-miR-NC的MH7A 细胞均接种至96孔板中(2.5×104个/孔),培养4 h后,弃培养液,分组处理。MH7A细胞分为对照组、TNF-α组、不同剂量(0.1、1.0、10 μmol/L)HSYA+TNF-α组,其中对照组细胞用常规培养液培养24 h,TNF-α组细胞用含10 ng/ml[1]TNF-α的培养液培养24 h,不同剂量(0.1、1.0、10 μmol/L)HSYA+TNF-α组细胞分别用含0.1、1.0、10 μmol/L[7]HSYA与10 ng/ml TNF-α的培养液培养24 h。转染miR-20a-5p mimics、miR-NC的MH7A 细胞处理同TNF-α组,并分别记为miR-20a-5p+TNF-α组、miR-NC+TNF-α组。转染anti-miR-20a-5p、anti-miR-NC的MH7A 细胞处理同10 μmol/L HSYA+TNF-α组,并分别记为anti-miR-NC+10 μmol/L HSYA+TNF-α组、anti-miR-20a-5p+10 μmol/L HSYA+TNF-α。各组细胞培养结束后,每孔加10 μl CCK-8。孵育2 h后,酶标仪(λ=450 nm)测各孔光密度(OD)值。OD值越小,说明细胞增殖活性越弱。
1.2.3 流式细胞术检测细胞凋亡:将MH7A细胞及转染miR-20a-5p mimics、miR-NC、anti-miR-20a-5p和anti-miR-NC的MH7A 细胞均接种至6孔板中(1.0×105个/孔),培养4 h后,弃培养液,分组处理,方法同1.2.2。各组细胞培养结束后,弃培养液,收集各组细胞,并用磷酸盐缓冲液(PBS)清洗细胞2次。利用Annexin®V-FITC/PI试剂盒,上流式细胞仪检测各组细胞凋亡情况。细胞凋亡率(%)=(早期凋亡数+晚期凋亡数)/总细胞数×100%。
1.2.4 酶联免疫法检测细胞培养上清中IL-1β和IL-6表达:将MH7A细胞及转染miR-20a-5p mimics、miR-NC、anti-miR-20a-5p和anti-miR-NC的MH7A 细胞均接种至6孔板中(1.0×105个/孔),培养4 h后,弃培养液,分组处理,方法同1.2.2。各组细胞培养结束后,收集细胞培养上清液,离心(3 500 r/min、5 min)后,取上清,分别利用IL-1β和IL-6试剂盒检测上清中IL-1β和IL-6水平。
1.2.5 RT-qPCR检测细胞中miR-20a-5p表达:将MH7A 细胞及转染miR-20a-5p mimics、miR-NC、anti-miR-20a-5p和anti-miR-NC的MH7A 细胞均接种至6孔板中(1.0×105个/孔),培养4 h后,弃培养液,分组处理,方法同1.2.2。培养24 h后,收集各组细胞,并用PBS清洗2次。然后用miRNA抽提试剂盒提取细胞中总RNA,经逆转录后,行PCR扩增。引物序列:miR-20a-5p上游5’-TAAAGTGCTTATAGTGCAGGTAG-3’,下游5’-GGTACGATAGCGATCGAAG-3’;U6上游5’-CTCGCTTCGGCAGCACA-3’,下游5’-AACGCTTCACGAATTTGCGT-3’。2-△△Ct法计算miR-20a-5p相对于U6的表达量。
1.2.6 蛋白质印迹法检测TLR4蛋白表达:将MH7A 细胞及转染miR-20a-5p mimics、miR-NC、anti-miR-20a-5p和anti-miR-NC的MH7A 细胞均接种至6孔板中(1.0×105个/孔),培养4 h后,弃培养液,分组处理,方法同1.2.2。培养24 h后,收集各组细胞,并用PBS清洗2次。然后用RIPA试剂提取细胞中总蛋白,经BCA法定量、电泳、转膜及封闭后,分别用TLR4(1∶500)和GAPDH(1∶1 000)一抗4℃孵育过夜。洗膜后,再用山羊抗兔二抗(1∶2 000)37℃孵育1 h。加显影液避光显影,曝光拍照,Image J软件分析TLR4相对于GAPDH的表达量。
1.2.7 双荧光素酶报告基因实验:由上海吉玛制药技术公司根据Starbase靶基因在线软件预测显示的miR-20a-5p与TLR4的结合位点进行PCR扩增后,插入pmirGLO双荧光素酶,构建TLR4野生型载体(WT-TLR4),同时将结合位点进行突变,扩增后插入pmirGLO双荧光素酶,构建TLR4突变型载体(MUT-TLR4)。将MH7A 细胞接种至6孔板中(2.5×105个/孔),培养12 h后,弃培养液。用LipofectamineTM 2000脂质体法,分别共转染WT-TLR4与miR-20a-5p mimics、WT-TLR4与miR-NC、MUT-TLR4与miR-20a-5p mimics、或MUT-TLR4与miR-NC至MH7A 细胞。转染6 h后,弃培养液,重新加含10% 胎牛血清的DMEM培养液。再培养24 h,收集各组细胞。加裂解液将各组细胞充分裂解,离心(3 500 r/min、10 min)后,取上清,检测荧光素酶活性,结果以萤火虫与海肾的荧光强度比值表示。
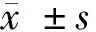
2 结果
2.1 羟基红花黄色素A对TNF-α诱导的MH7A细胞增殖活性及凋亡的影响 与对照组比较,MH7A细胞经10 ng/ml TNF-α刺激24 h后,细胞增殖活性降低(P<0.05),凋亡率升高(P<0.05);而羟基红花黄色素A可增强TNF-α诱导的MH7A细胞增殖活性(P<0.05),并降低细胞凋亡率(P<0.05),且呈剂量依赖性。见图1、表1。
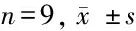
表1 HSYA对TNF-α诱导的MH7A细胞增殖活性和凋亡的影响
图1 HSYA干预的TNF-α诱导的MH7A细胞凋亡
2.2 羟基红花黄色素A对TNF-α诱导的MH7A细胞炎性因子表达的影响 与对照组比较,MH7A细胞经10 ng/ml TNF-α刺激24 h后,细胞培养上清液中IL-1β和IL-6表达水平升高,差异有统计学意义(P<0.05);而羟基红花黄色素A干预后,TNF-α诱导的MH7A细胞培养上清液中IL-1β和IL-6表达水平降低(P<0.05),且呈剂量依赖性,差异均有统计学意义(P<0.05)。见表2。
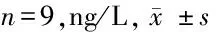
表2 HSYA对TNF-α诱导的MH7A细胞炎性因子表达的影响
2.3 羟基红花黄色素A对TNF-α诱导的MH7A细胞中miR-20a-5p和TLR4表达的影响 与对照组比较,MH7A细胞经10 ng/ml TNF-α刺激24 h后,细胞中miR-20a-5p表达降低(P<0.05),TLR4蛋白表达升高(P<0.05);而羟基红花黄色素A干预后,TNF-α诱导的MH7A细胞中miR-20a-5p表达升高(P<0.05),而TLR4蛋白表达降低(P<0.05),且呈剂量依赖性。见图2、表3。
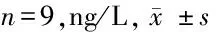
表3 HSYA对TNF-α诱导的MH7A细胞中miR-20a-5p和TLR4表达的影响
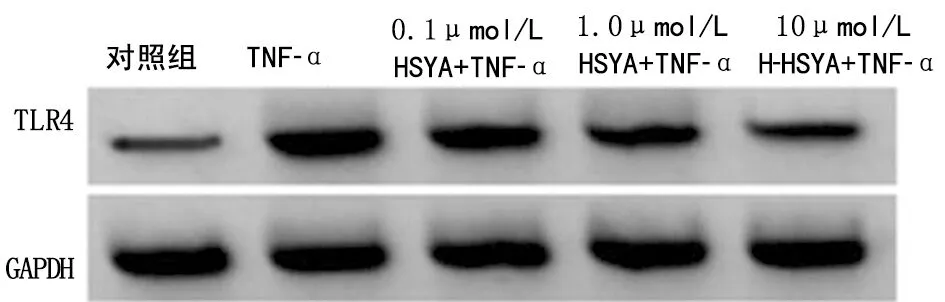
图2 HSYA干预的TNF-α诱导的MH7A细胞中TLR4蛋白表达
2.4 上调miR-20a-5p对TNF-α诱导的MH7A细胞增殖活性、凋亡及炎性因子表达的影响 转染miR-20a-5p mimics的MH7A细胞中miR-20a-5p表达明显高于转染miR-NC的MH7A细胞及对照组MH7A细胞(F=665.214,P<0.05),而转染miR-NC的MH7A细胞与对照组MH7A细胞中miR-20a-5p表达比较差异无统计学意义(t=1.342,P>0.05),表明上调miR-20a-5p表达的MH7A细胞构建成功。与TNF-α组或miR-NC+TNF-α组比较,miR-20a-5p+TNF-α组MH7A细胞增殖活性升高,而凋亡率及细胞培养上清液中IL-1β和IL-6表达水平降低(P<0.05),而TNF-α组与miR-NC+TNF-α组各检测指标比较差异均无统计学意义(P>0.05)。见图3,表4。
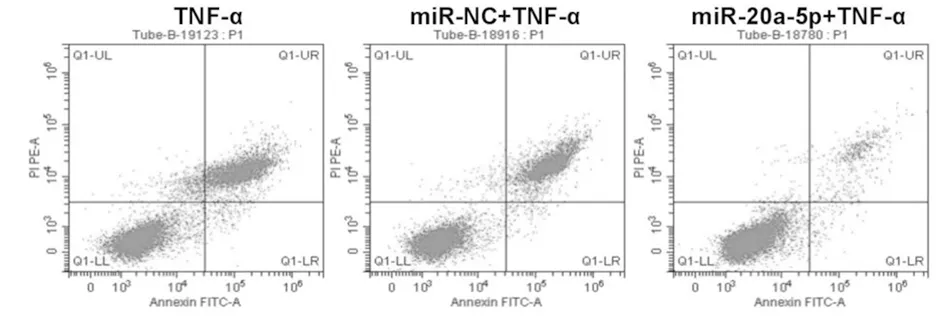
图3 TNF-α诱导的上调miR-20a-5p的MH7A细胞凋亡
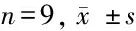
表4 上调miR-20a-5p对TNF-α诱导的MH7A细胞增殖活性、凋亡和炎性因子表达的影响
2.5 miR-20a-5p靶向负调控TLR4 Starbase靶基因软件预测显示的miR-20a-5p与TLR4的结合位点。双荧光素酶报告基因结果显示,共转染miR-20a-5p mimics与WT-TLR4的MH7A细胞荧光素酶活性显著低于共转染miR-NC与WT-TLR4的MH7A细胞,而共转染miR-20a-5p mimics与MUT-TLR4的MH7A细胞荧光素酶活性与共转染miR-NC与MUT-TLR4的MH7A细胞比较差异无统计学意义(P>0.05),说明TLR4是miR-20a-5p的靶基因。同时,转染miR-20a-5p mimics的MH7A细胞中TLR4蛋白表达明显低于转染miR-NC的MH7A细胞及对照组MH7A细胞(P<0.05)。见图4,表5,6。

图4 miR-20a-5p靶向调控TLR4;A miR-20a-5p与TLR4的结合位点;B miR-20a-5p与WT-TLR4共转染后的细胞荧
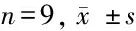
表5 双荧光素酶活性检测结果
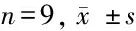
表6 上调miR-20a-5p对MH7A细胞中TLR4蛋白表达的影响
2.6 下调miR-20a-5p降低羟基红花黄色素A对TNF-α诱导的MH7A细胞增殖活性、凋亡及炎性因子表达的影响 转染anti-miR-20a-5p 的MH7A细胞中miR-20a-5p表达明显低于转染anti-miR-NC的MH7A细胞(t=107.331,P<0.05),表明下调miR-20a-5p表达的MH7A细胞构建成功。与10 μmol/L H-HSYA+TNF-α组或anti-miR-NC+10 μmol/L H-HSYA+TNF-α组比较,anti-miR-20a-5p+10 μmol/L H-HSYA+TNF-α组MH7A细胞增殖活性降低,而凋亡率、细胞培养上清液中IL-1β和IL-6表达及细胞中TLR4蛋白光素酶活性降低;C 上调miR-20a-5p抑制细胞中TLR4蛋白表达升高(P<0.05),而10 μmol/L H-HSYA+TNF-α组与anti-miR-NC+H-HSYA+TNF-α组各检测指标比较差异均无统计学意义(P>0.05)。见图5,表7。
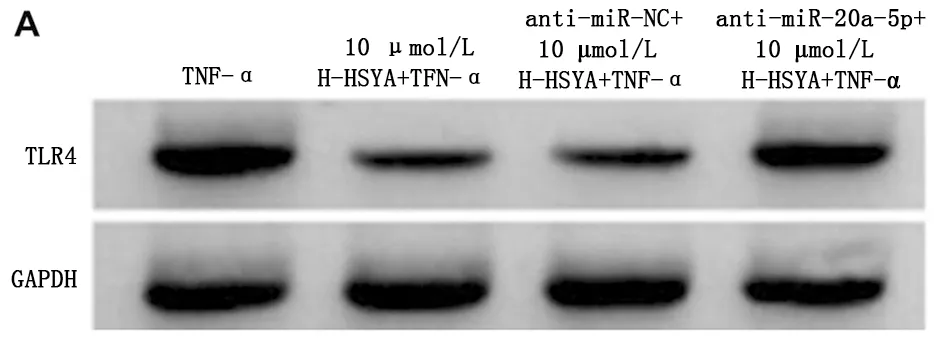
图5 下调miR-20a-5p降低HSYA对TNF-α诱导的MH7A细胞凋亡及TLR4蛋白表达的影响;A 下调miR-20a-5p降低HSYA对TNF-α诱导的MH7A细胞凋亡的影响;B 下调miR-20a-5p降低HSYA对TNF-α诱导的MH7A细胞中TLR4蛋白表达的影响
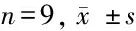
表7 下调miR-20a-5p降低HSYA对TNF-α诱导的MH7A细胞增殖活性、凋亡及炎性因子表达的影响
3 讨论
滑膜细胞在炎性因子的刺激下,增殖能力明显增强,且释放多种炎性因子,在类风湿关节炎的发生发展中起关键作用[11]。TNF-α是一种促炎因子,可引起成纤维样滑膜细胞炎性损伤,促进风湿关节炎的发展进程[12]。MH7A细胞来自于类风湿关节炎患者的成纤维样滑膜细胞,增殖速度较快,且可多次传代,是类风湿关节炎研究的常用细胞[2]。本研究利用TNF-α刺激MH7A细胞,结果显示,MH7A细胞经TNF-α刺激24 h后,细胞增殖活性降低,凋亡数及炎性因子IL-1β和IL-6的分泌水平增加,与相关报道结果[13]一致,提示TNF-α诱导的MH7A细胞损伤模型建立成功。
近年来,中药或其活性成分在风湿性关节炎的治疗中广受关注。作为中药红花的主要活性成分,羟基红花黄色素A具有多种药理活性。研究显示,羟基红花黄色素A可抑制心肌缺血再灌注损伤大鼠血清TNF-α、IL-6、CRP等炎性因子的表达,对心肌缺血再灌注损伤大鼠发挥保护作用[14];羟基红花黄色素A可能通过下调miR-1表达降低H2O2诱导的心肌细胞H9c2活性氧(ROS)的生成和细胞凋亡率,减轻心肌细胞氧化损伤[15]。本研究将一定剂量的羟基红花黄色素A作用于TNF-α诱导的成纤维样滑膜细胞MH7A后,发现其可提高TNF-α诱导的MH7A细胞增殖活性,减少细胞凋亡,且呈剂量依赖性;进一步检测发现,羟基红花黄色素A可呈剂量依赖性抑制TNF-α诱导的MH7A细胞分泌IL-1β和IL-6炎性因子,这提示羟基红花黄色素A可减轻TNF-α诱导的MH7A细胞炎性损伤,其可能具有治疗类风湿关节炎的潜在价值。
miRNA可通过调控靶基因的表达影响细胞增殖、凋亡、氧化应激及炎性反应等生理或病理过程,参与多种疾病的发展进程[16]。研究显示,miR-23、miR-650和miR-143-3p等多种参与调控滑膜细胞的增殖、凋亡及炎性反应,是类风湿关节炎治疗的潜在分子靶点[17]。本研究首先检测了TNF-α对MH7A细胞中miR-20a-5p表达的影响,TNF-α能够抑制MH7A细胞中miR-20a-5p的表达,提示miR-20a-5p可能参与TNF-α诱导的MH7A细胞损伤;通过转染miR-20a-5p模拟物至MH7A细胞,再用TNF-α刺激上调miR-20a-5p的MH7A细胞发现,细胞增殖活性增加,而凋亡数及炎性因子IL-1β和IL-6的分泌减少,这表明上调miR-20a-5p可抑制TNF-α诱导的MH7A细胞凋亡及炎性损伤,miR-20a-5p有可能成为类风湿关节炎治疗的分子靶点。本研究结果还显示,羟基红花黄色素A可呈剂量依赖性促进TNF-α诱导的MH7A细胞中miR-20a-5p的表达,而下调miR-20a-5p降低羟基红花黄色素A对TNF-α诱导的MH7A细胞凋亡及IL-1β和IL-6炎性因子的表达,提示羟基红花黄色素A可能通过上调miR-20a-5p表达来抑制TNF-α诱导的MH7A细胞凋亡及IL-1β和IL-6炎性因子表达。
为了进一步探究羟基红花黄色素A通过上调miR-20a-5p抑制TNF-α诱导的MH7A细胞凋亡及IL-1β和IL-6炎性因子表达的分子机制,本研究证实了TLR4是miR-20a-5p的靶基因,且上调miR-20a-5p可降低MH7A细胞中TLR4蛋白表达,说明miR-20a-5p靶向负调控TLR4。TLR4与炎性反应密切相关,其与相应配体作用后,可启动核因子-κB(NF-κB)信号通路,调控炎症相关基因的转录翻译和表达,产生和释放IL-6和IL-8等炎性因子,而这些炎性因子又可作用于TLR4等信号通路,进一步加剧炎性反应[18]。本研究结果显示,羟基红花黄色素A可抑制TNF-α诱导的MH7A细胞中TLR4蛋白表达,而下调miR-20a-5p则降低了羟基红花黄色素A对TNF-α诱导的MH7A细胞中TLR4蛋白表达的抑制作用,进一步提示羟基红花黄色素A可能通过上调miR-20a-5p进而抑制TLR4的表达来减少TNF-α诱导的MH7A细胞凋亡及炎性因子表达,发挥对MH7A细胞的保护作用。

