天冬多糖的结构、免疫调节活性及体外抗氧化活性
牧 丹,萨仁高娃,包 良,陈永福,苏日娜*
(1 内蒙古医科大学 呼和浩特 010010 2 内蒙古农业大学 呼和浩特 010010)
天冬(Radix asparagi) 为百合科植物天门冬【Asparagus cochinchinensis(Lour.)Merr.】的干燥块根,是国家卫生部公布的第三批药食两用资源之一[1],是一种既可食用也可药用的珍品,经济价值较高。其味甘、苦,性寒,归肺肾经,具有养阴润燥、清肺生津的功效,用于肺燥干咳、顿咳痰黏、咽干口渴、肠燥便秘等症[2]。根据《现在蒙医药学》的记录,天冬、喜马拉雅紫茉莉、黄精与玉竹并列在蒙医药四大传统的根类补益药材之中,并具有滋补、固精、祛协日乌苏、镇赫依(指各生理功能的动力)等功效[3-4],主治协日乌苏病,身体虚弱、头晕、妇赫依症、肾寒、遗精、阳痿、阴伏热、陈热等病症[5]。《名医别录》载“去寒热,养肌肤,益气力”,《月华于本草》载“镇心,润五脏,益皮肤,悦颜色”,能使肌肤艳丽,保持青春活力[6]。由此可见,天冬滋养肌肤的功能明显,民间有采用“天冬煮猪蹄”“天冬煮火腿”“天冬炖母鸡”制作的食谱,极大地丰富了人们的养生美食范围[7]。常食天冬能够改善肌肤的血液循环,增强代谢功能,具有抗衰老的作用,尤其适合爱美人士食用。据研究报道,天冬主要化学成分包括19 种氨基酸、多糖与其它活性小分子化合物,如β-谷甾醇、胡萝卜甾醇、9-二十七烷、异菝葜皂甙元、薯蓣皂甙元、洋菝葜皂甙元-3-O-β-D-糖苷-脒蚜胺及甾体皂苷等。其中,多糖是天冬较为重要的组成,具有多种治疗特性,包括抗氧化[8]、抗菌及抗炎[9-12]、抗肿瘤[13-14]、降血糖[15]、抗疲劳[16]及止咳等功效[17]。多糖作为非特异性免疫增强化合物,能提高机体的免疫功能[18-20]。我国十分重视糖类药物的开发,国家科技部已将“糖生物学与重大疾病发生、发展的机制研究”列入未来十年对生物经济起引导作用的重大生命科学的应用基础研究课题[21-23]。近年来研究表明,天冬的抗肿瘤活性、免疫增强作用、清除自由基和抗脂质过氧化活性等主要的药理作用均与天冬的多糖成分有着密切的关系[24],对天冬多糖的研究具有重要意义。本文研究了天冬多糖的提取、纯化、结构解析、免疫调节及抗氧化活性,为今后天冬多糖的开发利用奠定试验依据。
1 材料与方法
1.1 试验材料与试剂
天冬药材、无水乙醇、蒸馏水、氯仿、正丁醇、超纯水、浓硫酸、苯酚、无水葡萄糖标准品(GZDD-0114),中国食品药品检定研究院;不同分子质量葡聚糖标准品 (5 800,11 800,47 300,100 000,380 000,788 000 u,批号90601),日本昭和电工公司;无水乙酸钠(分析纯级)、冰醋酸(分析纯级)、三氟乙酸、50%氢氧化钠溶液、醋酸钠、甘露糖标准品、鼠李糖标准品、半乳糖醛酸标准品、半乳糖标准品、葡萄糖标准品、葡萄糖醛酸标准品、阿拉伯糖标准品、葡萄糖胺标准品、岩藻糖标准品,Sigma chemical 公司;γ 干扰素(IFN-γ)、白介素-2(IL-2)、肿瘤坏死因子-α (TNF-α)、白介素-1β(IL-1β)和白介素-6(IL-6)酶联免疫吸附试验试剂盒(ELISA 试剂盒),深圳市达科为生物技术股份有限公司。
1.2 仪器与设备
JA5003N 电子天平,上海菁海仪器有限公司;R-1001N 旋转蒸发仪,郑州长城科工贸有限公司;电热鼓风干燥箱,上海一恒科学仪器有限公司;BFX5-320 型低速自动平衡离心机,白洋离心机厂;透析袋,和光纯药工业株式会社;78-1 磁力加热搅拌器,常州国华电器有限公司;Telstar lyoQuest-85 冻干机 (西班牙);IRAffinity-1 红外分光光度计,日本岛津公司;ICS5000 离子色谱仪,ThermoFisher 公司;UGC-24M 氮吹仪,上海力辰科技有限公司;MAPADA-P9 双光束紫外-可见分光光度计。上海美谱达仪器有限公司;515 高效液相色谱仪、2410 示差折光检测器、Empower2 色谱工作站,Waters 公司。
1.3 试验方法
1.3.1 天冬粗多糖的提取 将天冬药材粉碎过筛(40 目),称取100 g 置于圆底烧瓶中,加入500 mL 蒸馏水,加热回流3 次,每次1 h,放冷后抽滤。将3 次滤液合并浓缩至约100 mL。加无水乙醇,调节至最终乙醇体积分数达80%,冷藏静置,密封醇沉1 夜。将醇沉物抽滤,收集固体烘干后得棕色粗多糖粉末。
1.3.2 粗多糖的分离纯化以及含量测定
1.3.2.1 纯化 称取1 g 天冬粗多糖粉末,加100 mL 蒸馏水溶解。将溶液置于分液漏斗中,加入Sevage 试剂(V氯仿∶V正丁醇=4 ∶1)25 mL,强烈振摇20 min 后离心,收集上层液体,再次分液,重复上述脱蛋白操作,直至无蛋白层出现。将脱蛋白后的水溶液置于透析袋内透析2~3 d。收集透析后的溶液浓缩后冻干,得白色天冬脱蛋白多糖冻干粉。
1.3.2.2 苯酚-硫酸法测定糖含量测定
1) 绘制标准曲线 精密称取0.0250 g 无水葡萄糖标准品于100 mL 容量瓶中,用超纯水定容,振荡摇匀,得0.25 mg/mL 无水葡萄糖标准溶液。精密吸取上述标准溶液0.20,0.40,0.60,0.80,1.00,1.20 mL,分别置于10 mL 容量瓶中,加入超纯水补至2.0 mL,分别加入6%的苯酚试剂1.0 mL,振荡摇匀,用浓硫酸定容至刻度线,振荡摇匀,静置5 min 后40 ℃水浴30 min,取出。另取超纯水2.00 mL 置于10 mL 容量瓶内,同上述操作制得空白对照溶液。用紫外-可见分光光度法在波长490 nm 处检测其吸光度值。以吸光度值为纵坐标,葡萄糖的质量浓度为横坐标绘制标准曲线。
2) 供试品溶液的制备 精密称取天冬粗多糖粉末与天冬脱蛋白冻干粉末各10 mg 于10 mL容量瓶中,加入超纯水使其溶解并定容至刻度线,振荡摇匀、备用。分别精密吸取以上溶液0.2 mL,置于10 mL 容量瓶中,同标准品溶液制备方法制备供试品溶液,在波长490 nm 处测定其吸光度值,根据标准曲线计算样品中多糖含量。
1.3.3 脱蛋白多糖的分级醇沉 称取1.45 g 天冬脱蛋白冻干粉,置于烧杯中,加入150 mL 蒸馏水溶解,分别用30%,60%,80%质量分数的乙醇分级醇沉。每级醇沉物离心后所得沉淀用适量蒸馏水溶解,透析、冻干后进行凝胶渗透色谱(GPC)测定。离心后剩余液体继续进行醇沉操作,最后得30%醇沉物73 mg,60%醇沉物365 mg 及80%醇沉物80 mg,用于结构表征及活性测定。
1.3.4 TD-80 红外光谱检测 取适量溴化钾,烘干后置于研钵内研磨至粉末状,加入1~2 mg TD-80 冻干粉,混合后研磨均匀,压片,用红外光谱仪,在4 000~400 cm-1范围测定TD-80 多糖的红外光谱。
1.3.5 天冬多糖的分子质量的测定 采用凝胶渗透色谱(GPC)-示差检测器法对天冬脱蛋白多糖及不同分级醇沉多糖进行分子质量测定。色谱条件:Ultrahydrogel 500 和Ultrahydrogel 250 (7.8 mm×300 mm)连用;排阻范围(0.1~1 000 ku);流动相为醋酸盐缓冲溶液(pH 4.5);流速:0.9 mL/min;柱温:45 ℃。分别称取分子质量为5 800,11 800,47 300,100 000,380 000,788 000 u 的 标准葡聚糖样品各7 mg,用1 mL 流动相溶解,待用。吸取不同分子质量的对照品溶液,分别进样20 μL,以保留时间(RT)为横坐标(x 轴),分子质量的对数值为纵坐标(y 轴),绘制标准曲线,采用Empower 2 色谱工作站计算得到回归方程。根据标准曲线回归方程,计算样品的数均分子质量。
1.3.6 TD-80 单糖组成分析 采用离子色谱-安培检测法,色谱条件:色谱柱:DionexCarbopacTMPA20 (3 mm×150 mm);流 动相:A:H2O;B:250 mmol/L NaOAC、50 mmol/L NaOH 和500 mmol/L NaOAC;流速:0.3 mL/min;进样量:5 μL;柱温:30℃;检测器:安培检测器。
单糖标准品(岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、果糖、半乳糖醛酸、葡萄糖醛酸、盐酸氨基葡萄糖、N-乙酰-D 氨基葡萄糖、核糖)配成约10 mg/mL 标准溶液。取各单糖标准溶液精密配制1,5,10,20,50,80,100 mg/L 梯 度质量浓度的标准品。根据绝对定量方法,测定不同单糖质量。
取多糖TD-80 样品4 mg 于安瓿瓶中,加入2 mol/L 三氟乙酸(TFA)1 mL,120 ℃水解3 h。准确吸取200 μL 酸水解溶液转移至1.5 mL EP 管中,氮吹吹干,加入1 mL 水涡旋混匀,12 000 r/min 离心5 min。取上清进行离子色谱分析。
1.3.7 免疫调节活性试验
1.3.7.1 TD-80 对脾淋巴细胞免疫增殖活性的测定 评价天冬的80%分级醇沉后得的均一多糖(TD-80)对脾淋巴细胞的增值活性,细胞存活率计算公式如下:

小鼠断颈处死,乙醇浸泡后剪开腹腔,取出脾脏,加分离液,研磨脾脏,单细胞透过尼龙网进入分离液中,分离液转至离心管,培养基离心30 min,分离出淋巴细胞层。淋巴细胞分离完成后,进行细胞计数。向96 孔板中加入100 μL 5×106个/mL 细胞悬液。阳性对照组加入100 μL 终质量浓度为2.5 μg/mL 氘逗素(ConA),试验组加入终质量浓度分别为200,40,5 μg/mL 的多糖溶液,每孔终体积为200 μL,设置细胞对照。在37 ℃、5%CO2条件下培养48 h 后,加入CCK-8 在波长450 nm 处测定OD 值。
1.3.7.2 TD-80 对IFN-γ 和IL-2 细胞因子分泌的影响 如1.3.7.1 节所述,制备淋巴细胞悬液,加入96 孔细胞培养板,每孔100 μL。试验组每孔加入100 μL 质量浓度为200,40,5 μg/mL 多糖样品,37 ℃、5% CO2条件下培养48 h,2 000 r/mim、4℃离心10 min,收集上清。使用双抗体夹心法,参照IFN-γ 和IL-2 ELISA 检测试剂盒说明书评估其细胞因子水平。将细胞因子标准品连续稀释至500,250,125,62.5,31.3,15.6 pg/mL 和7.8 pg/mL。
1.3.7.3 TD-80 对TNF-α,IL-1β 和IL-6 细胞因子分泌的影响 RAW264.7 细胞是一种巨噬细胞样细胞系(从中国科学院的细胞库中获得),在含有10%热灭活胎牛血清的Dulbecco 改良Eagle 培养基(Invitrogen)中保存。RAW264.7 细胞在96 孔板(1×106细胞/孔)中培养,与不同质量浓度(5,40 μg/mL 和200 μg/mL) 的TD-80 多糖在37 ℃、5%CO2条件下共培养48 h。以2.5 μg/mL 脂多糖(LPS)为阳性对照。除去上清液后,保存在-20 ℃。参照TNF-α,IL-1β 和IL-6 ELISA 试剂盒说明书的方法评估其细胞因子水平。
1.3.8 体外抗氧化活性的测定
1.3.8.1 超氧阴离子清除能力测定 AP-TEMED系统产生超氧阴离子,与盐酸羟胺反应生成NO2-,NO2-与对氨基苯磺酸和α-萘胺作用生成红色的偶氮化合物,在波长530 nm 处有特征吸收峰。样品对超氧阴离子的清除能力与在波长530 nm 处的吸光值呈负相关。采用超氧化物阴离子清除试剂盒使用说明书——微量法检测超氧阴离子自由基的清除活性。简而言之,将10 μL Tris-HCl 溶液(TEMED)和40 μL 过硫酸铵加到对照管和样品管中,仅将25 μL H2O 添加到对照管中,在25 ℃下混合反应1 min。将25 μL 多糖TD-80 溶液和阳性对照溶液抗坏血酸 (ASA)(0.01~0.1 mg/mL)添加到样品管中,然后将50 μL 盐酸羟胺溶液添加到两个管中,在37 ℃下反应30 min。最后,将50 μL 对氨基苯磺酸和α-萘胺在乙酸溶液中混合后加入到上述混合物中,在37 ℃下显色反应20 min,在波长530 nm 处测量吸光度A。计算超氧化物自由基清除活性。

1.3.8.2 羟自由基清除能力 H2O2/Fe2+通过Fenton 反应产生羟自由基,将邻二氮菲-Fe2+水溶液中Fe2+氧化为Fe3+,导致波长536 nm 处吸光度下降,样品对536 nm 处吸光度下降速率的抑制程度,反映样品清除羟自由基的能力。采用超氧化物阴离子清除试剂盒使用说明书——微量法检测羟自由基的清除活性。简而言之,在空白管、对照管及样品管中分别加入250 μL 工作液 (V邻二氮菲-无水乙醇∶VNa2HPO4·12H2O-NaH2PO4·2H2O∶VFeSO4·7H2O=100∶50 ∶100),空白管加入100 μL H2O;对照管加入50 μL H2O 和50 μL H2O2;样品管中加入50 μL H2O2和50 μL不同质量浓度的多糖及阳性对照ASA,混匀,37℃保温60 min,8 000×g、25 ℃离心5 min。吸 取200 μL 上清液,于96 孔板中测定波长536 nm 处的吸光值,空白管、对照管和测定管的吸光值分别记为A空、A对和A测。

1.3.8.3 DPPH 自由基清除率的测定 配制质量浓度为1×10-5g/mL 的DPPH-乙醇溶液和0.2 mg/mL 天冬多糖溶液。分别取不同体积的多糖溶液200,400,600,800,1 000,1 500,2 000 μL,补足乙醇溶液至2 mL,用移液枪分别加入DPPH-乙醇溶液。混匀后置无光环境中反应30 min,于波长517 nm 处测定吸光度。以乙醇作为空白,按式(4)计算天冬多糖对DPPH 自由基的清除率。每份样品平行操作3 次,取平均值。

式中,A对照——DPPH 本身在测定波长处的吸光度;A样品——样品对DPPH 作用后的吸光度数值(除去样品自身吸收)。
2 结果与讨论
2.1 多糖糖含量
苯酚-硫酸法含量测定结果表明,葡萄糖质量浓度在0.00~1.588 μg/mL 范围呈线性关系,线性回归方程为y = 0.0796x-0.3613,相关系数R2=0.9945。粗多糖中糖含量为63.13%,脱蛋白冻干粉中糖含量为73.98%。
2.2 TD-80 红外光谱检测
粗多糖80%醇沉物红外光谱扫描结果见图1。3 428.01 cm-1处的强吸收峰是糖分子中O-H 键的伸缩振动吸收,2 936.59 cm-1处的峰是C-H 键的伸缩振动吸收,1 630.16 cm-1处的峰是糖结合水的吸收峰,1 442.34cm-1的峰是糖分子中C-H 键的变角振动吸收,1 020.49 cm-1处的峰是吡喃环醚键C-O 键的变型振动吸收。另外,在1 745.73 cm-1附近有酯羰基对应的强吸收峰,表明该糖含有糖醛酸,是酸性多糖。916.47 cm-1的峰是吡喃糖β 型C-H 变形振动的吸收峰,760.44 cm-1的峰是α-构型吡喃环的对称振动,说明天冬的80%醇沉多糖是含有α、β 两种构型的酸性吡喃多糖。
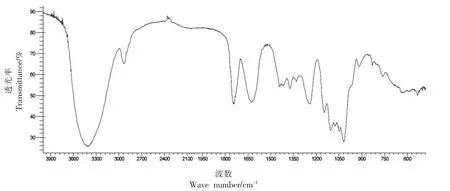
图1 TD-80 红外光谱图Fig.1 FT-IR spectrum of TD-80
2.3 分子质量的测定
经GPC 法测定脱蛋白天冬多糖和80%醇沉产物TD-80 的分子质量。图2a 为脱蛋白后天冬多糖的色谱图,其显示天冬脱蛋白多糖由两个分子质量的多糖组成,保留时间11.51 min 的峰的重均分子质量为59.4 ku,保留时间16.29 min 的峰的分子质量为3.9 ku。图2b 显示一个色谱峰,峰型对称,说明TD-80 多糖相对分子质量分布均一。根据葡聚糖标准曲线,线性回归方程为y =-0.3079x+5.9129,相关系数R2=0.9992。TD-80的重均分子质量Mw 为6.8 ku,多分散指数为2.48。其余醇沉产物未得到单一组分多糖,文中未提供GPC 图谱。
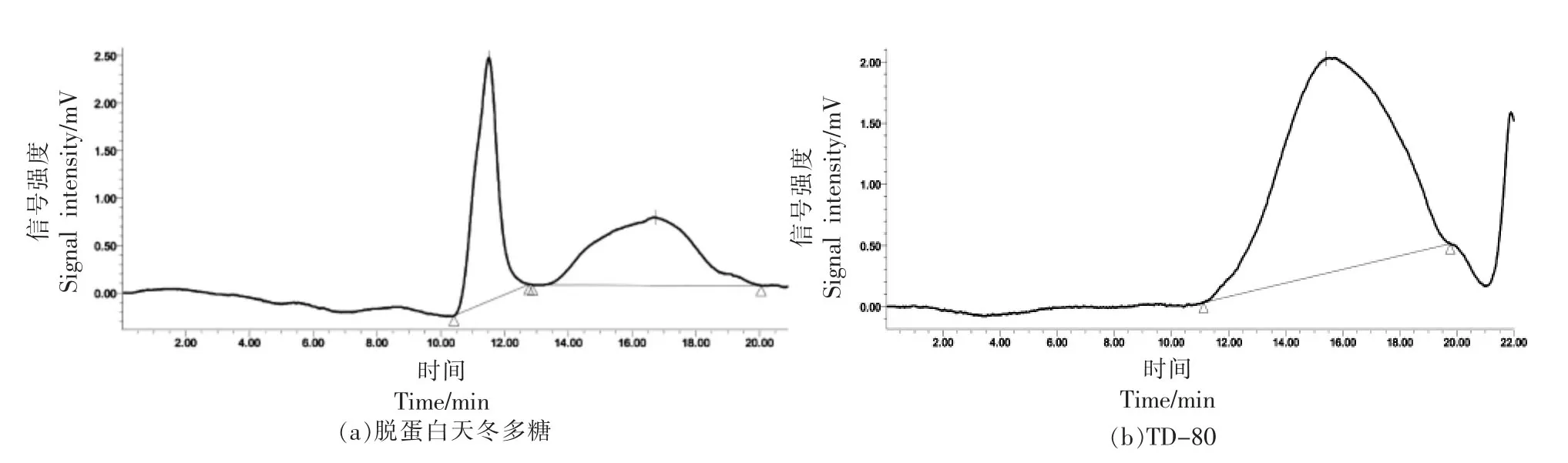
图2 GPC色谱图Fig.2 GPC chromatogram
2.4 单糖组成分析
采用离子色谱仪,以13 种单糖标准品为标准,测定水解后TD-80 多糖的单糖组成。根据单糖标准品和多糖样品色谱图谱的出峰时间,鉴定样品中相应的单糖峰。结果表明:样品TD-80 多糖中鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、半乳糖醛酸物质的量比为0.048 ∶0.102 ∶0.316∶0.157∶0.101∶0.017∶0.259,结果见图3。

图3 离子色谱图Fig.3 Ion chromatogram
2.5 TD-80 多糖免疫调节作用
2.5.1 TD-80 多糖对脾淋巴细胞增殖活性的影响 结果表明(图4、表1),试验组OD450nm值与空白组比较均增大,表明TD-80 多糖组和Con-A 阳性对照组均不同程度地促进小鼠脾淋巴细胞的增值作用,其中TD-80 多糖组在5~200 g/mL 质量浓度下,显示质量浓度依赖关系;当TD-80 质量浓度在40 μg/mL 和200 μg/mL 时,差异显著(P<0.05)。

表1 TD-80 对正常小鼠的脾淋巴细胞增值反应的影响Table 1 Effect of TD-80 on proliferation of splenic lymphocytes in normal mice

图4 TD-80 对正常小鼠的脾淋巴细胞增值反应的影响Fig.4 Effect of TD-80 on proliferation of splenic lymphocytes in normal mice
2.5.2 TD-80 多糖对IFN-γ 和IL-2 细胞因子分泌的影响 3 个质量浓度的TD-80 多糖对小鼠脾淋巴细胞中IFN-γ 的分泌具有极显著的影响(P<0.01),并具有质量浓度依赖性。当TD-80 多糖质量浓度大于40 μg/mL 时,与细胞空白比较IFN-γ的分泌达到300 多倍,表明TD-80 多糖对IFN-γ的分泌影响极大。与细胞空白比较TD-80 多糖对IL-2 分泌的影响不显著(结果见图5)。
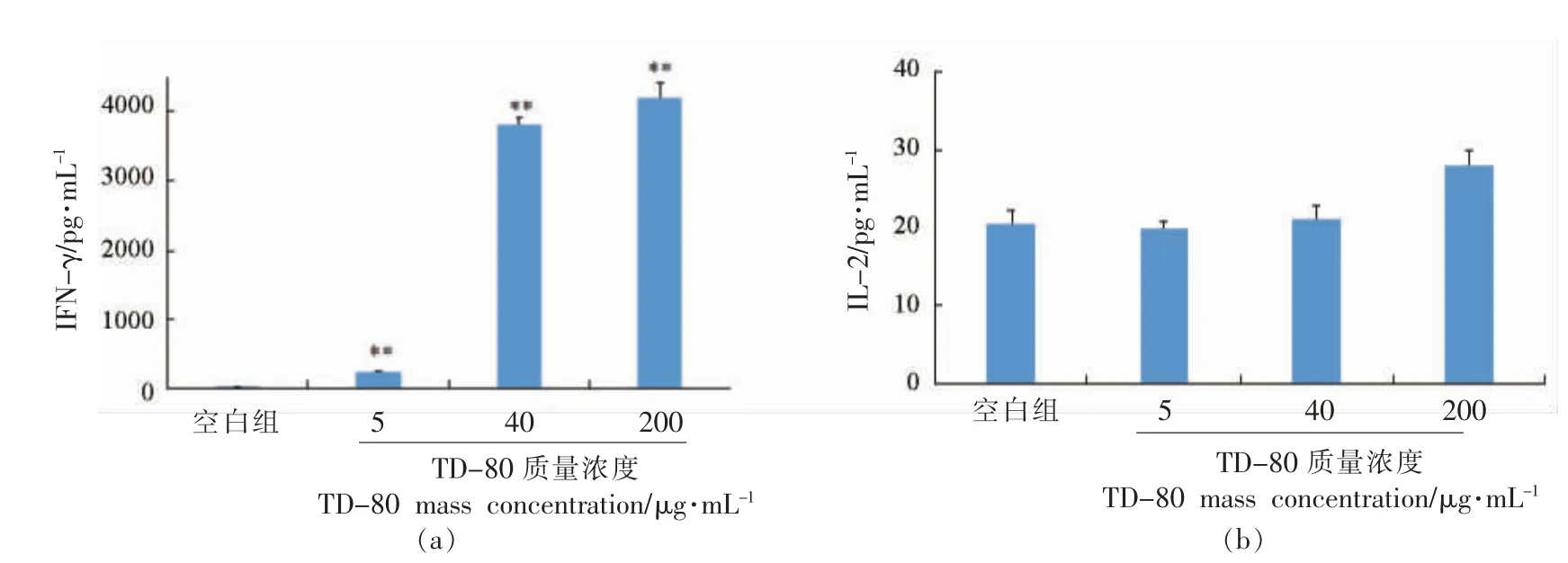
图5 TD-80 多糖对IFN-γ 和IL-2 细胞因子的分泌影响Fig.5 The effect of TD-80 polysaccharide on the secretion of IFN-γ and IL-2 cytokines
2.5.3 TD-80 多糖对TNF-α,IL-6 和NO 细胞因子分泌的影响 测定TD-80 对小鼠巨噬细胞系RAW264.7 细胞相关细胞因子分泌的影响,研究TD-80 多糖的免疫调节活性。如图6所示,将质量浓度5~200 μg/mL 的TD-80 多糖与RAW264.7 细胞共培养48 h,发现TD-80 能促进TNF-α (图6a),IL-6(图6b)和NO(图6c)细胞因子的分泌。其中TD-80 的3 个质量浓度组(5~200 μg/mL)与空白细胞组相比,均极显著地增加肿瘤坏死因子α 的分泌(P<0.01)(图6a),且具有质量浓度依赖关系。TD-80 多糖同时对白介素-6 的分泌也有质量浓度依赖性的影响,与空白细胞相比,高质量浓度多糖组具有极显著差异(P<0.01),阳性对照组LPS 和中浓度多糖组具有显著性差异(P<0.05)(图6b)。在NO 细胞因子的分泌影响中,TD-80 的2个质量浓度组(40,200 μg/mL)和LPS 与空白细胞组相比,均显著地增加NO 的分泌(P<0.05 或P<0.01)(图6c),且具有质量浓度依赖关系。

图6 TD-80 多糖对TNF-α、IL-6 和NO 细胞因子的分泌影响Fig.6 The effect of TD-80 polysaccharide on the secretion of TNF-α,IL-6 and NO cytokines
2.6 体外抗氧化活性
活性氧(ROS)主要由羟自由基和过氧化氢组成,过量的ROS 产生与细菌感染期间肝脏和肾脏的氧化损伤有关,这可能有助于了解疾病的发病机理和死亡率[25]。如今,合成抗氧化剂在食品工业中得到广泛使用,然而,这些合成物质的毒性和致癌作用令人担忧[26]。解决该问题途径之一是使用天然抗氧化剂。
在活性氧中,羟自由基是反应性最高的一种,可以攻击生物分子,例如DNA 和蛋白质[27]。从天冬分离的多糖在4~10 mg/mL 质量浓度范围具有清除羟自由基的能力(图7a),两种样品的活性均以质量浓度依赖性方式增加。此外,TD-80 的清除活性随着质量浓度的增大而增大,特别是在高剂量(10 mg/mL)下,TD-80 表现出非常高的自由基清除活性(45.12%),与阳性对照比较P<0.05。在低剂量(4~7.5 mg/mL)时,TD-80 的自由基清除活性低,这说明多糖TD-80 在高剂量下具有较强的抗氧化活性。
与抗坏血酸(ASA)相比,TD-80 清除超氧阴离子活性如图7b 所示。样品以质量浓度依赖性方式表现出明显的清除超氧阴离子的活性。TD-80多糖在质量浓度0.01~0.1 mg/mL 范围具有清除超氧阴离子的能力。与维生素C 比较,在质量浓度0.1 mg/mL 下,TD-80 具有显著的清除超氧阴离子活性(60.72%,P<0.05)。这些结果表明TD-80 具有清除超氧阴离子的抗氧化能力。
DPPH 通常用作评估抗氧化剂活性的化合物,在波长517 nm 处表现出特征吸收,通常被认为是具有稳定自由基的化合物之一。本研究用比色法检测纯化的多糖TD-80 对DPPH 自由基的清除能力,结果如图7c 所示。在质量浓度0.02~0.2 mg/mL 范围,阳性对照组ASA 的DPPH 清除率为100%;TD-80 多糖组具有质量浓度依赖的DPPH 自由基清除能力,在最高质量浓度下,其DPPH 自由基的清除率达到68.8%。以上羟自由基清除能力、超氧阴离子清除能力、DPPH 自由基清除能力等3 种抗氧化活性的测定仅在体外化学系统中建立。需进行体内动物实验或细胞试验以进一步验证其抗氧化活性。

图7 TD-80 的体外抗氧化活性Fig.7 Antioxidant activity of TD-80 in vitro
3 结论
从天冬中提取多糖,分离纯化后分析结构特征,研究其免疫调节活性和体外抗氧化活性。结果表明:天冬粗多糖中糖含量为63.13%,脱蛋白冻干粉中糖含量为73.98%。根据红外检测结果,天冬的80%醇沉多糖(TD-80)是含有α、β 两种构型的酸性吡喃多糖。GPC 法测定结果表明:TD-80 的重均分子质量Mw 为6.8 ku,多分散指数为2.48。天冬的80%醇沉多糖(TD-80)由鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、半乳糖醛酸等单糖组成。体外活性试验表明,TD-80 能促进脾淋巴细胞增殖,对相关细胞因子 (TNF-α,IL-1β和IL-6)的分泌有一定的刺激作用,呈现一定的免疫调节活性和抗氧化活性。

