系统性轻链型淀粉样变性并发致命性自发性脾破裂1例报告
李 朵, 赵英仁, 陈红梅
西安交通大学第一附属医院 感染科, 西安 710061
系统性轻链型淀粉样变性 (light-chain amyloidosis,AL)是由错误折叠的免疫球蛋白轻链蛋白引起的,其病理机制为淀粉样物质沉积于各个器官细胞间,致使细胞功能障碍,最终导致受累脏器衰竭[1],其无组织、器官特异性,可发生于全身各个部位。其临床表现与受累器官有关,临床表现中水肿发生最多,其次为疲劳、体位性低血压和体质量减轻,肾功能不全、紫癜、复发性腹泻、充血性心力衰竭、呼吸困难和感觉异常者也占很高比例[2]。其临床上表现复杂,容易出现漏诊、误诊。现报道1例并发致命性自发性脾破裂,经病理证实为AL病例,以期提高对该病的认识。
1 病例资料
男性患者,50岁,从事汽车修理30年,以主诉“腹胀伴眼黄1年,加重伴双下肢水肿20 d”于2020年6月13日入西安交通大学第一附属医院感染科。病程中突出表现为体质量明显减轻,下降约15 kg,外院行上腹部CT检查示:肝大并密度减低,肝囊肿,腹膜后数个小淋巴结(图1a),诊断为“脂肪肝”。2020年1月24日出现腹痛于当地医院行“脾破裂切除术”,并送检肝脾病理(结果不详)。2020年5月24日出现腹胀加重,活动后双下肢水肿,休息后减轻,并出现双下肢“无处安放”,夜间睡眠差,外院检查肝功能:Alb 33.5 g/L, TBil 91.20 μmol/L, ALT 27 U/L,AST 85 U/L。肝血管成像示:下腔静脉肝后段细,肝内静脉显示不清;肝大,腹水(图1b)。骨髓穿刺示:增生骨髓象,可见异型淋巴细胞;给予对症支持治疗,腹胀、双下肢水肿较前减轻,夜间睡眠仍差。为明确诊断于本院就诊。
既往史:胆囊切除术1年余,有输血史 ,否认其他疾病史,无药物过敏史。个人史吸烟30年,平均2支/d,已戒烟;饮酒25年,每周2~3次,约150 g/次,已戒酒。家族史:父亲因肾衰竭已故,流行病学史无特殊。
入院查体前臂穿刺点可见瘀斑,胸前可见蜘蛛痣1个,有肝掌;巩膜轻度黄染,眼睑苍白。颈部可触及淋巴结肿大;口腔:颊黏膜以及下唇溃疡,右侧舌体有色素沉着;双肺听诊呼吸音清,未闻及干湿性啰音以及胸膜摩擦音。心率87次/min,律齐,各瓣膜区未闻及杂音。腹膨隆,无腹壁静脉曲张,左肋下可见约15 cm手术瘢痕;剑突下、肝缘下方有压痛,无反跳痛,肝肋下约8 cm,脾脏未触及,腹部叩诊浊音,移动性浊音阳性,听诊肠鸣音减弱,双下肢中度水肿。神经系统:扑翼样震颤、踝阵挛(-)。血常规:Hb 92 g/L,WBC 16.17×109/L,N% 74.4%,L%17.2%,PLT 83×109/L;肝功能:Alb 37.3 g/L,Glo 41.0 g/L,LDH 390 U/L,ALP 162 U/L,GGT 34 U/L,AST 60 U/L,ALT 30 U/L,TBil 142.2 μmol/L;肾功能:CysC 2.00 mg/L,Cr 68 μmol/L,BUN 11.76 mmol/L;凝血功能:PT 28.60 s,APTT 62.40 s,INR 2.66,PTA 27%,FIB 1.45 g/L;心肌酶谱:CK 291 U/L,CKMB 27 U/L;免疫八项:IgG 23.10 g/L,IgA 11.60 g/L,IgM 1.43 g/L;血清蛋白电泳:γ球蛋白24.40%,β2球蛋白12.10%,α2球蛋白3.50%,M蛋白 0;游离轻链:KAP轻链 77.7 g/L;LAM轻链80.30 g/L;KAP/LAM:0.97;C3 0.47g/L;IgG分型:IgG 18.90 g/L,IgG1 16.90 g/L,IgG4 1.17 g/L;血清免疫固定电泳、尿常规及24 h尿蛋白均阴性;心电图:窦性心律,心率87次/min,律齐,电轴不偏,QRS时限82 ms,QTc间期438 ms;心脏彩超:左室射血分数67%,左室舒缓功能减低。于2020年6月18日复查上腹部增强CT示:肝大,不均匀脂肪肝征象,肝右前叶稍低密度灶(图1c);为排除布加综合征,同日复查腹部大血管造影示:下腔静脉肝内段局限性狭窄,余正常(图1d);因患者出现神经系统症状,查头颅及椎体磁共振未见明显异常。为进一步明确诊断,于2020年6月24将“脾切除术”时肝脾标本送检西京医院病理科。肝脏免疫组化:CD34染色显示局部肝窦内皮血管化,CK7染色显示胆小管显著增生,HBsAg (-);特殊染色结果:Masson、PSA、PAS-D、铁染色未提示异常网织纤维局部破坏,刚果红(+)。脾脏:白髓结构消失,呈显著的淤血性改变,局部大量出血,血管壁可见红染无结构物沉积,刚果红染色提示为淀粉样变性(图2、3)。结合以上结果,最终确诊为AL。从累及心、肾严重程度进行危险分层和预后判断,梅奥2012分期为Ⅰ期,因TBil>34 μmol/L,为中危组。患者及家属拒绝进一步治疗,于出院1个月后因“肝衰竭”去世。
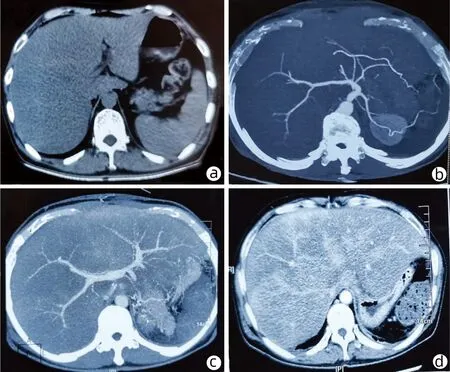
注:a,腹部平扫CT; b,肝血管成像; c, 腹部增强CT ; d, 腹部大血管造影。
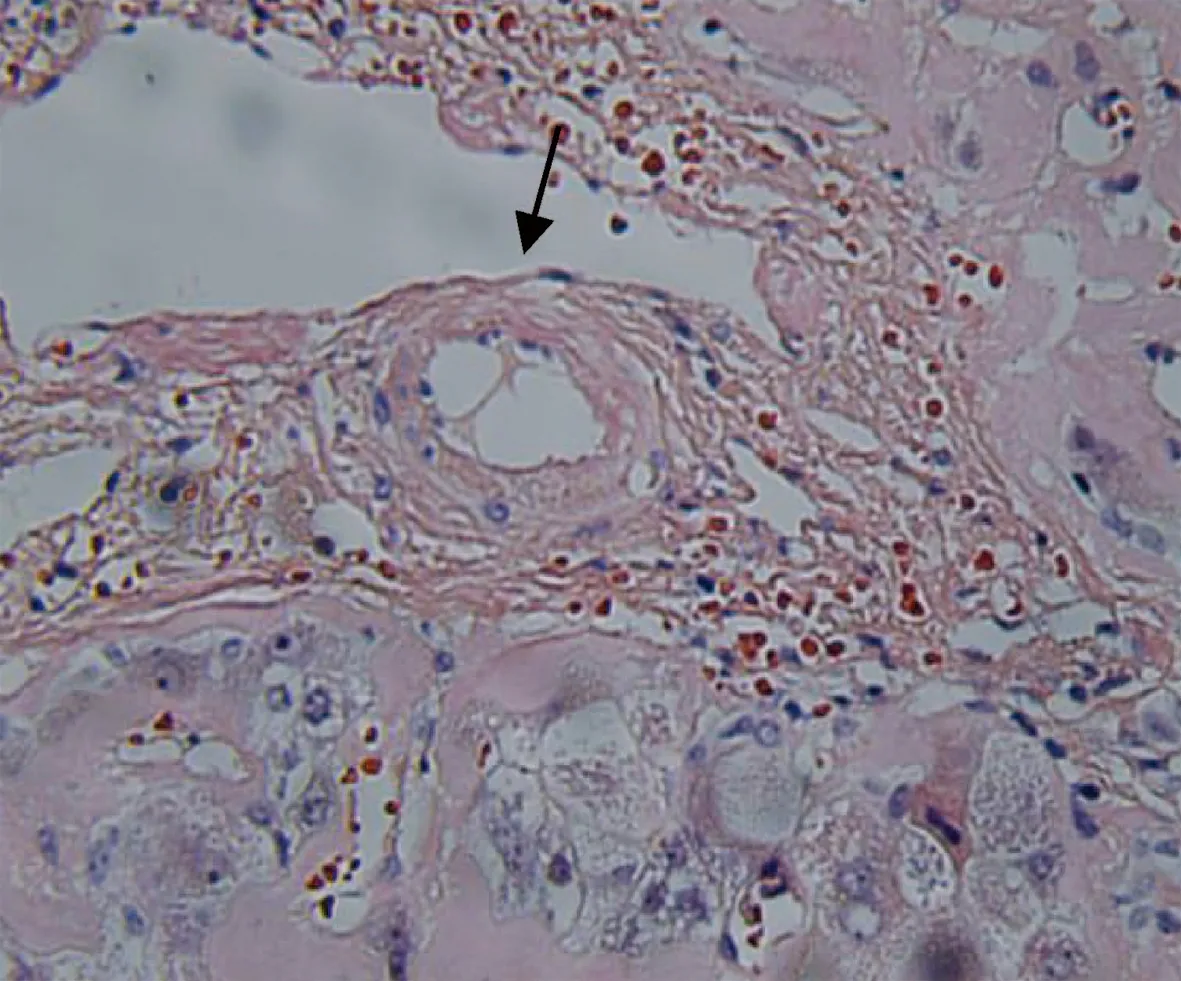
注:箭头示局部肝窦内皮血管化,胆小管显著增生。图2 肝组织刚果红染色(×100)Figure 2 Congo red staining of liver tissue(×100)
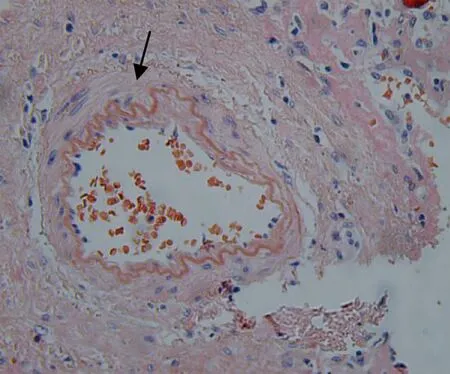
注:箭头示血管壁可见红染无结构物沉积。图3 脾组织刚果红染色(×100)Figure 3 Congo red staining of spleen tissue(×100)
2 讨论
AL是一组疾病,可累及全身各个系统。肾脏受累提示,24 h尿蛋白> 0.5 g/d,以白蛋白为主;心脏受累表现:在心电图中可呈现低电压,在心超中室壁平均厚度>12 mm[3];当影像学检查提示肝全长>15 cm,排除其他导致肝大原因,需警惕肝脏受累;神经系统受累多为周围神经病变及自主神经病变,表现为四肢感觉异常,低血压等[4];肺脏受累形式通常表现为弥漫性间质性,无特异性[5]。必要时各个系统的明确诊断均需病理诊断的支持。
目前,淀粉样变性病因、致病机理仍不明确。Shientag等[6]研究发现,在鸟类中,SSA基因中r52l突变可能是导致肝淀粉样变的遗传因素。而就所有疾病而言,无外乎遗传以及环境二者之间所占比例的多少以及相互交互作用。患者父亲死于肾衰竭,淀粉样变性可能性大。有研究[7]报道,该病在骨髓浆细胞染色体t(11;14)异常最常见,且遗传学异常与器官累及无显著关系,即同一家族不同个体间临床表现可能不同。Gunathilaka等[8]报道了1例可能由汽油导致的慢性肝损伤。在本病例中患者长期从事汽车修理行业,汽油与人类疾病,包括与肝病的关系,以及导致相关基因突变等问题越来越受到人们关注。
AL的标准治疗方案为硼替咗咪联合地塞米松或环磷酰胺+硼替咗咪+地塞米松[9]。目前新兴的AL治疗有非化学疗法[10],是基于AL淀粉样变是一种淋巴细胞增生性B淋巴细胞疾病,目的为清除浆细胞克隆。作为治疗终末期肝病的唯一有效方法,肝移植已经成为一种常规治疗手段[11]。我国的肝移植数量及质量达国际领先水平,而肝移植亟待解决的根本问题在于供体短缺。关于该病的预后,Palladini等[12]一项多中心研究报道,游离轻链水平的减少程度与存活率相关,Godara等[13]进一步发现游离轻链<10 mg/L时,全身性轻链淀粉样变性预后更好。
淀粉样变性发生率低,单纯影像学无法鉴别,且临床症状多样,需要反复询问病史,仔细查体,在排除病毒性肝炎、酒精性肝病、自身免疫性肝病、代谢性肝病、胆道疾病以及寄生虫导致的肝损伤外,应该考虑AL。
伦理学声明:本例报道已获得患者家属知情同意。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:李朵负责采集数据,分析数据,查阅文献,撰写论文;赵英仁、陈红梅负责设计课题,审阅文章内容并最终定稿。

