转录因子阴阳1在肝细胞癌中的作用
周 洁, 华芸豪, 王晓美, 牛俊奇
吉林大学第一医院 a.感染病与病原生物学中心 肝胆胰内科, b.感染控制科, 长春 130021
原发性肝癌是全球第六大常见癌症,也是癌症相关死亡的第三大原因。其中,肝细胞癌(HCC)占原发性肝癌的75%~85%,易复发转移,预后差,是一项全球重大健康问题[1]。
转录因子阴阳1(Yin Yang 1,YY1)是一种进化相对保守的锌指蛋白,属于GLI-Kruppel家族[2]。“Yin-阴”表示抑制,“Yang-阳”表示激活。其作为一种双向功能转录因子,既能发挥抑制基因表达的作用,也可发挥促进基因表达的作用[3]。YY1参与多种细胞生理过程包括细胞分化、自噬、凋亡、增殖和DNA修复等[4]。YY1调控基因转录的双重功能是由于其N端存在一个激活域,C端存在一个抑制域[5]。YY1已被证实在许多肿瘤中发挥重要作用。例如,YY1在胰腺导管腺癌中发挥抑癌作用[6],而在三阴性乳腺癌中促进肿瘤进展[7]。虽然个别报道[8-9]显示YY1在HCC癌组织中的表达低于癌旁组织,并抑制HCC进展,但越来越多的证据[10-13]表明YY1在HCC中表达上调,并通过调节HCC的癌症特征参与HCC的发生发展,包括维持增殖信号、抵抗细胞凋亡、激活侵袭和转移以及诱导肿瘤内血管生成等。此外,YY1高表达水平还与HCC的化疗、免疫治疗耐药性和不良预后密切相关。
1 YY1促进HCC发生
p53作为一种公认的抑癌基因,参与细胞周期、细胞凋亡、细胞衰老、DNA修复等多种细胞功能的调节。p53缺失促进HCC的发生[14]。YY1是p53的重要负调控因子。YY1通过抑制p53与p300的相互作用,从而抑制p53的转录活性,同时也阻断了p300介导的p53乙酰化。此外,YY1通过增强Mdm2(一种致癌泛素连接酶)与p53的相互作用,提高Mdm2介导的p53泛素化。总之,YY1通过调控p53的转录活性、乙酰化、泛素化和稳定性以减少p53蛋白总量[15]。Raf-1激酶抑制蛋白(raf-1 kinase inhibitor protein,RKIP)具有抑制MAPK通路和NF-κB通路的致癌活性的作用,而YY1可减少RKIP的转录,进而促进HCC的发生[16](图1)。CCAAT/增强子结合蛋白α(CCAAT/enhancer-binding protein alpha,CEBPA)是诱导肝细胞分化的重要转录因子。研究[13]表明,YY1可通过下调CEBPA的表达,抑制正常肝细胞的分化,并促进肝细胞发生癌变。
2 YY1促进HCC细胞增殖
HCC进展的一个共同特征是逃避增殖控制。YY1通过转录激活或转录抑制调控某些基因的表达,进而增强癌细胞的增殖能力。YY1是网钙结合蛋白2(reticulocalbin-2,RCN2)的上游转录因子,促进RCN2的表达[17]。而既往研究[18]表明,
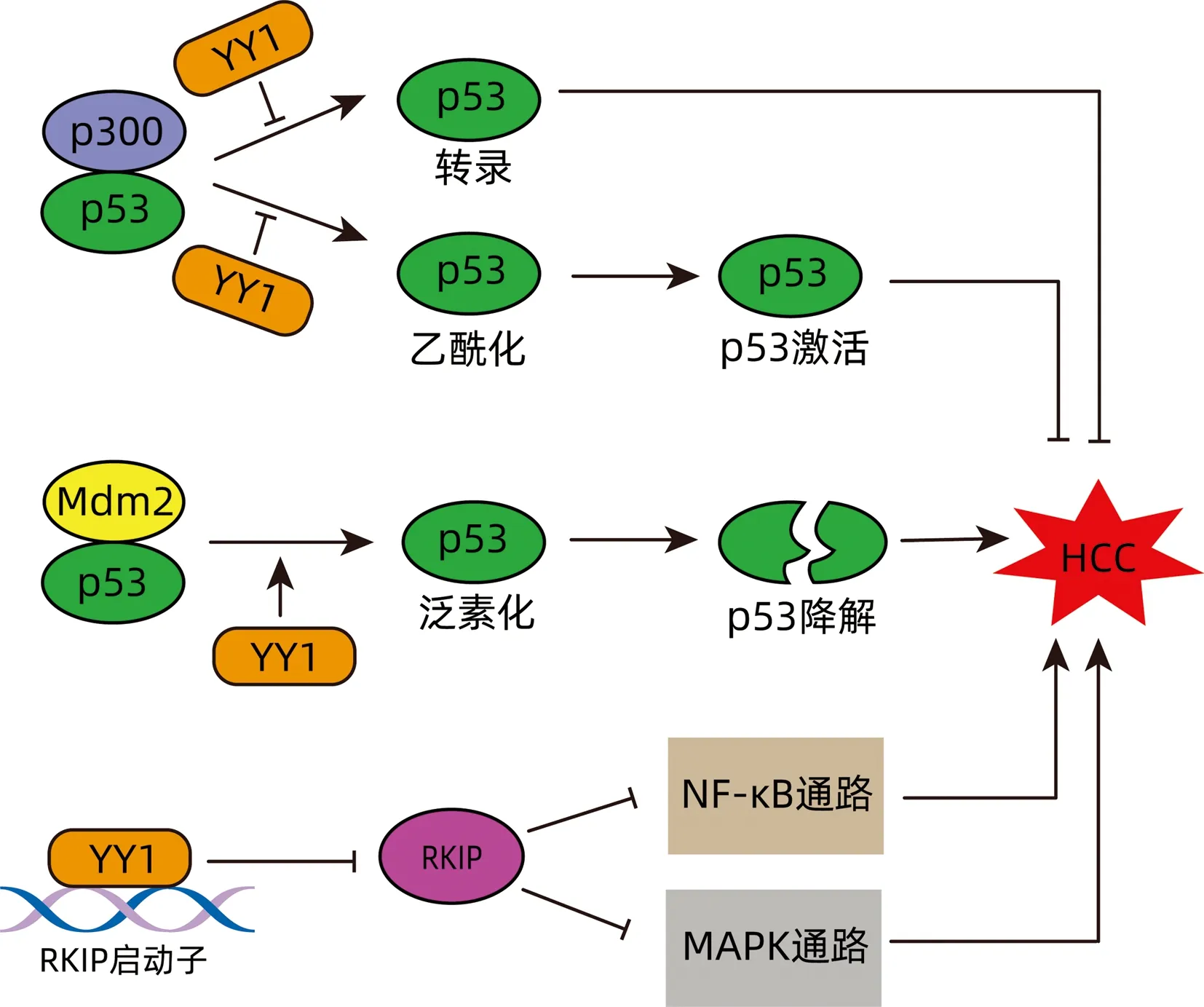
图1 YY1促进HCC发生Figure 1 YY1 promotes HCC occurrence
RCN2通过上皮生长因子受体(epidermal growth factor receptor,EGFR)-细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)通路促进HCC增殖,据此推测YY1通过调控RCN2的表达促进HCC细胞增殖。近年研究[12]发现,miR-34a-5p的过表达抑制肝癌细胞的增殖、迁移和侵袭,而YY1可通过抑制MYCT1(MYC target 1)转录,逆转miR-34a-5p对肝癌细胞增殖、迁移和侵袭的影响。此外,YY1还可介导Opa相互作用蛋白5-反义RNA1(Opa-interacting protein 5 antisense RNA 1,OIP5-AS1),通过Wnt途径促进HCC细胞增殖[19](图2)。
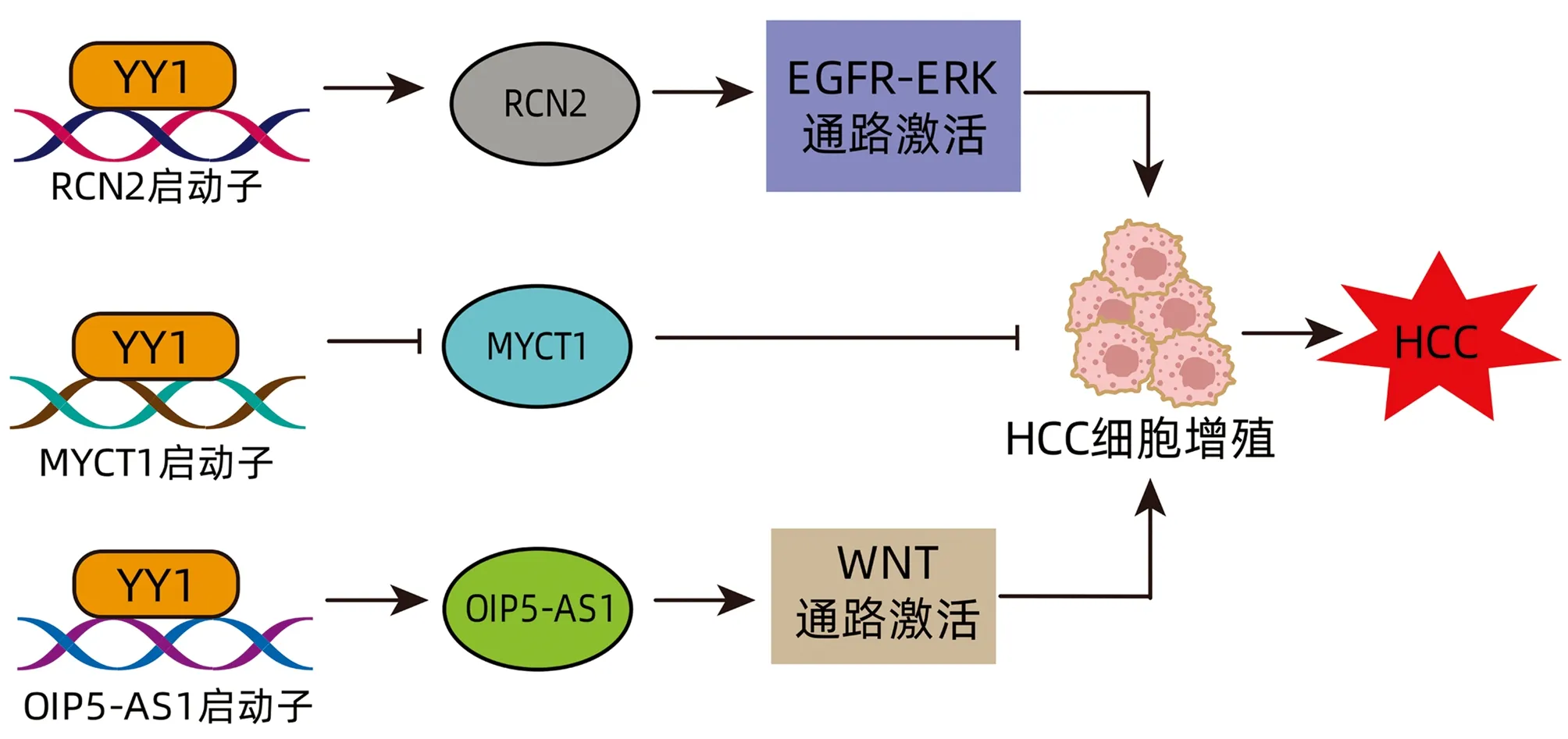
图2 YY1促进HCC细胞增殖Figure 2 YY1 promotes HCC cells proliferation
YY1缺失可抑制HCC细胞生长,并伴有明显的形态学改变[13]。在体外实验[11]中,下调SNU-387细胞系中YY1的表达水平后,细胞集落形成能力下降。在体内实验[11]中,LINC00668的下调明显抑制了HCC的生长,然而,YY1过表达恢复了LINC00668沉默对HCC的影响,使肝肿瘤体积和重量明显增加。由此推测,YY1可加速细胞增殖,促进HCC细胞生长。
YY1对细胞周期具有异常调控作用,可能参与调节细胞周期过渡的检查点功能。过表达的YY1诱导DNA合成,驱动G0/G1细胞进入S期[20]。除了细胞周期调节外,肿瘤细胞可通过逃避细胞衰老,维持增殖信号。CDKN2A是与细胞衰老相关的抑癌基因之一,其编码的p16-INK4a(一种细胞周期依赖性蛋白激酶抑制因子)在细胞周期进展、细胞分化、细胞衰老和细胞凋亡中起关键作用[2]。YY1通过抑制p16-INK4a的转录,导致肿瘤细胞逃避衰老[21]。YY1还通过促进DNA修复,介导肿瘤细胞逃避DNA损伤诱导的衰老[2]。总之,上述研究显示出YY1在促进HCC细胞增殖中具有突出作用。
3 YY1抑制HCC细胞凋亡
细胞凋亡是一种基因程序性细胞死亡,是机体的一种自我保护机制,用以清除不需要的细胞或异常的细胞,属于细胞的自杀行为。细胞凋亡机制高度保守并受严格调控。而肿瘤细胞有别于正常细胞,即使在DNA损伤和致癌基因激活后仍然能够逃逸凋亡。细胞凋亡的失败与肿瘤的发展和肿瘤对治疗药物的抵抗密切相关。YY1可通过打破凋亡-抗凋亡平衡,保护肿瘤细胞存活,并通过激活自噬,帮助肿瘤细胞抵抗死亡[2]。
在HCC发展过程中,NF-κB激活是一个常见的早期事件。NF-κB是细胞存活的主要调控因子。YY1过表达有助于HCC中NF-κB的激活。YY1可通过NF-κB信号通路诱导细胞凋亡抵抗,促进HCC的生长[22]。RKIP可促进药物诱导的细胞凋亡[23],而YY1可减少RKIP的转录进而抑制细胞凋亡[16]。肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor related apoptosis inducing ligand,TRAIL)是一种死亡配体,能够诱导HCC细胞发生凋亡[24]。TRAIL通过与死亡受体TRAIL-R1(也称为DR4)和TRAIL-R2(也称为DR5)结合,诱导肿瘤细胞凋亡[25]。研究[25]显示,YY1可与TRAIL-R2(DR5)的启动子直接结合,并降低TRAIL-R2(DR5)启动子的活性。抑制YY1将上调TRAIL-R2(DR5)的表达,进而使肿瘤细胞对TRAIL诱导的凋亡敏感。由此表明,YY1可抑制TRAIL诱导的细胞凋亡(图3)。
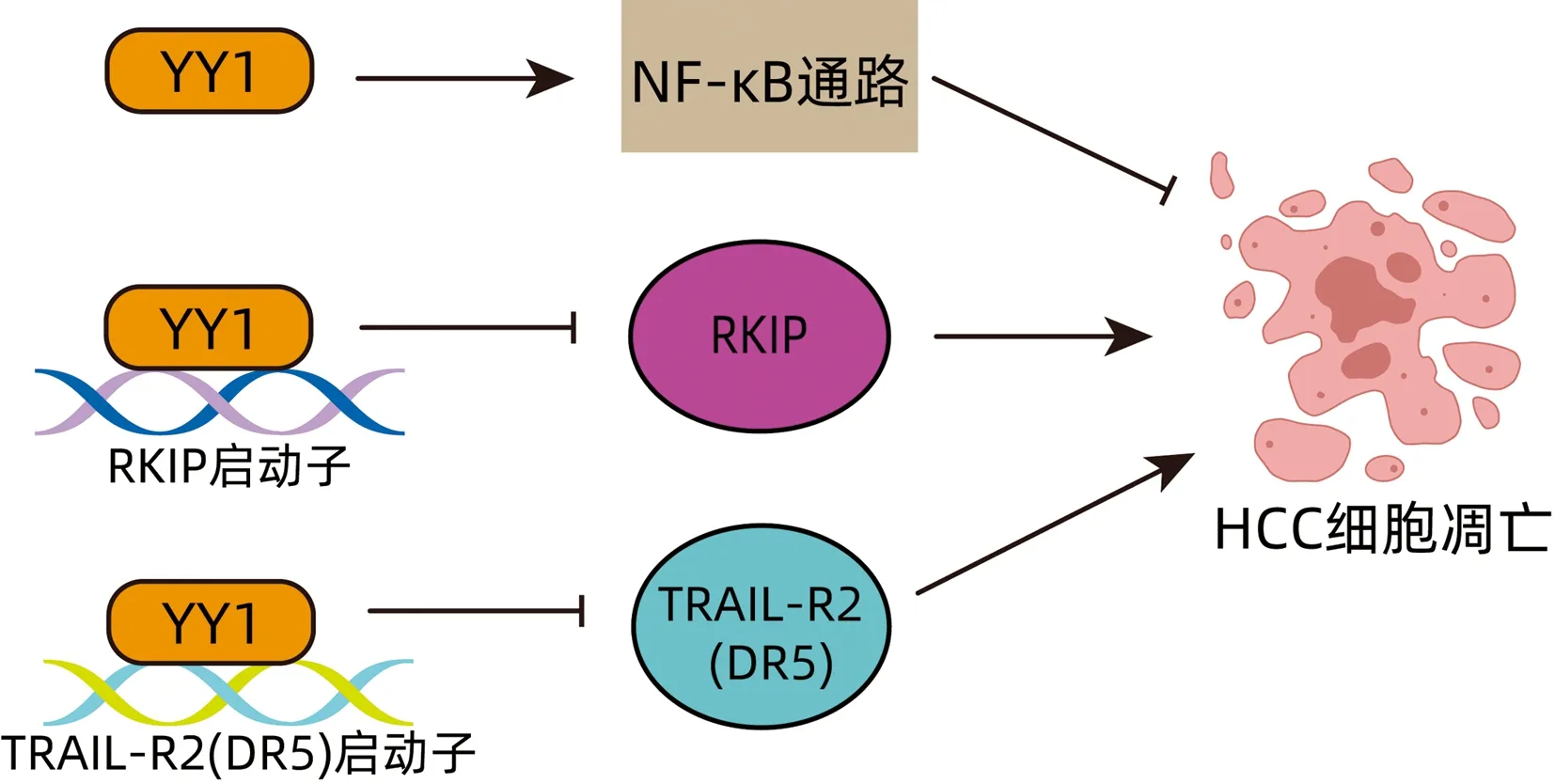
图3 YY1抑制HCC细胞凋亡Figure 3 YY1 inhibits apoptosis of HCC cells
4 YY1促进HCC侵袭和迁移
众所周知,肿瘤细胞可发生恶性转化,改变其特征,出现上皮-间质转化(epithelial-mesenchymal transition,EMT),并转移至其他组织[26]。恶性转化细胞获得了一种运动侵袭表型,使其能够通过血液或淋巴扩散。EMT在肿瘤进展中起着关键作用[27],其与侵袭性的获得有关,是转移的第一个关键限制步骤[2]。EMT是上皮细胞失去细胞极性和细胞间黏附成为迁移性间充质干细胞的过程。与正常细胞相比,间充质干细胞具有更强的迁移能力、侵袭性和更高的抗凋亡能力[28]。EMT激活后,E-cadherin的表达被抑制,导致上皮细胞典型的多边形、鹅卵石状形态丧失。细胞获得梭形间充质细胞形态,并表达与间充质细胞状态相关的标志物,特别是N-cadherin和Vimentin[29]。YY1表达升高有助于细胞发生EMT,增加癌细胞转移的潜能。在HCC中,YY1和p65、p300形成YY1/p65/p300复合物,与QKI(Quaking,一种RNA结合蛋白)的超级增强子和启动子结合,导致QKI的异常激活。异常激活的QKI可导致EMT的发生和肿瘤的转移[27]。据报道[2],YY1还可通过抑制核内不均一核糖核蛋白M(heterogeneous nuclear ribonucleoprotein M,hnRNPM)的转录,调节EMT的关键激活因子Twist相关蛋白1,从而诱导EMT的发生。此外,YY1可与Snail的3′增强子区域直接结合,诱导Snail的表达[30]。过表达的Snail通过直接下调上皮标志物E-cadherin[31]和Claudin[32],上调间充质标志物Vimentin[33]、N-cadherin[34]和fibronectin[35],导致细胞发生EMT,使癌细胞获得间充质细胞的侵袭和迁移特性。上述研究清楚地表明,YY1可通过调控QKI、hnRNPM、Snail等基因,促进EMT的发生(图4)。
5 YY1促进HCC血管生成
肿瘤细胞由于增殖速度加快,往往处于缺氧和营养不良的微环境,尤其是位于实体肿瘤中心的肿瘤细胞。为了适应这种微环境,肿瘤细胞改变代谢途径,诱导异常肿瘤血管生成,以满足自身对氧和营养物质的需求。血管生成是由血管生成因子如血管内皮生长因子(vascular endothelial growth factor,VEGF)、血管生成素-1、成纤维细胞生长因子2(fibroblast growth factor 2,FGF2)和血小板源性生长因子B(platelet-derived growth factor B,PDGFB)等刺激产生的内在过程[36]。VEGF是用于检测肿瘤组织血管生成最为重要的因子之一。在HCC中,YY1通过结合VEGFA的启动子,促进VEGFA的转录活性。HCC细胞分泌的VEGFA在体外促进血管内皮细胞的管状形成、细胞迁移和侵袭,在体内促进肿瘤生长和血管生成[10]。YY1 还可调控低氧诱导因子-1α(Hypoxia inducible factor-1α,HIF-1α),增加血管生成。HIF-1α的表达与急性缺氧反应有关,YY1可在低氧的条件下增加HIF-1α的稳定性,从而使HIF-1α积累增多,而HIF-1β在常氧和缺氧条件下均有表达[37]。HIF-1α和HIF-1β组成的HIF-1复合物激活促进血管生成的基因,如VEGF、FGF2和PDGFB等[2]。通过体外血管生成实验观察到,沉默YY1可降低血管密度。在体内实验中,沉默YY1可减少体内新生血管形成[38]。此外,YY1作为DNA结合蛋白果蝇Eph激酶(drosophila Eph kinase, DEK)转录的正调控因子,促进DEK表达[39],而DEK上调可增强VEGF的表达,刺激新生血管形成[40]。总之,现有证据表明,YY1对肿瘤血管生成的调控涉及一个复杂的多途径机制,该机制基于血管生成基因的直接和间接激活(图5)。
6 YY1对HCC化疗和免疫治疗耐药性的影响
大多数HCC对常规化疗药物耐药。细胞毒性药物如阿霉素或顺铂对HCC治疗通常无明显效果[41]。近年来,YY1被报道可通过调控下游基因的表达影响癌细胞对化疗药物的敏感性和耐药性。例如,有报道[42]称,组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACi)可诱导HCC细胞凋亡并抑制细胞增殖,而YY1可降低体外HCC细胞对HDACi的敏感性。在HDACi治疗下,YY1过表达可显著促进HEPG2细胞增殖并抑制细胞凋亡,从而减弱HDACi对HCC的抑制作用。因此,YY1与HCC对化疗药物的敏感性和耐药性有关。
当前,免疫治疗在实体肿瘤治疗领域快速发展,使得其在HCC方面的应用得到越来越多的关注。程序性死亡受体-1(programmed death 1,PD-1)是T淋巴细胞表面的免疫抑制蛋白。PD-1配体(PD-L1)与PD-1结合,抑制慢性炎症、感染或癌症中的T淋巴细胞活性,促进T淋巴细胞凋亡[43]。免疫诱导的肿瘤细胞PD-L1表达被认为是肿瘤细胞应对免疫挑战的适应性抵抗机制[44]。PD-L1的表达水平可能与细胞毒性T淋巴细胞介导的抗肿瘤免疫治疗的反应不良相关[45]。YY1可通过多种途径影响PD-L1的表达。YY1作为p53的负调控因子,抑制p53的激活[15],而p53可通过miR-34a负调控PD-L1的表达[46]。YY1还可能通过激活IL-6和信号传导转录激活因子3转录而导致PD-L1的上调[45]。总之,YY1正调控PD-L1的表达,从而在免疫耐药中发挥作用。

图4 YY1促进HCC侵袭和迁移Figure 4 Fig 4 YY1 promotes HCC invasion and migration
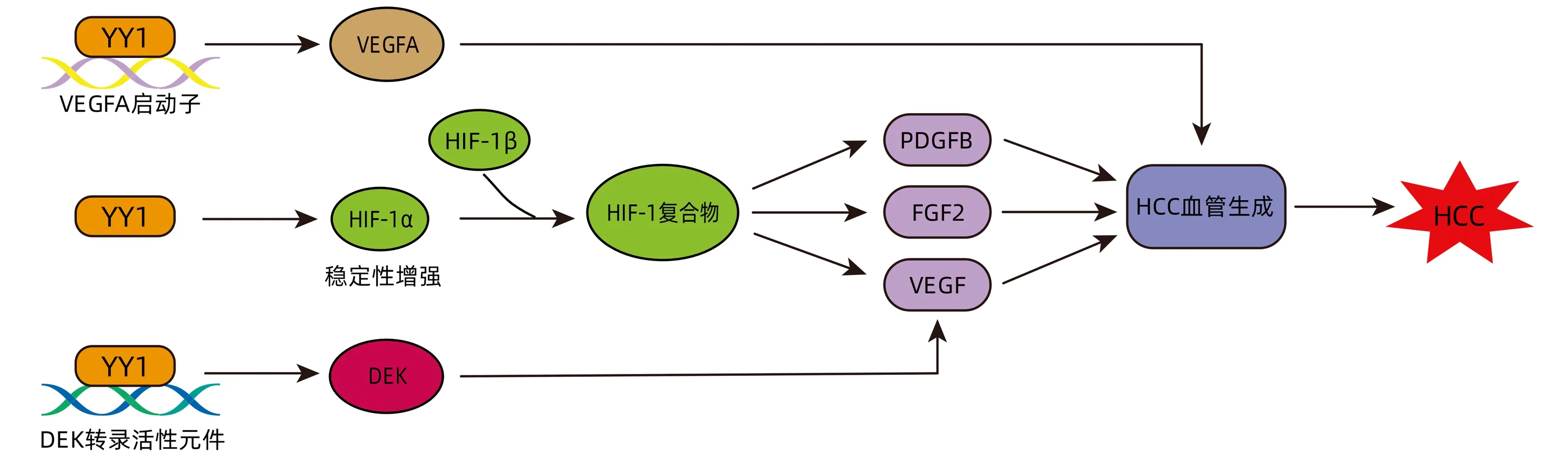
图5 YY1促进HCC血管生成Figure 5 YY1 promotes HCC angiogenesis
因此,YY1抑制剂和抗肿瘤药物的联合治疗,可能会逆转化疗、免疫治疗的耐药性,成为针对HCC治疗的一种选择。
7 YY1对HCC预后的影响
目前,由于HCC患者起病早期无明显临床症状,绝大部分患者发现时已进展至HCC中晚期,失去了最佳治疗时机,导致HCC患者生存期短、预后差。据报道[47],YY1高表达与较高的AJCC分期和小血管浸润程度显著相关。相较于肿瘤体积分期为T1、T2的患者,T3、T4期患者呈更高的YY1表达水平。肿瘤分期越晚(Ⅲ+Ⅳ)、组织学分化越差(Ⅲ+Ⅳ)的患者中 YY1 表达显著增加[48]。同时,相较于YY1表达水平低的患者,YY1表达水平高的患者中位生存期较短[47-48]。另有报道[22]显示,YY1在HCC中表达上调,并与HCC晚期患者的生存率低相关。Han等[27]通过分析YY1在正常肝、癌旁非癌肝组织和HCC组织中的表达,也获得了一致的结果,YY1在生存时间较短的HCC患者中呈高表达,并且YY1表达水平与HCC患者临床分期、病理分级呈正相关。YY1高表达提示肿瘤病情恶化,预后不良。
8 小结
综上所述,虽然大量证据支持YY1促进HCC发生发展,但仍有少量报告显示YY1抑制HCC进展,故其在HCC中的作用仍然存在争议。YY1对HCC的调控机制是多途径的过程。YY1具有双向调节功能,其在HCC发生发展中的整体调控功能可能依赖于组织环境以及相互作用因子。在不同病因的HCC患者中,不同的细胞环境导致YY1与不同的蛋白质发生优先相互作用,从而产生不同的调控功能。YY1在HCC中的作用机制尚不完全清楚。因此,进一步深入研究YY1的结构、功能及其与其他蛋白质的相互作用,不仅有助于理解YY1在HCC中的作用,而且有助于为HCC的治疗和药物靶点的研发提供新思路。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:周洁负责资料搜集,资料分析与总结,撰写论文;华芸豪参与搜集资料,修改论文;王晓美负责拟定写作思路,指导撰写文章;牛俊奇负责论文写作方向设计并最后定稿。

