基于细菌磁小体-核酸适配体的赭曲霉毒素A富集纯化方法研究
潘 程,刘晓萌,张云鹏,邹球龙,张晓琳,陈 新,印 铁
(北京市畜产品质量安全源头控制工程技术研究中心;中粮营养健康研究院有限公司1,北京 102209) (武汉轻工大学生物与制药工程学院2, 武汉 430023)
赭曲霉毒素A(OTA)是一类由氯化的异香豆素类似物和苯丙氨酸通过酰胺键连接而成的无色透明晶体化合物。OTA污染在玉米、小麦、大麦、花生等农作物中时有发生[1]。OTA主要由曲霉菌(Aspergillus)和绿青霉菌(Penicillum)产生,而造成OTA产生的主要因素为作物种植、运输、储存过程中环境温度过高或湿度过大,导致霉菌滋生[2,3]。毒理学研究表明,高剂量的OTA通过消化道进入人体和动物体后,会严重破坏机体肝脏、肾脏等多个器官,造成机体的免疫能力下降,生殖能力降低,同时还会引起DNA损伤,具有致癌、致畸、致突变等危害[4],因此国际癌症研究机构(IARC)将其列为可能致癌物质(IIB类)[5]。GB 2761—2017《食品安全国家标准 食品中真菌毒素限量》规定食品中OTA的限量为5 μg/kg[6]。
目前,常用的OTA检测方法有荧光光度法、高效液相色谱法(HPLC)、免疫胶体金法、酶联免疫法等[7-10]。由于OTA在样品中痕量存在,检测过程中样品的前处理技术尤为重要。常用的样品前处理技术包括固相萃取(SPE)、液-液萃取(LLE)、免疫亲和柱(IAC)以及QuEChERS,然而这些前处理技术普遍存在操作繁琐、耗时长、有机溶剂消耗量大、重复性低、假阳性率高、成本高等问题。
核酸适配体(APT)是一段具有高特异性、高亲和力、化学性质稳定、易于结构修饰的单链寡核苷酸序列,长度通常为10~100 bp,目前主要通过指数富集系统进化技术(SELEX)筛选得到。可在体外与配体(细胞、蛋白、真菌毒素、食源性致病菌、重金属离子、药物残留、食品添加剂)通过氢键、静电力、碱基互补配对等方式特异性结合,形成复杂的三维空间构象,如假结、G-四分体、凸环等[11-18]。因其作用与抗体相似,常被称作“化学抗体”,在真菌毒素检测领域受到广泛关注[19-21]。Wang等[22]基于Cy5荧光标记的适配体与靶标物特异性结合的原理, 建立了基于适配体互补链同时检测OTA和黄曲霉毒素B1(aflatoxin B1, AFB1)的方法;Zhao等[23]以特异性的核酸适配体作为识别元件,制备了黄曲霉毒素B1(AFB1)的适配体亲和柱(AAC),用于AFB1的特异性识别和富集;Tan等[24]基于介孔二氧化硅纳米粒子(MSN)和核酸适配体特异性,设计一种新颖、简单的AFB1检测方法。细菌磁小体(BMs)是一种由趋磁细菌(Magnetospirillumgryphiswaldense)合成的具有细胞质膜包被的生物纳米磁性材料,具有粒径均一、分散性好、趋磁性、易修饰、无细胞毒性等优点,在药物靶向治疗、生物工程、检疫检测和环境治理等领域具有广阔的应用前景[25]。
本实验选用细菌磁小体和核酸适配体复合体作为吸附材料,建立了一种富集和纯化OTA的新方法。将氨基修饰过的核酸适配体连接到细菌磁小体表面,利用功能性细菌磁小体对OTA进行富集和纯化,并结合HPLC对细菌磁小体上的OTA进行定量检测,并对影响萃取效率的各个因素进行优化。与免疫亲和柱法对比,该方法具有操作简便,检测成本低等优势,在样品前处理技术领域具有较大的研发潜力。
1 材料与方法
1.1 仪器与试剂
5810R型高速离心机,AL140型电子分析天平,冷冻干燥机,超声破碎仪,凝胶电泳仪,全向动立式高压灭菌锅,-80 ℃冰箱。
OTA的适配体序列5′-NH2-GATCGGGTGTGGGTGGCGTAAAGGGAGCATC GGACAGATTG-3′、赭曲霉毒素A、趋磁细菌MSR-1、超纯水、Tris、氯化钠、氯化钾、磷酸氢二钠、磷酸二氢钾、乳酸钠、磷酸氢二钾、七水硫酸镁、酵母提取物、硫代乙醇酸钠、氯化铵、氨三乙酸、硫酸镁、硫酸锰、硫酸亚铁、硫酸钴、氯化钙、硫酸锌、硫酸铜、硫酸铝钾、硼酸、钼酸钠、氯化镍、亚硒酸钠、三水氯化铁、饱和氨水溶液、菲啰嗪、盐酸羟胺、柠檬酸铁等。
1.2 趋磁细菌MSR-1的发酵培养及细菌磁小体的制备
1.2.1 趋磁细菌种子培养基(1 L)
乳酸钠(>60%)1.5 g,磷酸氢二钾0.5 g,七水硫酸镁0.1 g,酵母提取物0.1 g,硫代乙醇酸钠0.05 g,10×矿质元素混合液 0.5 mL,pH 7.0,121 ℃灭菌30 min。
1.2.2 趋磁细菌发酵培养基(4.5 L)
乳酸钠(>60%)4.0 g,氯化铵1.0 g,磷酸氢二钾3.0 g,七水硫酸镁1.2 g,酵母提取物3.0 g,10×矿质元素混合液 3.5 mL,pH 7.0,121 ℃灭菌30 min。
1.2.3 发酵补料培养基(1 L)
乳酸(>95%)200.0 g,饱和氨水溶液36.0 mL,磷酸氢二钾6.0 g,七水硫酸镁2.4 g,酵母提取物6.0 g,10×矿质元素混合液7.0 mL,三水氯化铁4.0 g,121 ℃灭菌30 min。
1.2.4 10×矿质元素液(1 L)
氨三乙酸15.0 g,七水硫酸镁30.0 g,硫酸锰5.0 g,氯化钠10.0 g,硫酸亚铁1.0 g,硫酸钴1.8 g,氯化钙1.0 g,硫酸锌1.8 g,硫酸铜0.1 g,硫酸铝钾0.2 g,硼酸0.1 g,钼酸钠0.1 g,氯化镍0.25 g,亚硒酸钠0.003 g,121℃灭菌30 min。
1.2.5 趋磁细菌MSR-1(MagnetospirillumgryphiswaldenseMSR-1)发酵培养
趋磁细菌MSR-1发酵种子活化:5 mL保存于-80 ℃冰箱中的趋磁细菌MSR-1接种于50 mL趋磁细菌种子培养基(分装于容积130 mL血清瓶中),30 ℃,100 r/min培养24 h。活化2次后,将50 mL菌液接种于500 mL种子培养基(分装于1 L三角瓶),30 ℃,120 r/min培养24 h至OD600≈0.8。
趋磁细菌MSR-1发酵培养:将500 mL趋磁细菌MSR-1种子培养液全部接种于灭菌后的发酵罐中,初始培养条件为:通气0.3 L/min,100 r/min搅拌,以补料培养基作为酸溶液控制pH=6.9。接种后培养约10 h至DO≈10%,调通气量至0.5L/min,待DO降至<1%,缓慢增加转速及通气量,控制DO<1%。每隔2 h取1次样,发酵36 h左右,至Cmag值开始明显下降作为发酵培养重点。
1.2.6 细菌磁小体的制备
将获得的趋磁细菌湿菌体与10 mmol/L PBS 缓冲液以1∶10混合,重悬细胞,250 W超声破碎30 min,超声3 s,间隔5 s。破碎后的细胞置于钕铁硼磁铁上静置过夜,弃去上清;加入100 mmol/L 10 mmol/L PBS缓冲液,重复该过程,直至光学显微镜100倍物镜下未见明显的细胞碎片,将纯化制备的细菌磁小体冷冻干燥,于-20 ℃保存。
1.2.7 趋磁细菌磁响应能力(Cmag)测定
使用经改装后的分光光度计(在分光光度计检测样品室周围添加线圈,以添加垂直于管路和平行于光路的磁场)检测发酵菌液在565 nm处的吸光度。以水作为空白对照,分别测量发酵菌液在垂直于光路磁场(OD⊥)和平行于光路磁场(OD∥)下的吸光度值,Cmag=(OD⊥/ OD∥)-1(OD⊥:垂直光路磁场条件下测定波长600 nm处样品的吸光度,OD∥:平行光路磁场条件下测定波长600 nm处样品的吸光度)。
1.3 核酸适配体修饰的功能性细菌磁小体的构建
将冷冻干燥后的细菌磁小体悬浮于1 mL 0.01 mmol/L PBS(pH 7.4)中,配制成1 mg/mL的细菌磁小体混悬液,分别移取1 mL细菌磁小体混悬液,1 mL 25%戊二醛溶液和3 mL 0.01 M PBS于10 mL离心管中,使用超声波清洗器对混合液进行超声处理(超声1 min,间隔4 min,重复12次),反应结束后,将离心管置于磁力架上分离上清液,用1 mL PBS清洗3次后弃上清。加入含有1 nmol OTA适配体和10 μL 5 μg/kg OTA的混合物,加PBS至终体积为100 μL超声混匀(超声1 min,间隔4 min,重复12次),取上清液检测OTA残留量,计算该复合物对OTA的吸附效果。
1.4 高效液相色谱检测条件
色谱柱为C18反相色谱柱,250 mm×4.6 mm,粒径 5 μm;柱温:40 ℃;流动相:乙腈∶水∶乙酸=48∶51∶1;激发波长:333 nm,发射波长:460 nm;进样量:10 μL;流速:1.0 mL/min。
1.5 数据分析
使用SPSS 20.0进行统计分析。采用最小方差分析法比较概率水平为0.05时,不同处理的平均值的显著性差异。

图1 发酵过程中趋磁细菌MSR-1生长曲线,溶氧值及磁响应水平的变化
2 结果与讨论
2.1 趋磁细菌MSR-1发酵培养及细菌磁小体的制备
发酵培养时间为40 h,在培养过程中每隔2 h取1次,使用紫外分光光度计检测趋磁细菌MSR-1生长情况及磁响应情况。结果如图1所示,发酵至10 h后发酵培养基中溶氧值(DO)降至1%以下,趋磁细菌细胞进入磁小体快速合成阶段,细胞磁响应值迅速上升,至发酵第24 h磁响应值达到最高。发酵至34 h时,细胞磁响应值开始下降,至40 h发酵培养结束。将发酵液高速离心(4 000 r/min,15 min)收集细胞,按1.2.6所述方法纯化细菌磁小体,冷冻干燥后保存于-20 ℃冰箱待用。
2.2 OTA标准曲线的制定
用流动相稀释OTA标准品母液,使OTA的浓度分别为0.5、1、2、3、5、8、10、15、20 μg/L,利用HPLC进行检测,绘制标准工作曲线。以峰面积为Y,对OTA的浓度为X轴绘制线性回归曲线,以信噪比S/N=3确定方法的检出限,信噪比S/N=10确定方法的定量限。OTA标准曲线参数见表1。

表1 OTA的标准曲线参数
2.3 核酸适配体修饰的功能性细菌磁小体的构建及优化
新型核酸适配体修饰的细菌磁小体的制备采用氨基-醛基-氨基交联的固定化方法,即先将一定量的戊二醛吸附到表面含有氨基的载体上,再添加经过氨基修饰的APT,通过胺醛缩合反应形成BMs-戊二醛-APT复合物。反应原理及流程见图2。

注:a 带氨基的BMs;b 戊二醛;c BMs-戊二醛复合物;d 氨基修饰的APT;e OTA;f BMs-戊二醛-APT-OTA复合物。图2 磁小体-戊二醛-适配体复合物结合过程
2.3.1 核酸适配体修饰功能性细菌磁小体构建方式的优化
为促进APT与OTA的结合,本实验首先对复合物的构建方式进行了优化。首先,制备两个BMs-戊二醛的复合物,分别标记为A和B,在A管中先加入含量为0.1 nmol APT,超声处理使APT连接在细菌磁小体上,再加入10 μL 50 μg/kg OTA标准品,加入PBS缓冲液至终体积为100 μL,超声处理12次后,将离心管置于磁力架上,待磁小体全部吸附于管壁时,取上清液进行HPLC分析;先将APT与OTA进行结合(体系与A管体系相同),随后将混合液移至B管中,加入PBS缓冲液至终体积为100 μL,超声混匀后,置于磁力架上静置,取上清液进行HPLC分析。结果显示,BMs-戊二醛复合物依次与APT和OTA结合时,复合物对OTA的吸附效果较差,吸附率仅为57%;当戊二醛-BMs复合物与APT-OTA的混合液结合时,复合物对OTA的吸附效果较好,吸附率为83%,其吸附效果显著高于BMs-戊二醛复合物依次与APT和OTA结合的处理方式(P<0.05)。因此,本研究中核酸适配体修饰功能性细菌磁小体构建方式为:先将APT和OTA结合,再与BMs-戊二醛复合物反应。
2.3.2 APT添加量的优化
APT是特异性识别与吸附OTA的关键组分,其含量的确定对复合物的富集效果有较大影响。选择APT添加量分别为0.1、0.5、1.0、1.5、2.0、2.5、3.0 nmol,研究其对OTA吸附率的影响,结果如图3所示,随着APT物质的量的增加,该复合物对OTA的吸附效果逐渐升高随后降低,当APT的添加量为1 nmol时,该复合物对OTA的吸附效果最好,吸附率达到96%。因此选择1 nmol作为最佳APT含量。

图3 不同因素对OTA吸附效果的影响
2.3.3 戊二醛含量的优化
使用戊二醛作为双功能试剂分别连接细菌磁小体和APT,以实现APT的固定化及溶液中OTA的回收。如图3所示,一定范围内,随着戊二醛浓度的提高,BMs-APT复合物对OTA的吸附率增大,当戊二醛体积分数为25%时,APT在细菌磁小体上的固定化效果最好,BMs-APT复合物对OTA的吸附量最高达到95%。
2.3.4 BMs含量的优化
由于BMs为纳米磁性颗粒,其自身具有磁性聚沉的特性,过多的BMs添加量可能会导致聚沉严重,减少复合物有效表面积,因此合理优化BMs添加量具有重要意义。如图3所示,当BMs的添加量在0.1~1.5 mg/mL范围内时,BMs-APT复合物对OTA的吸附效率呈上升趋势;当BMs的质量浓度大于1.5 mg/mL时,BMs-APT复合物对OTA的吸附效率逐渐趋于平稳状态,因此选用1.5 mg/mL作为BMs的最佳添加量。
2.3.5 戊二醛与BMs连接次数的优化
BMs表面丰富的亚氨基残基,是对其进行表面修饰的关键位点。基于BMs-APT复合物构建原理,推测BMs表面连接的戊二醛越多,捕获APT-OTA复合体能力越强。研究连接次数对OTA吸附率的影响,将1 mg BMs与25%戊二醛混合,超声混匀1 min,静置4 min,重复操作12次记为连接1次;结果表明,随着连接次数的增加,BMs吸附APT-OTA复合物的效率逐渐降低。推测可能原因:由于BMs为单磁筹纳米磁性颗粒,在每一次连接后更换戊二醛溶液的过程中,部分BMs随溶液流失,导致溶液中磁小体总量不断减少,从而导致APT-OTA复合物对OTA吸附率下降。
2.3.6 洗脱液的选择及洗脱条件优化
为将结合在BMs-APT复合物上的OTA释放出来,以便于OTA的回收与检测,利用沸水浴、甲醇洗脱、NaOH洗脱及DNaseI酶解4种方式处理结合OTA后的BMs-APT复合物,通过对BMs细胞膜或APT结构进行破坏,达到释放OTA的目的。结果显示,沸水浴10 min并不能有效释放OTA(OTA回收率仅20%,其中回收率=OTA检测浓度/富集前OTA浓度×100%),经过甲醇及NaOH洗脱、OTA回收率分别为65%、50%,经DNaseI酶解后,OTA回收率为57%。沸水浴、甲醇洗脱、NaOH洗脱方式均通过破坏BMs细胞膜的方式进行OTA的释放,DNaseI酶解则通过破坏APT结构的方式释放OTA,综合考虑,通过甲醇洗脱与DNaseI酶解相结合的方式可能会达到较好的效果。
分别以沸水浴、甲醇、NaOH溶液、DNaseI酶进行2次洗脱,计算OTA回收率;先用DNaseI酶对BMs-APT-OTA复合物进行酶解(反应条件:37 ℃,2 h),再用沸水浴、甲醇、NaOH分别对酶解后BMs进行处理,计算OTA回收率。结果如图4所示,沸水浴洗脱2次回收率为27%;甲醇洗脱2次回收率为72%;NaOH溶液洗脱2次回收率为54%;通过DNaseI酶解2次回收率为72%;DNaseI酶+甲醇(1次)洗脱回收率为91%;DNaseI酶+甲醇(2次)洗脱回收率为96%;DNaseI酶+NaOH(1次)洗脱回收率为57%;DNaseI酶+NaOH(2次)洗脱回收率为62%。因此选择DNaseI酶+甲醇(2次)作为最佳洗脱条件。

注:1.沸水浴2次;2.甲醇洗脱2次;3.NaOH溶液洗脱2次;4.DNaseI酶解2次;5.DNaseI酶+甲醇(1次);6.DNaseI酶+甲醇(2次);7.DNaseI酶+NaOH(1次);8.DNaseI酶+NaOH(2次)。图4 不同洗脱条件对OTA的洗脱率的影响
2.3.7 BMs-APT复合物与免疫亲和柱吸附/回收效果对比
以免疫亲和柱为对照,评估BMs-APT复合物对OTA的吸附/回收性能。结果如图5所示,在低浓度(<0.5 μg/L)条件下,免疫亲和柱对OTA的吸附及回收效果优于BMs-APT复合物;当溶液中OTA浓度高于1 μg/L,BMs-APT复合物与免疫亲和柱对OTA吸附/回收性能基本相当。
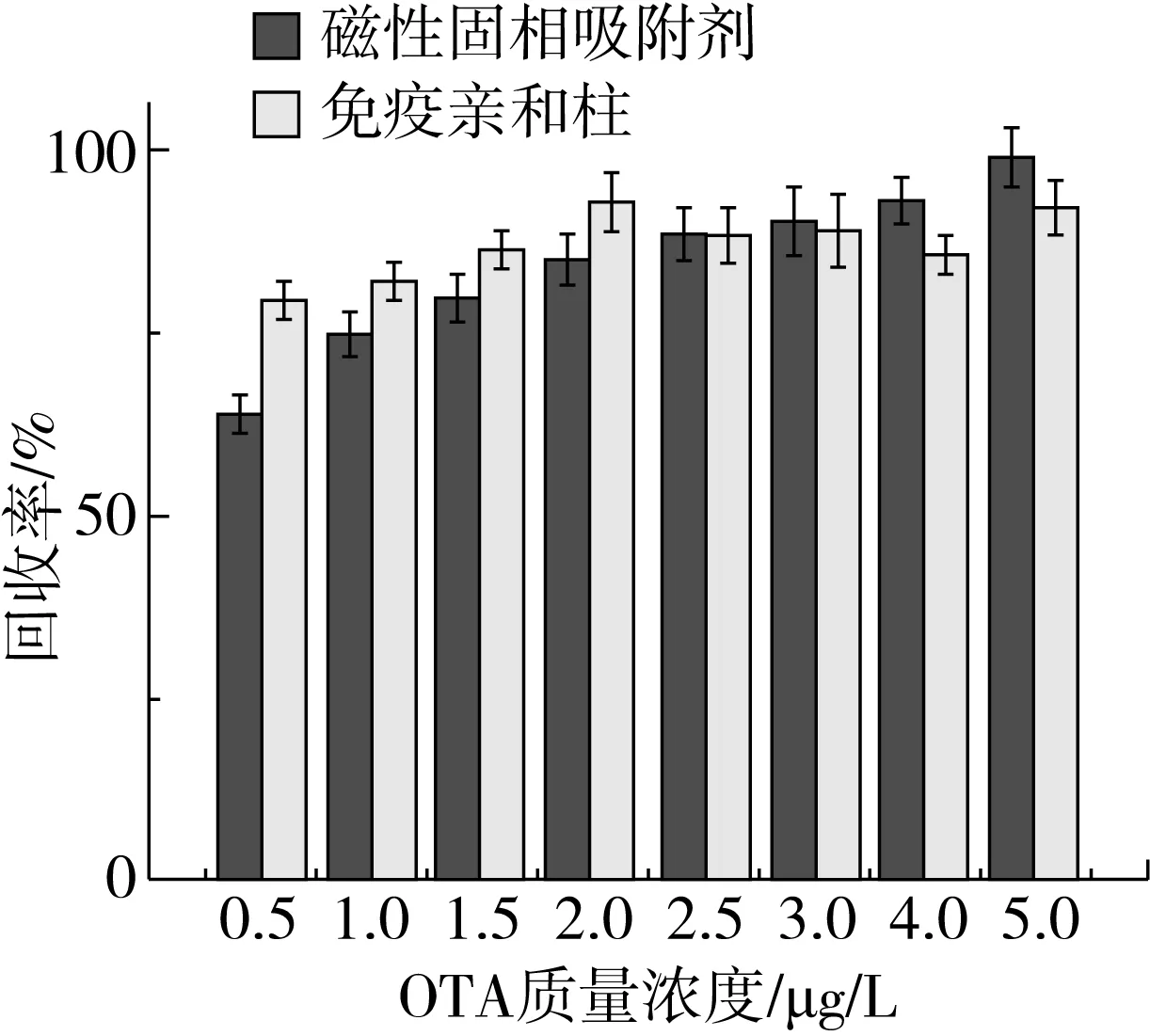
图5 不同吸附剂对OTA的吸附效果
3 结论
建立了一种以APT和BMs为基础,用于富集纯化样品中OTA的前处理方法。研究了核酸适配体、戊二醛及细菌磁小体的添加比例及它们之间的最优结合方式、反应条件及洗脱条件。通过优化,本方法对OTA的最高吸附率为96%,回收率为96%,相对标准偏差为12.5%;同时将BMs-APT复合物对OTA吸附效果与市售免疫亲和柱进行比较,发现其对OTA吸附/回收性能于市售免疫亲和柱基本相当,证实了本方法的可行性。利用BMs-APT复合物对OTA进行吸附,操作简单、成本低、快速高效、特异性强,为OTA的富集和纯化提供了新的研究方向。

