一种检测羧酸酯酶的Turn-off型荧光探针的制备
谢国旺,滕明刚,游 辉,刘家芳,柴慧芳
(贵州中医药大学药学院,贵州 贵阳 550025)
0 引言
羧酸酯酶(carboxylesterase,CES)属于α/β水解酶超家族,是一种重要的药物代谢酶,包括蛋白酶、脂肪酶和胆碱酯酶[1],普遍存在于不同种属的哺乳动物体内。CES有6个亚型,其中在人体中最主要有人羧酸酯酶1(hCE1)和人羧酸酯酶2(hCE2)[2,3]。此外,CES能将酯类或酰胺催化水解成醇或酚,并且由于CES广泛的底物特异性,其通常被称为非特异性酯酶,这归功于它拥有一个庞大的整合活性位点,因此它能与结构多样性的底物结合[4],包括一些外源性药物如卡培他滨、哌替啶和伊立替康(CPT-11)等[5]。CES的亚型CES 2作为CPT-11的关键代谢酶,不仅已成为CPT-11治疗结直肠癌和神经鞘瘤的指标,而且其表达和活性还被认为是胰腺导管腺癌患者CPT-11治疗敏感性的主要因素[6]。另外,CES还负责代谢各种内源性酯底物,例如胆固醇酯、乙酰辅酶A等。因此,检测羧酸酯酶对研究其生物学功能有重要意义。
目前用于检测人体内的酶的方法包括蛋白免疫印迹、 PCR和蛋白质组学等[7-9]。但是,上述检测酶的方法存在操作较为复杂、设备昂贵且时间成本较高等缺点,而荧光探针因具有灵敏度高,准确性好,特异性强及操作简单等优点而被广泛应用于荧光传感、光学成像、细胞及组织成像等方面。荧光探针通常由三个部分构成:荧光报告器基团、接收器基团与连接器部分,其通过与底物特异性结合后引起荧光基团的结构发生改变,使其反应前后荧光光谱发生变化。荧光探针用羧酸酯酶(CES)处理后,其荧光性质发生变化。其荧光变化一般分为以下三种:开启(turn-on)、关闭(turn-off)和比率计(ratiometric)[10-13]。这些类型的探针各有优势。开启(turn-on)的探针几乎没有荧光,其被羧酸酯酶(CES)水解后,该分子荧光强度显著增加;而关闭(turn-off)探针功能则正好相反,其与羧酸酯酶(CES)反应前有荧光,反应后荧光淬灭;但是比率计荧光探针在羧酸酯酶(CES)水解前后都具有荧光,能够根据探针水解状态来显示不同的激发和发射波长[14]。近年来使用荧光探针检测羧酸酯酶(CES)的方法被相继报道,如葛广波[15,16]等,设计了分别对hCE1和hCE2具有高选择性及高敏感性的探针NMHN和TCFB,且还证明了这些探针可分别用于检测复杂生物系统样品中的hCE1和hCE2活性。因此,本文拟基于咔唑环为母核设计并合成一种用于检测羧酸酯酶的荧光探针,实现快速、简便、准确且低成本的酶检测。
本文以咔唑为原料设计并合成一种用于检测羧酸酯酶的turn-off荧光探针TX-01(见图1),以咔唑(1)为起始原料,经甲基化反应得9-N甲基咔唑(2),(2)上醛基得到3-醛基-9-N甲基咔唑(3),(3)通过溴化得到3-醛基-6-溴-9-N甲基咔唑(4),通过(4)合成得到3-醛基6-羟基-9N甲基咔唑(5),(5)经过缩合得到(6),最后酯化得到目标分子(7)。
1 实验部分
1.1 仪器与试剂
仪器:DF DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);78-1磁力搅拌器(金坛市易晨仪器制造有限公司);OSB-2200油浴锅(上海爱郎仪器有限公司);SHB-ⅢA循环水式多用真空泵(郑州长城科工贸有限公司);N1200旋转蒸发仪(东京理化器械株式会社);FA22204B电子天平(上海天美天平仪器有限公司);Bruker 400 MHz型核磁共振仪(瑞士Bruker公司);TU-1810型紫外分光光度计(北京普析);F-98型荧光分光光度计(上海棱光技术有限公司)。
试剂:咔唑;氢化钠、碘甲烷、氢氧化锂一水合物(LiOH ·H2O)、乙酰丙酮酸铜(Cu(acac)2)、BHMPO,均购自安耐吉公司;溴代丁酰亚胺(NBS)、三氯氧磷(POCl3)购自九鼎化学;吡啶、哌啶、DMF、乙醇,DMSO均购自天津科密欧公司;4-氟苯甲酰氯(购自阿拉丁)、羧酸酯酶(E3019-3.5KU)购自西格玛奥德里奇。
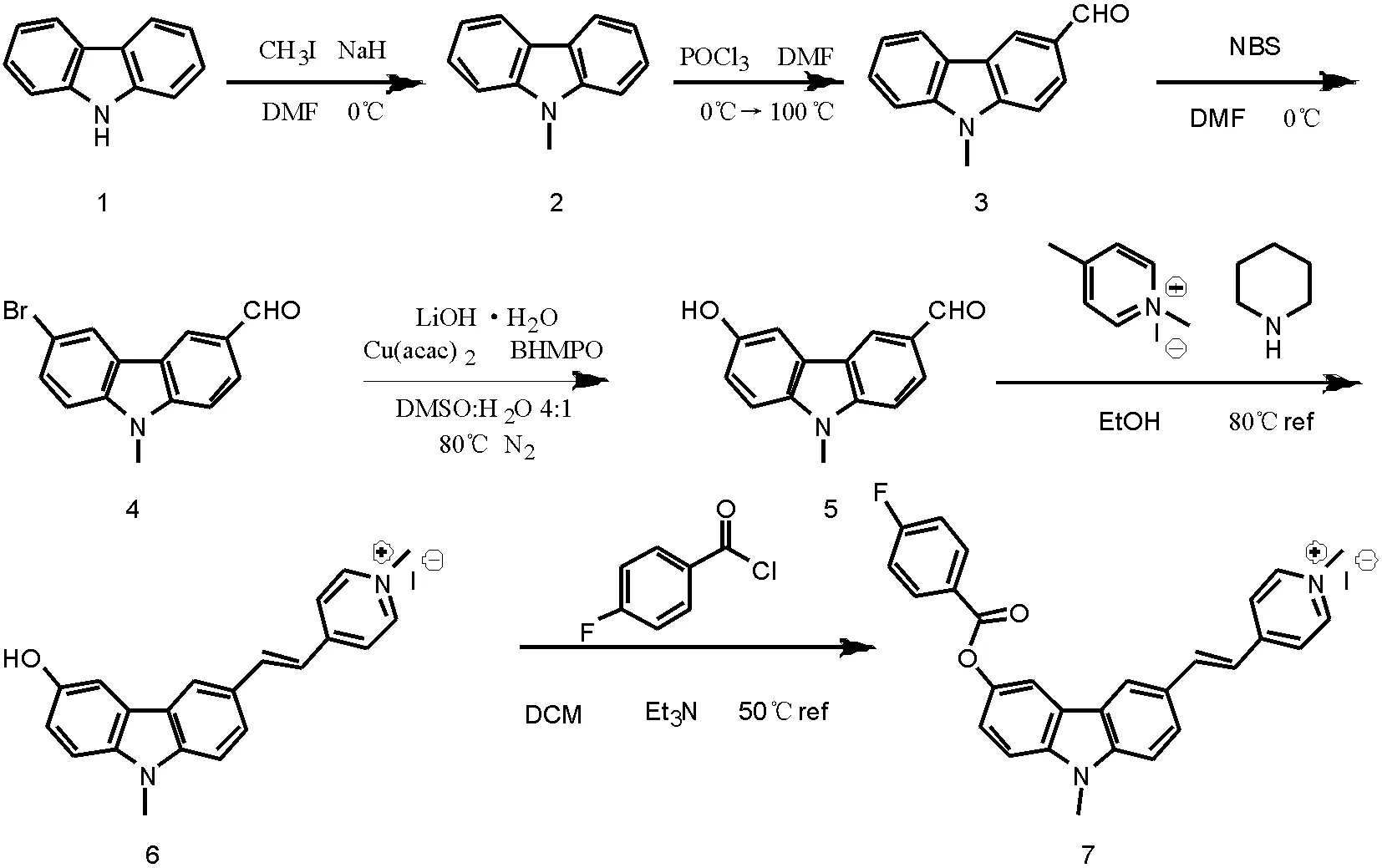
图1 荧光探针的合成路线
1.2 实验方法
1.2.1 9-N甲基咔唑(2)的制备
取1L圆底烧瓶,将咔唑(50 g,0.3 mol)溶于300 mLDMF中,在冰浴条件下缓慢加入钠氢(18 g,0.75 mol)并搅拌,反应30 min后,往反应液中滴加碘甲烷(42.67 g,0.3 mol)。室温反应2 h后监测反应完全,将反应液边搅拌边倒入1L水中,待有白色固体析出,过滤后得白色固体,减压干燥的产物9-N咔唑(化合物2)51.49 g,产率95%。1H-NMR(400 MHz,DMSO)δ 8.15(d,J=7.6 Hz,2H),7.59(d,J=8.1 Hz,2H),7.47(t,J=7.5 Hz,2H),7.21(t,J=7.3 Hz,2H),3.87(s,3H)。
1.2.2 3-醛基-9-N甲基咔唑(3)的制备
取1L圆底烧瓶,将9-N甲基咔唑(50 g,0.28 mol)溶于DMF(200 mL)中,将三氯氧磷(77.37 mL,0.83 mol)在冰浴条件下滴加入反应瓶,滴加完后将反应瓶转移至油浴锅中加热至90 ℃下反应,30 min后反应完全,减压回收三氯氧磷后,在搅拌下将反应液慢慢倒入冰水中淬灭反应,用4M的氢氧化钠水溶液将pH值调至9,再用乙酸乙酯(3x100 mL)萃取3次后,合并有机相。有机相用饱和食盐水洗涤三次后用无水硫酸钠干燥,过滤并减压回收溶剂后获得化合物(3)的粗品,然后通过柱层析(洗脱剂为石油醚∶乙酸乙酯=10∶1)分离纯化得白色固体即3-醛基-9-N甲基咔唑49.09 g,产率85%。1H-NMR(400 MHz,DMSO)δ10.07(s,1H),8.75(d,J=1.3Hz,1H),8.29(d,J=7.8Hz,1H),8.01(d,J=10.1 Hz,1H),7.97(s,3H),7.75(d,J=8.6 Hz,1H),7.68(d,J=8.3 Hz,1H),7.60-7.52(m,1H),7.32(t,J=7.9 Hz,1H),3.94(s,3H)。
1.2.3 3-醛基-6-溴-9-N甲基咔唑(4)的制备
取500 mL圆底烧瓶,在水浴下将3-醛基-9-N甲基咔唑(40,0.19 mol)溶于DMF(200 mL),在搅拌下加入NBS(34 g,0.19 mol),室温下反应30 min后反应完全,而后将反应液倒入水中搅拌,过滤得粗产物。乙醇重结晶后得白色晶体即3-醛基6-溴-9N甲基咔唑(4)50.61 g,产率92%。1H-NMR(400 MHz,DMSO)δ 10.05(s,1H),8.81(s,1H),8.55(s,1H),8.03(d,J=8.6 Hz,1H),7.78(d,J=8.6Hz,1H),7.67(s,2H),3.94(s,3H)。
1.2.4 3-醛基-6-羟基-9-N甲基咔唑(5)的制备
取500 mL圆底烧瓶,将(4)(30 g,0.104 mol)放入烧瓶中,溶于DMSO∶H2O=4∶1 100 mL,搅拌状态下分别加入LiOH·H2O(9.17g,0.218 mol)、BHMPO(0.68 g,0.002 mol)和Cu(acac)2(0.45 g,0.002 mol),加氮气置换三次后80 ℃反应3 h,反应液过滤后倒入水中搅拌,后有黄色固体析出,旋干固体,甲醇打浆的黄色固体15.26 g,产率60%。1H NMR(400 MHz,DMSO)δ 10.02(s,1H),8.63(s,1H),7.94(d,J=8.6 Hz,1H),7.66(d,J=8.6 Hz,1H),7.60(d,J=2.2 Hz,1H),7.49(d,J=8.7 Hz,1H),7.06(dd,J=8.7,2.3 Hz,1H),3.87(s,3H)。
1.2.5 化合物(6)制备
取500 mL圆底烧瓶,将化合物(5)(22.7 g,0.101 mol),加入100 mL无水乙醇,加入4-甲基吡啶季铵盐(24.97 g,0.106 mol),加入哌啶(4.54 mL,0.046 mol),50 ℃回流反应5h。旋干乙醇得红色固体,经硅胶柱层析(DCM∶MeOH 10∶1)纯化得红色固体38.22 g,产率85.7%。1H-NMR(400 MHz,DMSO)δ 8.84(s,1H),8.63(s,1H),8.23-8.14(m,4H),7.97(d,J=8.6 Hz 1H),7.93(d,J=8.6 Hz 1H),7.73(d,J=2.2 Hz 1H),7.67(d,J=8.7 Hz 1H),7.53(s,1H),7.29(dd,J=8.7,2.3 Hz 1H),4.25(s.3H),3.90(s,3H)。
1.2.6 探针分子(7)即TX-01合成
取500 mL圆底烧瓶,将化合物(6)(5 g,0.012 mol)用15 mLDCM溶化,加入三乙胺(4.7 mL,0.034 mol)冰浴搅拌状态下加入4-氟苯甲酰氯(3.4g,0.022 mol),加完后升温至50 ℃。反应2 h后,旋掉三乙胺用DCM萃取三次(3×15 mL)。有机相用无水硫酸钠干燥,减压回收溶剂后得红色固体粉末,之后用DCM∶MeOH=20∶1过柱,过完柱后用乙醇打浆得深红色粉末2.8 g,产率42.9%。1H-NMR(400 MHz,DMSO)δ 8.80(d,J=6.4 Hz),8.60(s),8.30(dd,J=21.8,13.8 Hz),8.17(dd,J=13.2,6.3 Hz),7.95(d,J=8.6 Hz),7.82-7.69(m),7.56-7.40(m),4.23(s),3.97(s)。
1.3 光谱实验
称取一定量的探针分子溶于DMSO配成浓度为10 mM的溶液,用PBS缓冲溶液(PH=7.4)稀释至2 mM,利用紫外分光光度计扫描最大吸收波长,再用PBS缓冲溶液将探针溶液稀释至10μM,通过荧光分光光度计测量最大发射波长。
用PBS缓冲溶液稀释一定量的酶配成0.3 mg/mL的酶溶液,将1 mL探针溶液与酶溶液在37 ℃ 1200 rpm的条件下孵育30 min后加入1 mL乙腈淬灭反应。反应液用离心机2000转离心10 min后取其上清液,测量最大吸收波长,同时以该最大吸收波长扫描最大发射波长,并记录酶反应前后荧光强度,最后用高分辨质谱检测探针分子与酶反应后的清液。
2 结果与讨论
合成的探针分子TX-01氘代DMSO溶解确定氢谱(图2)后,在365 nm紫外下检测该Turn-off型探针分子TX-01,其本身呈现出强橙黄色荧光,在其与酶反应后荧光淬灭(图3),经过全波长紫外扫描得到探针分子最大激发波长为423 nm,经酶处理后最大激发波长为422 nm。在423 nm激发波长下,TX-01最大发射波长为580 nm,经酶处理后荧光发生淬灭,经计算探针分子斯托克斯位移为157 nm,同时对该探针分子进行三维荧光扫描(图4)。TX-01经酶反应前后荧光强度发生显著变化(图5)。最后用高分辨质谱检测探针分子与酶反应后上清液,其中有m/z为315.1517的峰(图6),证明羧酸酯酶水解了该Turn-off型荧光探针TX-01的酯键,使其荧光淬灭。

图2 探针分子(7)TX-011H-NMR(400 MHz,DMSO)

图3 探针TX-01与酶反应前后荧光现象

图4 探针TX-01的三维扫描图

图5 经酶反应前后荧光强度变化
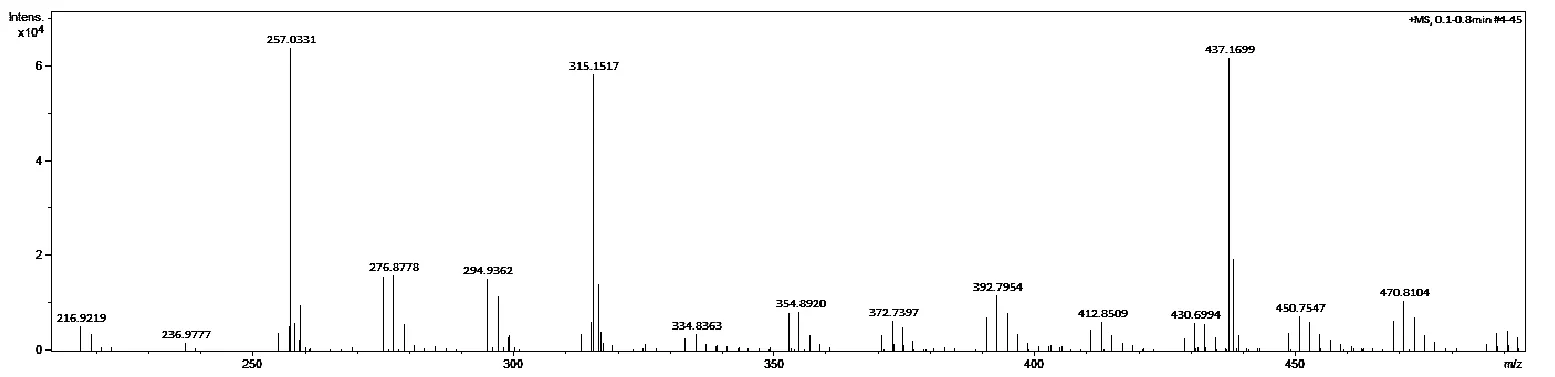
图6 探针TX-01与羧酸酯酶反应后的高分辨质谱图

