花生属野生资源基因组大小及遗传多样性分析
付春张鲲李膨呈张伟男夏晗李长生仇静静王兴军赵传志李爱芹
(1.潍坊市农业科学院,山东 潍坊 261071;2.山东省农业科学院农作物种质资源研究所(生物技术研究所)/山东省作物遗传育种与生态生理重点实验室,山东 济南 250100;3.山东农业工程学院,山东 济南 250100)
花生是重要的油料作物和经济作物。我国花生年种植面积约467万hm2,仅次于玉米、水稻、小麦、大豆、油菜、马铃薯等作物。近年来,我国花生生产与消费持续增长,已经成为我国总产量最大的油料作物,发展花生生产对于保障我国粮油安全、促进农民增收、调整农业种植结构和改善膳食结构等具有重要意义[1]。
栽培花生(Arachis hypogaeaL.)是异源四倍体(AABB,2n=4×=40),是由二倍体祖先种Arachis duranensis(AA,2n=2×=20)和Arachis ipaensis(BB,2n=2×=20)杂交后自然加倍形成的[2,3]。由于优异亲本种质资源缺乏,在花生育种过程中,狮头企和伏花生等骨干亲本被反复利用,导致栽培花生的遗传背景狭窄[4]。花生属有70多个野生近缘种,遗传多样性丰富。与栽培种相比,花生野生种所处的环境更复杂、更恶劣,对生物和非生物胁迫具有很高的抗性,尤其对青枯病、黄曲霉、叶斑病保持了很高的抗性,如A.diogoi和A.correntina对番茄斑点枯萎病毒(TSWV)具有很好的抗性,是花生抗病、抗虫、抗干旱种质创新的重要基因库;另外,野生花生资源还具有高蛋白质、高氨基酸和高油脂含量等特点[5-9]。因此,将野生花生的优良基因转移到栽培花生中是花生遗传改良的重要途径。然而,关于花生野生资源遗传多样性和基因组方面的研究相对滞后,制约了其在花生遗传改良中的应用。
基因组大小(genome size)是指一个基因组中所拥有的DNA含量,是种质资源评价和利用的重要参考之一。流式细胞术(flow cytometry)是测定基因组大小的常用方法之一,与传统压片方法相比更具优势和特点,已广泛应用于植物、真菌等的基因组大小测定[10-12]。DNA分子标记(molecular marker)是能反映生物个体或种群间基因组中某种差异的特异性DNA片段,在农作物种质资源的鉴定和遗传多样性分析等方面具有广泛应用。
本研究对收集和保存的10份野生花生资源进行了遗传多样性分析和基因组大小测定,以期为野生花生的鉴定和评价、基因组解析、重要性状的遗传解析及在育种中的应用提供参考。
1 材料与方法
1.1 试验材料
本研究所用的花生种质资源材料Tifrunner、狮头企、伏花生和IpaDur由本实验室保存,野生花生种质资源由中国农业科学院油料作物研究所、广西农业科学院和美国种质资源库提供(表1)。2021年5月将供试材料种植于山东省农业科学院饮马泉试验场,7月取幼嫩叶片提取基因组DNA。流式细胞仪分析采用马铃薯(Solanum tuberosumL.)做内标,马铃薯材料由山东省农业科学院蔬菜研究所杨煜老师提供。

表1 本研究所用的花生种质材料
1.2 花生基因组DNA的提取
取未展开的花生嫩叶置于装有钢珠的2.0 mL离心管中,用高通量组织研磨器(SCIENTZ-48)磨成粉。利用北京天根生化科技有限公司的植物基因组DNA提取试剂盒,参照说明书的步骤进行DNA提取。分别用Eppendorf分光光度计和1.0%琼脂糖凝胶电泳检测DNA的浓度和质量,存于-20℃备用。
1.3 SSR分子标记分析
PCR反应体系如下:正、反向引物(10μmol/L)各1μL,2×PowerTaqPCR Master-Mix 10μL,DNA模板2μL,加入灭菌的双蒸水补足到20μL。在PCR仪(宝生物TP600)上进行如下程序:95℃预变性3 min;94℃变性30 s,50~60℃退火30 s(退火温度参照引物报告单),72℃延伸30 s,35个循环;然后72℃延伸7 min,16℃结束反应。PCR结束后采用变性聚丙烯酰胺凝胶电泳检测PCR扩增产物。电泳及染色参照文献[13]的方法进行。
1.4 聚类分析
电泳完毕后,以二进制人工读带法进行数据分析,清晰的条带记为“1”,在同一位置无带或不易分辨的记为“0”。参照文献[13]的方法,利用软件NTSYS-pc计算遗传相似系数(genetic similarity,GS),采用UPGMA法进行聚类分析。
1.5 流式细胞术检测基因组大小
采用Otto细胞核提取液配方和PI荧光染料,按照文献[14]的方法进行,具体步骤如下:
(1)细胞核悬液的制备。取待测花生种质材料的新鲜嫩叶4~8片及内标马铃薯(Solanum tuberosumL.)新鲜嫩叶混合后置于冰上的培养皿中,加入预冷的OttoⅠ缓冲液(0.1 mol/L柠檬酸,0.5%(v/v)Tween 20,pH 2.3)2 mL,用锋利刀片将叶片切碎,得到细胞核粗悬液;用45μm孔径尼龙网过滤粗悬浮液,150×g离心5 min,弃大部分上清,留约100μL,轻轻振动使细胞核重新悬浮,再加入100μL新鲜预冷的OttoⅠ缓冲液,轻轻晃动,室温孵育。
(2)基因组DNA特异性染色。加入OttoⅡ缓冲液(0.4 mol/L Na2HPO4∙12H2O,pH 8.9)1 mL和50μg/mL RNase 50μL,3 min后加入碘化丙啶(PI)至浓度为5μg/mL。
(3)上机检测。使用CytoFLEX流式细胞分析仪(美国Beckman)对染色样品进行检测,每个样品至少收集5 000个颗粒,并进行3次重复测定。使用仪器自带的软件进行数据收集和分析。当标准偏差/平均通道数的比值CV<3%时,说明实验结果可信。待测样本核DNA含量或倍性水平=参照样本核DNA含量或倍性水平×(待测样本G0峰荧光均值/参照样本G0峰荧光均值)。
2 结果与分析
2.1 SSR分子标记筛选和分析
随机选取10个本实验室前期开发的花生SSR标记,对9个花生野生近缘种和1个花生栽培种(Tifrunner)的基因组DNA进行PCR扩增和多态性筛选,其中7个标记能在至少7个以上的花生材料中扩增出清晰、可辨识的多态性条带,最终用这7个标记对所选10份花生材料进行遗传多样性分析(表2)。这7个标记分别来源于花生A03(2个)、A07、A09、B02、B03和B06染色体,从10个花生种质材料中共检测到33个变异位点,平均每个标记4.7个,变幅为3~6个,其中,标记gSSR-87000和gSSR-101199检测到的等位变异最多,均为6个;gSSR-20130和gSSR-25150检测到的等位变异最少,均为3个。鉴别力(discriminating power,DP)变幅为2~4,平均每个标记2.85,其中,gSSR-25150和gSSR-101199的鉴别力最高,均为4;gSSR-87000、gssR-20130和gSSR-31113鉴别能力最低,均为2。遗传多态性信息含量(PIC)在0.68~0.98之间,平均0.90。

表2 花生全基因组SSR来源及多态性等信息
2.2 种质材料间的亲缘关系
根据相似系数矩阵按UPGMA法进行聚类,绘制10份种质材料的亲缘关系树,结果(图1)显示,四倍体的花生栽培种Tifrunner与四倍体的野生花生A.monticola聚在一起,与人工合成的四倍体材料IpaDur距离也比较近;花生A和B亚基因组的祖先种A.duranesis和A.ipaensis被聚在了一起;花生属花生区组的另外3个材料A.stenosper-ma、A.batizocoi和A.magna聚在一起;来源于根茎区组的A.glabrata与花生区组的A.cardenasis聚在一起。
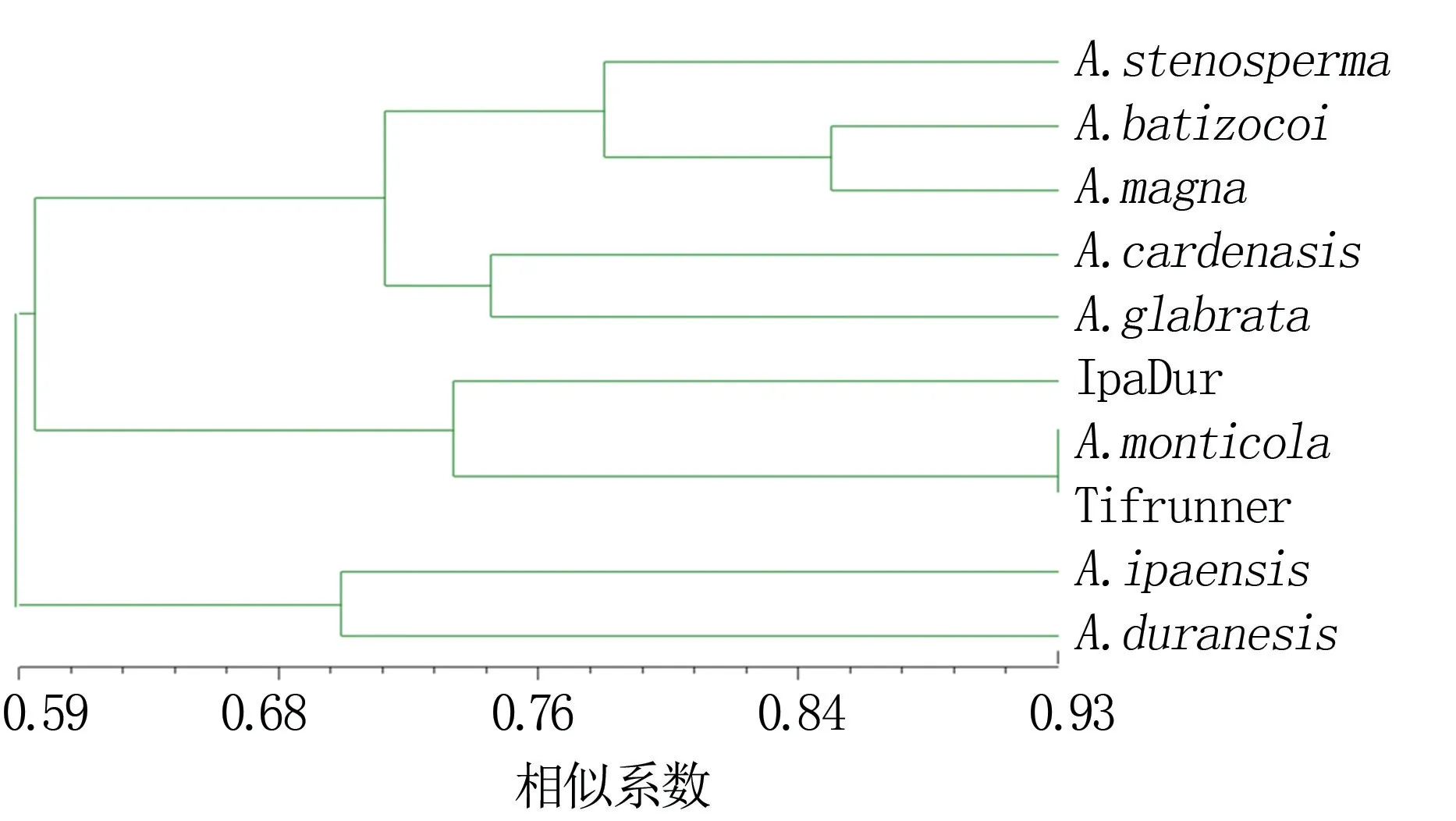
图1 10份花生种质材料聚类分析结果
2.3 花生属部分野生资源基因组大小的测定
为了测定野生花生基因组的大小,我们首先利用流式细胞仪测定了已知基因组花生种质Tifrunner、伏 花 生、狮 头 企、A.duranensis(V14167)、A.ipaensis、A.monticola(PI 497261)及内标(马铃薯Solanum tuberosumL.)的荧光强度(图2)。各种质的基因组大小测定结果与文献中的预测结果基本一致(表3),说明该测定方法准确有效,可用于对花生野生种基因组大小的测定。但由于基因组中存在大量重复序列和一些不能组装的序列,因此,预测的基因组大小要大于实际组装的结果。
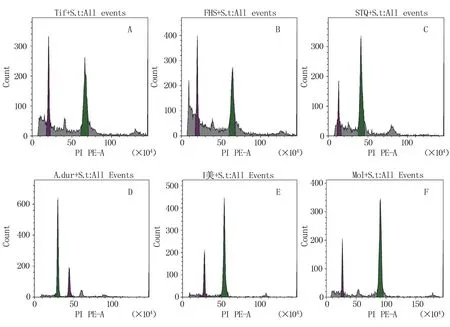
图2 已知基因组花生材料的荧光强度检测结果

表3 流式细胞仪对已知基因组花生种质基因组大小的测定结果
利用该测定方法对4个基因组大小未知的野生花生种质进行检测,结果表明,A.duranensis(PI sesn2848)、A.cardenasis(PI 262141)、A.batizocoi(Grif15032)、A.monticola(PI 468199)的基因组大小分别为1.26、1.61、1.25、2.78 Gb,人工合成四倍体IpaDur的基因组大小为2.81 Gb。其荧光强度检测结果见图3。

图3 花生野生种质的荧光强度检测
3 讨论与结论
优异的亲本种质资源是作物新品种培育的前提和基础,栽培花生的遗传基础相对狭窄导致难以培育出突破性品种。野生花生资源遗传多样性丰富且具有抗逆、优质等优异基因,是花生遗传改良的宝贵资源。引进野生花生种质资源,并了解其遗传多样性及亲缘关系是有效利用野生花生的基础。我国自20世纪70年代以来从美国和国际半干旱热带地区作物研究所(International Crops Research Institute for the Semi-Arid Tropics,ICRISAT)引进了大量的野生花生种质资源,大部分保存在武汉和南宁的野生花生种质资源圃,并开展了一系列野生花生资源的评价和利用工作。根据形态学特征、地理分布和杂交亲和性等特点,花生属的植物可以分为9个区组,其中花生区组是比较大的一个区组,栽培花生及其二倍体祖先种A.duranensis、A.ipaensis及四倍体野生种A.monticola均属于花生区组[9,20]。花生区组的野生花生与栽培花生亲缘关系较近,对它的研究和应用也相对较多。例如,广西农业科学院将花生区组抗锈病的二倍体野生种与珍珠豆型农家品种贺粤1号杂交后进行染色体加倍和选择,选育出了能稳定遗传且性状优良的四倍体新品系[21];中国农业科学院油料作物研究所系统鉴定了79份野生花生对青枯病的抗性反应,从中筛选出高抗青枯病材料15份,并通过SSR分析了花生属6个区组84份材料(38份为花生区组)的亲缘关系和遗传多样性,筛选出59对稳定的SSR引物[22]。这些野生材料均来源于花生区组且具有很高的抗性,是花生遗传改良的宝贵材料,而且很多材料的染色体片段已经渗入到栽培花生中[22,23]。
本课题组前期利用花生野生种A.duranensis和A.ipaensis的基因组,开发了11万条覆盖花生基因组的SSR标记[24]。本研究从中随机选取了10个标记,用于对栽培花生Tifrunner和野生花生A.stenosperma、A.batizocoi、A.magna、A.cardenasis、A.glabrata、A.monticola、A.duranensis、A.ipaensis及人工合成四倍体材料IpaDur进行检测,发现其中7个标记具有稳定的多态性,可以用于这些花生材料的特异性识别,也可以用于在创新材料中追踪野生花生的基因组片段。我们开发的花生全基因组SSR很多是A和B亚基因组特异的,而本研究所用野生花生材料基本上都是二倍体,只含有A、B亚基因组或者K基因组等,因此很多标记是特异的,但在不同材料中不会表现出共显性的特点。另外,这一特性也可能会对野生花生遗传进化树的聚类结果产生影响。
流式细胞术重复性好、测定结果精确,已被广泛用于植物基因组大小的测定。本研究利用流式细胞术对6份基因组大小已知的花生种质进行测定,结果与预测基因组大小相近,也证明了该方法的准确度较高。用该法对4份基因组大小未知种质进行检测,得到其基因大小分别为A.duranensis(PI sesn2848)1.26 Gb,A.cadenasis(PI 262141)1.61 Gb,A.batizocoi(Grif15032)1.25 Gb,A.monticola(PI 468199)2.78 Gb。本研究结果可为野生花生的基因组学研究提供参考。

