亚麻籽炒籽过程美拉德反应底物变化及其模拟体系产物的抗氧化活性
杜 玥 ,熊 倩 ,李可瑶 ,李 颖 ,蔡子哲 ,汪 勇
(1.暨南大学 食品科学与工程系,广州 510632; 2.广东省油料生物炼制与营养安全国际联合研究中心,广州 510632)
亚麻是我国的八大油料作物之一,主要产地为西北地区[1-2]。亚麻籽,为亚麻(LinumusitatissimumL.)的成熟种子。亚麻籽由于富含油脂和木酚素、环肽、多糖等营养价值较高的功效成分而广受消费者的喜爱。近年来,亚麻籽市场逐渐壮大,2020年亚麻籽进口量达37.3万t[3]。亚麻籽油是市面上最主要的亚麻籽产品,热榨亚麻籽油是西北当地居民的日常食用油。采用热榨工艺制备亚麻籽油除了可以提高出油率、增强油脂风味外,还可以进一步使油料中潜在具有抗氧化活性的脂质伴随物(如多酚、植物甾醇等)进入原油。与此同时,炒籽过程中发生的美拉德反应也是引起亚麻籽油色泽加深、风味增强、氧化稳定性更好等一系列变化的重要原因[4]。美拉德反应又称“非酶褐变反应”,是羰基化合物(主要是还原糖)和氨基化合物(氨基酸、多肽和蛋白质)之间非酶反应。研究表明,美拉德反应产物(MRPs)不仅具有抗癌、抗菌、抗氧化等生理活性[5-7],更是在食品体系中表现出很好的抗氧化能力和增强风味能力[8]。余盖文等[9]研究发现亚麻籽适度炒籽后可以使亚麻籽油香味浓郁,并可以提高其DPPH自由基清除能力;Suri等[10]发现在180℃下干炒黑孜然籽(NigellasativaL.)10 min,所制油样的氧化稳定性更好;Qin等[11]发现由木糖和芝麻蛋白制备的MRPs不仅可以提高芝麻油的氧化稳定性,还可以减少芝麻油本身生育酚的损失。目前看来,热榨亚麻籽油氧化稳定性较好的原因可能与亚麻籽自身含有的还原糖和氨基酸在高温炒籽后生成的MRPs进入油中有关。但对于热榨亚麻籽油中可能发生美拉德反应的底物以及不同底物反应体系MRPs抗氧化效果的差别,并未见系统性研究。
本文通过比较不同炒籽条件下亚麻籽油的全氧化值,筛选出最优炒籽条件,探究炒籽前后亚麻籽脱脂粉中氨基酸和还原糖变化,确定美拉德反应的潜在底物;然后构建各类还原糖-氨基酸模拟反应体系,评价不同体系MRPs的抗氧化活性,确定最优模拟体系条件;最终通过在冷榨亚麻籽油中添加MRPs,进一步研究最优模拟体系条件制备的MRPs对亚麻籽油氧化稳定性的影响,以期为亚麻籽加工条件优化提供相关数据支持,并为后续热榨亚麻籽油中高抗氧化活性MRPs的研究提供参考。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
宁亚21号亚麻籽,宁夏君星坊公司提供;木糖、葡萄糖、果糖、半乳糖、阿拉伯糖、鼠李糖标准品,上海源叶生物有限公司;葡萄糖、果糖、半乳糖、精氨酸、谷氨酸、赖氨酸、丙氨酸、亮氨酸,纯度98.0%,麦克林生物有限公司;氘代氯仿,上海百灵威科技有限公司;无水乙醇、正己烷、氢氧化钾、磺基水杨酸溶液、三氯甲烷、冰乙酸、碘化钾、硫代硫酸钠、可溶性淀粉、异辛烷、p-茴香胺,均为分析纯。
1.1.2 仪器与设备
Gene Café干热烘焙机;磁力搅拌器,美国塞洛捷克公司;UV-9600 紫外分光光度计,北京瑞利分析仪器公司;DF-101S集热式恒温加热磁力搅拌器,上海力辰邦西仪器科技有限公司;Seven Compact pH计,瑞士梅特勒-托利多公司;N-1300旋转蒸发仪,上海爱朗仪器有限公司;Avance 600 M高场核磁共振仪,美国布鲁克公司;L-8900型全自动氨基酸分析仪,日立高新技术公司;ICS 5000+离子色谱仪(配四元梯度泵,脉冲安培检测器),美国Thermo Fisher公司;YJY-Z200螺旋榨油机,湖北益加益机械设备有限公司。
1.2 实验方法
1.2.1 亚麻籽油样的制备
亚麻籽油:称取亚麻籽约 200 g,用干热烘焙机在120、140、160、180、200℃条件下分别旋转干炒10、20、30 min后,粉碎,加入正己烷(固液比1∶6)过夜浸提,抽滤、离心后取上清液,在40℃下减压旋转蒸发脱除正己烷后得到亚麻籽油,于-20℃冰箱储藏。
冷榨亚麻籽油:称取亚麻籽约1 000 g,在室温下直接用螺旋榨油机压榨制油,将原油离心除去杂质后得到冷榨亚麻籽油,于-20℃冰箱储藏。
1.2.2 亚麻籽脱脂粉的制备
将炒籽前后亚麻籽粉碎后加入正己烷过夜浸提,抽滤,取抽滤后固体,再次采用正己烷索氏提取进一步脱脂,常温晾干,得到亚麻籽脱脂粉。
1.2.3 MRPs 的制备
分别称取一定质量的氨基酸和还原糖至容量瓶中,添加适量磷酸盐缓冲液(10 mmol/L,pH 7.4),调节pH至7.0。按一定比例将不同的氨基酸和还原糖溶液混合,配制不同类型的氨基酸-还原糖反应体系(还原糖浓度为0.1 mol/L);将溶液放置油浴锅中在一定温度下反应一定时间,反应结束后,将反应溶液迅速冷却至室温,冻干后放入干燥器。
1.2.4 亚麻籽油氧化稳定性测定
采用Schaal烘箱法,将亚麻籽油及添加了MRPs的冷榨亚麻籽油放置于(60 ± 1)℃的烘箱中加速氧化,每2 d取1次油样,测定氧化指标。
1.2.5 亚麻籽油氧化指标的测定
过氧化值的测定,参照GB 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》第一法;p-茴香胺值的测定,参照GB/T 24304—2009《动植物油脂 茴香胺值的测定》;全氧化值按照公式(1)计算[12]。
VT=4VP+VA
(1)
式中:VT为全氧化值;VP为过氧化值,mmol/kg;VA为p-茴香胺值。
醛类物质含量的测定:采用核磁共振氢谱法测定。移取50 μL亚麻籽油于直径5 mm核磁管中,加入500 μL氘代氯仿溶解,混合均匀后,用高场核磁共振仪采集不同样品的氢谱数据,以观测亚麻籽油中次级氧化产物醛类物质含量的变化。高场核磁共振仪的参数[13]:频率400 MHz及以上,光谱宽度5 000 Hz,弛豫时间3 s,扫描次数64 次,采集时间3.744 s,脉冲宽度90°,总采集时间12.9 min,温度25℃。
1.2.6 亚麻籽脱脂粉还原糖含量的测定
采用离子色谱仪通过绘制标准曲线的方法对样品中还原糖含量进行测定。
标准溶液的制备:分别称取一定质量的葡萄糖、果糖、木糖、鼠李糖、半乳糖、阿拉伯糖标准品,用去离子水溶解并定容至10 mg/mL,冷藏储存。用移液枪准确移取一定量上述标准品溶液,加去离子水逐级稀释至8、10、20、30、40 μg/mL,作为系列标准工作液,现用现配。
样品处理:分别称取0.3 g炒籽前后的亚麻籽脱脂粉至15 mL离心管中,加入10 mL 75%的乙醇溶液,磁力搅拌器常温提取20 min,超声提取10 min,离心后收集上清液,重复提取3 次。将提取液旋干后用去离子水配制成一定质量浓度的样品溶液,过0.22 μm水系滤膜后,进离子色谱仪测定。
色谱分析条件:CarboPac PA10分析柱(4 mm×250 mm),CarboPac PA1保护柱(4 mm×50 mm);ED电化学检测器;流动相A相为纯水,B相为200 mmol/L的NaOH溶液,流速0.8 mL/min;梯度洗脱,洗脱程序见表1。
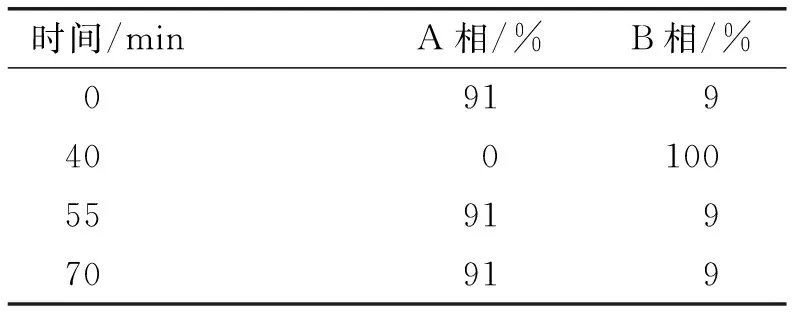
表1 梯度洗脱程序
1.2.7 亚麻籽脱脂粉游离氨基酸含量的测定
参照GB 5009.124—2016 《食品安全国家标准 食品中氨基酸的测定》测定游离氨基酸含量。称取0.1 g亚麻籽脱脂粉,加入2 mL 5%磺基水杨酸溶液,60℃水浴浸提20 min,取出,离心过滤后进全自动氨基酸分析仪测定。
分析条件:日立855-4507型色谱柱;色谱柱温度57℃;反应柱温度135℃;柠檬酸(锂)PF缓冲液梯度洗脱;第1通道检测波长570 nm;第2通道检测波长440 nm;进样量20 μL;洗脱泵流速0.35 mL/min,衍生泵流速0.30 mL/min;分析时间148 min。
1.2.8 MRPs抗氧化活性分析
将MRPs用去离子水稀释至不同梯度浓度后,将其与0.2 mmol/L DPPH无水乙醇溶液按1∶1比例混匀后放置暗处反应30 min,测其在517 nm波长下的吸光值,并按照公式(2)计算MRPs的DPPH自由基清除率(y)。
(2)
式中:A1为 2 mL DPPH溶液 + 2 mL 样品溶液在 517 nm 波长处的吸光值;A0为 2 mL 无水乙醇 + 2 mL 样品溶液在 517 nm 波长处的吸光值;A为 2 mL DPPH溶液+2 mL 去离子水在 517 nm 波长处的吸光值。
1.2.9 美拉德反应进程指标的测定
作为语言的载体,情感需要通过语言来表达,在广播电视节目中,主持人的真情流露往往能获得良好的艺术效果。情感的表达要注重真实性,不能随意释放自己的情感,要考虑观众的感受,适当利用情感调节节目气氛,减轻观众的思想包袱。在情感表达时,主持人要把握好尺度,控制好自己的情绪,从而为整体节目效果的提升做好准备。
准确称取0.5 g MRPs溶于20 mL去离子水中,配制MRPs溶液。将上述溶液用去离子水稀释100倍后,测其在420 nm波长下的吸光值,表征美拉德反应终产物(类黑精)的积累量;将上述溶液用去离子水稀释20倍后,测其在294 nm波长下的吸光值,表征美拉德反应形成的无色、无荧光(如糖、醛和二羰基化合物等)中间产物的积累量;用pH计测定不同反应条件下MRPs的pH。
2 结果与讨论
2.1 不同炒籽条件下亚麻籽油的氧化稳定性
亚麻籽油含有大量的不饱和脂肪酸,在用Rancimat法考察其氧化稳定性时测得的氧化诱导时间较短,不能显示不同炒籽条件下亚麻籽油氧化稳定性的差异性。因此,选用Schaal烘箱法加速氧化实验,测定亚麻籽油的全氧化值及醛类物质含量,探究不同炒籽条件下的亚麻籽油氧化稳定性,结果见表2。
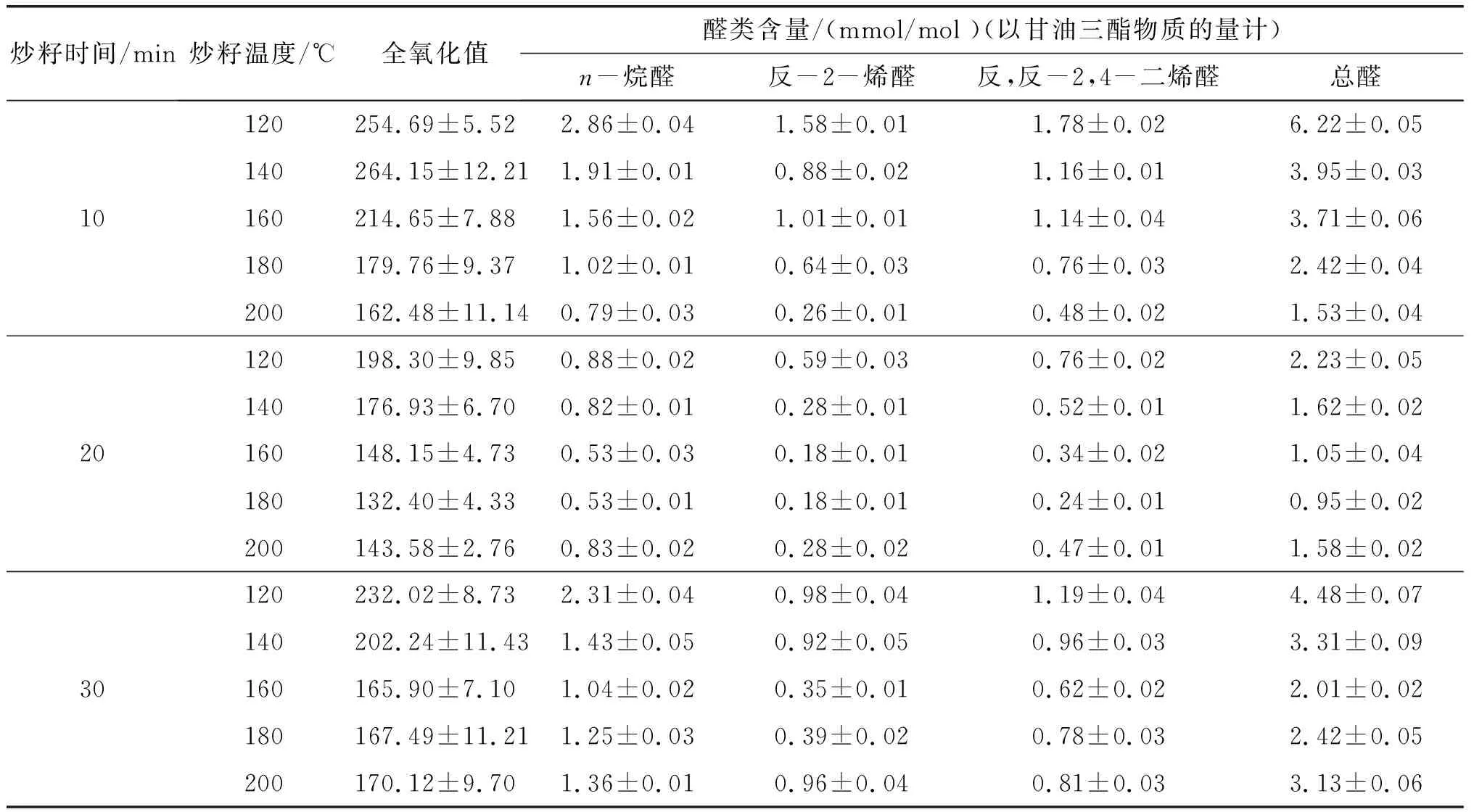
表2 不同炒籽条件下亚麻籽油60℃加速氧化20 d后的氧化稳定性
过氧化值表征的是氢过氧化物的含量,为评定油脂氧化初期品质的重要指标;p-茴香胺值表征的则是氢过氧化物进一步氧化后生成的小分子醛酮类次级氧化产物(α、β-不饱和醛类)的含量;全氧化值是将p-茴香胺值和过氧化值综合来看,更能反映油脂的整体质量[14]。由表2可看出:在炒籽时间为10 min时,炒籽温度从120℃上升至140℃,全氧化值从254.69增长到264.15,推测可能是由于炒籽程度较轻,生成具有抗氧化活性的MRPs少,起到的抗氧化效果有限;炒籽10、20、30 min时,亚麻籽油的全氧化值呈下降趋势温度区间分别为140~200℃、120~180℃以及120 ~160℃,可以初步推断随着炒籽程度的加剧,生成的MRPs含量较高,亚麻籽油的氧化稳定性也随之提高;当炒籽20 min时,炒籽温度从180℃上升至200℃,以及炒籽30 min时,炒籽温度从160℃上升至200℃,亚麻籽油的全氧化值呈上升趋势。杨金娥等[15]也发现了类似的现象,烤籽温度上升到160℃以上,亚麻籽油的过氧化值急剧上升。由于MRPs在亚麻籽油中的溶解度有限,所以适度炒籽对亚麻籽油的氧化稳定性有积极影响。炒籽条件为180℃、20 min时,亚麻籽油的全氧化值处于最低水平。
评价亚麻籽油次级氧化产物含量除了p-茴香胺值,还有硫代巴比妥酸(TBARS)值等方法,但均存在一定局限性,如目标产物种类有限、存在假阳性反应等情况。而核磁共振氢谱法,通过对次级氧化产物的质子信号进行积分后,可对其相对于甘油三酯的含量进行测定,具有快捷、高效、所需样品量少等优点。在本研究所获得的核磁共振氢谱中,多不饱和脂肪酸分子重排形成含过氧化基团的共轭双烯信号并不明显,低于检出限,表明亚麻籽油形成的过氧化物在加速氧化过程中迅速被进一步氧化,形成次级氧化产物,这与Guillen等[13]报道的橄榄油氧化过程的现象相符。本研究采用核磁共振氢谱法测定的次级氧化产物主要有n-烷醛、反-2-烯醛、反,反-2,4-二烯醛,其中:n-烷醛的化学位移在9.75处,可能为饱和、不饱和酰基过氧化产物断裂形成;反-2-烯醛的化学位移在9.49处,可能由单、多不饱和酰基链断裂形成;而反,反-2,4-二烯醛的化学位移在9.52处,形成的主要底物为亚麻酸酰基链。p-茴香胺值反映的是次级氧化产物中不挥发性的α、β-不饱和醛,即能被核磁氢谱方法检测到的反-2-烯醛和反,反-2,4-二烯醛。从表2可以看出,n-烷醛、反-2-烯醛、反,反-2,4-二烯醛及总醛含量和全氧化值变化趋势基本相同。综合来看,炒籽条件为180℃、20 min获得的亚麻籽油的醛类物质含量最低,且氧化稳定性最好。后续研究将通过比较该条件下炒籽前后亚麻籽脱脂粉中还原糖及氨基酸含量的变化,进一步确定美拉德反应底物类型。
2.2 最优炒籽条件下亚麻籽脱脂粉中还原糖及游离氨基酸含量变化
亚麻籽中含有的还原糖和氨基酸在炒籽过程中会发生美拉德反应,对比炒籽(180℃,20 min)前后亚麻籽脱脂粉中还原糖和游离氨基酸含量的变化,以此推测亚麻籽在炒籽过程中发生美拉德反应的潜在底物。最优炒籽条件下亚麻籽脱脂粉中还原糖及游离氨基酸含量变化分别见表3、表4。
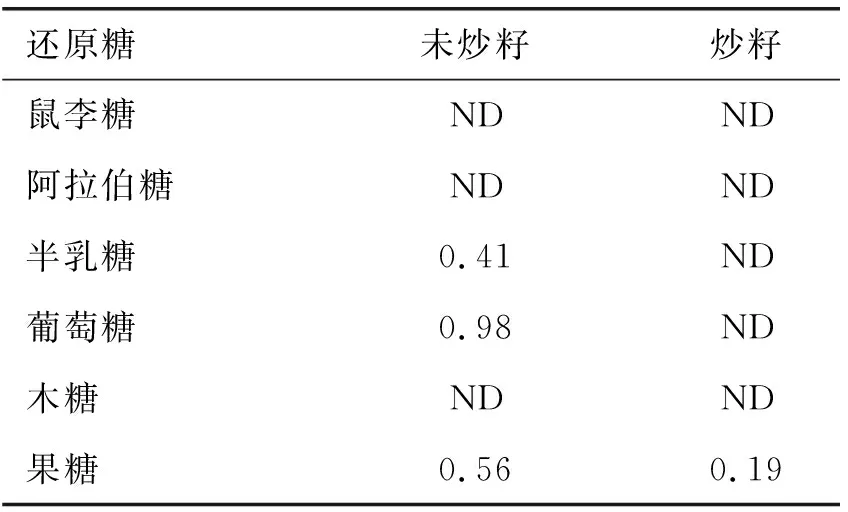
表3 最优炒籽条件下亚麻籽脱脂粉中还原糖含量变化 mg/g
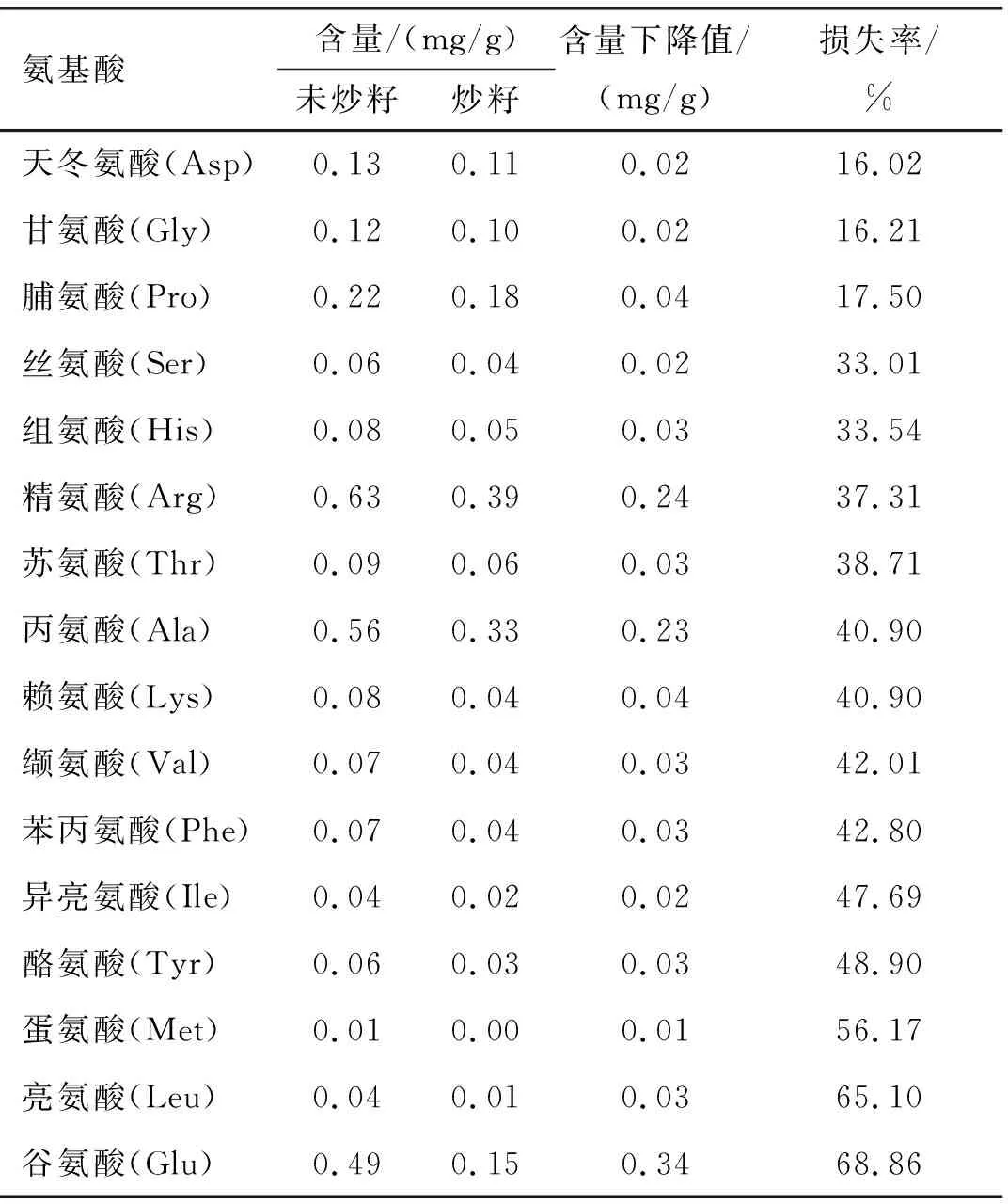
表4 最优炒籽条件下亚麻籽脱脂粉中游离氨基酸含量变化
由表3可以看出,亚麻籽中含量较高的可溶性还原糖半乳糖、葡萄糖及果糖,经炒籽后都有一定量的损失。炒籽前亚麻籽脱脂粉中半乳糖、葡萄糖含量分别为0.41、0.98 mg/g,炒籽后完全损失;炒籽前亚麻籽脱脂粉中果糖含量为0.56 mg/g,炒籽后损失66.07%;鼠李糖、阿拉伯糖及木糖含量低于检出限,且炒籽前后没有明显变化。以上结果与魏长庆等[16]报道的相似,炒籽过程葡萄糖、果糖及半乳糖的含量消耗较大。亚麻籽中可溶性还原糖下降的程度大小为葡萄糖>半乳糖>果糖,初步推断葡萄糖、半乳糖及果糖是亚麻籽在炒籽过程中为美拉德反应提供羰基的主要潜在底物。
由表4可知:未经炒籽的亚麻籽脱脂粉中精氨酸含量最高,为0.63 mg/g,其次是丙氨酸、谷氨酸,含量分别为0.56、0.49 mg/g;经炒籽后,精氨酸、丙氨酸及谷氨酸含量下降明显,谷氨酸、亮氨酸损失率较大;与此同时赖氨酸作为含有两个氨基的氨基酸(ε-NH2和α-NH2),化学性质活泼,相比其他氨基酸更易产生美拉德产物。魏长庆[17]研究发现,葡萄糖-亮氨酸、葡萄糖-蛋氨酸及葡萄糖-赖氨酸比葡萄糖-精氨酸的美拉德反应产物添加到亚麻籽油中的过氧化值低。综上所述,根据表4游离氨基酸含量变化情况及氨基酸化学性质,选用精氨酸、丙氨酸、谷氨酸、亮氨酸及赖氨酸作为亚麻籽炒籽过程中为美拉德反应提供氨基的主要潜在底物。
2.3 美拉德模拟反应体系构建及MRPs抗氧化活性探究
以葡萄糖、半乳糖、果糖和精氨酸、丙氨酸、谷氨酸、亮氨酸、赖氨酸为底物,在底物物质的量比1∶1、反应温度120℃、反应时间1 h条件下制备MRPs,以DPPH自由基清除能力为指标,筛选抗氧化效果较好的底物组合,不同底物组合MRPs的DPPH自由基清除率IC50值见表5。

表5 不同底物组合MRPs的DPPH自由基清除率IC50值 mg/mL
由表5可看出,赖氨酸作为氨基酸底物与还原糖所制备的MRPs的DPPH自由基清除能力最强,其次是精氨酸、谷氨酸、丙氨酸和亮氨酸。这是由于赖氨酸和精氨酸含有多个氨基,且为碱性氨基酸,更易发生美拉德反应[18]。除精氨酸外,在氨基酸相同的情况下,与不同还原糖配对制备MRPs,发现具有相似的DPPH自由基清除能力排序,即葡萄糖>半乳糖>果糖,结合还原糖的结构差异可以看出,葡萄糖作为醛糖, 相比酮糖(如果糖),末端基团位阻效应小,更易与氨基酸发生反应[19]。与此同时,赖氨酸和精氨酸在与葡萄糖反应过程中,色泽加深明显,DPPH自由基清除能力比较强,因此推测亚麻籽炒籽过程中起到抗氧化作用的主要是精氨酸、赖氨酸和葡萄糖的反应。后续实验将选用赖氨酸和精氨酸与葡萄糖为底物,对其美拉德模拟反应条件进行优化并探究相应的抗氧化活性。
2.3.2 反应温度对美拉德模拟反应进程和MRPs抗氧化活性的影响
在美拉德反应过程中,中间产物及类黑精的最大光吸收波长处的吸光值及pH可以表征美拉德反应的进程,DPPH自由基清除率则反映了MRPs的抗氧化活性。在底物物质的量比(葡萄糖与氨基酸物质的量比)1∶1、反应时间1 h条件下,考察反应温度对美拉德模拟反应进程的影响,并将所得MRPs稀释至0.5 mg/mL(下同),测定其DPPH自由基清除率,研究反应温度对MRPs抗氧化能力的影响,结果见图1。

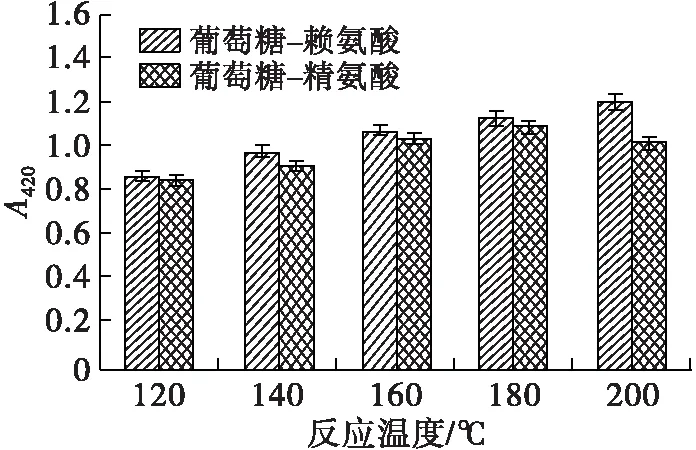
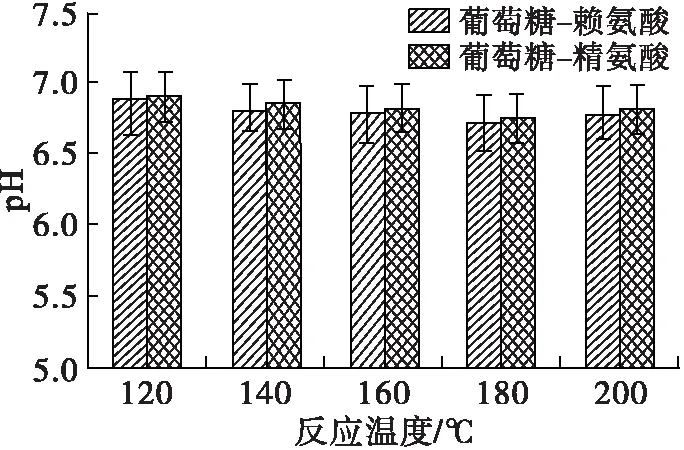
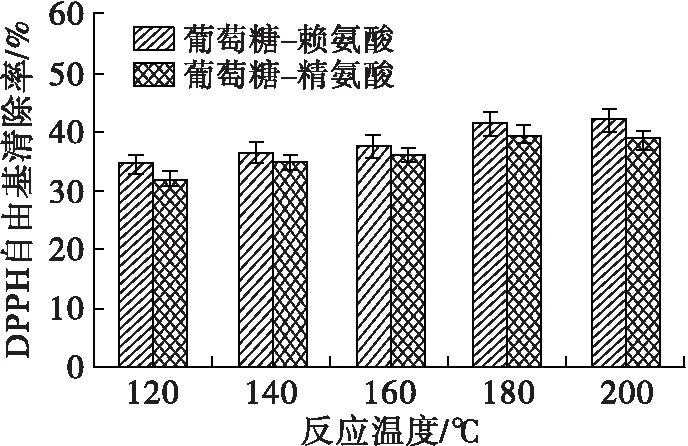
图1 反应温度对美拉德反应进程及MRPs抗氧化活性的影响
由图1可看出:两个波长下MRPs的吸光值总体上随着反应温度的升高而增加;葡萄糖-赖氨酸和葡萄糖-精氨酸反应体系,中间产物含量(A294)在180℃时最高,反应温度进一步上升后,出现一定程度的下降,可能为中间产物分解或进一步生成了类黑精化合物;对于类黑精含量(A420),葡萄糖-赖氨酸MRPs的A420随着反应温度的升高持续上升,于200℃达到最高,而葡萄糖-精氨酸MRPs的A420在180℃时达到最高后,出现了一定程度的下降。美拉德反应过程中产生的酸性物质和氨基的消耗会导致pH下降[20-21],180℃的反应温度下,两个反应体系MRPs的pH最小。随着反应温度的升高,在120~180℃范围内,葡萄糖-赖氨酸MRPs的DPPH自由基清除率从34.51%上升至41.88%,葡萄糖-精氨酸MRPs的DPPH自由基清除率从32.16%上升至39.89%,180℃和200℃下MRPs的DPPH自由基清除能力没有明显差异。综上所述,升高反应温度可以推进美拉德反应进程,并有利于生成抗氧化物质、加深反应产物的褐变程度,但反应温度过高对MRPs抗氧化能力的增长贡献不大,两个反应体系在180℃反应综合效果最好。
2.3.3 反应时间对美拉德模拟反应进程和MRPs抗氧化活性的影响
在底物物质的量比(葡萄糖与氨基酸物质的量比)1∶1、反应温度180℃条件下,考察反应时间对美拉德模拟反应进程和MRPs抗氧化活性的影响,结果见图2。

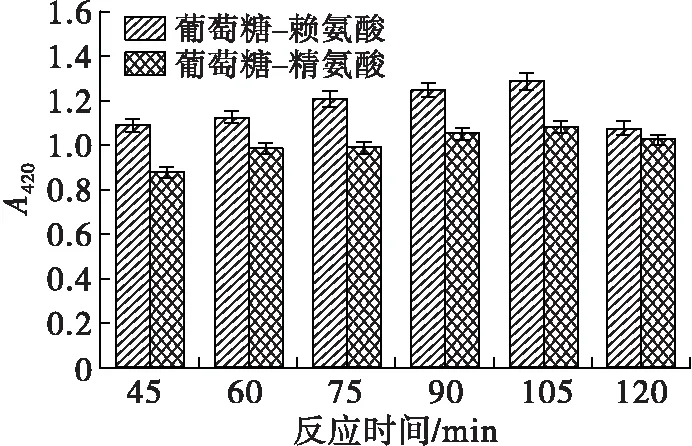


图2 反应时间对美拉德反应进程及MRPs抗氧化活性的影响
由图2可看出,反应前期葡萄糖-赖氨酸和葡萄糖-精氨酸体系MRPs的含量随反应时间延长明显上升,105 min时达到最大,之后降低。45~105 min范围内两个体系美拉德反应中间产物含量差别不大,120 min时葡萄糖-赖氨酸美拉德反应中间产物含量略低于葡萄糖-精氨酸的,而葡萄糖-赖氨酸美拉德反应终产物含量在45~120 min范围内均略高于葡萄糖-精氨酸的。葡萄糖-赖氨酸MRPs的pH在前期随反应时间变化明显,105 min时pH为6.50;葡萄糖-精氨酸MRPs的pH随反应时间延长而降低,且105 min后降低幅度不大。45~105 min范围内,两个体系MRPs的DPPH自由基清除率随着反应时间的延长呈增长趋势,葡萄糖-赖氨酸MRPs的DPPH自由基清除率从40.84%上升至49.29%,葡萄糖-精氨酸MRPs的DPPH自由基清除率从38.15%上升至47.35%,可见在确定最优的反应温度条件后,延长反应时间可以进一步提高MRPs的DPPH自由基清除能力。在反应后期(105~120 min),中间产物和终产物类黑精含量降低,DPPH自由基清除率和pH的变化趋于平稳。因此,确定反应时间为105 min。
2.3.4 底物物质的量比对美拉德模拟反应进程和MRPs抗氧化活性的影响
在反应温度180℃、反应时间105 min条件下,考察底物(葡萄糖与氨基酸)物质的量比对美拉德模拟反应进程和MRPs抗氧化活性的影响,结果见图3。



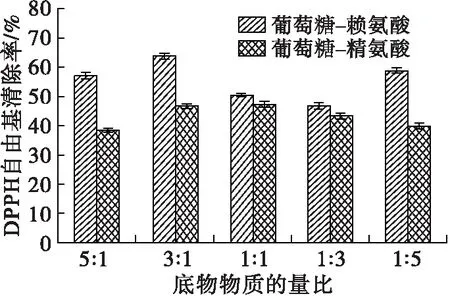
图3 底物物质的量比对美拉德反应进程及MRPs抗氧化活性的影响
从图3可以看出:在底物物质的量比3∶1的条件下,葡萄糖-赖氨酸MRPs含量达到最大值,A294和A420分别为0.169 4和1.537 5;而在底物物质的量比1∶1条件下,葡萄糖-精氨酸MRPs含量最大,A294和A420分别为0.115 7和1.087 7。pH的变化反映体系内氨基酸的反应程度,两个体系MRPs的pH最低点也分别出现在底物物质的量比3∶1 (葡萄糖-赖氨酸)和1∶1(葡萄糖-精氨酸)。葡萄糖-赖氨酸MRPs的DPPH自由基清除率在底物物质的量比3∶1时最高,为63.71%,而葡萄糖-精氨酸MRPs的DPPH自由基清除率在底物物质的量比1∶1时最高(47.35%),趋势与A294和A420相同。 综上所述,当葡萄糖与赖氨酸物质的量比为3∶1,葡萄糖与精氨酸物质的量比为1∶1时,美拉德反应产物的抗氧化能力比较好。基于此,利用葡萄糖和赖氨酸、精氨酸制备MRPs的最优条件分别为反应温度180℃、反应时间105 min、底物物质的量比3∶1和反应温度180℃、反应时间105 min、底物物质的量比1∶1。
2.4 MRPs对冷榨亚麻籽油氧化稳定性的影响
为了探究MRPs对冷榨亚麻籽油氧化稳定性的影响,添加200 mg/kg按最优条件制备的MRPs到冷榨亚麻籽油中,在60℃下进行Schaal烘箱法加速氧化实验,测定过氧化值和p-茴香胺值,结果见图4。
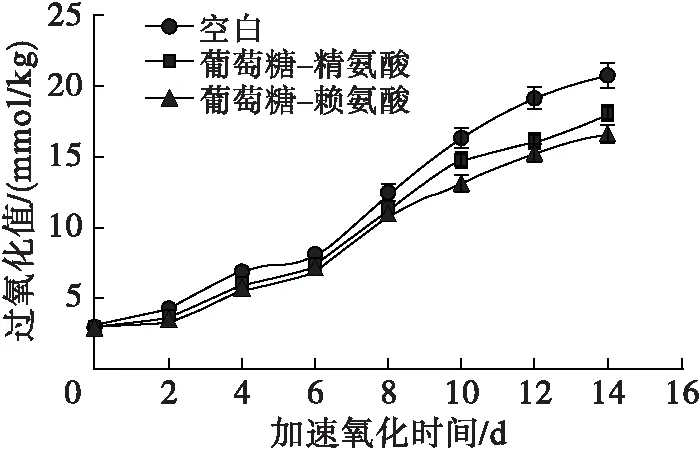

图4 MRPs对冷榨亚麻籽油氧化稳定性的影响
由图4可知:随着加速氧化时间的延长,空白冷榨亚麻籽油的过氧化值从2.94 mmol/kg上升至20.79 mmol/kg,与易志[22]报道的冷榨亚麻籽油60℃恒温箱下储存过氧化值变化趋势相近;添加了200 mg/kg MRPs(葡萄糖-精氨酸)的冷榨亚麻籽油,过氧化值从2.94 mmol/kg上升至18.11 mmol/kg;添加了200 mg/kg MRPs(葡萄糖-赖氨酸)的冷榨亚麻籽油,过氧化值从2.94 mmol/kg上升至16.62 mmol/kg。在60℃储藏14 d后,与空白冷榨亚麻籽油相比,添加200 mg/kg MRPs分别使过氧化值降低了12.89%(葡萄糖-精氨酸)和20.06%(葡萄糖-赖氨酸),对过氧化值抑制效果不明显。空白冷榨亚麻籽油的p-茴香胺值从3.67上升至28.63;添加了200 mg/kg MRPs(葡萄糖-精氨酸)的冷榨亚麻籽油,p-茴香胺值从3.67上升至19.85,相较于空白冷榨亚麻籽油降低了30.67%;添加了200 mg/kg MRPs(葡萄糖-赖氨酸)的冷榨亚麻籽油p-茴香胺值最低,p-茴香胺值从3.67上升至17.98,相较于空白冷榨亚麻籽油下降了37.20%。本研究中添加MRPs(葡萄糖-赖氨酸、葡萄糖-精氨酸)对p-茴香胺值的抑制效果与Mohanan等[23]在亚麻籽油中添加200 mg/kg抗坏血酸棕榈酸酯并进行60℃加速氧化实验的结果相当。
3 结 论
一定程度的炒籽对亚麻籽油的氧化稳定性有积极影响,在180℃、20 min炒籽条件下,亚麻籽油烘箱法加速氧化20 d后的全氧化值及醛类物质含量最低。炒籽过程中发生美拉德反应的潜在底物为葡萄糖、半乳糖、果糖和精氨酸、丙氨酸、谷氨酸、亮氨酸、赖氨酸;葡萄糖-赖氨酸及葡萄糖-精氨酸MRPs的抗氧化活性较好。对于葡萄糖-赖氨酸反应体系,在反应温度180℃、反应时间105 min、底物物质的量比3∶1条件下反应,MRPs抗氧化能力最好;对于葡萄糖-精氨酸反应体系,在反应温度180℃、反应时间105 min、底物物质的量比1∶1条件下反应,MRPs抗氧化能力最好。两种体系制备的MRPs对冷榨亚麻籽油过氧化值增长的抑制效果有限,但对p-茴香胺值的增长有一定的抑制作用。由此可知,炒籽中赖氨酸、精氨酸与葡萄糖的美拉德反应是提高热榨亚麻籽油氧化稳定性的原因之一,其MRPs对冷榨亚麻籽油的氧化有一定的抑制作用。

