秀丽隐杆线虫对辛硫磷趋化效应研究
邹伟,李梦圆,唐秀琴,杨庆红,常巍
(昆明医科大学 公共卫生学院,云南昆明 650500)
秀丽隐杆线虫(Caenorhabditiselegans)对食物和病原体产生的各种气味剂表现出趋化效应,土壤中生活的秀丽隐杆线虫具有12对纤毛结构化感神经元用于感知化学物质[1]。通过嗅觉神经元AWA、AWB和AWC检测嗅觉信号,其中AWA和AWC检测吸引性挥发化合物,AWB神经元感应排斥性挥发化合物[2]。线虫神经元感知趋化物质具有特异性,如AWA和AWC神经元受体ODR-10特异性感知吸引性物质二乙酰[3]。
AWA与AWC的嗅觉转导途径相似,即特定信号分子对其配体作出反应,激活下游效应分子。在AWC神经元中,环核苷酸门控通道TAX-2/TAX4转导G蛋白偶联受体(G Protein Coupled Receptors,GPCR)下游的信号[4];AWA的转导则是通过TRPV通道OSM-9/OCR-2[5]。
辛硫磷是一种高效低毒的有机磷杀虫剂,通过抑制虫体内胆碱酯酶的活性抑制神经传导,导致虫体麻痹而死亡。同时,辛硫磷对一些寄生虫宿主的胆碱酯酶活力具有抑制作用,增强宿主胃肠蠕动,加速虫体排出体外。辛硫磷杀虫谱广、应用简单,对多种鳞翅目幼虫防治效果较好[6]。研究发现,辛硫磷是一种具有挥发性气味的杀虫剂。秀丽隐杆线虫表现出对不同浓度的辛硫磷的趋化作用。作为挥发性信号,线虫通过AWA或AWC何种受体感知,感知后如何进行信号转导有待阐明。本研究旨在探讨线虫感知辛硫磷挥发性气味的机制,为高效杀虫农药的开发提供新思路。
1 材料与方法
1.1 试剂与仪器
50%辛硫磷,LR级,山东埃森化学有限公司;RNA提取试剂盒、cDNA合成试剂盒,北京天根生物科技公司;SYBR Green,北京聚合美生物有限公司;qPCR引物,上海生工生物工程有限公司;叠氮化钠,分析纯,美国Sigma-Aldrich;异丙基硫代半乳糖苷(IPTG),分析纯,上海生工生物工程有限公司;氨苄青霉素(AMP),分析纯,上海生工生物工程有限公司。
Allegra X-30R低温高速离心机,美国贝克曼公司;TD-600低速离心机,四川蜀科仪器有限公司;Light Cycler 96实时荧光定量PCR仪,德国Eppendorf公司;TSX超低温冰箱,美国Thermo Fisher Scientific;Boxun超净工作台,上海博讯实业有限公司。
1.2 线虫品系和培养基
线虫品系为N2,线虫干扰株包括odr-1、odr-7、str-2、odr-10、str-7、str-112、str-193、odr-3、gpa-2、gpa-3、gpa-13、gsa-1、goa-1、kin-2、pde-1、daf-11和odr-1基因干扰HT115细菌株。
NGM培养基:蛋白胨2.5 g、氯化钠3.0 g、氯化钙0.11 g、硫酸镁0.12 g、胆固醇0.005 g、磷酸二氢钾3.4 g、琼脂17.0 g,蒸馏水1 L。
Sbasal缓冲液:100 mmol/L氯化钠,0.01 mmol/L胆固醇,50 mmol/L磷酸钾(pH 6.0)。
LB培养基:酵母提取物5 g、胰蛋白胨10 g、氯化钠10 g,蒸馏水1 L。
秀丽隐杆线虫培养于接种了大肠杆菌(Escherichia coli)OP50的NGM平板上,20 ℃恒温培养。
1.3 趋化实验
趋化性实验在9 cm固体平板培养基上进行。线虫在接种OP50的NGM培养基上培养至成熟期,用Sbasal缓冲液洗涤数次,放置于准备好的趋化性测定板上。待线虫散开后,在趋化板背面标记两个点,一个标记点准确滴加1 μL辛硫磷(10-1、10-2、10-3稀释度)和1 μL叠氮化钠(1 mol/ L),另一标记点准确滴加1 μL水和1 μL叠氮化钠(1 mol/L)作为对照。在辛硫磷和对照物等距中心添加大约100条成熟期线虫(图1),加入1 h后,计算趋化指数,每组设3个平行样,试验重复3次。
图1 趋化实验示意图
趋化指数=(辛硫磷处的线虫数量-对照处线虫数量)/线虫总数
1.4 RNAi干扰实验
-80 ℃超低温冰箱中将干扰细菌株取出划线于含有100 μg/mL氨苄青霉素抗性的LB平板上活化,培养过夜。挑取单克隆干扰细菌至含100 μg/mL氨苄青霉素抗性的LB液体培养基中,放到摇床中,180 r/min、37 ℃培养过夜。取300 μL菌液加到含1 mmol/L IPTG和100 μg/mL氨苄青霉素抗性的NGM培养基上,超净工作台里吹干,25 ℃培养过夜,诱导小RNA的生成,达到干扰降低该基因表达的目的。平板培养完成后,将L1线虫接种于平板上,待线虫生长至young adult阶段进行后续实验。
1.5 qPCR实验
线虫在接种OP50的NGM培养基中20 ℃下培养至young adult,用S basal缓冲液洗涤数次,并置于趋化测定板上;滴加5 μL辛硫磷于无菌棉上,并用双面胶固定于板盖上,翻转盖子盖住底部,用封口膜封实。1 h后收集线虫,按标准程序提取总RNA并反转录为cDNA。以act-1为内参基因,用2-ΔΔCt计算辛硫磷处理组较对照组基因转录水平的差异,引物序列见表1。
1.6 数据分析
实验均重复3次,应用GraphPad Prism 8.4.0绘图和数据分析,所有数据均表示为平均值±标准差。采用t检验进行两两比较,P<0.05表示差异有统计学意义。
2 结果与分析
2.1 辛硫磷的趋化性依赖于AWC神经元
前期研究发现0.5 μg/mL、1.0 μg/mL、2.5 μg/mL及5.0 μg/mL辛硫磷暴露,线虫死亡率分别为17%、28%、52%和76%,均有较强杀灭效应(图2A),同时发现不同浓度辛硫磷对线虫有较强趋化效应。
为了确定辛硫磷的最佳趋化浓度,通过水稀释辛硫磷建立10-1、10-2和10-33个浓度梯度。通过趋化实验检测3个稀释度线虫的趋化效应分别为0.46、0.52和0.10,稀释度为10-2时趋化指数最高(图2B),因此在后续实验中使用该稀释液。
两对化感神经元AWA和AWC是感知挥发性趋化物的关键神经元,odr-1和odr-7基因突变分别导致AWC和AWA神经元功能障碍。为了确定传递辛硫磷信号的神经元,检测了odr-1和odr-7 RNAi线虫的趋化指数。与野生型线虫(N2)趋化指数0.53相比,odr-1 RNAi趋化指数下降为0.12(P<0.05),趋化反应明显缺陷;odr-7基因干扰,趋化正常(图2C)。实验结果表明,AWC神经元对辛硫磷的感知至关重要。
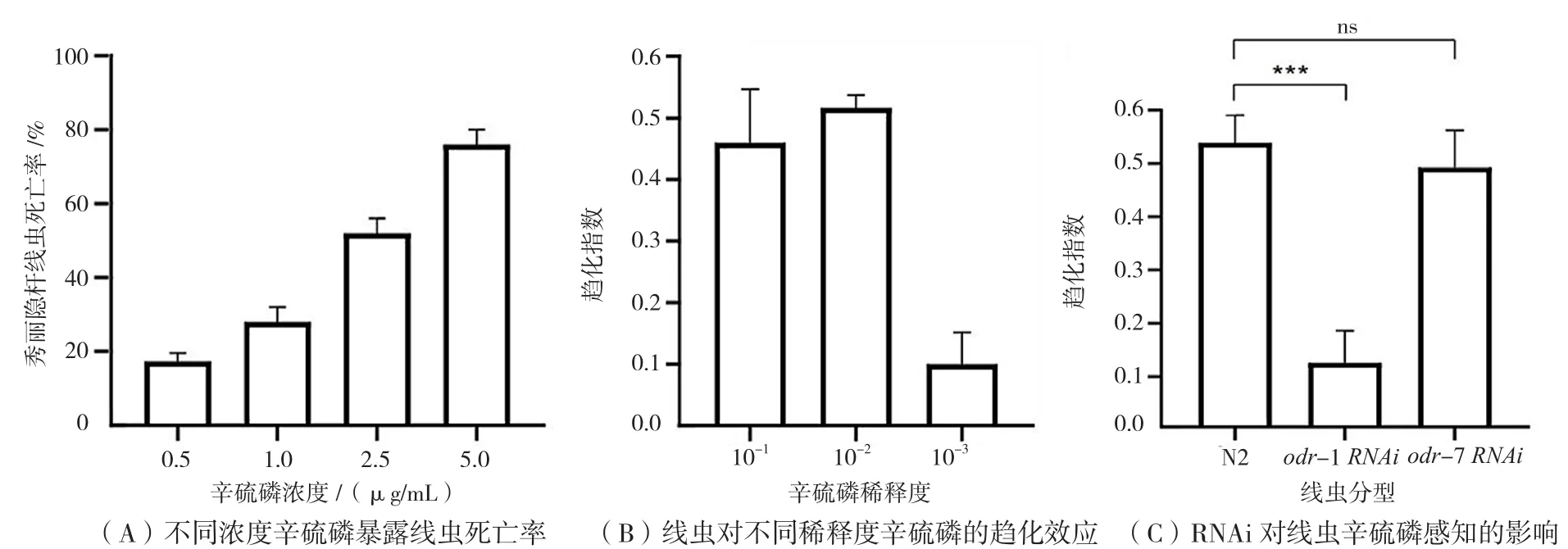
图2 介导线虫对辛硫磷趋化反应的神经元鉴定
2.2 G蛋白偶联受体str-112对辛硫磷信号具有特异性反应
据报道,G蛋白偶联受体(GPCR)STR-2和odr-10定位于AWC和AWA的神经元,分别在感知2-庚酮和双乙酰中发挥作用[5]。此外,一些候选gpcr,如str-7、str-112、str-193等被预测为潜在的化学品受体[7]。
为了检测参与感知辛硫磷的GPCR,分别干扰str-2、odr-10、str-7、str-112和str-193基因表达,检测线虫趋化行为。如图3A所示,str-2、odr-10、str-7和str-193基因干扰后趋化无明显变化,str-112基因干扰后趋化降为0.13(P<0.05)。
为了检测趋化过程中GPCR蛋白的表达情况,通过 qPCR检测 str-2、odr-10、str-7、str-112和 str-193基因转录水平。如图3B所示,str-2、odr-10基因转录水平无明显变化,str-7、str-193基因转录水平分别降低为0.02和0.25(P<0.05),str-112基因转录水平则升高0.79倍(P<0.05)。结果表明,线虫通过STR-112感知辛硫磷挥发性气味信号,在感知过程中STR-7、STR-193转录受到抑制,STR-112转录活性增强。
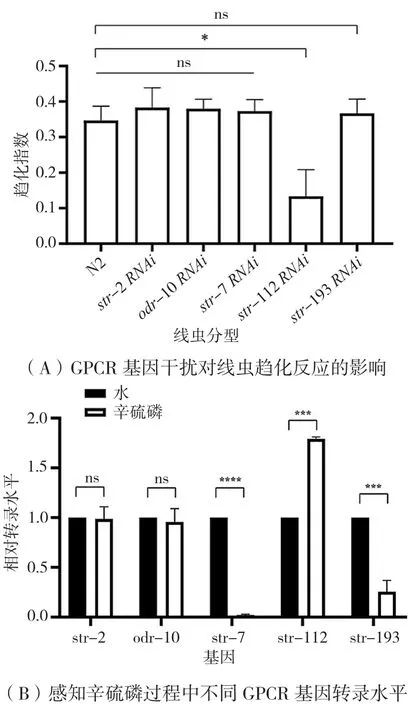
图3 参与辛硫磷感知的GPCR鉴定
2.3 Gα参与线虫对辛硫磷的信号转导
当GPCR接收到挥发性气味等细胞外信号后,信号传递至下游信号传感器G蛋白。G蛋白是由α、β和γ亚基组成的异聚体蛋白复合物,α亚单位的激活负责信号转导[8]。在秀丽隐杆线虫中,至少有6个Gα亚单位在AWC神经元中表达,分别为odr-3、gpa-2、gpa-3、gpa-13、gsa1 和 goa-1。
通过odr-3、gpa-2、gpa-3、gpa-13、gsa-1和goa-1的RNAi实验筛选负责辛硫磷感知的Gα亚单位。如图4A所示,odr-3、gpa-2、gpa-3和gpa-13基因的干扰对趋化反应无显著影响;gsa-1和goa-1基因干扰导致对辛硫磷趋化性缺陷,趋化指数降为0.24(P<0.05)。
为了检测趋化过程中Gα表达情况,通过qPCR检测 odr-3、gpa-2、gpa-3、gpa-13、gsa-1和goa-1基因转录水平。如图4B所示,odr-3、gpa-2、gpa-3和gpa-13基因转录水平无明显变化,gsa-1和goa-1基因转录水平分别升高1.51倍和2.58倍(P<0.05),说明线虫通过GSA-1和GOA-1传导辛硫磷挥发性气味信号。
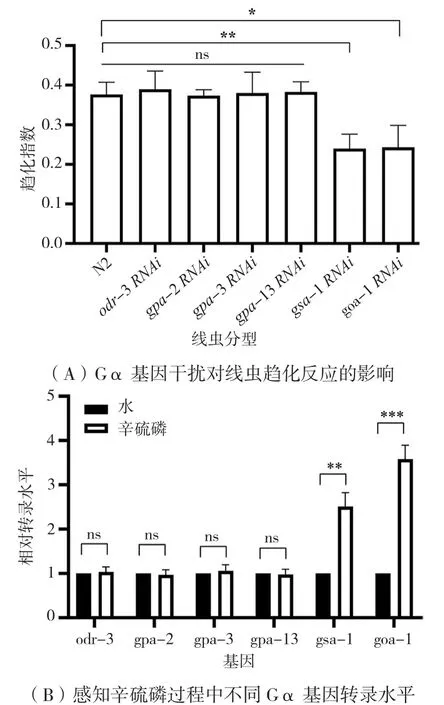
图4 参与线虫对辛硫磷感知的Gα筛选
2.4 辛硫磷趋化的下游级联信号
当配体结合且GPCR和Gα蛋白被激活时,可触发信号级联中下游信使的激活,如细胞内环核苷酸(cAMP或cGMP)、肌醇1,4,5-三磷酸二酰甘油(DAG)和细胞质钙。为了阐明AWC神经元中负责辛硫磷嗅觉感知的信号通路,对鸟苷酸环化酶受体cGMP信号通路,包括编码受体型鸟苷酸环化酶(DAF-11和ODR-1)、活化阳离子通道的两个亚基(TAX-2和TAX-4)和腺苷酸环化酶受体cAMP(KIN-2和PDE-1)相关基因进行RNAi干扰,检测趋化指数。
如图5A所示,kin-2和pde-1基因干扰,趋化指数无明显变化;daf-11和odr-1基因干扰导致趋化指数下降为0.31和0.30(P<0.05);tax-2和tax-4基因干扰导致趋化指数下降为0.27和0.25(P<0.05)。结果表明,GSA-1和GOA-1信号转导至鸟苷酸环化酶受体,激活第二信使cGMP信号,进一步活化TAX-2/TAX-4门控通道(图5B)。
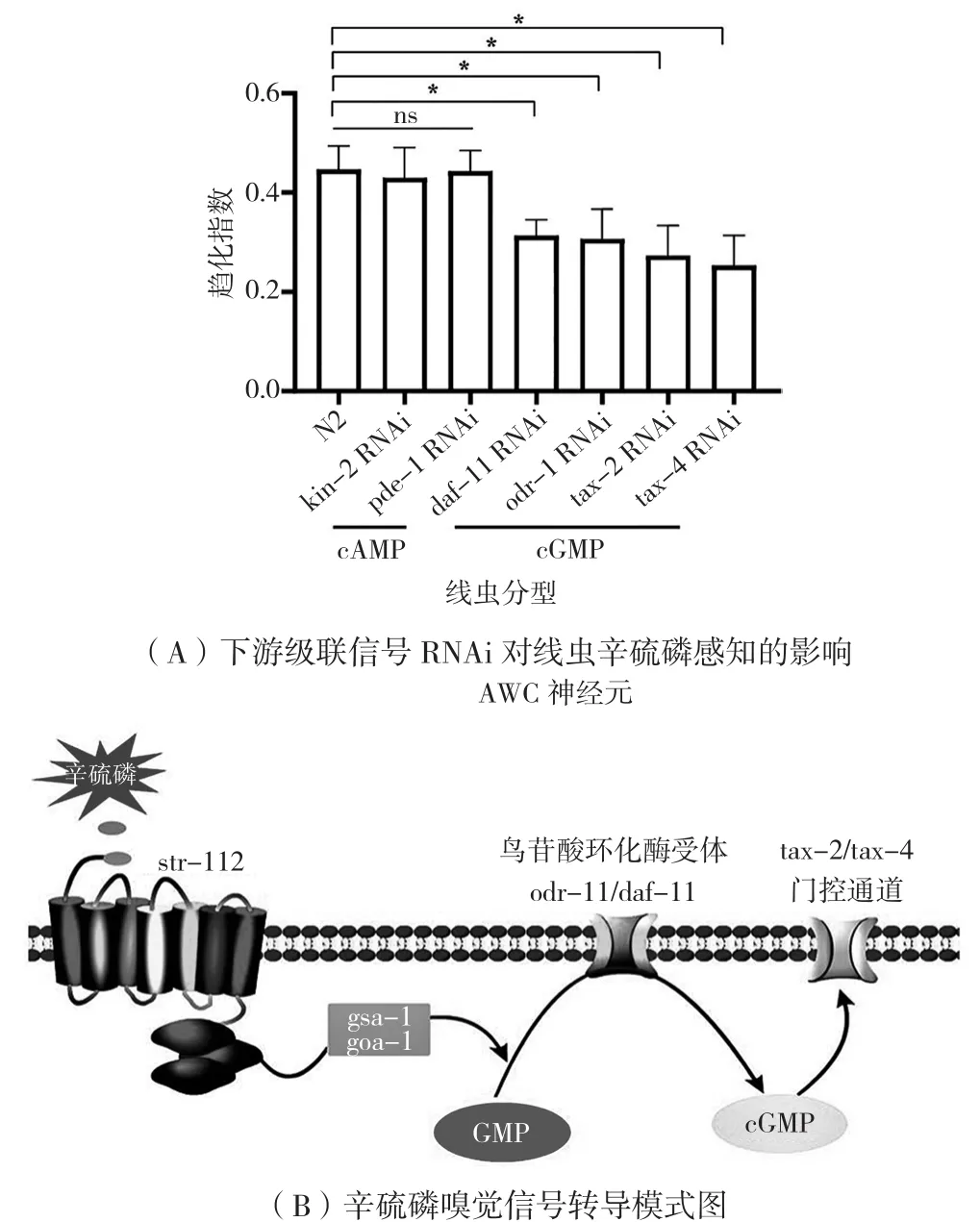
图5 辛硫磷趋化的下游级联信号分析
3 结论
秀丽隐杆线虫对挥发性物质的感知依赖于GPCR将胞外信号转导至胞内,GPCR由一个大基因家族编码,线虫中一个神经元可能表达多个功能独立的化学受体。ODR-10是AWA中二乙酰的特异性受体,STR-7是AWA中2-乙基己醇的特异性受体,STR-2是AWC中2-庚酮的特异性受体,STR-193是AWC中吲哚的特异性受体[3,5,9]。因此,一个或多个特定神经元上不同化学感受器的激活导致线虫趋化或趋避行为。在AWC神经元中,ODR-1作为跨膜鸟苷酸环化酶发挥作用,cGMP门控阳离子通道(TAX-2/TAX-4)由第二信使cGMP激活。辛硫磷嗅觉信号被线虫受体STR-112接收,将信号转导至胞内。辛硫磷信号通过Gα GSA-1和GOA-1转导至鸟苷酸环化酶受体,激活第二信使cGMP信号,进一步活化TAX-2/TAX-4门控通道,完成信号转导。

