敲低、过表达NCOA4慢病毒包装及稳转HFL1细胞株构建
黄德林,陈雅慧,凡志婷,石祥广,黄炎,王少辉,王久存,姜帅
(复旦大学 生命科学学院,上海 200438)
细胞死亡是所有真核生物的共同特征,对保持细胞和机体正常生长发育有着至关重要的作用。科学家根据细胞死亡时不同的形态学特征提出了坏死性凋亡、自噬性死亡、焦亡和铁死亡等细胞死亡类型[1-2]。铁死亡(ferroptosis)是2012年DIXON等学者发现的一种新的调节性细胞死亡(Regulatory Cell Death,RCD)形式,在多种疾病中扮演重要角色[3]。目前已发现铁死亡在肺纤维化、肺癌、慢性阻滞性肺病(COPD)、急性肺损伤、肺结核等肺部疾病中发挥重要作用[4]。
铁死亡是一种区别于传统细胞死亡形式的全新细胞死亡方式。铁死亡的典型特征是依赖于铁过载导致的细胞脂质过氧化[5]。铁的吸收主要来源于膳食,小肠吸收铁离子转运进入细胞后被还原为二价铁离子,过量二价铁离子会催化细胞发生脂质过氧化而死亡。伴随铁过载引发的脂质过氧化所催化的细胞死亡方式,被称为铁死亡[6]。随着工业化进程加速,人类活动和环境破坏导致恶性和非恶性呼吸系统疾病的发病率急剧上升,而铁死亡的发现可能为解决呼吸系统疾病提供新思路。
核受体共激活因子4(Nuclear Receptor Coactivator 4,NCOA4)介导铁自噬(ferritinophagy)的激活,在铁代谢过程中扮演重要角色[7-8]。铁蛋白(ferritin)是细胞内储存铁的重要方式,研究发现NCOA4可以识别结合铁蛋白[9],二者形成的蛋白复合体可以被自噬溶酶体识别并降解释放出游离铁,重新参与机体铁代谢循环,游离铁过量则会促进铁死亡的发生[10-12]。NCOA4介导的铁死亡对肺部细胞功能的影响尚待阐明,本研究旨在通过构建敲低、过表达人NCOA4慢病毒载体,感染目的细胞获得敲低、过表达NCOA4的人胚肺成纤维细胞(HFL1)稳转株,为研究NCOA4介导的铁死亡在肺部疾病中的作用机制提供工具细胞。
1 材料与方法
1.1 试剂
PCR引物、DEPC水,生工生物工程(上海)股份有限公司;NCOA4引物,赛音生物技术(上海)有限公司;PCR 酶、AgeⅠ、EcoRⅠ、NotⅠ,美国New England Biolabs公司;TaqManTMMicroRNA逆转录试剂盒、DMEM、胰酶、青霉素/链霉素、嘌呤霉素、低内毒素质粒抽提试剂盒、DNA快速回收试剂盒,美国Thermo Fisher Scientific公司;DNA marker,翌圣生物科技(上海) 股份有限公司;SYBR Premix Ex Taq™Ⅱ试剂,日本Takara公司;TEMED,美国Sigma公司;HFL1细胞,美国ATCC公司。
1.2 仪器
BCD-118TMPA型冰箱,海尔(上海)电器有限公司;MricroCL 21离心机、QuantStudio 7实时定量PCR仪、Heraguard ECO超净工作台,美国Thermo Fisher Scientific公司;MCO-20AIC细胞培养箱,日本Panasonic公司;Lecia DMR荧光显微镜,德国Fecialeica公司;Gel Doc XR+自动曝光仪,美国BIORAD公司;HW24水浴锅,上海一恒科学仪器有限公司。
1.3 实验方法
1.3.1 敲低、过表达载体的构建
1.3.1.1 设计NCOA4的shRNA和PCR引物
依据人NCOA4的cDNA序列以及pLKO.1、pCDH载体的酶切位点设计相应的shRNA和PCR引物。为保证实验准确性,本研究设计了2对shRNA(如表1所示),2对PCR引物(如表2所示),由赛音生物技术(上海)有限公司合成。
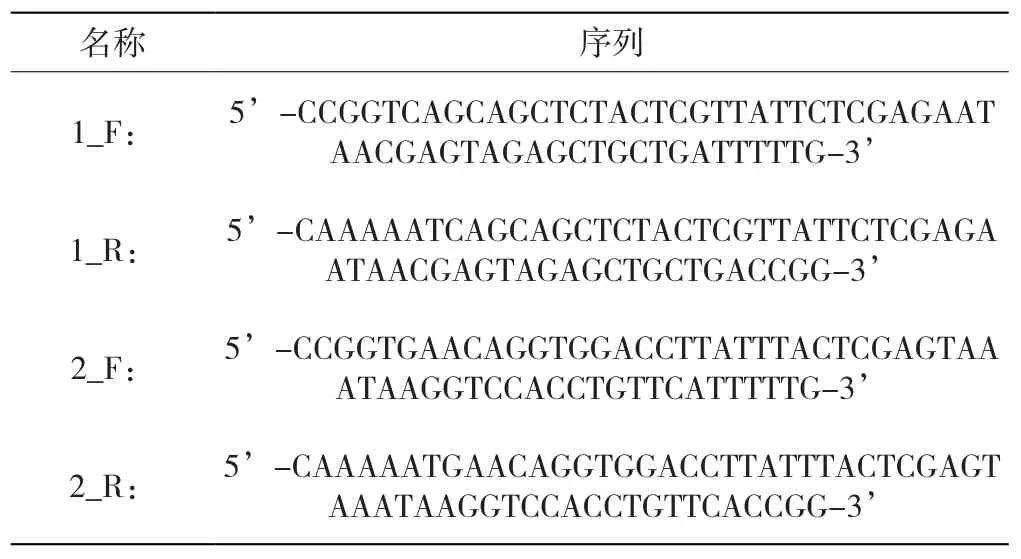
表1 NCOA4的shRNA
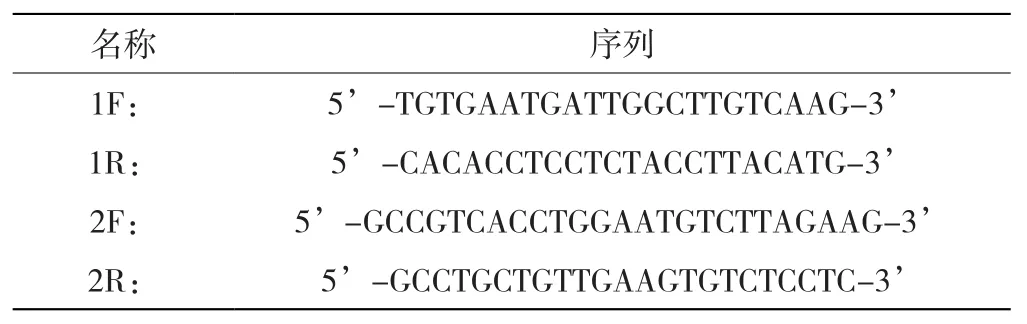
表2 NCOA4的PCR引物
1.3.1.2 NCOA4敲低、过表达慢病毒包装载体双酶切
(1)慢病毒包装质粒转化大肠杆菌感受态DH5-α,扩增后提取目的质粒。(2)检测质粒浓度后,取1 μg质粒,根据酶切位点选择合适的限制性内切酶双酶切目的质粒。酶切体系如下:1 μg质粒,10×NEB buffer 5 μL,pLKO.1载体加EcoRⅠ、AgeⅠ各1 μL(pCDH载体加EcoRⅠ、NotⅠ各1 μL),加ddH2O至总体积为50 μL,37 ℃酶切4 h。(3)琼脂糖凝胶电泳回收酶切产物,回收目的片段的胶条并检测浓度。
1.3.1.3 shRNA退火和目的基因PCR扩增
(1)将合成的shRNA和引物稀释成终浓度为5 μmol/mL的储藏液。(2)shRNA退火:正向、反向shRNA及10×NEB buffer 2各5 μL,加ddH2O至总体积50 μL,95 ℃加热5 min,梯度降温。(3)PCR扩增:正向、反向引物及高保真酶各5 μL,加ddH2O至总体积50 μL。94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,循环35次。(4)结束后进行琼脂糖凝胶电泳,并回收目的基因。
1.3.1.4 目的基因与载体连接
测定步骤1.3.1.2和1.3.1.3中回收的载体和目的基因的浓度,分别将退火后的shRNA与pLKO.1片段连接,将扩增的NCOA4基因与pCDH片段连接。连接体系:插入片段100 ng,线性化克隆载体500 ng,NEB T4 DNA ligase 2 μL,10×NEB T4 DNA ligase buffer 2 μL,ddH2O定容至20 μL。16 ℃连接过夜。
1.3.1.5 重组质粒的转化扩增、测序
取2 μL重组质粒,用移液枪转移至大肠杆菌DH5-α感受态细胞中,冰浴30 min,42 ℃水浴锅热激50 s,然后迅速置于冰上5 min。加入300 μL无抗生素培养基,37 ℃振荡培养2 h。3 000 r/min离心5 min,弃掉200 μL上清液,剩余液体吹打均匀,在含抗生素的LB培养板中涂匀,37 ℃培养箱内倒置培养过夜。挑取单克隆扩大培养,提取质粒后测序,测序正确即可进行慢病毒包装。
1.3.2 慢病毒包装感染HFL1构建稳转株1.3.2.1 包装慢病毒
本实验采用Addgene公司的三质粒包装体系。(1)在6 cm皿中铺板293T细胞,待长到80%时,更换新鲜培养基。(2)取靶基因质粒4 μg,psPAX2(Addgene #12260)3 μg,pMD2.G(Addgene#12259)1 μg加入到500 μL无血清opti-MEM中配制溶液A;同时取16 μL Lipo2000加入到500 μL无血清opti-MEM中配制溶液B;分别静置5 min。(3)混合溶液A、B,静置20 min,将混合后的溶液加入到293T细胞中。12 h后换液,并添加丁酸钠至终浓度为5 μmol/L。(4)48 h后培养基变黄,证明病毒包装成功,收集上清,用0.45 μm滤膜过滤。收集到的病毒溶液离心纯化后,-80 ℃冰箱冻存备用。
1.3.2.2 确定嘌呤霉素最佳筛选浓度
第1天:将HFL1铺板于10个6 cm的培养皿中,37 ℃、5% CO2条件下过夜培养。第2天:靶细胞应有约80%~90%汇合。嘌呤霉素的最终浓度为1~10 μg/mL,增量为1 μg/mL,分别标记为1~10号平板,并向细胞中添加适当的含有嘌呤霉素的培养基。第3天及以后:每天检查细胞,24 h后更换含嘌呤霉素的新鲜DMEM完全培养基。最佳嘌呤霉素筛选浓度为3~5天后细胞完全死亡的嘌呤霉素浓度,也是实验中应用于筛选细胞的浓度。最终确定HFL1嘌呤霉素的最佳筛选浓度为1 μg/mL。
1.3.2.3 慢病毒感染HFL1和稳转细胞株的筛选
第1天:铺板HFL1细胞,在37 ℃、5% CO2条件下培养过夜。第2天:靶细胞应有约70%汇合。慢病毒颗粒溶液,对于6 cm靶板,添加0.5~1.0 mL病毒(高MOI添加0.5 mL,低MOI添加1.0 mL,根据目标板的大小调整病毒添加量)。添加聚凝胺至终浓度为8 μg/mL,37 ℃、5%CO2条件下培养细胞过夜。第3天:感染24 h后更换新鲜培养基。如果在细胞系中观察到病毒毒性,可以将感染时间减少到4~20 h,清除含有病毒的培养基,并更换为新的培养基。建议保持一个未感染病毒的平行细胞孔板作为嘌呤霉素筛选的对照组。第4天及以后:每隔48 h根据细胞生长状况更换含有嘌呤霉素的新鲜培养基。持续筛选14天后检测NCOA4的表达情况。
1.4 qPCR检测稳转细胞株NCOA4的表达
(1)收集细胞,加Trizol充分裂解后提取总RNA。取1 μg的RNA,加DEPC水定容至7 μL,再加入1 μL 10×RT buffer,1 μL random primers,0.5 μL dNTP,0.5 μL反转录酶。混匀后按照25 ℃,5 min;37 ℃,2 h;85 ℃,5 min;4 ℃+∞完成逆转录获得cDNA。(2)获取的cDNA用ddH2O稀释10倍,qPCR定量。体系包括稀释后的cDNA 2 μL,浓度为2 μmol/L的上下游引物各0.5 μL,SYBR Mix 2 μL。反应条件:95 ℃,40 s;95 ℃,30 s;60 ℃,60 s;72 ℃,30 s;重复36个循环。
1.5 Western Blot检测稳转细胞株NCOA4的表达
收集细胞,加入RIPA蛋白裂解液,冰上裂解30 min。转移至离心管,加5×的loading buffer染色,100 ℃金属浴10 min,然后迅速置于冰上冰浴,防止蛋白复性。收集处理后的蛋白SDS-PAGE电泳至溴酚蓝跑出蛋白凝胶底部,进行转膜。转膜后用5%BSA封闭2 h,孵育一抗过夜,第二天洗膜,孵育二抗2 h,再次洗膜后显影。
1.6 统计分析
序列比对使用软件DNAMAN 9.0。打开软件后选择要添加的NCOA4基因序列、NCOA4的shRNA、克隆载体测序数据。导入序列后选择Multiple Sequence Alignment,参数全部保持默认。
差异性分析使用软件GraphPad Prism 9.0,使用方差分析(Analysis of Variance,ANOVA)进行统计分析。
2 结果与分析
2.1 NCOA4敲低、过表达载体
pLKO.1长7 091 bp,shRNA1长58 bp。在双酶切掉一个约1 900 bp片段的位置连接上shRNA,获得目的载体长约5 200 bp。pCDH长7 384 bp,NCOA4基因片段长1 890 bp,因此连接上NCOA4片段后长约9 200 bp。如图1所示,核酸电泳显示重组载体在相应分子量位置出现,在相同条件下环状质粒比线性质粒运动更快,酶切鉴定与预期相符。如图2所示,测序结果显示shRNA1(KO1)成功连到pLKO.1载体上,NCOA4基因片段成功连到pCDH载体上。
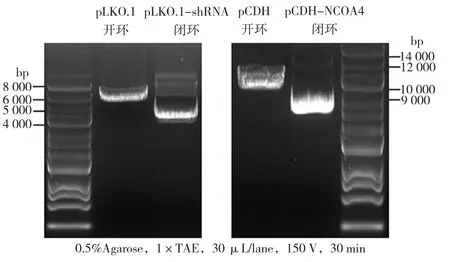
图1 目的基因质粒的酶切电泳

图2 目的基因质粒的测序
2.2 敲低、过表达NCOA4的HFL1稳转细胞系
用包装好的NCOA4敲低、过表达慢病毒感染HFL1细胞,得到敲低、过表达NCOA4的HFL1稳转株。如图3、图4所示,经qPCR和Western Blot检测发现NCOA4实现了稳定低表达和高表达,成功构建NCOA4敲低、过表达的HFL1细胞系。

图3 稳转细胞系中NCOA4蛋白表达情况

图4 稳转细胞系中NCOA4的mRNA相对表达量
4 结论
铁死亡与肺纤维化、肺癌、慢性阻塞性肺疾病(COPD)等多种肺部疾病发生发展密切相关[13]。研究表明,特发性肺纤维化(IPF)患者肺中的总铁水平、铁相关氧自由基均有所增加[14];Fer-1可以通过抑制铁死亡进而抑制成纤维细胞向肌成纤维细胞的分化[15]。正常HFL1能够活化形成肿瘤相关成纤维细胞(CAFs),促进肺癌的发生发展[16]。COPD常伴随成纤维细胞过度增殖,正常的组织结构破坏,并发间质性肺纤维化,诱导成纤维细胞发生铁死亡,可能为COPD的治疗提供新思路[17]。NCOA4介导的铁死亡与肺部疾病的研究尚处于早期阶段,大部分研究仅揭示了呼吸系统疾病中存在铁死亡现象,但其具体机制尚不明确。深入探究铁死亡与疾病发生发展的具体机制,有助于加深对肺部疾病的认识,为肺部疾病提供更精准的治疗[18-19]。
基于此,使用基因工程技术构建了NCOA4敲低、过表达慢病毒包装质粒,通过慢病毒三质粒包装系统包装敲低、过表达NCOA4慢病毒感染颗粒,并确定了HFL1的嘌呤霉素最佳筛选浓度为1 μg/mL。慢病毒感染目的细胞2~3天后,嘌呤霉素筛选2周,获得了敲低、过表达NCOA4的HFL1稳转株,为深入研究NCOA4介导的铁自噬引发的铁死亡在肺部疾病中发挥的作用提供了一个优良的细胞模型。
——一道江苏高考题的奥秘解读和拓展

