环巴胺对四氯化碳所致肝损伤小鼠模型的作用
丁海虎,李澳峰,徐银花
(1.蚌埠医学院 基础医学院机能实验中心,安徽 蚌埠 233030;2.蚌埠医学院 医学影像学院,安徽 蚌埠 233000)
肝损伤是机体肝脏受各类复杂致病因素影响而诱发肝脏发生病变的过程。有研究表明,药品和生物制品对肝损伤进程具有显著干预作用,能够有效保护肝功能[1]。环巴胺(Cyclopamine),又名环靶明,是一种从植物中提取分离而得到的生物碱,是Hedgehog(Hh)信号通路的特异性抑制剂,肝损伤后该信号通路可被激活,并参与包括促进肝脏祖细胞的增殖等过程[2-3];此外,环巴胺可通过抑制该信号通路中关键蛋白的表达从而影响肝再生[4]。本实验旨在通过研究环巴胺预防性给药对CCl4诱导的肝损伤小鼠模型的干预作用及其可能的治疗机制,为环巴胺临床治疗肝损伤提供理论基础[5]。
1 材料与方法
1.1 药品与试剂
环巴胺冻干粉(批号:DST190314-087),HPLC≥98%,成都德思特生物技术有限公司;四氯化碳溶液(CCl4)(批号:C805332),HPLC≥98%,上海麦克林生化科技有限公司;橄榄油(批号:C10438063),分析纯,上海麦克林生化科技有限公司;总超氧化物歧化酶(T-SOD)、丙二醛(MDA)、总胆红素(TBil)以及谷胱甘肽(GSH)检测试剂盒(批号依次为:20200328、20200417、20200508、20200513),南京建成生物工程研究所有限公司。
1.2 试验动物
清洁级ICR小鼠40只,周龄7~8周,雌雄不限,体重(25±5)g,购自安徽医科大学实验动物中心。生产许可证号:SCXK(皖)2017-001号。饲养环境及方式:分笼饲养,动物自由进食任意饮水,12 h交替光照,恒温22 ℃,相对湿度为50%~75%的环境中适应性饲养7日后进行实验。
1.3 仪器与设备
EPOCH型酶标分析仪,美国伯腾仪器有限公司;Velocity 18R pro台式高速冷冻离心机,英国Dynamica;HH-4型数显恒温水浴锅,常州金坛良友仪器有限公司;FA2004B型电子天平,上海越平科学仪器有限公司;BX53(LED)半电动荧光型显微镜,日本奥林巴斯(北京)公司。
1.4 实验方法
1.4.1 试验设计
采用随机数表法将适应饲养后的动物随机均分为4组,分别为正常对照组(n=10),模型组(n=10),环巴胺预防1、2组(每组n=10)。正常对照组给予腹腔注射等体积生理盐水,其余3组通过腹腔注射2 mL/kg的40%CCl4-橄榄油混悬液(即CCl4浓度为0.8 mL/kg),每周2次,以建立肝损伤化小鼠模型。环巴胺预防1、2组在建模同时,分别给予浓度为1 mg/mL 的环巴胺 5 mg/(kg·d)、10 mg/(kg·d)腹腔注射。3周后最后一次给药后禁食禁水12 h,按体重采用20%氨基甲酸乙酯溶液0.067 5 mL/10 g腹腔注射麻醉,眼球摘除法采集血样。
1.4.2 肝指数测量
麻醉前称重并记录,待取血后,剖开腹部取出肝组织,置于盛有提前预冷4 ℃生理盐水培养皿中清洗肝脏数次至血液澄清,定性滤纸吸去水分后称重计算肝指数。计算肝指数方法为:肝指数=[肝脏湿重(g)/小鼠体重(g)]×100%[6]。
1.4.3 生化指标检测肝功能
取血后静置2 h,保持温度为4 ℃,在台式高速冷冻离心机中以3 500 r/min离心10 min,取上层血清,采用酶标分析仪检测TBil含量和T-SOD活性。在冰盒上切取0.3 g肝组织,加入3 mL预冷生理盐水后剪成细块,移入组织匀浆器中研磨,制备得10%肝匀浆以检测MDA含量与GSH活性,方法参照说明书操作。
1.4.4 肝脏病理学检查
称取肝湿重后均切取左外侧叶置于4%的多聚甲醛中固定,再用刀片修整并取相同部位,按照程序进行组织石蜡包埋、切片及HE染色,在显微镜下观察组织病理形态并摄片保存分析。
1.5 统计学方法
采用SPSS 27.0软件对所得数据进行分析,计量资料数据结果以(±s)表示,各组间差异比较采用单因素方差分析,方差齐时组间事后多重检验采用LSD法,方差不齐则事后多重检验采用Tamhane’s T2法,P<0.05表示组间差异具有显著性[6]。
2 结果与分析
2.1 环巴胺对小鼠体重、肝指数的影响
由表1可知,实验前小鼠体重组间均衡无差异;通过3周造模、给药处理后,动物体重及肝指数结果均显示:模型组较正常对照组显著降低(分别为P<0.05、P<0.01);环巴胺预防1、2组较正常对照组均略有降低,较模型组有所改善(P<0.01),提示环巴胺对动物体重和肝指数有一定干预作用,且两者均与剂量成正相关性。
表1 环巴胺对CCl4诱导的肝损伤化模型小鼠体重、肝指数的影响(±s)
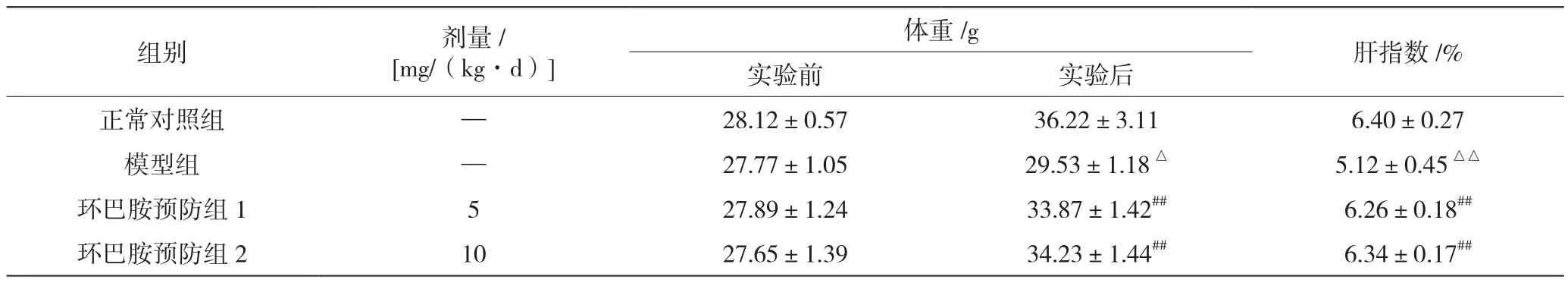
表1 环巴胺对CCl4诱导的肝损伤化模型小鼠体重、肝指数的影响(±s)
注:与正常对照组相比,Δ表示P<0.05,ΔΔ表示P<0.01;与模型组相比,#表示P<0.05,##表示P<0.01。下同。
组别 剂量/[mg/(kg·d)]体重/g 肝指数/%实验前 实验后正常对照组 — 28.12±0.57 36.22±3.11 6.40±0.27模型组 — 27.77±1.05 29.53±1.18△ 5.12±0.45△△环巴胺预防组1 5 27.89±1.24 33.87±1.42## 6.26±0.18##环巴胺预防组2 10 27.65±1.39 34.23±1.44## 6.34±0.17##
2.2 环巴胺对小鼠血清T-SOD活性和TBil含量的影响
检测血清T-SOD的活性,可在一定程度上反映内源性氧自由基清除的能力[7]。由表2可知,模型组血清T-SOD活性较正常对照组显著下降(P<0.05),提示CCl4诱导3周可使小鼠机体清除超氧自由基的能力减弱;环巴胺预防1、2组血清T-SOD活性较模型组显著升高(分别为P<0.05、P<0.01),且与剂量呈正相关性,较正常对照组无显著差异,表明其可通过提高小鼠机体清除自由基的能力来保护肝组织。
人体内绝大部分TBil来源于被破坏的衰老红细胞,当肝脏或胆道出现疾病时均可出现TBil的升高[8]。本实验结果显示(见表2),与正常对照组相比,模型组血清TBil含量显著升高(P<0.01);环巴胺预防1、2组均能显著下调TBil水平(P<0.01),表明CCl4诱导小鼠肝脏处理的能力下降,而环巴胺可通过干预该过程而提高机体肝脏处理TBil能力。
表2 环巴胺对CCl4诱导的肝损伤模型小鼠血清T-SOD、TBil的影响(±s)
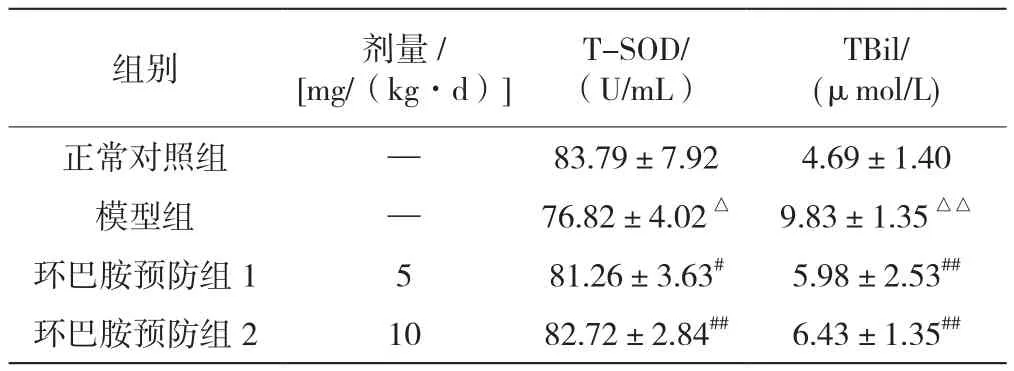
表2 环巴胺对CCl4诱导的肝损伤模型小鼠血清T-SOD、TBil的影响(±s)
组别 剂量/[mg/(kg·d)]T-SOD/(U/mL)TBil/(μmol/L)正常对照组 — 83.79±7.92 4.69±1.40模型组 — 76.82±4.02△ 9.83±1.35△△环巴胺预防组1 5 81.26±3.63# 5.98±2.53##环巴胺预防组2 10 82.72±2.84## 6.43±1.35##
2.3 环巴胺对小鼠肝组织MDA、GSH的影响
机体内MDA水平在肝损伤模型中用于评价脂质过氧化情况[7]。由表3可知,模型组肝组织MDA含量较正常对照组显著升高(P<0.01);与模型组相比,环巴胺预防1、2组血清MDA含量均显著下降(P<0.05),提示CCl4诱导小鼠肝损伤的机制可能是脂质过氧化损伤,环巴胺可能通过干预氧化酶活性来发挥保护作用。
GSH是肝细胞内最重要的抗氧化物,对肝损伤有保护和修复作用[7]。本实验结果显示(见表3),模型组肝组织的GSH活性较正常对照组显著下降(P<0.01),可能是因为CCl4诱导使动物机体氧化程度增强,自由基产生增多造成了明显的氧化损伤;环巴胺预防1、2组较模型组虽有一定升高,且与剂量呈正比关系,但差异不显著。
表3 环巴胺对CCl4诱导的肝损伤模型小鼠肝匀浆MDA、GSH的影响(±s)
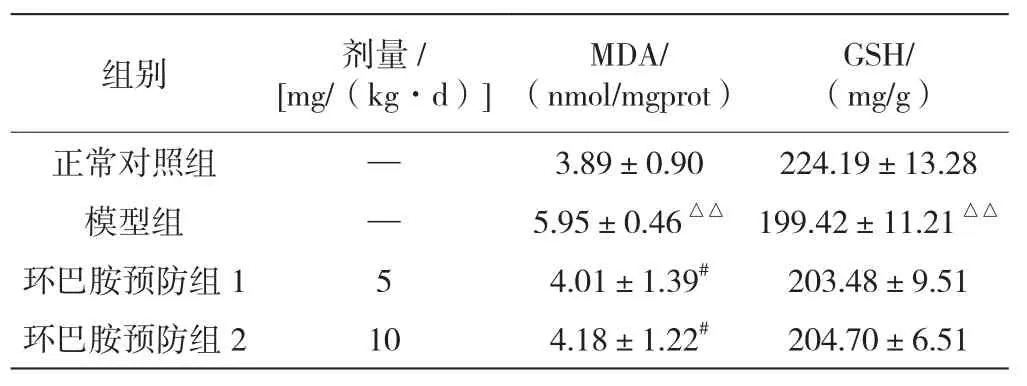
表3 环巴胺对CCl4诱导的肝损伤模型小鼠肝匀浆MDA、GSH的影响(±s)
?
2.4 小鼠肝组织病理学检查
小鼠肝组织切片病理学结果如图1所示。正常对照组肝组织各视野范围内未见明显病理学改变;模型组肝组织镜下形态呈现肝细胞弥漫分布的点状坏死,炎性细胞浸润,结构上肝小叶结构破坏、细胞索排列紊乱;环巴胺预防1、2组肝内条索分割明显,水肿现象明显减少,有少量炎性细胞浸润但不典型,表明环巴胺可减轻肝细胞的损伤。
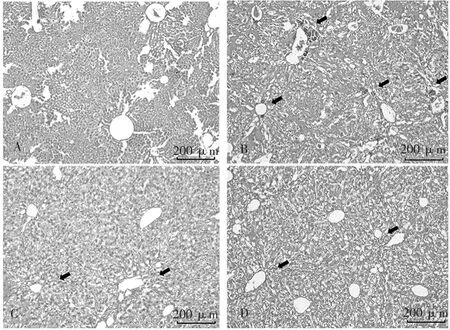
图1 小鼠肝组织病理学光镜图(HE染色,×100)
3 讨论与结论
3.1 讨论
延缓肝损伤进程或消除长期存在的肝损伤因素,避免肝组织由纤维化发展为肝硬化乃至肝癌的发病机制和药物治疗研究,一直是关系人类肝脏健康的热点[7]。化学性肝损伤是研究肝损伤常采用的动物模型之一,采用腹腔注射CCl4造模方法简便,可准确反映肝损伤后的功能、形态和代谢的变化,且在可控剂量内动物生存率较高[9-10]。本实验采用2 mL/kg的40%CCl4-橄榄油混悬液,即CCl4终浓度0.8 mL/kg,经腹腔注射吸收进入小鼠机体内15 min左右即可引起肝细胞损伤,2 d抵达峰点后进入修复阶段[4,11]。故本实验在建立肝损伤模型的时间上采用间隔3~4 d(即固定在每周周一与周四),以保障动物的生存率,结果表明该模型建立方法符合实验设计。有研究表明,急性肝损伤可表现为肝组织大量坏死,慢性肝损伤的发病机制复杂,主要表现出细胞外基质大量过度沉积,肝损伤中氧自由基消除失衡,过度滞留肝内而启动炎性反应,导致细胞膜通透性改变而释放大量酶终致失活,引发肝损伤[12]。本实验也观察到CCl4诱导的小鼠机体内与清除自由基相关T-SOD、GSH酶活性发生了改变,过氧化物产物MDA、肝损伤产物TBil显著升高,提示环巴胺的干预机制可能是通过调节肝脏组织中氧自由基的产生与消除平衡从而起到肝保护的作用。
Hh是一种形态发生信号通路,在胚胎发生过程中控制祖细胞的途径和组织构建,发生在成人许多类型的肝损伤中[13]。肝疾病相关研究表明,该信号通路在肝损伤后可被激活,并参与如促肝祖细胞增殖、炎性细胞聚集等过程,这些进程都参与了后期肝硬化的发病机制[2,13]。预防性腹腔注射给予1 mg/mL浓度的环巴胺 5 mg/(kg·d)和 10 mg/(kg·d),在 3 周内能对CCl4诱导的肝损伤有干预作用,且毒副作用小[4]。本研究采用CCl4诱导肝损伤化的方法以研究肝损伤化发生机制,并对环巴胺进行抗肝损伤化疗效的评价,初步探究环巴胺基于氧化应激可能的肝保护机制,其对Hh信号通路的分子调控是本实验尚需进一步验证和研究的方向。已有研究显示环巴胺在抗肿瘤等方面有良好的前景,但在致畸作用和对其他组织器官毒副作用方面尚缺乏完整评价,在进入临床使用之前还需要进行多方面的深入研究[14-16]。
3.2 结论
综上,环巴胺在肝损伤小鼠体内具有明显的抗肝损伤作用,但其在人体内的抗肝损伤等作用机理有待研究和探索。

