慢性子代应激改善妊娠期慢性应激诱导的子代雄鼠抑郁
陶 龙,刘 锐,徐家雯,张 阔,姚余有
作者单位:安徽医科大学公共卫生学院1卫生检验与检疫学系、2人口健康与优生安徽省重点实验室,合肥 230032
抑郁症作为一种全球性的精神疾病,其特点是消极和动机减少,严重危害人们的身心健康[1],是全球总体疾病负担的主要原因[2]。目前,抑郁症的发病机制尚未阐明,有研究[3]显示暴露于慢性应激事件可以增加人类患抑郁症的风险。同时,动物研究[4-5]发现,孕鼠在怀孕期间遭受慢性应激会诱导其后代出现抑郁样行为, 且雄性子代更易出现。当今社会竞争激烈,孕妇和其子代都有可能暴露于慢性应激环境中,但很少有研究关注慢性子代应激对妊娠期慢性应激的子代抑郁有何影响。因此,该文拟通过观察妊娠期慢性应激和慢性子代应激联合作用对子鼠抑郁样行为的影响,研究慢性子代应激对妊娠期慢性应激的子代抑郁有何作用,并探讨其作用机制。
1 材料与方法
1.1 实验动物60只7周龄C57/BL6J小鼠(40只雌性、20只雄性)购自江苏集萃药康生物科技公司,体质量17~20 g。在标准实验室条件下[室温(24±1)℃, 湿度50%±2%, 光照12 h循环,无病原体环境]饲养。开始实验前适应性喂养7 d,自由获取水和食物。
1.2 试剂与仪器
1.2.1主要仪器 垂直电泳仪、转移槽、凝胶成像系统(美国Bio-Rad公司);ELX全自动酶标仪(美国BD公司);Centrifuge5424R冷冻离心机(德国Eppendorf公司);正置荧光显微镜(德国莱卡仪器有限公司);SuperMaze系列行为学实验系统(上海欣软公司)。
1.2.2主要试剂 TUNEL试剂盒(上海罗氏制药有限公司); mTOR单克隆抗体(美国Abmart公司);p-mTOR(Ser24448)单克隆抗体(美国Cell Signaling Technology公司);山羊抗兔IgG抗体和DBA显色液(北京中杉金桥生物技术有限公司); BCA测定试剂盒(上海碧云天公司)。
1.3 动物模型建立方案及分组C57/BL6J小鼠以雌雄2 ∶1的比例在19 ∶00进行合笼,第二天07 ∶00查阴栓,查到阴栓后将其进行单笼饲养,为怀孕第一天。正常饲养1周后,随机选取20只孕鼠进行妊娠期慢性应激(chronic stress during pregnancy,CSDP)。应激方式包括:① 禁水24 h; ② 禁食24 h; ③ 束缚 2 h; ④温水游泳15 min; ⑤ 冰水游泳5 min; ⑥ 夹尾5 min; ⑦ 昼夜颠倒12 h。自孕第7天开始,采用随机数表法每天进行一种应激,直至孕鼠分娩。子鼠出生后于第21天被随机分为母代正常对照+子代正常对照组(NC+NC);母代正常对照+子代慢性应激组(NC+COS);母代妊娠期慢性应激+子代正常对照组(CSDP+NC);母代妊娠期慢性应激+子代慢性应激组(CSDP+COS),每组8只。子代应激方式同孕鼠应激方式,在出生第21天至35天进行14 d的慢性应激。
1.4 行为学实验
1.4.1高架十字迷宫实验(elevated plus maze, EPM) 实验时,将每组的8只小鼠单独置于离地面50 cm高度的迷宫中,在迷宫上方固定摄像机,记录小鼠运动情况。在测试前,用75%酒精溶液清洗迷宫,以避免嗅觉提示。每只小鼠被放置在迷宫的中央,面对着其中一只闭合的臂。每只动物探索时间为5 min。
1.4.2强迫游泳实验(forced swimming test, FST) 在实验开始前,将每组的8只小鼠单独置于直径20 cm的透明桶中游泳15 min(深度12 cm,水温23~25 ℃)。第二天,将小鼠单独放置在桶中进行游泳6 min,统计最后4 min不动时间总和。
1.5 TUNEL检测海马CA3区神经元凋亡用石蜡对脑组织进行包埋,在相应位置进行切片,经二甲苯脱蜡乙醇水化后,PBS清洗3次,滴加0.1%T-ritonX-100,0.1%柠檬酸钠室温消化8 min,PBS清洗3次后滴加TUNEL反应混合物,37 ℃、60 min,PBS清洗后滴加DAPI染液复染10 min,在荧光显微镜下(× 200)观察。统计TUNEL阳性细胞数与细胞总数,阳性细胞数/细胞总数即为凋亡指数。
1.6 Golgi-Cox染色观察海马神经元树突变化将小鼠大脑置于高尔基染色中浸泡7 d后,将其置于30%蔗糖溶液中浸泡3 d,使用震动切片机对其进行冠状切片(200 μm)。切片分别在水(1 min)、氢氧化铵(30 min)、水(1 min)、显影液(30 min)、水(1 min)连续染色。然后将切片在(50%、75%、95%和100%)酒精中连续脱水,二甲苯清洗后,中性树脂封片,在显微镜下观察。

2 结果
2.1 慢性子代应激对CSDP的子代雄鼠行为学影响高架十字迷宫实验结果如图1所示。与NC+NC组相比,CSDP+NC组开臂进入次数百分比降低(F(3,8)=24.689,P<0.05),CSDP+COS组开臂进入次数百分比提高(F(3,8)=24.689,P<0.001),NC+COS组开臂进入次数百分比差异无统计学意义;与CSDP+NC组相比,CSDP+COS组和NC+COS组开臂进入次数百分比均上升(F(3,8)=24.689,P<0.001)。此外,与NC+COS组相比,CSDP+COS组开臂进入次数百分比也上升(F(3,8)=24.689,P<0.01)。强迫游泳结果显示,与NC+NC组相比,CSDP+NC组强迫游泳不动时间提升(F(3,28)=3.631,P<0.01);与CSDP+NC组相比,CSDP+COS组强迫游泳不动时间降低(F(3,28)=3.631,P<0.01)。此外,与NC+COS组相比,CSDP+NC组和CSDP+COS组强迫游泳不动时间差异均无统计学意义;与NC+NC组相比,NC+COS组和CSDP+COS组强迫游泳不动时间差异亦无统计学意义。见图2。
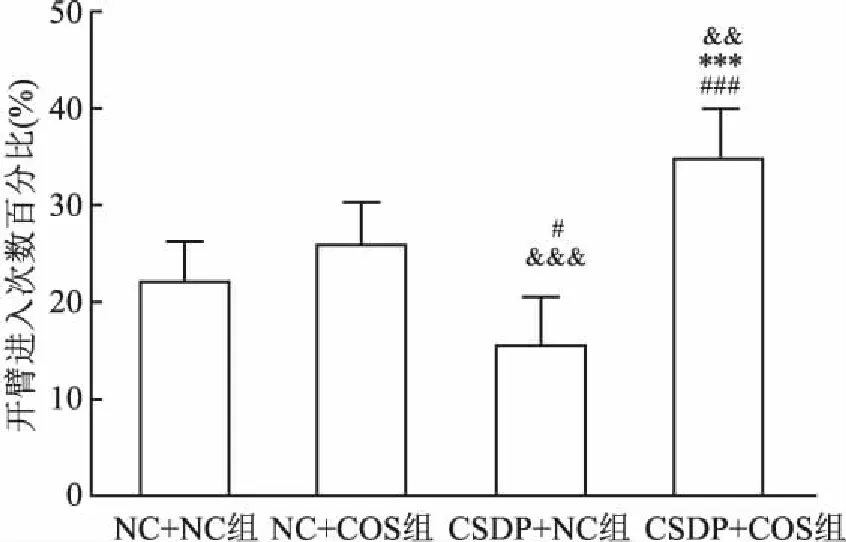
图1 各组雄性子代小鼠开臂进入次数百分比
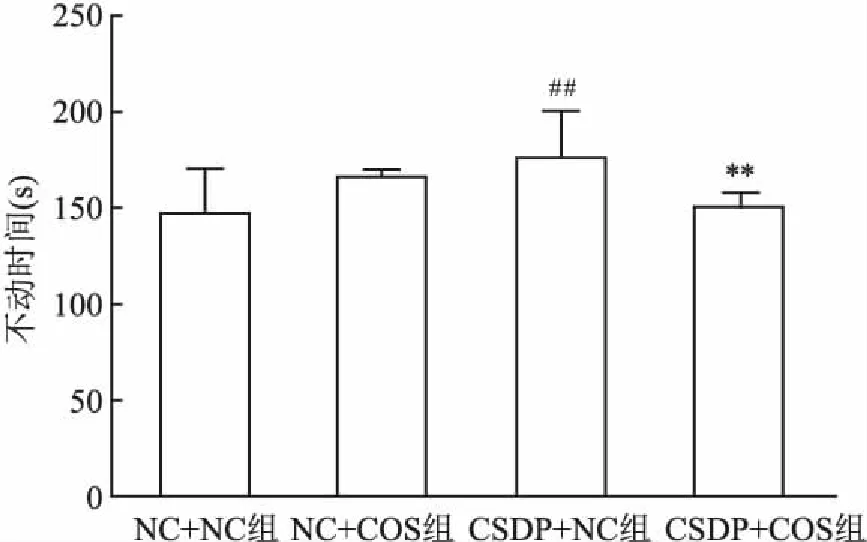
图2 各组雄性子代小鼠强迫游泳不动时间
2.2 慢性子代应激对CSDP的子代雄鼠海马神经元的影响在正置光学显微镜(×200)下观察Golgi-Cox染色的小鼠脑切片,选取小鼠海马CA3区进行拍照(图3A)。使用sholl分析海马神经元树突进行分析(图3B)。与NC+NC组相比,CSDP+NC组在30~90 μm同心圆上的树突交点数量减少(30 μm:F(3,16)=54.00,P<0.01; 40 μm:F(3,16)=118.73,P<0.001; 50 μm:F(3,16)=106.05,P<0.001; 60 μm:F(3,16)=103.12,P<0.001; 70 μm:F(3,16)=59.27,P<0.01; 80 μm:F(3,16)=40.20,P<0.05; 90 μm:F(3,16)=25.78,P<0.05),CSDP+COS组仅在40 μm和90 μm同心圆处存在差异(40 μm:F(3,16)=118.733,P<0.05; 90 μm:F(3,16)=25.783,P<0.05)。与CSDP+NC组相比,CSDP+COS组树突交点数量在30~70 μm间增加(30 μm:F(3,16)=54,P<0.05; 40 μm:F(3,16)=118.733,P<0.01; 50 μm:F(3,16)=106.05,P<0.05; 60 μm:F(3,16)=103.117,P<0.05; 70 μm:F(3,16)=59.267,P<0.05)。NC+COS组和CSDP+NC组相比,NC+COS组在40~90 μm同心圆内的树突交点数量增加(40 μm:F(3,16)=118.733,P<0.01; 50 μm:F(3,16)=106.05,P<0.01; 60 μm:F(3,16)=103.117,P<0.01; 70 μm:F(3,16)=59.267,P<0.01; 80 μm:F(3,16)=40.2,P<0.05; 90 μm:F(3,16)=25.783,P<0.05)。见图4。
在正置荧光显微镜(×200)下使用不同荧光波长观察TUNEL处理海马CA3区脑组织切片,DAPI染色的细胞核呈蓝色,TUNEL染色的细胞核呈绿色,凋亡指数=TUNEL阳性细胞数/总细胞数。如图5所示,与NC+NC组相比,CSDP+NC组凋亡指数增大(F(3,8)=117.514,P<0.001); 与CSDP+NC组相比,CSDP+COS组细胞凋亡指数降低(F(3,8)=117.514,P<0.001)。此外,NC+COS组凋亡指数明显低于CSDP+NC组,差异有统计学意义(F(3,8)=117.514,P<0.001);NC+NC组、NC+COS组与CSDP+NC组3组之间细胞凋亡指数差异均无统计学意义(F(3,8)=117.514)。见图6。
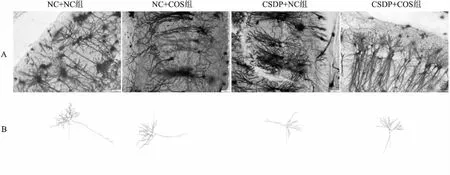
图3 Sholl分析中各组具有代表性的神经元树突追踪
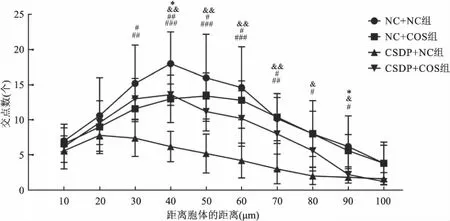
图4 各组海马神经元sholl分析的结果
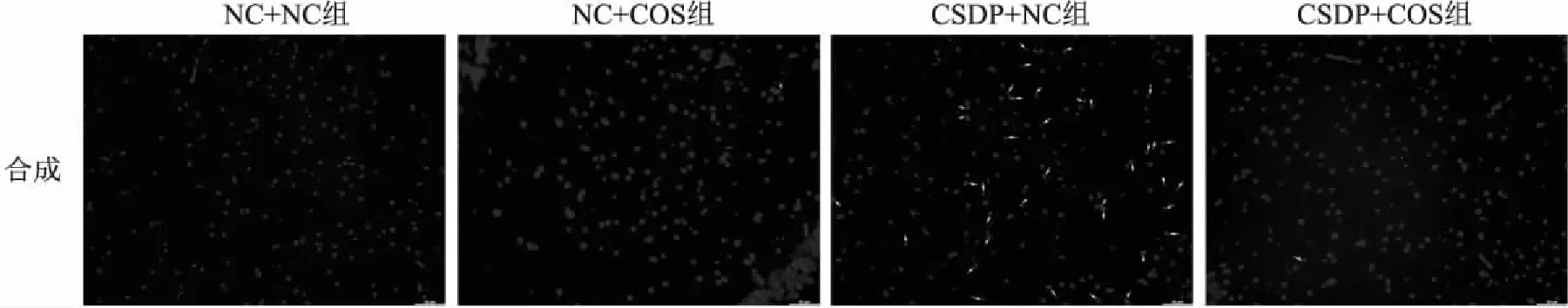
图5 TUNEL染色法检测海马CA3区神经元凋亡图×200
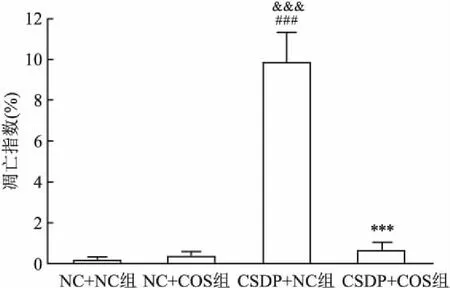
图6 各组TUNEL染色法凋亡指数
2.3 慢性子代应激对CSDP的子代海马mTOR活性的影响采用Western blot方法检测小鼠海马中mTOR和p-mTOR蛋白含量,使用p-mTOR/m-TO来表示mTOR蛋白活性,结果如图7所示。与NC+NC组相比,CSDP+NC组子代小鼠海马mTOR活性降低(F(3,8)=28.762,P<0.01), CSDP+COS组海马mTOR活性增加(F(3,8)=28.762,P<0.01), NC+COS组海马mTOR活性呈下降趋势(F(3,8)=28.762,P<0.05);与CSDP+NC组相比,CSDP+COS组海马mTOR活性增加极为明显(F(3,8)=28.762,P<0.001)。此外,NC+COS组与CSDP+NC组差异无统计学意义(F(3,8)=28.762,P>0.05);NC+COS组相比于CSDP+COS组,其mTOR活性较低(F(3,8)=28.762,P<0.001)。
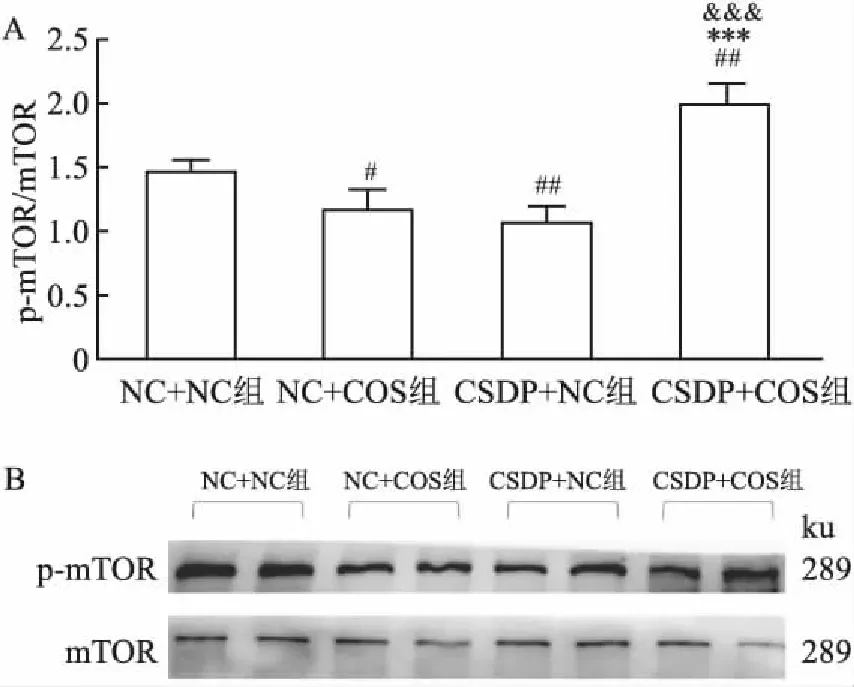
图7 各组小鼠海马mTOR蛋白活性
3 讨论
越来越多的研究[6-7]表明抑郁症与海马损伤息息相关。很多研究关注于CSDP对诱发子代抑郁的影响。关于CSDP和慢性子代应激在雄性子代抑郁中有何种交互作用的研究很少。因此,本文旨在探讨CSDP和慢性子代应激在诱导雄性子代抑郁中的相互作用及其机制。
该研究采用了慢性不可预测应激进行应激实验,避免孕鼠对应激产生适应性。有研究[8]已证实鼠在妊娠期接受慢性不可预测应激后可表现出抑郁样行为。FST和EPM已被广泛应用于测量抑郁样行为[9]。在FST实验中,不动时间越长,表明小鼠抑郁程度越严重;在EPM实验中,开臂进入次数百分比越低,代表小鼠抑郁程度越严重。本研究结果显示,与NC+NC组相比,CSDP+NC组雄性子代小鼠在FST中不动时间延长、在EPM中开臂进入次数百分比明显降低,表明抑郁样行为增加,求生欲望较低;与CSDP+NC组相比,CSDP+COS组开臂进入次数百分比明显升高,强迫游泳不动时间降低。这些结果表明,CSDP诱导子代雄鼠呈现抑郁样行为,慢性子代应激可以抑制妊娠期慢性应激诱导产生的雄性子代小鼠的抑郁样行为,这与Van Den Hove et al[10]课题组在CSDP所产成年子代大鼠身上进行实验所得到的的结果具有相似性。本研究结果,慢性应激对子鼠抑郁样行为无明显影响,这可能与子鼠月龄较小且应激时间较短有关。
以往的研究[11-12]表明海马CA3区与抑郁样行为存在着密切联系。本研究选取海马CA3区进行高尔基染色,结果显示,与NC+NC组相比,CSDP+NC组在30~90 μm同心圆处树突交点数量减少,CSDP+COS组仅在40 μm与90 μm同心圆处树突交点数量有差异;与CSDP+NC组相比,CSDP+COS组在30~70 μm同心圆处树突交点数量明显增加。上述结果表明,CSDP引起了海马CA3区神经元树突分支复杂性降低,慢性子代应激逆转了CSDP所引起的海马神经元树突损伤。为了进一步验证慢性子代应激是否能够改善CSDP引起的海马神经元损伤,课题组采用TUNEL染色法观察细胞凋亡,结果显示,与NC+NC组相比,CSDP+NC组海马CA3区凋亡指数明显升高;与CSDP+NC组相比,CSDP+COS组海马CA3区细胞凋亡指数明显降低,这些结果进一步证实了CSDP诱导雄性子代小鼠海马神经元损伤,慢性子代应激减轻了CSDP引起的神经元损伤。
mTOR信号通路参与调节神经元兴奋、神经元分化和突触的部分功能[13]。最近的研究[14]也表明mTOR可能介导了抑郁症的发生。本研究显示,与NC+NC组相比,CSDP+NC组mTOR活性明显降低; 与CSDP+NC组相比,CSDP+COS组mTOR活性上升; CSDP+COS组相较于NC+NC组,其mTOR活性更高,提示慢性子代应激可能通过mTOR信号通路改善CSDP引起的抑郁样行为和海马病理损伤。
总之,CSDP诱导雄性子代小鼠出现抑郁样行为,并伴有海马神经元损伤和mTOR活性降低。慢性子代应激可以改善雄性子代小鼠的抑郁行为和海马的病理损伤。CSDP和慢性子代应激在诱导雄性子代小鼠抑郁样行为中具有拮抗作用,mTOR信号通路在其中发挥可能着重要作用,但更进一步的机制,有待深入研究。

