DNA脱碱基位点的检测方法及其生物学研究进展
武海江,张雅姣,袁舒妍,徐 华*,谢剑炜
(1.军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850;2.沈阳药科大学 无涯创新学院,辽宁 沈阳 110016)
生理条件下,DNA会自发断裂N-糖苷键脱去碱基(Apurinic/apyrimidinic,AP)形成AP位点损伤[1-7](图1A),据报道,平均每天每个哺乳细胞至少会产生10 000个内源性AP位点[2,8]。当DNA暴露于外源性物质如酸、烷化剂、电离离子或紫外线后[9-12]均会使DNA脱去碱基并生成AP位点[13](图1B)。另外AP位点也是碱基切除修复(Base excision repair,BER)途径的关键中间体[14],如活性氧引起DNA氧化损伤的标志物8-羟基-2′-脱氧鸟嘌呤核苷(8-OHdG)经BER中特殊糖基化酶的切除而形成AP位点[13,15](图1C)。若AP位点未有效修复,可能会导致DNA聚合酶停滞和DNA链断裂,产生突变和细胞毒性[1-2,13,16],因此对AP的检测有助于细胞损伤程度评估和化合物毒性评价[17-19]。近年来,由于交联损伤的严重性,AP位点形成的DNA链间交联(Interstrand crosslink,ICL)[20-27]和蛋白质交联[28-32](DNAprotein crosslink,DPC)亦引起人们的重点关注。本课题组在前期工作中建立了细胞、血液、尿液及脏器中DNA加合物的质谱定量方法,实现了各脏器中DNA损伤的定量评价[33-35];构建了组蛋白H2AX和H3磷酸化生物标志物的稳定同位素稀释液相色谱-串联质谱(LC-MS/MS)方法,实现对化合物基因毒性的快速发现和定量检测,并初步证明了该方法具有体外评价化学品致癌性的应用潜力[36-37]。课题组近期还开展了脱碱基位点交联加合物(AP-base)的高灵敏LC-MS/MS分析,在细胞中首次鉴定3种新型AP-base,对不同类型细胞中AP-base本底值进行了定量评价及相关毒物暴露研究[38]。

图1 AP位点的形成机制:DNA自发脱碱基形成AP位点(A);AP位点形成的潜在来源(B);脱氧鸟苷(dG)与活性氧反应生成8-OHdG,随后经DNA糖基化酶将8-OHdG切除后生成AP位点(C)Fig.1 Mechanisms of AP site formation:spontaneous base loss of DNA leads to the AP site formation(A),potential sources of base damage destabilizing the N-glyosidic bond and generating AP site(B),and deoxyguanosine(dG)reacted with reactive oxygen species to generate 8-OHdG,which is subsequently cleaved by DNA glycosylase to generate AP sites(C)R:DNA
AP位点的检测方法主要有14C[39-40]或32P[41-42]后标记法、含醛基反应探针(Aldehyde-reactive probe,ARP)的酶联免疫吸附分析法(ELISA-like)[43-46]、荧光法[17-18,47-49]和液相色谱-质谱法[50-54]等。其中,含ARP的ELISA-like方法是检测和定量分析AP位点的重要方法,但其除标记AP位点的开链醛外[48,55-56]还会标记其它含醛基的化合物,可能会导致假阳性结果。近些年,质谱法以其高灵敏和高特异的技术优势逐渐应用于AP位点的分析检测[50,57-58]。
本文对AP位点的定性和定量分析方法进行了总结,对AP位点损伤在环境污染物及抗癌药物的评价、细胞损伤和疾病相关的研究进展进行了评述。由于AP位点相关交联(如ICL和DPC)存在潜在重要的生物学意义,本文亦重点对其进行了介绍。
1 脱碱基位点特点
每个细胞每天均可能产生成千上万的AP位点,其作为一种常见的DNA损伤形式,能对细胞的功能、基因组稳定性和疾病产生较大影响,能有效阻断聚合酶并影响其对基因组信息的读取和复制,是致突变的潜在源头之一[13]。
AP位点的结构以闭链缩醛形式(99%)和开链醛(1%)两者的平衡形式存在(图2)[4]。由于氢键及其他非共价相互作用的缺失,AP位点会使DNA双链变得不稳定。AP位点自身亲电且具有化学不稳定性,例如,DNA的AP位点在生理条件(pH 7.4,37℃)下的半衰期约为200 h[59],在加热处理或弱碱处理时会加速DNA链在AP位点的断裂[60-62],在酸性条件下也会通过脱嘌呤产生额外的AP位点。
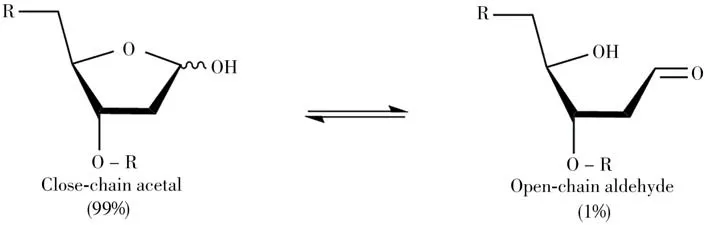
图2 AP位点在水溶液中的平衡态存在形式:闭链缩醛和开链醛[4]Fig.2 The equilibrating forms of AP site in aqueous solution:close-chain acetal and open-chain aldehyde[4]
除了产生链断裂,由于AP位点的化学反应活性,AP位点的开链醛还会分别与蛋白质或DNA互补链上的碱基发生共价反应形成DPCs和ICLs,从而形成更严重的损伤类型[2,19]。目前,细胞有多种修复和耐受机制以应对DNA损伤,双链DNA中的AP位点大多数通过BER途径进行修复,核苷酸切除修复(NER)则作为备用途径[14]。近期,对AP位点的修复和耐受途径研究已有评述报道[13]。
2 脱碱基位点作为中间体形成的交联
相比于其它DNA损伤如DNA加合物、碱基错配和碱基损伤等类型,DNA链间交联和DNA-蛋白质交联的研究报道较少[28-29]。但由于DNA交联以及DNA-蛋白质交联可导致严重的基因毒性,近年来其研究越来越受到重视[28],AP位点作为最常见的DNA损伤类型之一,与其相关的ICL和DPC交联现象已成为研究重点[29,31]。
2.1 AP位点形成的DNA交联
DNA链间交联是最严重的DNA损伤类型之一,其形成会影响DNA的复制和转录[2]。由于AP位点存在两种互变平衡结构(图2),DNA中AP位点的开链醛可与互补链上的碱基发生共价加合形成ICL(图3)。
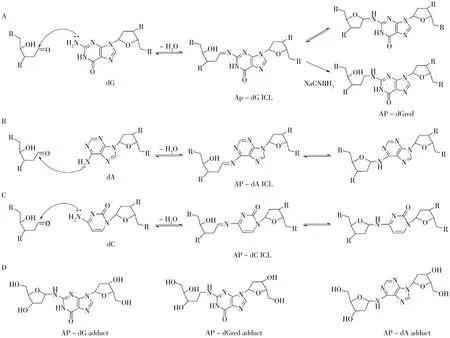
图3 由AP位点作为中间体形成ICL的形成机制及对应生成的交联加合物Fig.3 The formation mechanisms of ICL derived from the AP site as intermediate and the corresponding crosslinked adducts
Dutta等[27]首次在无外源分子参与情况下清晰表征了DNA链间交联情况,随后运用质谱技术和凝胶电泳技术证明AP位点可分别与鸟嘌呤和腺嘌呤的环外氨基发生反应,形成AP-dG和AP-dA的ICL[20-21](图3A、3B),同时利用核磁共振技术表征了形成的ICL交联加合物(图3D)[63-64]。通过考察AP-dG和AP-dA交联加合物的稳定性,发现这两类交联加合物在pH 7.0、37℃时相当稳定,意味着AP-dG ICL和AP-dA ICL可能是一种持久损伤,可能导致DNA的复制阻滞[63-64]。研究又通过可以耦合DNA合成和链置换的噬菌体φ29 DNA聚合酶作为模型系统测试了AP-dA交联影响DNA加工酶的能力,证明AP位点形成的交联能阻断细胞中各种DNA加工酶的作用[65]。
最近,Hu等[66]利用高分辨质谱技术在小牛胸腺DNA(Calf thymus DNA,CT-DNA)酶解样品中检出了AP位点与胞嘧啶残基反应形成的交联加合物(AP-dC)[66-67]。Varela等[24]随后也证明了AP位点的醛基可与互补链上已错配胞嘧啶的环外氨基发生反应,形成AP-dC ICL(图3C)。值得注意的是,研究表明,当胞嘧啶残基与鸟嘌呤发生正常沃森-克里克配对时,这二者并不能形成交联。
目前,AP-dG、AP-dA和AP-dC等3种ICLs的形成仅在溶液体系中被鉴定,但细胞中是否存在上述链间交联及其结构特性如何仍属未知[19,24]。对不同寡核苷酸序列的研究表明AP-dA、AP-dG形成交 联的 产率 分别 为15%~85%[21]和2%~3%[20,27],经NaCNBH3还原 后 的AP-dG交联 产率 为20%左右[20,27]。考虑到细胞在正常生理条件下会产生至少10 000个AP位点[2,8],研究者们推断在细胞中可能会检测到AP位点交联加合物,但对检测方法的灵敏度和实验设计提出了更高要求[19,66]。Huskova等[22]通过体外实验研究了AP-ICL的形成速率、产量和稳定性,揭示AP位点周围富含腺嘌呤-胸腺嘧啶碱基对(AT)比富含鸟嘌呤-胞嘧啶碱基对(GC)的区域更易形成AP-ICL,并基于AP-ICL形成的生化实验,推断在人体细胞中存在或可形成1~5个ICLs。相比其它常见的DNA损伤类型,由AP位点作为中间体形成的DNA链间交联是一种更为严重的DNA损伤,这种交联在细胞中存在的可能性及其可能引起的生物学结局值得重点关注。
2.2 AP位点形成的蛋白质交联
DNA-蛋白质交联是蛋白质和DNA中1条链发生共价加合形成的一种交联,也是严重的DNA损伤类型之一,同样会阻滞DNA复制和翻译。受到检测技术重复性、灵敏性和特异性等方面的限制,与其它的DNA损伤类型相比,DPC的研究相对较少[13,29]。AP位点可在细胞和组织中自发产生,是多种生理过程中形成的最普遍的DNA损伤之一。由于AP位点与核小体中的组蛋白非常接近,以AP为中间体形成的DPC已被重点研究报道,如AP-Lys和AP-Cys(图4)[28,32,68]。Chan等[28]用同位素稀释LC-MS/MS方法首次从细胞中检出新型的由AP位点与蛋白质的半胱氨酸(Cys)残基发生反应形成的AP-Cys交联,从HeLa细胞(Human cervix adenocarcinoma cell)中测得AP-Cys DPCs的本底含量为5.45个/107nts。近期,Chan等[32]再次利用LC-MS/MS方法首次定量分析了细胞内AP位点与赖氨酸(Lys)残基反应形成的DPCs,检测到HeLa细胞中AP-Lys DPCs的本底含量为0.03个/107nts。结果表明,在HeLa细胞中AP-Cys DPCs的含量高于AP-Lys DPCs,且与近期文献报道的细胞中本底AP位点数目接近。此外,Tang等[69]基于DNA-蛋白质交联测序技术,利用AP位点与Lys残基共价结合的特点,应用于人类HEK293T细胞(Human embryonic kidney 293T cell)中胸苷乙二醇的全基因组图谱绘制。表1列出了采用不同方法对细胞或哺乳动物组织中AP位点的检测结果及特征分析比较。
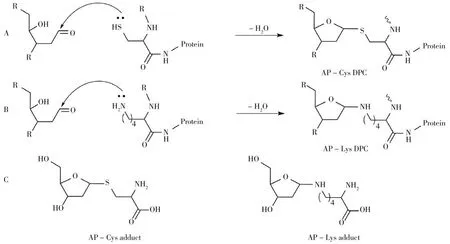
图4 由AP位点作为中间体形成的DNA-蛋白质交联形成机制及对应生成的交联加合物Fig.4 The formation mechanisms of DNA-protein crosslink derived from the AP site as intermediate and the corresponding crosslinked adducts
DPCs交联的形成与修复机制亦值得深入研究,研究发现AP位点也可与多种修复酶如5′-脱氧核糖-5-磷酸/脱碱基裂解酶(KU)[70]、DNA聚合酶β(Pol β)[71]和多聚ADP核糖聚合酶1/2(PARP1/2)[72-73]等形成交联,形成的DPC通常被认为是有害或短暂的中间体,且与AP位点的修复相关[31]。目前对AP位点作为中间体形成DPC的化学结构或生物学结局的了解很有限,仍亟待开发相应的检测方法并深入研究[29,31]。
3 DNA脱碱基位点的检测方法
当前检测AP位点主要基于以下两种方式。一种是非共价方式,依靠试剂与DNA分子间的氢键、范德华力和静电引力等弱相互作用力,使检测分子能够进入AP位点,通过改变检测分子的物理信号(如荧光和电化学),进而实现对AP位点的标记检测[74]。另一种是共价标记AP位点的方式,依靠不同含氨基基团的标记试剂分子与AP位点的开链醛发生反应形成相对稳定的共价亚胺(通常称为席夫碱)[75-77](图5),并进一步利用不同技术检测标记分子实现对AP位点的分析。由于非共价标记方式基于弱相互作用力,其结合能力普遍低于共价反应探针,因此目前研究报道以共价标记方式居多,本文主要概述利用共价标记AP位点检测方法的研究进展。

图5 标记DNA脱碱基位点示意图Fig.5 Schematic of labeling DNA abasic site
AP位点的重要检测方法有14C或32P标记法、ELISA-like分析法、荧光分析法和LC-MS法等,其各具优势和不足。其中,ELISA-like分析法是用于检测和定量分析AP位点的常用方法之一,近年来,随着高特异和高灵敏质谱技术的发展,质谱方法正逐渐成为AP位点检测的主流方法。
3.1 14C或32P后标记法
14C标记法是利用同位素闪烁计数技术对AP位点的醛基基团和14C甲氧胺反应形成的肟类化合物进行检测。该方法灵敏度和特异性均较低,无法实现对AP位点的准确定量[39-40,52]。Weinfeld等[42]使用32P后标记法可在fmol水平对DNA中的AP位点进行定量分析,方法灵敏度较高,但该方法需进行核酸凝胶电泳和色谱分离等前处理操作,费时耗力,且涉及放射性污染等问题[41]。因此,目前鲜有关于上述两种标记方法的报道。
3.2 ELISA-like分析法
为应对上述14C或32P后标记法的不足,Kubo等[78]于1992年构建了一种生物素标记的含醛反应性探针(ARP)的ELISA-like方法。其原理是利用生物素标记探针的羟胺基团与DNA中AP位点发生加合反应,然后使用偶联辣根过氧化物酶的抗生物素蛋白作为指示酶,通过ELISA-like方法对生物素标记的AP位点进行比色测定[43,78]。
该方法灵敏度较高且操作简单,因此基于其改进的方法相继被用于检测和定量分析AP位点或含其它醛基的潜在DNA损伤[46,53,79-81]。Kubo等[78]在热解或酸解后的CT-DNA或噬菌体f1 DNA中检测到fmol水平的AP位点,该方法无需使用一抗和二抗,通过指征指示剂酶偶联的抗生物素蛋白/生物素复合物直接检测生物素和DNA的含量即可测定AP位点。Kubo等[44]在HeLa RC355细胞(具辐射抗性的HeLa细胞株)中测得的AP位点为<1个/105nts[43],在HeLa细胞中为5个/106nts(0.1 fmol)。
ELISA-like方法虽有较多应用,但由于缺乏特异性[48,55-56],尚存在诸多局限:①该方法所使用的生物素在细胞中也同样存在[49];②ARP的结构空间体积较大[52],因此ARP很可能因位阻导致未与AP位点充分反应;③DNA中存在的除AP位点之外的DNA氧化产物[82]、其它含醛基化合物如5-甲酰基胞嘧啶(5fC)和5-甲酰基尿嘧啶(5fU)亦可能被错误标记[56,83-84],存在假阳性风险。因此,近年来出现了基于其它原理的高特异性方法的报道和应用。
3.3 荧光分析法
相比于ELISA-like分析法,目前用于定量分析AP位点的荧光分析法应用仍较少,多数研究主要集中在如何提高检测方法的灵敏度和特异性[48-49]。荧光分析法通过设计能与AP位点的开链醛反应的荧光探针分子,对荧光信号进行检测并实现对AP位点的测定[18,48]。
使用常规含赖氨酸-罗丹明[18]和荧光素[85]标记的荧光分析方法分别能检测到129 fmol和17 fmol水平的AP位点,其实验操作所需时间虽比ELISA-like分析法少,但灵敏度较低,且所需DNA样品量较大,洗涤后也难以避免痕量荧光探针的存在,从而影响分析结果。Fundador等[17]利用激光诱导荧光的毛细管电泳技术检测荧光团-ARP标记的AP位点,灵敏度较前述荧光方法明显提高,检出限可达1.2个AP位点/106nts(0.02 fmol),但受限于必须采用合适的抗体,该方法的普适性较低。
最近,Liu等[48]测试了含萘二甲酰亚胺荧光标签的羟胺探针分子与DNA中含醛基或酮基的化合物的反应能力,发现其均能与AP位点、5fU和5fC发生反应,三者反应效率并无较大差别。而以往研究报道中使用的羟胺或烷氧胺试剂仅标记了AP位点[18,47]、5fU[51,86]和5fC[87]中的一种化合物,推测其原因可能是实验未考虑DNA中所有含醛基化合物或优化特殊反应条件所致[48]。因此,利用荧光分析法准确检测AP位点或其它含醛基化合物时,除考虑适当的荧光标签外,必须考虑结合特殊的反应条件以评估和优化荧光标记分子与目标物的反应效率[49,88]。
3.4 液相色谱-质谱法
液相色谱-质谱法是利用烷氧胺[50,52]或肼类[54]试剂对AP位点开链醛进行衍生标记形成稳定的肟或腙类目标化合物,实现对AP位点的准确定量分析。
Zhou等[52]基于14C甲氧胺衍生化构建了AP位点的加速器质谱法,检出限为1个AP位点/106nts。该方法虽提高了灵敏度,但能与14C甲氧胺反应的除AP位点外,还包括链断裂位点及多种带有醛和酮基的降解产物,故该方法仅适用于检测造成多位点损伤的DNA。Li等[54]利用同位素稀释的LC-MS/MS法定量分析基因组DNA中的AP位点,检出限为4个AP位点/109nts(6.5 fmol),该方法灵敏度虽有提高,但对AP位点的衍生化标记发生于DNA酶解完成后,存在DNA酶解导致假阳性AP位点生成的可能性,从而导致定量结果不准确。Rahimoff等[51]亦利用LC-MS/MS方法在小鼠胚胎干细胞中测得0.9个AP位点/106nts。Turesky等[50]构建基于利用O-[(3-吡啶基)甲基]羟胺(PMOA)试剂对AP位点进行衍生化标记的高灵敏和高特异性的LC-MS/MS定量方法,验证了与提取DNA后对AP位点进行衍生化的流程相比,在细胞裂解时即直接对AP位点进行衍生化标记是减少假阳性结果的较好方式,并最终从小鼠肝组织中测得约0.9个AP位点/107nts。
质谱法测定AP位点灵敏度的不断提高有益于实现对AP位点的分析检测,同时质谱方法能提供精确质量及特征碎片离子,可实现精确定性与准确定量。但构建AP位点液质定量方法时除需考虑衍生化试剂的衍生化效率外,更需要考虑的重要影响因素是AP位点自身结构的不稳定性,由于在DNA裂解、消化或衍生化过程中均可造成AP位点的形成或丢失,易导致定量结果出现偏差,因而目前测定AP位点时需重点关注其化学稳定性[4,29,50]。通常考虑以下样品处理条件,以尽量避免假阳性或假阴性结果:①条件尽量温和,如酶解温度不能太高、样品混匀时轻轻振荡及选择适宜pH值等[50,89-90];②酶解时添加剂的选择,如加入甲磺酸去铁胺能有效防止样品被氧化[66,89-91];③衍生化时机的选择,如衍生化试剂越早添加越能监测到生物体本底水平的AP位点[50]。
如表1所示,在诸多测定AP位点的分析方法中,ELISA-like分析法和液相色谱-质谱法最为常用和有效。前者在人类细胞系中最少可检出超过6.7个AP位点/107nts,最高在人或哺乳动物组织中检出100个AP位点/107nts;后者在人肺脏或白细胞中最少检出2个AP位点/107nts,最高在小鼠胚胎干细胞中测得10个AP位点/107nts。两组数据比较分析显示,对于细胞系或组织的AP位点本底水平测定,ELISA-like分析法测得的含量较高,其主要原因可能与ELISA-like方法的非特异性有关[55]。因此,目前亦日趋采用更特异更灵敏的LC-MS方法用于AP位点的检测和定量分析。

表1 不同方法对寡核苷酸、细胞或哺乳动物组织中DNA AP位点的检测分析特征总结Table 1 Summary of the characteristics of determination of DNA AP sites in oligonucleotides,cell lines or mammalian tissues by a variety of techniques
4 毒性评价和癌症治疗相关应用研究
4.1 毒性评价
自从报道在细胞内存在大量AP位点后,多数检测方法的目的是测定AP位点在细胞或组织中的本底表达水平和经毒物暴露后的AP位点变化情况及损伤修复趋势,并进一步研究其作为生物标志物用于损伤评价、BER修复过程检测和化合物毒性评价等的可能性。
早期,人们利用ELISA-like分析方法开展了致癌物暴露细胞后AP位点的含量测定[44,46]、细胞中AP位点的修复过程监测[43]和老龄化过程中AP位点的变化程度[45]等研究,但由于该方法的特异性不强,导致上述研究可能存在较高的假阳性问题(见表1)。因此,近十五年来,陆续报道利用高灵敏和高特异的质谱技术对AP位点进行定性定量分析,但大多均停留在方法构建方面。近期Turesky课题组[50]构建了能有效降低假阳性的定量分析AP位点的LC-MS/MS方法,基于该方法,Guo等[58]开展了动物暴露于烟草中特异性亚硝胺形成AP位点的研究,并评估了吸烟者和非吸烟者DNA中的AP位点,为理解烟草中亚硝胺诱发癌症的可能机制提供了一个新的角度。
4.2 癌症治疗
数十年来,人们对DNA损伤反应(DNA damage response,DDR)的理解不断加深,拓宽了肿瘤学的治疗领域。DDR缺陷导致的细胞基因组不稳定性诱发了癌症的发生,但这些缺陷亦可被应用作为治疗切入点,如选择一些DDR途径中成员的抑制剂进行癌症靶向治疗[92]。AP位点作为BER途径中的修复中间体,是最常见的DNA损伤之一,基于AP位点的癌症治疗研究也逐步兴起[93-94]。
Chen等[57]利用LC-MS方法测定了氮芥(NM)处理小鼠后各组织中NM-DNA加合物和AP位点含量,并绘制了二者之间的动力学曲线,发现AP位点的修复过程与NM-DNA加合物的清除有密切关联,提示AP位点可作为用于新型化疗方案设计和疗效评估的生物标志物。近期,Mandi等[94]将AP位点作为抗癌药物发现的靶标,发现荧光喹喔啉胺能增强特定双功能烷基化药物的反应,当含硝基的单喹喔啉DNA嵌入剂单独或与荧光喹喔啉胺组合使用时可导致HCT-116细胞(Human colorectal carcinoma cell)凋亡,为后期靶向癌细胞中AP位点的治疗应用提供了思路。Xue等[93]结合癌细胞中谷胱甘肽(GSH)的丰度,开发了具有靶向抗肿瘤活性和细胞光毒性的GSH响应性AP捕获剂,为癌症靶向化疗提供了一种可能策略。
5 展望
AP位点损伤可由核苷酸自发水解产生,亦是DNA修复烷基化或氧化碱基过程中生成的中间体。若DNA中的AP位点未及时获得修复,可能会导致DNA复制阻滞并影响转录过程,并进一步诱发细胞突变或细胞毒性。因此,通过体内或体外实验探讨AP位点损伤数目与细胞或哺乳动物组织中DNA损伤程度的关联,以及验证AP位点数目超过某一阈值可否作为判断基因毒性的标志,对于AP位点损伤的定量分析研究显得尤为重要[17-18]。由于AP位点结构的不稳定性,目前能准确定量分析AP位点的方法仍较少[29,50]。近年来,随着利用LC-MS/MS技术定量分析AP位点损伤的研究逐渐增多[50],已初步开展了人群受基因毒性物质如亚硝胺的暴露研究[58],相信LC-MS/MS技术将在定量分析AP位点中扮演重要角色。
尽管AP损伤仍被认为是易于修复的致突变损伤,但AP位点的亲电性使其在生物学效应中扮演的角色(如ICL或DPC)仍需获得更多关注[2,28],相信与AP位点相关的毒性评价和癌症治疗相关应用研究亦会逐步兴起。

