投喂频率对凡纳滨对虾(Litopenaeus vannamei)PI3K信号通路及糖代谢相关酶基因表达的影响*
赵楠楠 崔彦婷 王忠凯 王 聪 张志豪 邓之通 赵瑞阳 孙金凤 王仁杰 李玉全
投喂频率对凡纳滨对虾()PI3K信号通路及糖代谢相关酶基因表达的影响*
赵楠楠 崔彦婷 王忠凯 王 聪 张志豪 邓之通 赵瑞阳 孙金凤 王仁杰 李玉全①
(青岛农业大学海洋科学与工程学院 山东青岛 266109)
适宜的投喂频率能提高对虾的代谢和免疫能力, 加快生长, 实现提质增效的目标。为探讨不同投喂频率对凡纳滨对虾()糖代谢及相关信号通路的影响, 以(7.6±1.0) g的凡纳滨对虾为实验材料, 设置2、3、4、6次/d, 共4个投喂频率处理组, 每组设3个平行, 实验持续14 d, 实验结束时取样, 测定PI3K信号通路相关因子、、, 代谢酶基因中、、、、, 葡萄糖转运蛋白、mRNA表达水平的变化。结果发现: 随着投喂频率的增加, PI3K信号通路关键基因表达的水平显著上升(0.05), 其中6次/d投喂组、、和表达水平显著高于2次/d投喂组(0.05), 4次/d投喂组表达水平显著高于2次/d投喂组(0.05); 代谢关键酶基因、、、、、的表达水平随投喂频率的增加而增加, 其中6次/d投喂组糖酵解、、酶基因表达水平显著高于2次/d投喂组(0.05), 3、4和6次/d投喂组糖异生酶表达水平显著高于2次/d投喂组(0.05), 葡萄糖转运蛋白在2、3、6次/d投喂频率处理组显著高于4次/d频率投喂组(0.05)。得出结论认为较高的投喂频率可以通过激活凡纳滨对虾糖代谢酶基因、糖转运蛋白及PI3K信号通路的表达来提高糖代谢水平。
凡纳滨对虾; 投喂频率; 糖代谢酶; 糖转运蛋白; PI3K信号通路
凡纳滨对虾()又称南美白对虾, 由于生长速度快, 抗逆性强, 是国内外主要经济虾类之一, 占我国海水对虾养殖总产量的80.52% (中国渔业统计年鉴, 2021)。投喂策略是养殖管理的重要环节, 其中投喂频率直接影响养殖对象的摄食量, 从而影响生长和饲料利用率(李笑天等, 2020)。投喂频率过高或过低都不利于获得好的养殖效果。研究发现投喂频率对对虾生长代谢、免疫和消化有显著影响: 在凡纳滨对虾研究中发现5次/d频率投喂时, 生长及饲料利用率最高(陈文霞, 2012); 3次/d、4次/d投喂组仔虾增重率相近, 且显著高于7次/d处理组(Pontes, 2008); 12次/d投喂组幼虾胃中蛋白酶和淀粉酶的活性以及消化腺中脂肪酶的特异性活性显著高于3次/d投喂组(Xu, 2020); 5次/d、7次/d频率投喂组的消化酶活力显著高于2次/d投喂组, 高频率投喂显著增强抗氧化能力(杨品贤, 2018)。日本沼虾()研究中发现3次/d投喂组增重率显著高于2次/d投喂组(宋大烨等, 2009)。所以, 适宜的投喂频率能提高对虾的代谢和免疫能力, 加快生长, 实现“提质增效”(杨品贤等, 2018b)。目前针对投喂频率对生长影响的分子机制仍不清晰。糖代谢的改变对生长有重大影响, 在哺乳动物的糖代谢过程中, 已发现信号通路和糖代谢关键酶之间存在相互调控关系, 比如经典的糖代谢PI3K-Akt信号通路在葡萄糖的吸收和利用中起着关键的作用。近年来在对虾研究中发现PI3K-Akt-mTOR通路可以调控HIF-1, 进而影响糖酵解关键酶己糖激酶、磷酸果糖激酶、乳酸脱氢酶的表达(Hernández-Palomares, 2018)。HIF-1还被证实可以调控1,6果糖二磷酸激酶的表达(Cota-Ruiz, 2016), 最终影响葡萄糖和乳酸的含量(Soñanez-Organis, 2010)。在虾类的糖代谢研究中, 信号通路和糖代谢关键酶之间相互调控的研究还较匮乏, 仅在对虾白斑综合症病毒(WSSV)、缺氧等胁迫方面略有发现(Cota-Ruiz, 2016; Hernández-Palomares, 2018)。而凡纳滨对虾投喂频率的研究集中在糖酵解酶, 还未能结合信号通路和关键酶基因全面研究投喂频率对糖代谢水平的影响。因此, 本实验拟通过研究2次/d、3次/d、4次/d、6次/d 4个不同投喂频率处理对凡纳滨对虾糖酵解、糖异生酶基因、糖转运蛋白和PI3K信号通路相关基因表达水平的影响, 明确投喂频率对糖代谢的影响, 为凡纳滨对虾健康养殖提供数据参考。
1 材料与方法
1.1 实验材料
实验在青岛农业大学海洋科学与工程学院实验室进行, 所用凡纳滨对虾来自山东省海阳市某养殖公司, 玻璃缸(55 cm×47 cm×39 cm)中暂养5 d, 期间水温(30±0.5) °C、盐度(30±0.5)、pH=8.0±0.2, 每日投喂人工配合饲料2次, 日换水1/3~1/2, 24 h不间断充气(DO≥5 mg/L)。
1.2 实验设计
实验设4个投喂频率, 分别为: 2次/d (9:00、21:00)、3次/d (6:00、14:00、22:00)、4次/d (6:00、11:00、16:00、21:00)和6次/d (6:00、9:00、12:00、15:00、18:00、21:00), 日投喂量为对虾湿重的5%, 每个处理35尾对虾, 设3个平行组, 养殖14 d后取样(宋大烨等, 2009), 每个处理随机取6尾对虾的肝胰腺组织样品, 存放于–80 °C中备用。
1.3 实验方法
1.3.1 总RNA提取和反转录 总RNA提取: 参照Trizol试剂(博迈德公司)使用说明书提取凡纳滨对虾肝胰腺组织总RNA; 反转录: 参照南京诺唯赞的反转录试剂盒[HIScript III RT SuperMix for qPCR (+gDNA wiper)], 总体系为20 μL。
1.3.2 荧光定量分析 cDNA模板样品浓度为5 ng/μL, 南京诺唯赞的荧光定量试剂盒(ChamQ Universal SYBR qPCR Master Mix), 总反应体系为10 μL, 内参基因为β-actin。引物如表1所示。
1.4 数据统计分析
实验数据采用均值±标准误(mean±S.E)表示, 利用Prism 7.0软件的单因素方差(ANOVA)分析检验、Tukey多重比较进行统计分析与作图, 以0.05作为统计学差异显著水平(*)。
表1 本研究中所用到的引物
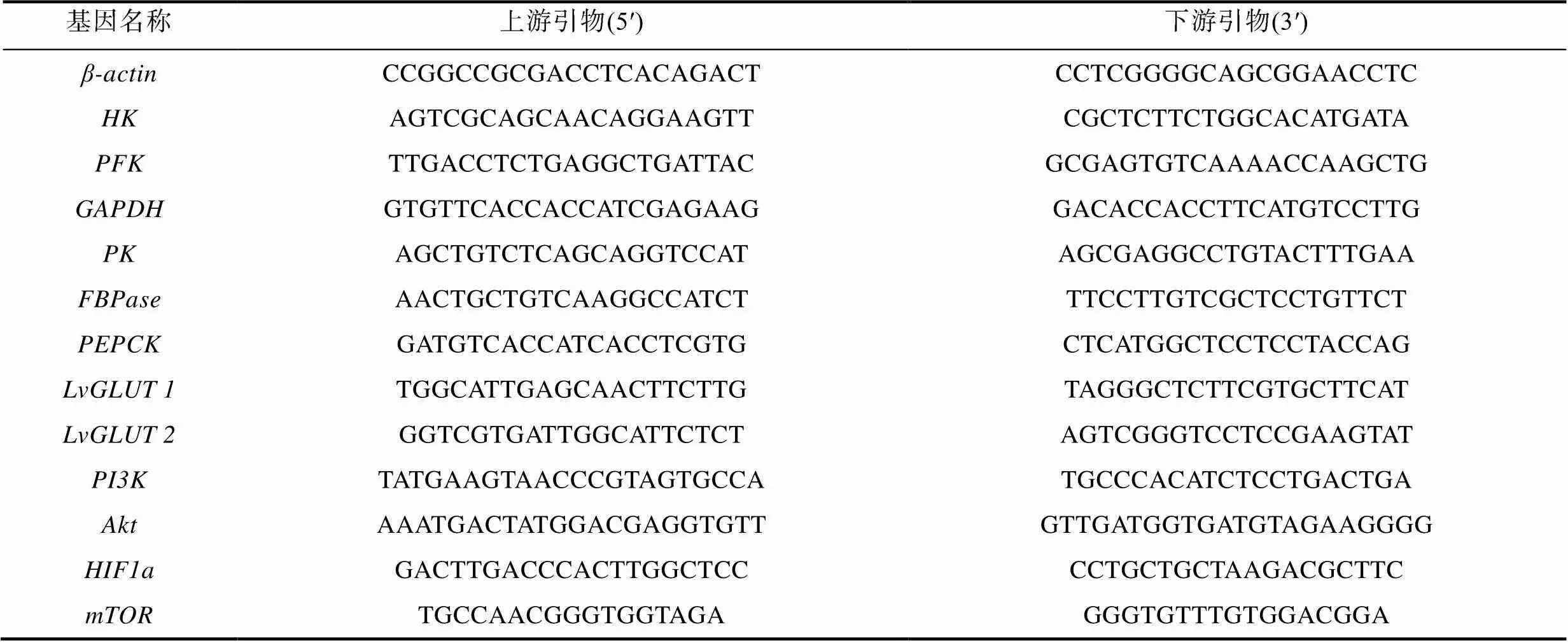
Tab.1 Primers used in this study
2 结果
2.1 投喂频率对凡纳滨对虾糖代谢酶基因表达的影响
凡纳滨对虾糖酵解第一阶段反应的关键基因己糖激酶(hexokinase,)、磷酸果糖激酶(phosphofructokinase,)、磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,)和丙酮酸激酶(pyruvate kinase,)的表达水平随着投喂频率的增加而增加(图1)。其中, 投喂频率4次/d和6次/d时基因表达水平显著高于2次/d (0.05,图1a); 6次/d处理组基因表达水平显著高于2次/d和3次/d处理组(0.05), 2次/d~4次/d处理组基因表达水平无显著差异(>0.05, 图1b); 6次/d处理组基因表达水平显著高于2次/d处理(0.05), 2次/d~4次/d处理组间无显著差异(0.05, 图1c); 6次/d处理组基因表达水平显著高于2次/d处理组(0.05, 图1d)。
糖异生过程中果糖-1,6-二磷酸酶(fructose-1,6- bisphosphatase,)与磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase,)两个基因的表达水平表现为: 2次/d处理组的基因表达水平显著低于在其他三个处理组(0.05), 3次/d、4次/d和6次/d处理间无显著差异(0.05, 图1e); 4个处理组间的基因表达水平呈现先下降后上升的趋势, 4次/d处理组表达水平最低, 且与2次/d、6次/d两处理组存在显著差异(0.05, 图1f)。

图1 投喂频率对凡纳滨对虾肝胰腺组织HK、PFK、GAPDH、PK、FBP、PEPCK基因表达的影响
凡纳滨对虾肝胰腺组织中葡萄糖转运蛋白1 (glucose transporter type 1,)、葡萄糖转运蛋白2 (glucose transporter type 2,)随投喂频率的变化如下:的表达水平随着投喂频率的增加而上升, 但处理间差异不显著(>0.05, 图2a); 2、3、6次/d处理组基因表达水平显著高于4次/d处理组(<0.05), 2、3、6次/d处理组间无显著差异(图2b,>0.05)。
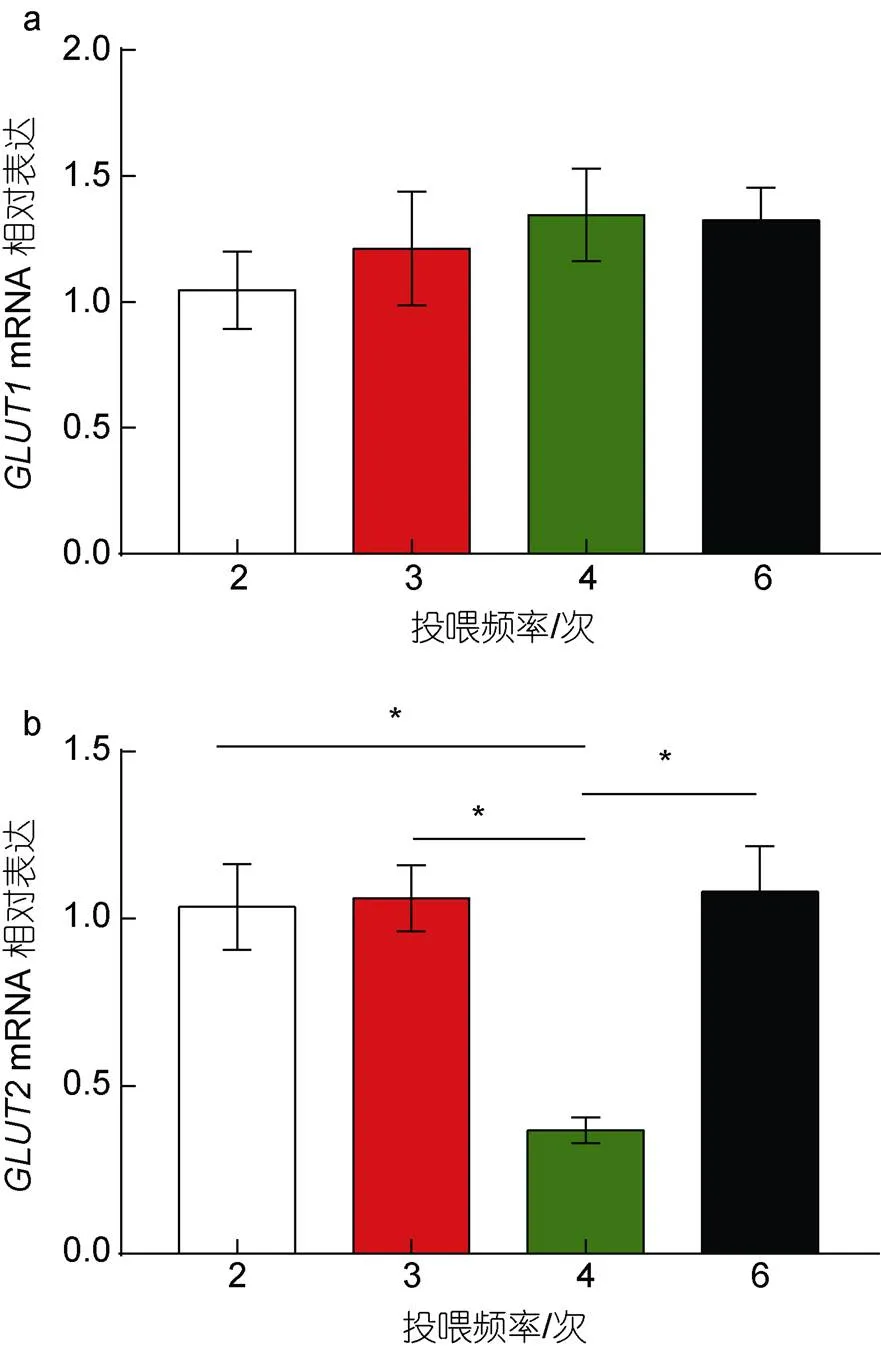
图2 投喂频率对凡纳滨对虾肝胰腺组织GLUT1、GLUT2基因表达的影响
2.2 投喂频率对凡纳滨对虾PI3K信号通路表达的影响
随着投喂频率的增加, 磷脂酰肌醇3-激酶(phosphoinositide3-kinase,)蛋白激酶B (protein kinase B,)雷帕霉素靶蛋白(mammalian target of rapamycin,)缺氧诱导因子1α亚基(hypoxia- inducible factor 1a,)几种基因的表达水平均呈现上升趋势(图3)。6次/d处理组PI3K信号通路相关基因的表达水平均显著高于2次/d处理组(0.05)其中,表达水平在6次/d处理组显著高于2次/d和3次/d处理组(0.05), 2、3、4次/d处理间无显著差异(0.05, 图3a);的表达水平仅2次/d与6次/d处理组间存在显著差异(0.05, 图3b); 6 次/d处理组表达水平显著高于2次/d处理组(0.05), 3次/d和4次/d处理组与2、6次/d处理间均无显著差异(0.05, 图3c); 4、6次/d处理组的表达水平均显著高于2次/d处理组(0.05, 图3d)。
3 讨论
3.1 投喂频率对凡纳滨对虾糖代谢酶基因表达水平的影响
代谢是营养物质在生物体内所经历的一切化学变化的总称, 是机体内维系生长和繁殖等生命活动重要特征之一。对虾通过摄食获得的葡萄糖通过糖酵解、TCA循环等方式彻底氧化分解成能量之后, 继而进行一切生命活动(李雪鹤, 2020)。其中,、、是糖酵解反应中的关键调节酶, 其活性变化对于维持糖酵解速率具有重要作用(Jenkins, 2011; 李英等, 2012)。本研究发现, 随着投喂频率的增加,、几种糖酵解酶基因的表达水平显著提高, 说明投喂频率的增加会提高糖酵解水平。推测投喂频率较低时, 对虾空胃时间较长, 造成血糖浓度维持时间较短, 提高投喂频率促进对虾对糖原的利用, 促进糖酵解水平, 从而增强代谢活动。杨品贤等(2018a)也得到了相似的结论, 0.37~2.67 g凡纳滨对虾在5次/d、7次/d投喂组肝胰腺HK、PFK 活性显著高于2次/d投喂组, 而PK活性无显著差异。对鱼类的研究发现投喂频率由2次/d增加至4次/d时, 鲤鱼()肝胰脏基因表达显著提高, PFK和PK酶活性也随之升高, 但差异并不显著(范泽, 2017)。其他研究发现, 凡纳滨对虾糖代谢的表达水平会受到多种因素的影响。比如温度变化, 当水温从17 °C突变为27 °C, 凡纳滨对虾肝胰腺组织中HK和PK活力显著升高, 分别在3 h、6 h达到顶点, 骤然升温加速了糖酵解途径反应(Guo, 2010)。还有盐度变化(Esparza-Leal, 2019), 当盐度从30下降到24和22, 凡纳滨对虾肝胰腺HK和PK活力显著升高, 通过糖酵解调节血糖水平来保证渗透调节所需的能量(李英等, 2012)。此外, 凡纳滨对虾糖代谢水平还会受到水体氮水平的影响, 在慢性亚硝酸氮胁迫时, 凡纳滨对虾通过调节肝胰腺中糖酵解水平做出短期响应(肖威等, 2020)。在氨氮胁迫时, 血淋巴中葡萄糖和乳酸含量也随之升高, 代谢活动增强(Cui, 2017; Long, 2021)。这些发现进一步验证凡纳滨对虾可以通过糖代谢变化来应对环境变化、维持机体内外稳态。其他水产养殖物种中糖代谢水平也会受到密度和饵料糖水平等因素的影响。例如, 中国明对虾()在较高密度养殖时HK、PK活性增加, 糖酵解速率提高(张海恩等, 2021)。斑节对虾()日粮中添加不同种类碳水化合物, 其中添加小麦淀粉的虾HK和G6PDH活性最高, 生长性能也最好, 说明小麦淀粉提高斑节对虾糖酵解水平, 促进生长, 是更好的碳水化合物来源(Niu, 2012)。日本沼虾日粮中添加淀粉, 肝胰腺HK和PFK活性显著升高, 表现出更高的糖代谢水平和生长性能(Kong, 2019)。
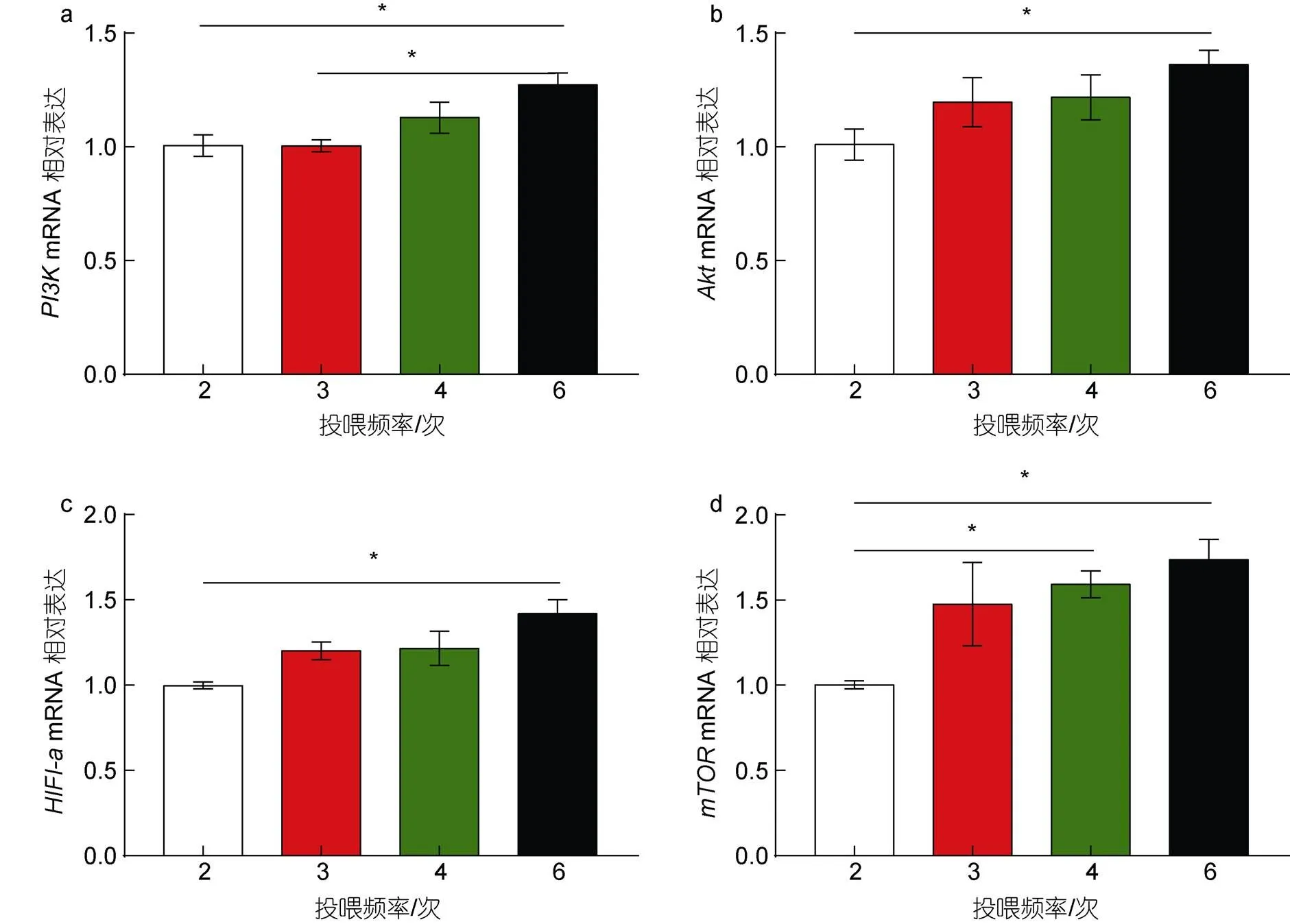
图3 投喂频率对凡纳滨对虾肝胰腺组织PI3K、Akt、HIF1-a、mTOR基因表达的影响
糖异生是乳酸、丙酮酸等非糖物质合成葡萄糖的过程。有报道指出肝脏是机体进行糖异生过程的主要器官, 其次是肾脏和肠道(Kirchner, 2008; 马红娜等, 2016; 韩锦铂等, 2019)。PEPCK被认为是肝糖异生途径关键酶之一, 而FBP参与肝胰腺组织中糖异生或戊糖磷酸途径的激活(Cota-Ruiz, 2015)。它们在机体内源性葡萄糖的合成、输出及调控中发挥重要作用。有研究发现鲤鱼提高投喂频率肝胰脏PEPCK及GS活性显著升高(范泽, 2017)。本研究发现在高频率投喂处理组(6次)时, 糖异生相关酶基因和表达水平显著上调, 说明糖异生过程增强。同时在本实验中还发现: 糖酵解中关键的限速酶的表达也显著增高。糖异生与糖酵解水平同时提高, 这说明在不同投喂频率条件下糖异生、糖酵解酶基因可能协同发挥作用, 最终调节葡萄糖在糖异生、糖酵解二者间的动态平衡(李荣翠等, 2018; 詹秋羽等, 2020)。此外, 糖异生酶还与摄入糖种类有关。在大菱鲆()中发现, 糊精糖源抑制FBP和PEPCK糖异生酶活性的表达, 但蔗糖糖源对FBP和PEPCK酶活性影响差异不显著(聂琴等, 2013)。
葡萄糖不能直接进入细胞发挥作用, 在这个过程中需要转运蛋白的参与。其机制是高度亲水葡萄糖借助通过镶嵌在细胞膜上的转运蛋白才可以通过疏水性生物膜从而进入细胞, 参与代谢。相关研究指出,在凡纳滨对虾中属于较为保守的一种蛋白, 表达受饲料糖水平、糖源的影响(王晓丹, 2017)。另有研究发现在斑节对虾()中的表达存在组织差异, 其规律是鳃>肝胰腺>卵巢(何鹏等, 2019)。本实验发现, 不同投喂频率下凡纳滨对虾肝胰腺组织中表达趋于稳定。是双向葡萄糖转运蛋白, 顺浓度梯度转运蛋白, 在哺乳动物和昆虫中都是促进性葡萄糖转运蛋白的标志(Zhao, 2007; Kikuta, 2010; Martínez- Quintana, 2015)。本实验发现高投喂频率下肝胰腺组织的表达水平显著增加, 说明可能在肝胰腺中发挥主要作用。范泽(2017)也在鲤鱼中发现4次/d投喂组肝胰腺表达水平显著高于2次/d投喂组。因此, 高频率投喂下凡纳滨对虾肝胰腺组织中增多, 会加速葡萄糖进入细胞, 充分参与代谢, 从而促进生长。
高频率投喂(6次)加速凡纳滨对虾糖的分解与合成, 导致糖代谢活跃。这是由于在较高投喂频率下对虾在代谢周期缩短、胃肠排空速度加快, 从而增加了营养物质的摄取(杨品贤等, 2018b)。
3.2 投喂频率对凡纳滨对虾PI3K信号通路表达的影响
糖代谢过程受到信号通路相关因子的调控。其中PI3K是经典的糖代谢信号通路, 激活的PI3K催化生成第二信使并激活Akt、mTOR、HIF-1α等下游分子, 实现多种信号因子的传导, 最终调节糖异生、脂肪酸合成及葡萄糖转运等过程(DeBerardinis, 2008; 迟毓婧等, 2010; Courtnay, 2015)。在葡萄糖供应充足的情况下, 该通路能够促进的表达, 增强HK、PFK的活性(Buzzai, 2005; Cárdenas-Navia, 2008)。本研究发现, 在较高投喂频率下凡纳滨对虾肝胰腺组织中PI3K信号通路相关因子(、、)的表达显著增高, 说明高频率投喂会激活PI3K-Akt信号通路。哺乳动物中已经证实PI3K-Akt信号通路和糖代谢关键酶之间存在调控关系, 可以影响葡萄糖的转运, 通过诱导的表达, 进一步影响磷酸果糖激酶等代谢酶(Li, 2020), 本实验中高频率投喂组的高表达, 可能体现高频率投喂下利用升高来介导2的表达, 从而控制葡萄糖进入细胞的速率调节糖代谢(Cui, 2018)。PI3K信号通路还可以通过调控的表达来影响靶基因等糖酵解酶基因的表达水平(Yalcin, 2009; Dang, 2012)。虽然在对虾中PI3K信号通路和糖代谢关键酶之间关系的研究还较匮乏, 但在凡纳滨对虾中发现干扰基因后,表达水平显著下降, HK和G6PDH酶活力显著下降, 在WSSV感染后借由增加关键糖酵解基因的表达来调节糖酵解过程(Godoy-Lugo, 2019)。另外, 在胁迫条件下(低氧)凡纳滨对虾借由调控、和等基因转录水平来调节机体内的葡萄糖代谢(Cota-Ruiz, 2016; Camacho-Jiménez, 2019)。本实验也发现随着投喂频率的增加的表达水平不断升高, 同时糖代谢过程中关键基因也相应升高, 说明高频率投喂下激活的PI3K通路, 通过调控关键的糖代谢酶基因和糖转运过程参与调节糖代谢过程。
4 结论
本实验通过研究不同投喂频率对凡纳滨对虾的糖代谢及相关信号通路的影响, 发现在高投喂频率(6次/d)下, 可以通过激活凡纳滨对虾糖代谢酶基因, 使其肝胰腺组织糖酵解、糖异生酶、糖转运蛋白及糖代谢PI3K信号通路相关因子的基因表达水平显著升高, 糖代谢能力增强, 本实验结果可以为进一步研究凡纳滨对虾健康养殖提供科学数据参考。
马红娜, 周飘苹, 陆游, 等, 2016. 不同脂肪和葡萄糖水平对大黄鱼生长性能、肝脏糖酵解和糖异生关键酶活性的影响[J]. 动物营养学报, 28(10): 3110-3122.
王晓丹, 2017. 凡纳滨对虾适应低盐度胁迫的糖营养和糖代谢研究[D]. 上海: 华东师范大学: 1-4.
中国渔业统计年鉴, 2021. 第二部分生产: 全国海水养殖产量(一)[M]. 北京: 中国农业出版社: 22.
李英, 王芳, 赵卓英, 等, 2012. 盐度突变对凡纳滨对虾渗透调节中血蓝蛋白和糖酵解影响的初步研究[J]. 中国海洋大学学报, 42(9): 28-34.
李荣翠, 刘率男, 申竹芳, 2018. 果糖-1, 6-二磷酸酶及其抑制剂的研究进展[J]. 药学学报, 53(9): 1477-1483.
李笑天, 刘宝良, 费凡, 等, 2020. 投喂策略对水产动物生长生理及行为特征影响研究进展[J]. 渔业现代化, 47(2): 7-15.
李雪鹤, 2020. 不同盐度下糖源对凡纳滨对虾代谢机制的影响[D]. 保定: 河北农业大学: 5.
杨品贤, 2018. 不同糖源在饥饿和不同投喂频率下凡纳滨对虾生长的影响[D]. 保定: 河北农业大学: 28.
杨品贤, 贾高旺, 夏辉, 等, 2018a. 投喂频率和糖源组成对凡纳滨对虾糖代谢的影响[J]. 大连海洋大学学报, 33(5): 583-588.
杨品贤, 郭冉, 夏辉, 等, 2018b. 糖源组成和投喂频率对凡纳滨对虾非特异性免疫功能及抗氧化性功能的影响[J]. 中国水产(1): 77-80.
肖威, 单洪伟, 马甡, 等, 2020. 亚硝态氮慢性胁迫对凡纳滨对虾体成分和糖代谢的影响[J]. 渔业科学进展, 41(6): 74-81.
何鹏, 江世贵, 李运东, 等, 2019. 斑节对虾GLUT1基因cDNA的克隆与表达分析[J]. 南方水产科学, 15(2): 72-82.
宋大烨, 张余霞, 赵卫红, 等, 2009. 不同投喂频率对日本沼虾影响的初步研究[J]. 上海农业科技(5): 78-80, 76.
迟毓婧, 李晶, 管又飞, 等, 2010. PI3K-Akt信号传导通路对糖代谢的调控作用[J]. 中国生物化学与分子生物学报, 26(10): 879-885.
张海恩, 何玉英, 李健, 等, 2021. 不同养殖密度对中国明对虾生长和能量代谢的影响[J]. 渔业科学进展, 42(5): 70-76.
陈文霞, 2012. 不同养殖策略对凡纳滨对虾生长、摄食与氮收支的影响[D]. 湛江: 广东海洋大学: 38.
范泽, 2017. 饲料糖源、糖/蛋白比与投喂频率对鲤生长和糖代谢的影响[D]. 天津: 天津农学院: 87.
聂琴, 苗惠君, 苗淑彦, 等, 2013. 不同糖源及糖水平对大菱鲆糖代谢酶活性的影响[J]. 水生生物学报, 37(3): 425-433.
韩锦铂, 王一国, 2019. 肝脏糖异生的调控[J]. 中国细胞生物学学报, 41(7): 1216-1224.
詹秋羽, 郑普强, 王骥腾, 等, 2020. 虾蟹类对糖类的利用和代谢[J]. 动物营养学报, 32(3): 1062-1075.
BUZZAI M, BAUER D E, JONES R G,, 2005. The glucose dependence of Akt-transformed cells can be reversed by pharmacologic activation of fatty acid-oxidation [J]. Oncogene, 24(26): 4165-4173.
CAMACHO-JIMÉNEZ L, LEYVA-CARRILLO L, PEREGRINO- URIARTE A B,, 2019. Regulation of glyceraldehyde- 3-phosphate dehydrogenase by hypoxia inducible factor 1 in the white shrimpduring hypoxia and reoxygenation [J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 235: 56-65.
CÁRDENAS-NAVIA L I, MACE D, RICHARDSON R A,. 2008. The pervasive presence of fluctuating oxygenation in tumors [J]. Cancer Research, 68(14): 5812-5819.
COTA-RUIZ K, LEYVA-CARRILLO L, PEREGRINO- URIARTE A B,, 2016. Role of HIF-1 on phosphofructokinase and fructose 1, 6-bisphosphatase expression during hypoxia in the white shrimp[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 198: 1-7.
COTA-RUIZ K, PEREGRINO-URIARTE A B, FELIX-PORTILLO M,, 2015. Expression of fructose 1, 6-bisphosphatase and phosphofructokinase is induced in hepatopancreas of the white shrimpby hypoxia [J]. Marine Environmental Research, 106: 1-9.
COURTNAY R, NGO D C, MALIK N,, 2015. Cancer metabolism and the Warburg effect: the role of HIF-1 and PI3K [J]. Molecular Biology Reports, 42(4): 841-851.
CUI X, QIAN D W, JIANG S,, 2018. Scutellariae radix andrhizoma improve glucose and lipid metabolism in T2DM rats via regulation of the metabolic profiling and MAPK/PI3K/Akt Signaling Pathway [J]. International Journal of Molecular Sciences, 19(11): 3634.
CUI Y T, REN X Y, LI J,, 2017. Effects of ammonia-N stress on metabolic and immune function via the neuroendocrine system in[J]. Fish and Shellfish Immunology, 64: 270-275.
DANG C V, 2012. Links between metabolism and cancer [J]. Genes & Development, 26(9): 877-890.
DEBERARDINIS R J, LUM J J, HATZIVASSILIOU G,, 2008. The biology of cancer: metabolic reprogramming fuels cell growth and proliferation [J]. Cell Metabolism, 7(1): 11-20.
ESPARZA-LEAL H M, PONCE-PALAFOX J T, CERVANTES- CERVANTES C M,, 2019. Effects of low salinity exposure on immunological, physiological and growth performance in[J]. Aquaculture Research, 50(3): 944-950.
GODOY-LUGO J A, MIRANDA-CRUZ M M, ROSAS- RODRÍGUEZ J A,, 2019. Hypoxia inducible factor-1 regulates WSSV-induced glycolytic genes in the white shrimp[J]. Fish & Shellfish Immunology, 92: 165-171.
GUO B, WANG F, DONG S L,, 2010. Effects of rapid temperature changes on HK, PK and HSP70 ofin different seasons [J]. Journal of Ocean University of China, 9(3): 303-308.
HERNÁNDEZ-PALOMARES M L E, GODOY-LUGO J A, GÓMEZ-JIMÉNEZ S,, 2018. Regulation of lactate dehydrogenase in response to WSSV infection in the shrimp[J]. Fish & Shellfish Immunology, 74: 401-409.
JENKINS C M, YANG J Y, SIMS H F,, 2011. Reversible high affinity inhibition of phosphofructokinase-1 by acyl-CoA: a mechanism integrating glycolytic flux with lipid metabolism [J]. The Journal of Biological Chemistry, 286(14): 11937-11950.
KIKUTA S, KIKAWADA T, HAGIWARA-KOMODA Y,, 2010. Sugar transporter genes of the brown planthopper,: A facilitated glucose/fructose transporter [J]. Insect Biochemistry and Molecular Biology, 40(11): 805-813.
KIRCHNER S, PANSERAT S, LIM P L,, 2008. The role of hepatic, renal and intestinal gluconeogenic enzymes in glucose homeostasis of juvenile rainbow trout[J]. Journal of Comparative Physiology B, 178(3): 429-438.
KONG Y Q, DING Z L, ZHANG Y X,, 2019. Types of carbohydrate in feed affect the growth performance, antioxidant capacity, immunity, and activity of digestive and carbohydrate metabolism enzymes in juvenile[J]. Aquaculture, 512: 734282.
LI L L, YAO Y, ZHAO J L,, 2020. Dehydroepiandrosterone protects against hepatic glycolipid metabolic disorder and insulin resistance induced by high fat via activation of AMPK-PGC-1α-NRF-1 and IRS1-AKT-GLUT2 signaling pathways [J]. International Journal of Obesity, 44(5): 1075-1086.
LONG J N, CUI Y T, WANG R J,, 2021. Combined effects of high salinity and ammonia-N exposure on the energy metabolism, immune response, oxidative resistance and ammonia metabolism of the Pacific white shrimp[J]. Aquaculture Reports, 20: 100648.
MARTÍNEZ-QUINTANA J A, KIKUTA S, FELIX-PORTILLO M,, 2015. A novel functional glucose transporter in the white shrimp-LvGLUT2- is up-regulated during hypoxia in hepatopancreas [J]. Marine Environmental Research, 112: 61-67.
NIU J, LIN H Z, JIANG S G,, 2012. Effect of seven carbohydrate sources on juvenilegrowth performance, nutrient utilization efficiency and hepatopancreas enzyme activities of 6-phosphogluconate dehydrogenase, hexokinase and amylase [J]. Animal Feed Science and Technology, 174(1/2): 86-95.
PONTES C S, DE LIMA P P, ARRUDA M D F, 2008. Feeding responses of juvenile shrimp(Boone) fed at different frequencies under laboratory conditions [J]. Aquaculture Research, 39(13): 1416-1422.
SOÑANEZ-ORGANIS J G, RACOTTA I S, YEPIZ-PLASCENCIA G, 2010. Silencing of the hypoxia inducible factor 1 -HIF-1- obliterates the effects of hypoxia on glucose and lactate concentrations in a tissue-specific manner in the shrimp[J]. Journal of Experimental Marine Biology & Ecology, 393(1/2): 51-58.
XU W J, XU Y, SU H C,, 2020. Effects of feeding frequency on growth, feed utilization, digestive enzyme activity and body composition ofin biofloc-based zero-exchange intensive systems [J]. Aquaculture, 522:735079.
YALCIN A, TELANG S, CLEM B,, 2009. Regulation of glucose metabolism by 6-phosphofructo-2-kinase/fructose-2, 6-bisphosphatases in cancer [J]. Experimental and Molecular Pathology, 86(3): 174-179.
ZHAO F Q, KEATING A F, 2007. Functional properties and genomics of glucose transporters [J]. Current Genomics, 8(2): 113-128.
EFFECTS OF FEEDING FREQUENCY ON EXPRESSION OF GENES RELATED TO METABOLISM AND PI3K SIGNALING PATHWAY IN
ZHAO Nan-Nan, CUI Yan-Ting, WANG Zhong-Kai, WANG Cong, ZHANG Zhi-Hao, DENG Zhi-Tong, ZHAO Rui-Yang, SUN Jin-Feng, WANG Ren-Jie, LI Yu-Quan
(School of Marine Science and Engineering, Qingdao Agricultural University, Qingdao 266109, China)
To investigate the effects of different feeding frequencies on glucose metabolism and related signaling pathways in, the PI3K signaling pathways (,,, and), metabolic enzyme (,,,,, and), and glucose transporters(and) mRNA expression in the hepatopancreas were determined. Shrimps [(7.6±1.0) g] were randomly distributed in four-frequency feeding treatments (2×/d, 3×/d, 4×/d, and 6×/d) in triplicate. The experiment lasted for 14 days. Results show that the expression levels of key genes in PI3K signaling pathway increased significantly at higher frequencies (0.05). The expression levels of,,,andin 6×/d were significantly higher than those of 2×/d (0.05), and the expression level ofin 4×/d was significantly higher than those of 2×/d (0.05). The expression levels of,,,,,andincreased with the increase in feeding frequency. The expression levels of glycolyticgenes,,,andin 6×/d group were significantly higher than those of 2×/d (0.05). The expression levels of gluconeogenic enzymein 3×/d, 4×/d, and 6×/d groups were significantly higher than those of 2×/d (0.05). Glucose transporterin 2×/d, 3×/d, and 6×/d was significantly higher than those of 4×/d (0.05). Therefore, higher feeding frequency could improve glucose metabolism by activating glucose metabolism enzyme, glucose transporter and PI3K signaling pathway in.
; feeding frequency; glucose metabolism enzyme; glucose transporter; PI3K signaling pathway
Q789; S968
10.11693/hyhz20211200336
*山东省虾蟹产业技术体系, SDAIT-15-011号; 山东省农业科技资金(园区产业提升工程)项目, 2019YQ003号; 国家自然科学基金项目, 31802269号; 山东省自然科学基金项目,ZR2019BC013号。赵楠楠, 硕士研究生, E-mail: 18893078465@163.com; 同等贡献第一作者: 崔彦婷, 博士, 讲师, E-mail: yt-cui1114@163.com
李玉全, 博士, 教授, 硕士生导师, E-mail: jiangfangqian@163.com
2021-12-23,
2022-02-19

