线粒体膜完整性对细胞命运的调控*
祁 宏 李智超 史志强
(1)国科温州研究院(温州生物材料与工程研究所),温州市生物物理重点实验室,温州 325000;2)山西大学,复杂系统研究所,太原 030006)
线粒体是真核细胞制造能量的场所,被称为“动力工厂”;近些年的研究表明它也是细胞死亡的“调控中心”。这与线粒体的双层膜结构密切相关,该结构将线粒体分为外膜、膜间隙、内膜和基质4部分[1]。虽然线粒体外膜起界膜作用,但由于其上有孔蛋白构成的通道,通透性很高,所以膜间隙中的离子环境几乎与细胞质相同[1]。内膜的不通透性限制了所有分子和离子的自由通过,导致膜间隙和基质之间存在质子电化学梯度,构成呼吸链合成ATP的必备条件[2]。膜间隙的细胞色素c虽是呼吸链的组成成分,却也是细胞死亡的重要因子。基质 中 的 线 粒 体DNA(mitochondrial DNA,mtDNA)虽负责部分线粒体蛋白质的合成,但也参与炎症反应和细胞死亡[3-4]。
细胞死亡是生物体的一项基本生命过程,其方式多种多样,主要包括凋亡、焦亡、铁死亡、坏死性凋亡等[5]。凋亡是一种“温和”的死亡方式,不会引起炎症或免疫反应,在胚胎发育和成体组织自稳态维持中发挥重要作用。焦亡是一种“剧烈”的死亡方式,其特征在于细胞膜的破裂和由此产生的炎症诱导因子的释放,在防御病毒和细菌感染过程中起重要作用[6]。过度的细胞死亡将导致阿尔茨海默病、帕金森病等神经退行性疾病的发生[7-8],而不足的细胞死亡则促进肿瘤的形成[9]。因此在过去的30年中,对细胞死亡的研究(尤其是以信号通路为主的分子机制研究)一直是生命科学的热门研究领域。
各种细胞死亡方式虽具有不同的形态和分子特征,但均受到各自信号通路的严密调控。近期的一系列研究表明:各细胞死亡方式的信号通路不是孤立存在的,它们之间存在交叉关联[10],线粒体正是它们交流的“主战场”[11]。维持线粒体双层膜的完整性是保持线粒体正常功能的关键,因此线粒体内外膜的完整性及其遭到破坏后导致的不同细胞命运成为国内外学者研究的焦点。
1 线粒体外膜通透与细胞凋亡
1.1 Bcl-2蛋白家族
细胞凋亡是研究得最为深入的细胞死亡方式,关于其分子机制的研究已比较透彻,它可通过受体途径(外源途径)和线粒体途径(内源途径)发生。线粒体凋亡途径主要依赖于线粒体外膜通透(mitochondrial outer membrane permeabilization,MOMP),而MOMP的发生主要受Bcl-2蛋白家族成员之间相互作用的精密调控(图1a)。
根据蛋白质结构以及在MOMP中所发挥的作用,可将Bcl-2蛋白家族成员划分为3大类[12-13]:a.效应者(effectors,如Bak和Bax),一般为包含3个BH结构域的促凋亡蛋白,被激活后可通过寡聚化在线粒体外膜上形成孔道,促使MOMP发生;b.保护者(guardians,如Bcl-2和Bcl-XL),大多为包含4个BH结构域的抗凋亡蛋白,可通过与效应者结合从而抑制其活性;c.起始者(initiators),因其只含1个BH结构域(即BH3结构域),也被称为BH3-only蛋白,属于促凋亡蛋白,可通过调控效应者或保护者促使MOMP发生。起始者又可进一步细分为:可直接激活效应者的激活者(activators,如Bid和Bim),以及间接激活效应者的致敏者(sensitizers,如Bad),它可以通过抑制保护者减弱后者对效应者的抑制作用,从而达到间接激活效应者的目的[14]。需要指出的是,很多激活者也可发挥致敏者的作用。
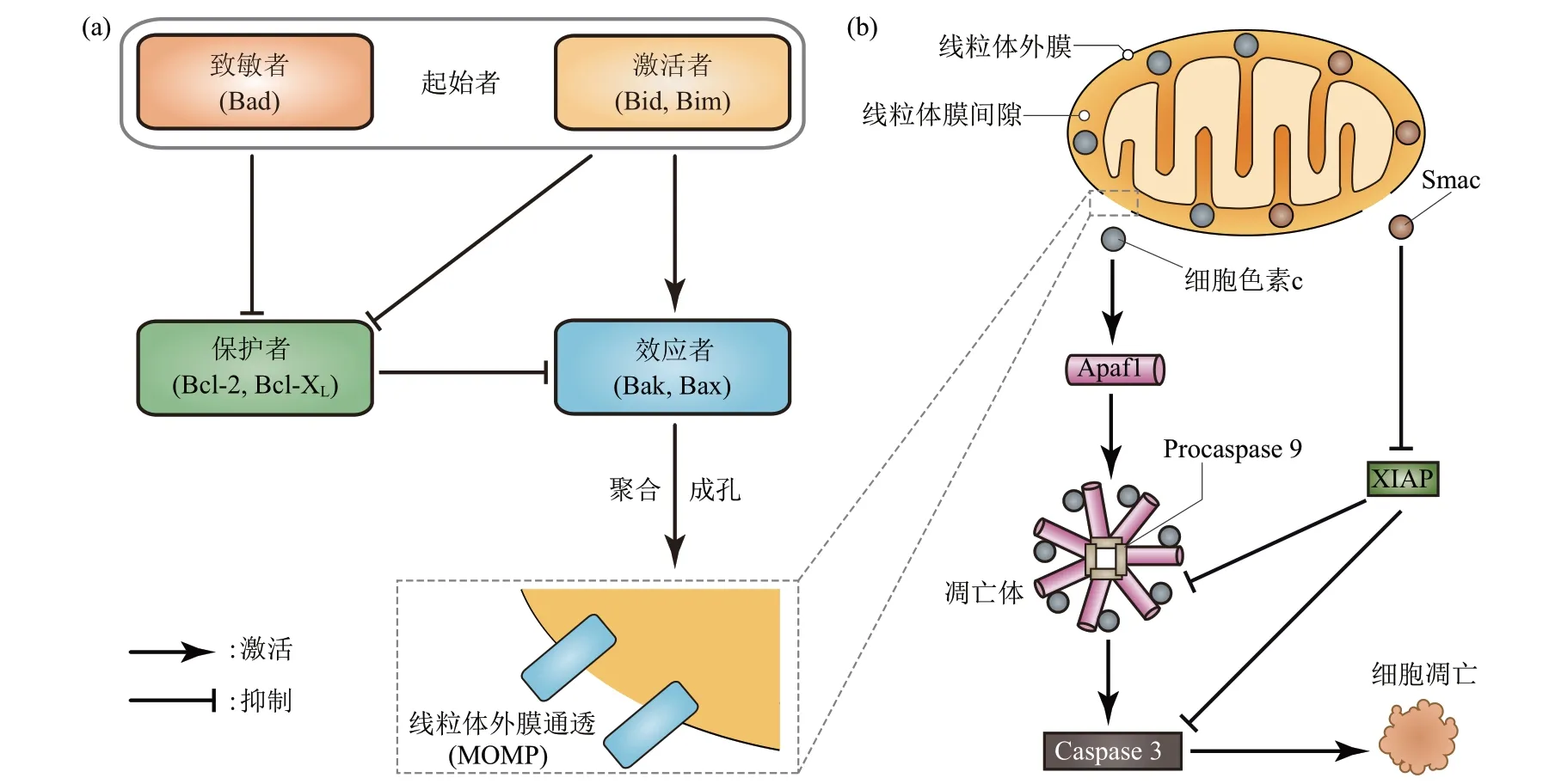
Fig.1 The major processes of mitochondrial apoptosis pathway图1 线粒体凋亡途径的主要过程
1.2 线粒体外膜通透调控凋亡
当细胞受到生存压力时,会将压力信号传递给Bcl-2蛋白家族中的激活者,激活者的BH3结构域插入效应者的疏水域使后者发生构象改变从而处于激活状态[15]。激活的效应者单体首先在线粒体外膜上形成二聚物,然后进一步以二聚物为基础形成不同的寡聚物[16],最后这些寡聚物在线粒体外膜上形成直径为几十到几百纳米的“指环状”结构[17-18],促使MOMP发生。
MOMP的发生常被看做是细胞凋亡的不可逆点。这是因为MOMP发生之后,原本位于线粒体膜间隙的一些物质,如细胞色素c和Smac便会释放到细胞质中,引发Caspase级联反应(图1b)。一方面,细胞色素c与单体形式的Apaf1结合,引起后者构象改变,随后在ATP或dATP参与下,7个Apaf-1细胞色素c复合物与4分子Procaspase 9组装成“车轮状”的凋亡体[19-20],从而激活Caspase 3,降解细胞内数百种蛋白质,导致细胞凋亡[21]。另一方面,细胞质内的XIAP可以抑制Caspase级联反应,但是它的活性可被Smac抑制[22],从而达到间接促进凋亡之目的。
1.3 线粒体外膜通透的三种程度及相应的细胞命运
传统观念常将MOMP是否发生看成是凋亡的开关,这是因为人们通常发现MOMP是一个“全或无”的事件[11]。然而最近的研究表明存在一些例外情况,比如当细胞遭受某些亚死亡刺激时会发生少量MOMP(minority MOMP),即一个细胞内仅有少数线粒体发生MOMP现象[23-24]。虽然发生少量MOMP并不会使细胞凋亡,但是它仍然会激活少量Caspase 3,使核酸内切酶产生微弱活性,从而使DNA有限损伤并引发基因组不稳定性,最终导致肿瘤发生[24-25]。
因此,在一般情况下,健康存活的细胞中无MOMP发生,而凋亡细胞中所有线粒体均发生MOMP;在一些病理情况下,细胞中仅有少量线粒体发生MOMP,引起细胞癌变(图2)。基于本课题组已发表的理论模型所得结果[26],认为此现象可用非线性动力学中的“三稳态”机制解释(待发表)。
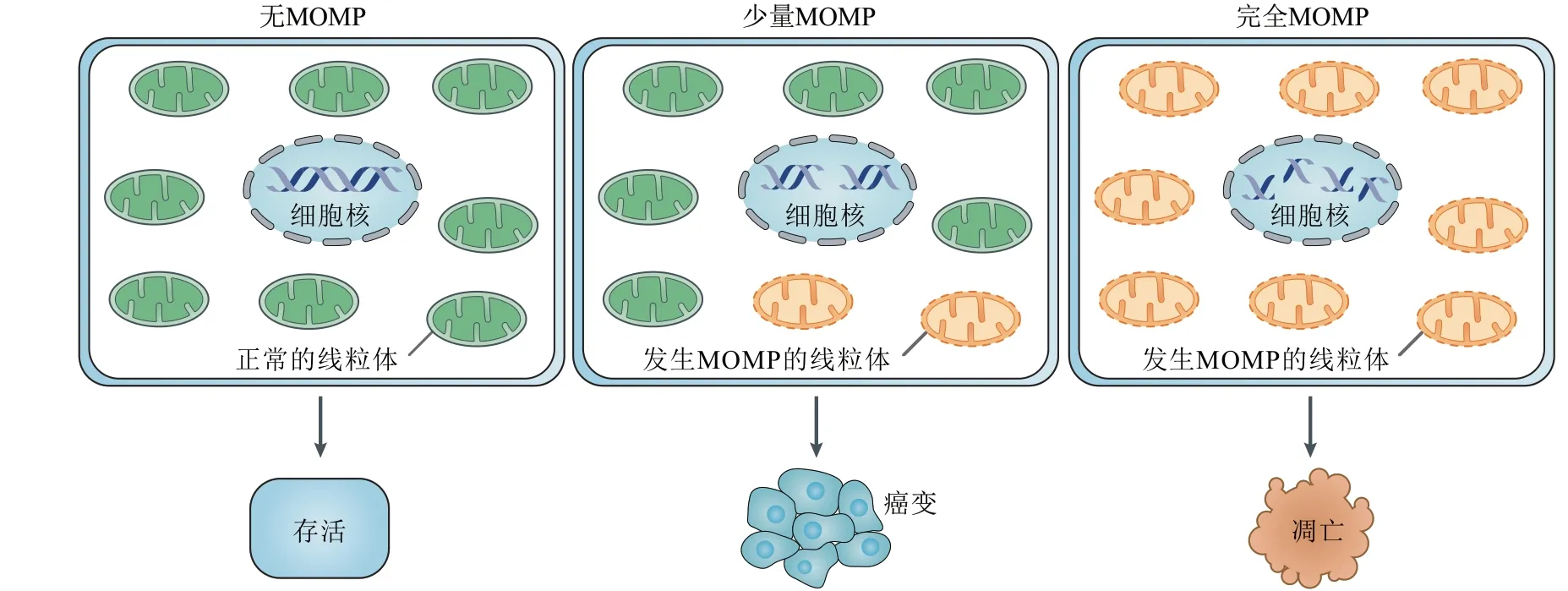
Fig.2 Three distinct settings of MOMP and the corresponding cell fates图2 线粒体外膜通透的三种程度及相应的细胞命运
2 线粒体内膜通透与炎症反应
2.1 cGAS-STING信号通路
凋亡是一种非炎症的死亡方式,这已是教科书式的观点。然而近年来的研究显示,由Bcl-2蛋白家族效应者Bak/Bax介导的MOMP不仅可以决定细胞是否凋亡,还可促进细胞发生炎症反应,激活机体免疫应答;这与新近鉴定出来的环状鸟苷酸-腺苷酸合成酶(cyclic GMP-AMP synthase,cGAS)-干扰素基因刺激因子(stimulator of interferon genes,STING)信号通路密切相关[27-28]。
细胞质中游离的DNA被宿主的固有免疫系统当做一种危险信号,cGAS-STING信号通路是宿主从检测这类信号到启动防御机制的重要途径[29]。当病毒或细菌感染细胞后,释放到细胞质内的DNA会被胞质DNA受体cGAS识别,从而催化ATP和GTP合成第二信使环状GMP-AMP(cyclic GMP-AMP,cGAMP)[30],它 与 内 质 网 膜 上 的STING蛋白结合,导致其构象发生变化并形成二聚体,继而寡聚化[31]。STING寡聚体作为信号平台招募并激活TANK-结合激酶1(TANK-binding kinase 1,TBK1),TBK1进一步磷酸化STING,从而招募并磷酸化干扰素调节因子3(interferon regulatory factor 3,IRF3)[32]。磷酸化的IRF3形成二聚体,进入细胞核,发挥其转录因子功能产生干扰素β(interferon-β,IFN-β),触发炎症反应[33]。cGAS-STING信号通路可激活免疫系统杀死癌细胞,已在癌症免疫疗法中显现出巨大前景[34-35]。
线粒体抗病毒信号蛋白(mitochondria antiviral signaling protein,MAVS)也在固有免疫信号通路中扮演重要角色[36],它的激活依赖于其线粒体外膜定位功能[37]。MAVS通过信号级联反应 活 化NF-κB(nuclear factor kappa-B)、IRF3、IRF7等信号蛋白,进而启动干扰素基因的表达,达到抑制病毒复制和传播之目的[37-38]。鉴于主题和篇幅的限制,本文仅讨论cGAS-STING信号通路调控炎症反应的机制。
2.2 线粒体内膜通透引发炎症反应
cGAS既可识别来自病毒或细菌等病原微生物的DNA,也可识别病理条件下泄露到细胞质的自身DNA,如核DNA和mtDNA[39]。当正常细胞中缺乏Caspase蛋白或其活性受到抑制时,mtDNA可激活cGAS-STING通路,产生IFN-β并导致炎症反应;但在凋亡细胞中Caspase级联反应可以抑制该过程[40-41]。最近的研究发现,Caspase 3可通过切割cGAS、IRF3等cGAS-STING通路中的关键物质抑制IFN-β的产生,从而避免发生炎症反应[42]。这些研究成功解决了细胞凋亡如何维持天然免疫沉默这一重要的科学问题,但mtDNA如何从线粒体进入细胞质却未被清楚解释。近期,科学家利用超高分辨率显微镜技术揭示:当细胞开始凋亡时,Bak/Bax通过寡聚化引发MOMP,释放出细胞色素c以激活Caspase 3;与此同时Bak/Bax形成的寡聚物不断聚合,形成巨大孔洞,使线粒体内膜透过外膜突出,从而导致线粒体内膜通透(mitochondrial inner membrane permeabilization,MIMP),释 放mtDNA[43-44]。
据此提出如下设想(图3):低阶Bak/Bax聚合物介导MOMP的发生和细胞色素c的释放,导致细胞凋亡[21,45];而高阶Bak/Bax聚合物介导MIMP的发生和mtDNA的释放,引起炎症反应。因为前者的发生不仅先于后者,而且快于后者,所以凋亡细胞可以凭借Caspase 3的激活阻止炎症发生。本课题组已针对这一设想建立了数学模型并取得了合理的结果(待发表)。
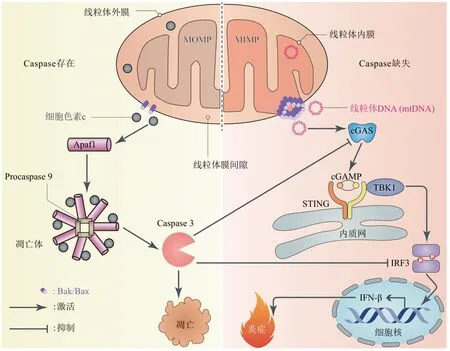
Fig.3 The interplay between apoptosis and inflammation regulated by MOMP and MIMP图3 线粒体内外膜通透调控的细胞凋亡和炎症之间的互作
3 线粒体通透性转换与细胞焦亡
3.1 线粒体通透性转换孔
通透性转换孔(permeability transition pore,PTP)位于线粒体内膜,在正常生理情况下,其呈瞬时开放状态,这对于维持一些重要的细胞活动是必需的;但在病理条件下,其呈持续性开放状态,可导致细胞死亡,引发神经退行性疾病[46-47]。
钙离子(Ca2+)经线粒体钙单向转运蛋白进入线粒体[48],线粒体钙稳态在细胞生理学和病理学中均起关键作用[48-49]。三羧酸循环是糖、脂肪和蛋白质三大营养物质代谢的共同通路,包括8个反应步骤,其中的两步必须依赖于Ca2+。三羧酸循环的最终产物通过其下游的氧化磷酸化反应产生ATP,从而保证生物体各项生命活动的能量供应。因为三羧酸循环和氧化磷酸化反应均发生在线粒体内,所以需要有适量的Ca2+由细胞质不断地流入线粒体[50-51]。此外,氧化磷酸化反应在产生ATP的同时,会生成少量的活性氧。适量的Ca2+和活性氧可刺激PTP瞬时开放,使部分Ca2+释放出去,避免线粒体钙超载[52]。
但细胞处于病理状态时,会有过量的Ca2+涌入线粒体,同时生成大量的活性氧,二者的强烈作用诱导PTP持续性开放,水和小分子物质自由通过PTP流入基质,称为线粒体通透性转换(mitochondrial permeability transition,MPT)[53]。
MPT会使线粒体内部的渗透压发生改变,导致其内膜膨胀,进而撑破外膜,引起细胞死亡[54]。
3.2 线粒体通透性转换调控焦亡
早在2005年就有研究指出MPT会导致细胞以非凋亡的方式(尤其是不依赖于Bcl-2蛋白家族的方式)死亡[55-56],但到底以何种形式死亡成了一个悬而未决的问题。细胞焦亡是近年来提出的一种新的细胞炎性死亡方式,Caspase家族部分成员常参与其上游信号通路,而下游信号通路很大程度上依赖于Gasdermin家族,其中Gasdermin E(GSDME)为焦亡的主要执行蛋白之一[57-58]。GSDME被Caspase 3切割后释放的片段在细胞膜上寡聚化穿孔,水分子等物质进入细胞导致胞膜破裂和内容物释放,发生焦亡[59]。近日的一项研究解释了MPT引发焦亡的作用机制[60]。
该研究揭示不同的刺激条件(钙超载、胆汁酸、腺嘌呤核苷酸转运子1激活剂诱导)可通过触发MOMP或MPT,选择性激活凋亡或焦亡信号通路(图4)。具体来说,低刺激强度触发MOMP,缓慢释放出细胞色素c,与Apaf1和Procaspase 9形成凋亡体,逐渐激活Caspase 3,切割PARP(实验上用于检测凋亡是否发生的一种底物)引发凋亡;高刺激强度触发MPT,迅速释放出细胞色素c,与Apaf1和Procaspase 4/11形成焦亡体(化学计量比为7∶2),快速激活Caspase 3,切割GSDME引发焦亡[60]。
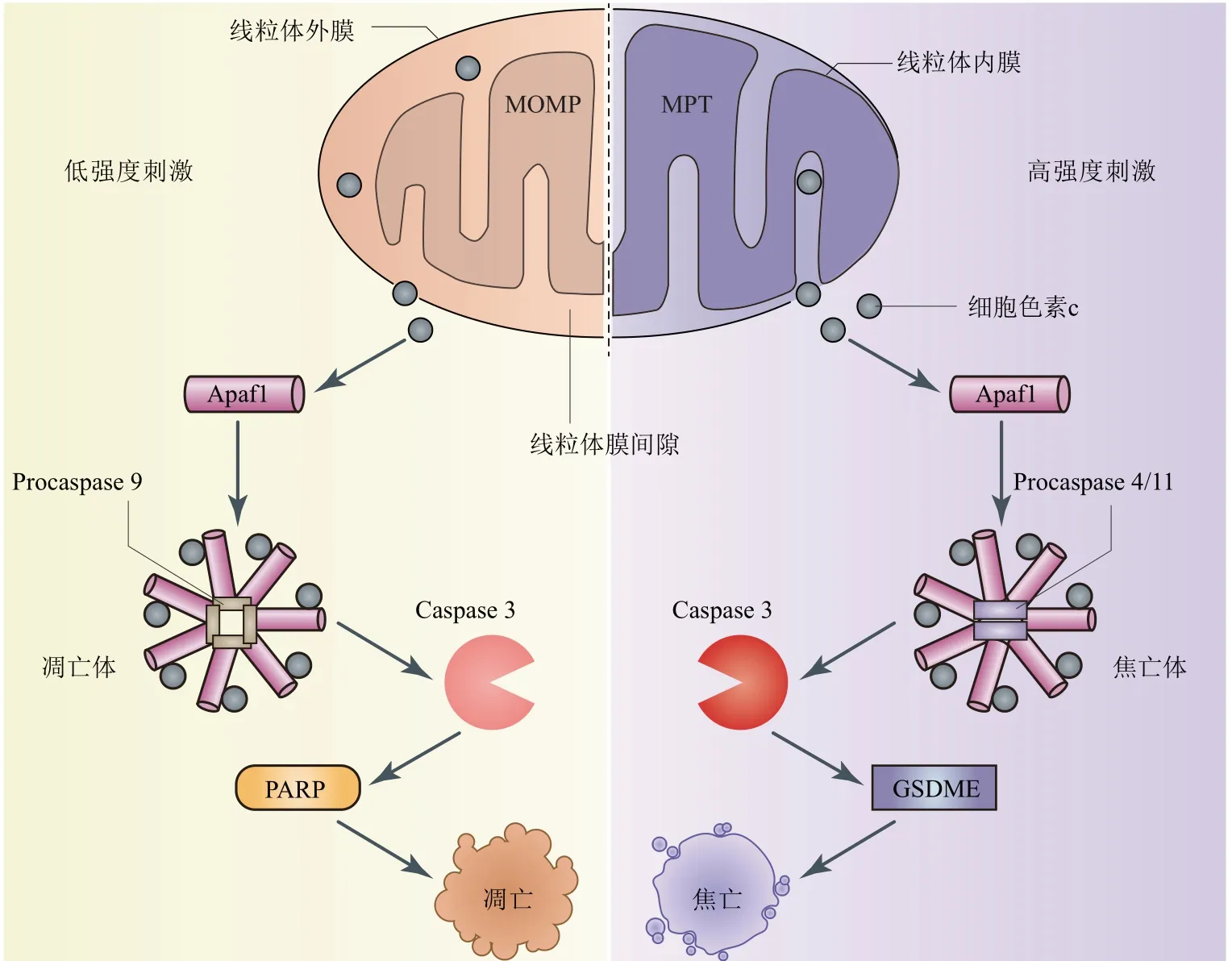
Fig.4 The regulation of apoptosis and pyroptosis by MOMP and MPT图4 线粒体外膜通透和通透性转换对细胞凋亡和焦亡的调控
基于上述研究以及本课题组新近的理论工作[21],提出如下假说:在低刺激强度下,细胞质Ca2+的提升激活Bcl-2蛋白家族中的激活者Bid,触发MOMP导致细胞凋亡;在高刺激强度下,线粒体Ca2+过载,触发MPT导致细胞焦亡。
4 线粒体膜完整性与细胞命运
线粒体双层膜的完整性是线粒体发挥正常功能乃至细胞存活的关键因素,其遭到破坏后一方面会使线粒体功能受损,无法产生能量,另一方面会释放出一些物质,引发不同的信号级联反应,最终导致细胞发生凋亡、焦亡或炎症(图5)。在凋亡诱导因子的刺激下,Bcl-2蛋白家族成员Bak/Bax在线粒体外膜上聚合形成小孔,促发MOMP,细胞色素c通过该孔释放到细胞质中,引发Caspase级联反应,最终导致细胞发生凋亡。在此过程中,Bak/Bax形成的小孔通过聚合不断扩大成宏孔,促发MIMP,mtDNA通过宏孔释放到细胞质中,引发cGAS-STING级联反应,使细胞产生炎症。发生凋亡的细胞中,由于细胞色素c和mtDNA的释放存在动力学方面的差异,以及Caspase 3对cGASSTING信号通路的抑制,所以观察不到炎症现象;但若Caspase级联反应受到抑制,则发生炎症反应。低强度的应激水平一般通过MOMP导致细胞凋亡,高强度的应激水平可使PTP持续性开放,水和小分子物质通过它流入基质,促发MPT,使线粒体内膜膨胀撑破外膜,引发Caspase 4/11-Caspase 3-GSDME级联反应,导致细胞发生焦亡。
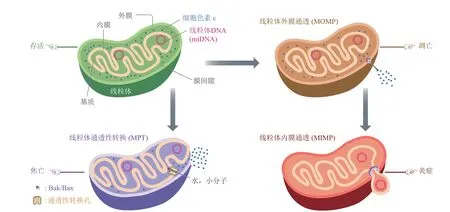
Fig.5 The regulation of cell fate by mitochondrial membrane integrity图5 线粒体膜完整性对细胞命运的调控
5 总结与展望
线粒体是真核生物细胞内最重要的细胞器之一,因此存在多种途径调控线粒体质量[61],主要包括线粒体生物发生、线粒体融合与分裂、线粒体自噬[62]。线粒体自噬是细胞通过自噬的方式清除受损伤线粒体的过程,Pink1(PTEN induced putative kinase 1)/Parkin介导的线粒体自噬是目前研究最为深入的机制[63-64]。Pink1招募并激活Parkin的过程即包含前馈机制[65],又包含反馈机制[66],从理论上来讲很可能蕴含复杂的非线性动力学现象。这些重要且有趣的问题也值得研究者们高度关注。
线粒体膜完整性的破坏会导致细胞发生凋亡、焦亡或炎症反应,在很多重要疾病中发挥重要作用[67]。虽然科学界近期在此方面取得了重大突破,但仍有许多重要问题有待进一步研究,如:影响MOMP发生的其他因素,MIMP发生的详细机制,PTP的分子鉴定,MOMP与MPT的偶联机制,细胞如何处理MOMP、MIMP和MPT构成的复杂信号转导网络等。解决这些问题,一方面需要针对单细胞和单分子的实时超分辨等生物技术的不断发展[68],另一方面需要借助生化反应动力学原理、非线性动力学理论、统计物理规律等构建合适的理论模型[20-21,47,69-71]。通过生物实验与理论模型的结合,将有助于深入了解线粒体膜完整性调控细胞命运的复杂调节机制,促进学科的交叉与融合,并为癌症和神经退行性疾病的诊断和治疗提供理论依据和制定最优策略。

