SUMO化修饰系统在哺乳动物胚胎发育及器官发生中的作用*
徐 瑞 王 可 李云智 张秀红***
(1)安徽医科大学生命科学学院,合肥 230032;2)合肥综合性国家科学中心人工智能研究院,合肥 230088;3)安徽省第二人民医院生殖医学中心,合肥 230041)
小分子泛素相关修饰物蛋白(small ubiquitinrelated modifier protein,SUMO)化修饰作为可逆的蛋白质翻译后修饰的一种重要修饰形式,在蛋白质的活性、定位和稳定性方面发挥着重要作用。SUMO(又称为sentrin)的大小约为10 ku,作为类泛素修饰物(UBLs)的一种,SUMO有类似于泛素的三维结构[1],但两者的序列同源性仅有18%左右,且两者总体表面电荷分布不同,并且SUMO具有泛素中没有的带电荷短氨基末端延伸,这表明两者具有不同的功能。泛素与蛋白酶体介导的蛋白质降解有关,而SUMO化修饰不具备这种功能。
在低等真核生物如酵母和其他无脊椎动物中,只表达1种单一的SUMO形式,也称为SMT3,而人类基因组编码至少4种亚型的SUMO蛋白,分别是SUMO1、SUMO2、SUMO3和SUMO4[1-2]。在氨基酸水平上,SUMO2与SUMO3具有97%的同源性(通常简称为SUMO2/3),而与SUMO1只有46%的同源性。SUMO1和SUMO2/3在体内广泛表达,但由于它们结合的底物蛋白不同,所以它们在功能上有很大的不同。SUMO4主要在肾脏、脾脏和淋巴结等特定组织中表达,尽管SUMO4的功能尚不清楚,但Song等[3]研究发现,SUMO4与1型糖尿病的易感性具有相关性。有趣的是,最近的研究还发现了一种新的颇有争议的SUMO亚型——SUMO5,被认为是核小体调控因子。然而,SUMO5是否为翻译所需的内源性蛋白质,还需要进一步研究[4]。
在大多数生物中,SUMO化修饰在调控生物学过程中扮演重要角色。例如在基因转录调控、DNA修复、核质运输和细胞信号传导等方面的作用已有较多的研究。本综述专注于SUMO化修饰在胚胎发育及器官发生过程中的作用。
1 SUMO化的分子机制
SUMO化是一个动态可逆的过程(图1),主要结合在靶蛋白保守序列(Ψ-K-X-[D/E])上,其中Ψ是任何大的疏水残基(如I、V或L),K是目标Lys,X可以是任意氨基酸,D/E是Asp/Glu[5-6]。SUMO分子与目标蛋白的共价结合涉及4个酶促反应(由SUMO蛋白酶、E1酶、E2酶和E3酶介导),使SUMO羧基末端的甘氨酸残基与靶蛋白赖氨酸残基上的ε氨基之间形成异肽键。这一过程类似于泛素化,但两者之间涉及的酶不同[2,7]。
SUMO蛋白最初以非成熟的无活性前体形式存在,由泛素样蛋白加工酶(ULPs)或SUMO特异性蛋白酶(SENPs)切除羧基末端的2~11个氨基酸延伸以暴露双甘氨酸残基而成熟。随后,在E1活化酶(由AOS1-UBA2组成的异二聚体)的作用下,SUMO的C末端羧基和UBA2的催化Cys残基之间形成硫酯键充当中间体,这一过程需要ATP的参与。接下来,该异二聚体通过酯交换反应将活化的SUMO转移到E2结合酶UBC9上。最后,UBC9通常与E3连接酶一起,通过在SUMO的C端Gly残基与目标蛋白的Lys侧链之间形成一个异肽键,将SUMO转移至底物。在哺乳动物中E3连接酶由PIAS家族蛋白基因编码,包括PIAS1、PIAS3、PIASxα、PIASxβ和PIASy 5种亚型[8]。
参与SUMO前体加工的ULPs/SENPs还具有将SUMO从底物中解离的作用,这一过程称为去SUMO化[9]。在人类中,已经鉴定出6个SENP成员:SENP1、SENP2、SENP3、SENP5、SENP6和SENP7[10-11]。根据亚细胞定位、序列同源性和底物特异性,可将其分为3个亚家族:SENP1和SENP2属于第一个亚家族,可以使SUMO1或SUMO2/3修饰的底物去SUMO化;第二个亚家族包括SENP3和SENP5;第三个亚家族由SENP6和SENP7组成,这两组优先使SUMO2/3与底物脱偶联。尽管蛋白质的SUMO化和去SUMO化之间处于微妙的平衡状态,但如何调节这一过程对于大多数底物来说仍然知之甚少。
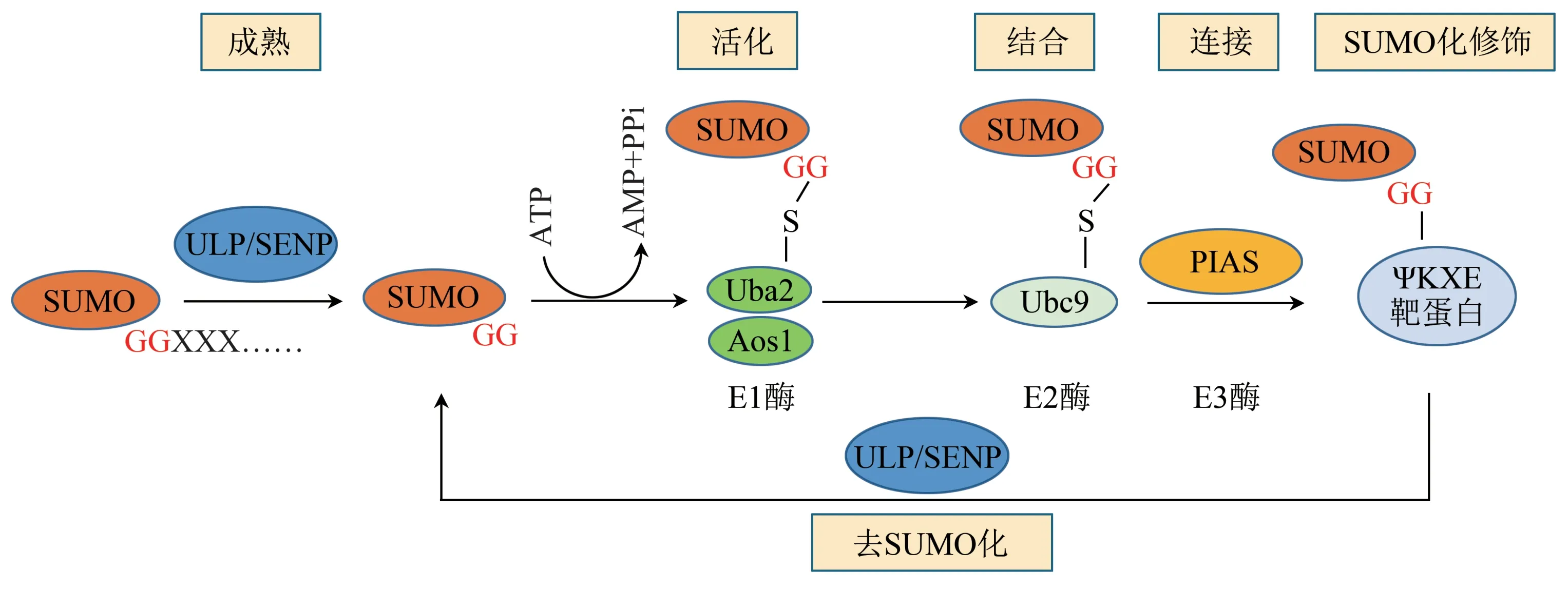
Fig.1 The mechanism of reversible sumoylation图1 可逆的SUMO化机制
2 SUMO化在哺乳动物发育中的功能
胚胎发育是一个复杂的过程,这一过程依赖于基因表达网络的精细协调。几种发育模型系统的使用已经确定了SUMO化在调控这一基因表达网络中扮演着重要角色,在多种生物的早期胚胎发育中发挥着重要作用。
SUMO途径的组成成分(包括SUMO、E2酶、E3酶和SENPs)在哺乳动物早期胚胎发育以及随后的器官发生过程中起着关键作用(表1)。下面将详细概述SUMO化修饰系统各组成成分在发育中的作用。
2.1 SUMO在哺乳动物发育中的作用
如上文所述,除了组织特异性表达的SUMO4外,哺乳动物体内主要表达3种蛋白(SUMO1~3)。在小鼠的整个胚胎发育过程中,SUMO1~3都广泛存在,但SUMO1似乎并不是胚胎发育的关键决定因素,因为SUMO1基因敲除小鼠是可以存活的,并且没有任何明显的表型[12-13]。Wang等[14]通过构建SUMO2和SUMO3基因敲除小鼠,证明SUMO2的缺失会导致胚胎致死,而SUMO3则无明显表型。此外,Yang等[15]通过用siRNA显微注射的方法敲低小鼠受精卵中SUMO2表达,发现体外囊胚发育率显著降低,推测SUMO2可能通过H3K27me3调节多能性基因OCT4、NANOG和SOX2的定位表达,从而影响小鼠植入前胚胎发育。
与 上 述 结 果 相 反,Alkuraya等[16]通 过 对SUMO1基因陷阱突变(RRQ016)小鼠进行研究,发现杂合子胚胎发育会产生颅面缺陷。SUMO1在颅面发育中作用最直接的证据表明是来自对一位患有唇腭裂的女性患者的染色体分析,发现其染色体2q和8q之间发生易位[16]。在2号染色体上定位断点显示编码SUMO1的基因发生了中断,并被预测会导致单倍体的缺失。并且已有研究发现,某些腭裂基因(如Eya1、Msx1和Tbx2等)与SUMO1的表达重叠,可作为SUMO化的底物[16-18]。总而言之,这些结果表明,SUMO1在小鼠颅面发育中具有重要作用。
有 趣 的 是,Lee等[19]的 研 究 结 果 发 现,SUMO1的过度表达对小鼠胚胎细胞系有毒害作用,存活的细胞群体通过降低游离SUMO1的水平来获得适应性,提示高浓度的SUMO1水平可能不利于早期胚胎发育。
2.2 UBC9在哺乳动物发育中的作用
UBC9是SUMO修饰途径中由单个基因编码的蛋白质,也是唯一的SUMO E2酶,其缺失会完全消除SUMO化。尽管针对不同物种描绘了不同的表型,但这些研究都证明UBC9从发育的早期阶段就发挥了至关重要的作用。它参与了有丝分裂的各个方面(包括染色体分离和完整性、细胞周期进程、动粒组装和胞质分裂等),这些功能最初是在酵母模型中观察获得的[20]。在小鼠胚胎发育中,UBC9的作用更为明显,表现为UBC9功能缺失的小鼠胚胎在染色体分离中显示出严重缺陷,并导致植入后早期胚胎死亡以及胚泡内细胞团细胞的选择性凋亡[21]。而Xu等[22]研究发现,当在体外培养的猪卵母细胞中添加不同浓度的UBC9时,随着UBC9浓度的增加,卵母细胞的成熟率、存活率以及囊胚形成率均显著降低,表明适宜浓度的UBC9对于早期的胚胎发育至关重要。
2.3 PIAS家族在哺乳动物发育中的作用
在SUMO途径的组成成分中,PIAS蛋白家族具有最大的多样性。PIAS蛋白通常以SUMO偶联无关的方式参与胚胎发育过程,并在发育过程中表现出特定的基因表达模式。Liu等[23]报道了PIAS1的缺失会导致小鼠胚胎致死,但缺乏进一步的研究。而Constanzo等[24]通过生成两个新颖的小鼠突变株(组成性或有条件地使PIAS1基因失活),并分析了处在不同发育阶段的胚胎,发现大约90%PIAS1缺失的胚胎在E10.5和E12.5之间死亡,并且卵黄囊的红细胞生成和血管生成存在缺陷。此外,由于心肌质量的损伤会损害胎儿发育过程中的心脏发育。已知Gata1和Gata4能发生SUMO化[25],并且其缺失会导致红细胞生成障碍和心脏发育异常[26-27],而PIAS1与Gata1/4共定位[24],表明可能是PIAS1促进了Gata1/4的SUMO化。Lee等[28]研究表明,PIAS1赋予了Msx1(一种同源盒基因,在发育过程中起调节细胞分化的作用)DNA结合特异性,从而有助于阻止成肌细胞前体的终末分化。此外,在胚胎发育过程中还会发生胚泡与子宫之间的对话,发育蛋白hedgehog(IHH)参与了这一过程。有研究表明,IHH的转录因子gli-krüppel家族成员Gli蛋白是SUMO1的靶标,而PIAS1的表达进一步增强了培养细胞和胚胎中Gli蛋白的转录活性,从而促进胚胎发育过程[29]。
PIAS3在小鼠视网膜发育中具有独特的表达模式。视网膜光感受器分为视杆和视锥两个亚型,在体视网膜发育过程中PIAS3的过度表达会促进视杆的分化并抑制视锥特异基因的表达[30]。此外,作者还发现PIAS3能结合CRX和NR2E3(视杆光感受器及其前体中共表达的两种转录因子),且PIAS3能催化NR2E3的SUMO化。他们另一项研究中发现,PIAS3在视锥细胞中也起作用,通过调节视锥视蛋白基因不同亚型的正确表达来保证色觉发育正常[31]。
在小鼠胚胎的2细胞阶段和人胚胎的4~8细胞阶段会发生合子基因组激活(ZGA)以确保随后的胚胎发育[32-34],ZGA期间的任何错误都可能导致胚胎发育终止,对生物体产生严重影响。据报道,转录因子双同源盒(DUX)可激活大量下游的ZGA转录物,其缺失会造成严重的植入前发育缺陷[35-36]。Yan等[37]研究确定了发育相关的转录因子多能性2和4(DPPA2/4)可直接上调DUX的表达来调控ZGA过程。此外,作者发现DPPA2可发生SUMO化,其活性受到PIASy(又被称为PIAS4)的负调控。Wong等[38]和Roth等[39]分别研究了PIASy敲除小鼠的特征,发现PIASy对小鼠的胚胎发生或成年生活不是必需的。胚胎没有明显的表型异常,表明存在其他PIAS蛋白的补偿作用。然而,受精卵中PIASy的过表达会导致严重的染色体分离异常和合子转录受损,在两细胞阶段引起发育 停 滞[37,40]。此 外,PIASy过 表 达 的 胚 胎 其H3K9me3的三甲基化水平更高,表明PIASy对于调控合子基因组激活和胚胎发育至关重要[40]。
2.4 SENPs在哺乳动物发育中的作用
SUMO特异性蛋白酶(SENPs)在调节SUMO化和去SUMO化的动态平衡之间发挥着重要作用,迄今为止所报道的SENP基因敲除小鼠的胚胎都不能存活直至出生,这表明SENPs没有冗余作用,具有特定的底物特异性。Yamaguchi等[41]通过在小鼠SENP1(SuPr-2)基因中插入逆转录病毒使得其表达降低,发现SUMO1的SUMO化水平显著提高,而SUMO2/3与靶蛋白结合水平无明显变化。Sharma等[42]的研究进一步验证了这一结果,表明SENP1对SUMO1具有特异性[43]。此外,还有报道SENP1功能完全失活的转基因小鼠由于缺氧诱导因子1α(HIF1α)的稳定性失调而发生造血缺陷[44]。无 独 有 偶,Caniggia等[45]研 究 发 现,SENP3通过调控SUMO2/3的SUMO化水平来调节HIF1α的稳定性,在人类胎盘发育中具有重要作用,从而确保了胎儿的正常生长。
SENP2与SENP1关系最密切,可以使SUMO1或SUMO2/3修饰的蛋白质解偶联[46]。Kang等[47]研究了SENP2敲除小鼠的表型,发现小鼠胚胎心脏发育发生缺陷,并且心脏发育所需的Gata4和Gata6表达降低。作者证明SENP2通过启动子Pc2/CBX4调节Gata4和Gata6的转录,对于调控胚胎发育中多梳基团蛋白介导的基因沉默至关重要。Yu等[48]研究发现,SENP2介导的胎盘形成需要SUMO2/3的存在,其缺失会造成严重的胎盘缺陷,并导致与心脏和大脑发育畸形相关的胚胎死亡。而最近的一项研究结果显示,SENP5在心脏结构的发育中也起着至关重要的作用[49]。他们发现,当妊娠母鼠处于缺锌状态时,会促使胚胎过度表达SENP5,从而导致心脏发育异常[49]。
此外,Huang等[50]研究发现,敲除SENP7基因会导致小鼠成熟卵子大量减少,并且胚胎出现分裂缺陷和进行性退化,从而确定了SENP7是胚胎发育程序的新决定因素。而SENP6在哺乳动物胚胎发育中的作用还未见详细报道,有待进一步研究。

Table 1 Roles of components of the SUMO pathway in development表1 SUMO通路的各组成成分在发育中的作用
3 总 结
SUMO化修饰是调节多种发育调节因子活性的一种非常有效的方式,这在对胚胎的相关研究中已得到证实。在所有已知影响细胞发育的机制中都存在SUMO化修饰,包括转录调控、蛋白质稳定性或蛋白质在细胞中的穿梭。SUMO化修饰过程受微环境和很多因素的诱导,主要功能为诱导胚胎发育及器官发生。此外,已有研究表明在卵巢、子宫等雌性生殖系统中也都涉及SUMO化修饰。在生理状况下发生的SUMO化修饰一旦失调,则可能引发生殖疾病。鉴于篇幅限制,本综述没有进一步阐述。
综上所述,SUMO化修饰对于了解正常的发育过程以及病理过程具有重要的意义,为研究防治一些生殖疾病提供新的思路和方法,未来值得进一步深入研究。

