油菜种子联合降解菌对多环芳烃污染土壤的修复*
赵琦慧 李法云 吝美霞 石 润
(1.上海应用技术大学生态技术与工程学院,上海 201418;2.上海城市路域生态工程技术研究中心,上海 201418;3.美丽中国与生态文明研究院(上海高校智库),上海 201418;4.湖南农业大学资源环境学院,湖南 长沙 410128)
在我国长三角、珠三角和环渤海区域石化产业分布密集,形成了三大石化产业集群。石化产业可导致大量多环芳烃(PAHs)排放[1]。据报道,排入环境的PAHs大部分进入到土壤环境中[2-5]。因此,受PAHs污染土壤迫切需要有效修复。
植物-微生物联合修复技术可以综合植物修复与微生物修复的优点[6-8]。有研究将睾丸酮丛毛单胞菌(Comamonastestosteroni)与羊草(Leymuschinensis)联合修复PAHs污染土壤,发现睾丸酮丛毛单胞菌可以在降解后期显著提高菲的降解效率,但对萘和苯并芘的降解效率只有小幅提高[9]。另有研究表明,固定化技术可能会提高微生物的环境适应能力,抵抗环境毒性,从而可能会对污染物的降解效率有所提高[10-11]。
本研究系统地研究了油菜(Brassicarapavar.chinensis(L.) Kitam.)种子(包括包衣和不包衣)和石油烃降解菌单一或联合修复对PAHs污染土壤的影响,并考虑了种子载体固定化降解菌,以期为构建植物与微生物共修复体系提供更多支撑和依据。
1 材料与方法
1.1 实验材料
清洁土壤采自上海应用技术大学植物园,pH为6.65。PAHs污染土壤采自辽河油田,pH为8.92,PAHs质量浓度为308.69 mg/kg。采集的土壤去除石块、动物残体和植物根系等杂质后过2 mm筛,备用。
作为填充材料的生物质炭由黄花菜秸秆在 500 ℃下炭化1 h后过0.075 mm筛制备得到。油菜种子来自湖南农业大学。包含假单胞菌(Pseudomonasadaceae)、芽孢杆菌(Bacillus)、微球菌(Micrococcus)、乳杆菌(Lactobacillus)、假丝酵母(Candida)、产碱杆菌(Alcaligenes)的石油烃复合菌剂来自安徽全民环保科技有限公司。蚯蚓粪有机肥来自上海温兴生物工程有限公司。
1.2 实验设计
种子载体固定化降解菌制备:以10 g/L海藻酸钠(SA)作为包埋剂、20 g/L CaCl2作为交联剂、100 mg/L萘乙酸(NAA)作为生长调节剂、10 g/L聚乙烯醇(PVA)作为保水剂、5 g/L生物质炭作为填充材料形成混合胶状液体;将混合胶状液体与复合菌剂均匀混合;经次氯酸钠消毒的油菜种子包埋在其中,用吸管吸取包埋种子滴入CaCl2溶液,在冰水浴中固定2 h,形成种子载体固定化降解菌。若不加复合菌剂形成的就是包衣种子。
清洁土壤与污染土壤混合配制成PAHs质量浓度为44.29 mg/kg的实验土壤。称取600 g实验土壤于花盆(高12 cm、直径13 cm)中,调节土壤含水率为60%,放置于上海应用技术大学植物园玻璃温室。实验设置5个处理,T1种植油菜包衣种子,T2在土壤中只接种复合菌剂,T3种植油菜包衣种子并在土壤中接种复合菌剂,T4接种油菜种子载体固定化降解菌,T5种植油菜种子并接种复合菌剂,所有实验组均施用土壤质量分数5%的蚯蚓粪有机肥,不进行任何处理的实验土壤作为对照处理(见表1)。第50天收取植物,并采集实验土壤,风干过筛供污染物含量分析。

表1 实验设计的不同处理
1.3 测定指标及方法
植物生理生长指标:油菜收获前测量叶长、叶宽;用LI-6400便携式光合作用测量系统测定光合速率和蒸腾速率;在叶片上取直径为1 cm的圆片3片,在95%(体积分数)乙醇中避光浸泡至完全脱色(一般24 h),分别在470、646、663 nm用分光光度法测定类胡萝卜素、叶绿素a、叶绿素b含量。油菜收获后用蒸馏水洗净,擦干后称生物量,同时测量根长、茎长。
土壤pH的测定:称取10.0 g风干土壤于50 mL离心管中,加入25 mL蒸馏水,以180 r/min振荡5 min后用pH计测定上清液pH。
PAHs的提取和分析参照《土壤和沉积物 多环芳烃的测定 气相色谱—质谱法》(HJ 805—2016),索氏提取土壤中的PAHs后过硅酸镁小柱净化,用Agilent 7890B/5977B气相色谱—质谱联用仪测定PAHs成分和含量。
1.4 数据分析方法
采用SPSS 16.0进行单因素方差分析(P<0.05),显著性检验采用邓肯(Duncan)法,数据用不同小写字母标注表示差异显著,用相同小写字母标注表示差异不显著。
2 结果与分析
2.1 油菜的生理生长情况
从表2比较T5和T3发现,T3比T5生物量显著增加了21.62%,说明包衣处理后的种子从包衣材料中可以获得更多营养物质,外壳保护又减少了污染物对其毒害作用,而T3比T5根长显著减少了13.48%,进一步说明未包衣的种子需要伸长根长来获取更多营养物质。T3与T1相比,接种复合菌剂后由于对污染物的降解作用使得叶长、叶宽、茎长、根长和生物量都有所增加。比较T4和T3发现,将降解菌固定化处理后,叶长、叶宽、茎长和生物量显著减少。
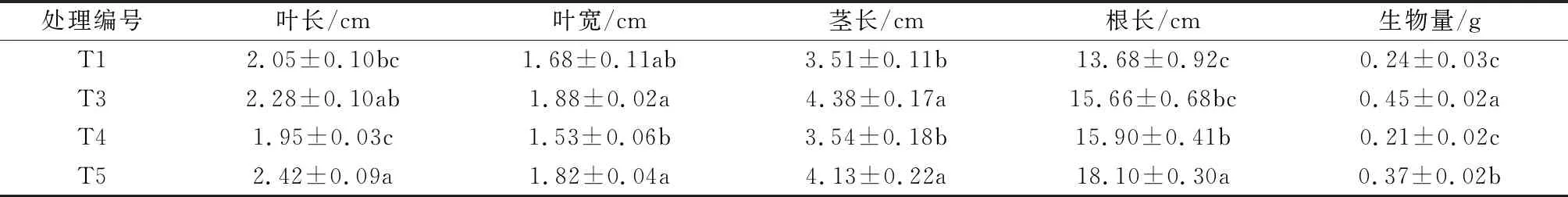
表2 油菜的根茎叶生长情况
由图1可知,无论是光合速率还是蒸腾速率都是T3最大。有机污染物对植物具有抑制效应,接种降解菌后由于降解菌可以降解PAHs,因此光合速率、蒸腾速率明显提升了,并且种子包衣处理后的植株光合速率与蒸腾速率高于裸露种子发育的植株,说明包衣处理有利于种子萌发及植株的生长发育,但将降解菌固定化会影响降解菌效果发挥。

图1 油菜的光合速率和蒸腾速率
种子包衣处理的油菜较裸露种子发育的植株色素含量有所提升,但固定化与否似乎对色素的影响不大(见表3)。
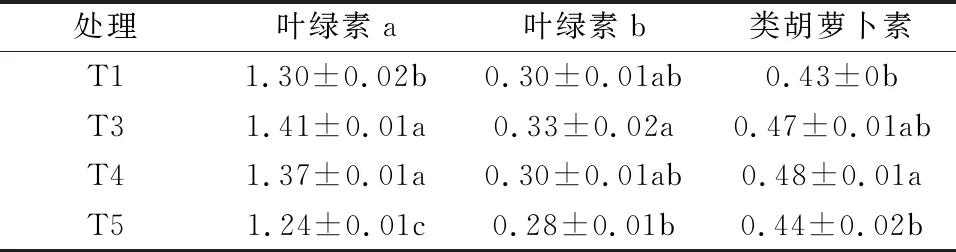
表3 油菜色素质量浓度
2.2 实验土壤pH差异
由图2可见,收取植物后对照组实验土壤的pH最高,这是因为污染土壤采自辽河油田石油,本身pH较高,为8.92。其余处理的pH相对对照组均有降低,其中T2无植物实验土壤的pH高于其他有植物实验土壤,而T1、T3、T4和T5实验土壤pH较CK分别显著降低了1.86%、1.61%、2.60%、1.73%,这是因为油菜的根系会分泌有机酸和腐殖质类物质,可以降低土壤pH。此外,添加降解菌和有机肥也可能改善土壤盐碱环境,使得土壤pH较自然降解情况下降低。

图2 实验土壤pH
2.3 对PAHs的去除效果
由表4可见,实验组的总PAHs都低于对照组,特别是T3、T4、T5联合修复的3个处理与对照组相比差异显著,T3残留的总PAHs质量浓度最低,为(3.88±0.61) mg/kg,比CK降低了55.25%。其中,各组低环PAHs质量浓度为1.99~4.61 mg/kg,高环PAHs为1.70~4.06 mg/kg。T1、T2和T5表现为高环PAHs含量大于低环PAHs,其余处理均表现为低环PAHs含量大于高环PAHs。在T1中,由于油菜对PAHs的吸收作用,与CK相比低环PAHs降低了53.14%,高环PAHs降低了22.66%。T2只接种了降解菌,该降解菌表现出对低环和高环PAHs相似的去除效果,其中低环PAHs比CK降低了19.09%,而高环PAHs降低了17.98%。T3既种植油菜也接种降解菌,低环和高环PAHs含量较对照都大幅降低,其中低环降低了52.71%,高环降低了58.13%。由此可以看出,油菜的种植对低环PAHs去除作用较明显,接种降解菌可以更好地去除高环PAHs,植物与微生物之间起到相互促进、互为补充的作用。T4经油菜种子载体固定化降解菌处理后,PAHs的含量相比T3反而又有所增加,不过T3~T5残留的总PAHs浓度差异不大。
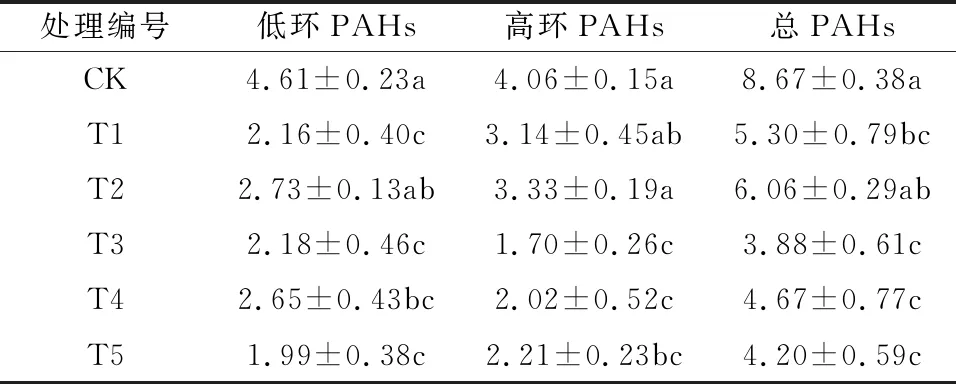
表4 实验土壤中残留的PAHs质量浓度1)
3 讨 论
本研究比较了植物与微生物单一或联合去除污染土壤中PAHs的效果。首先,土壤中的PAHs在自然条件下也会通过风化、挥发、光降解和微生物降解等作用而去除[12]。植物修复和微生物修复都能提升PAHs的去除率。油菜单独处理主要对2~3环的低环PAHs效果较好,这是因为植物对小分子物质的吸收效果更好。有研究表明,植物根系吸收并传输到地上部分的PAHs多为低环PAHs,高环PAHs因水溶性低,不易被植物吸收,更很难通过木质部向上运输[13]。已有研究表明,除植物吸收PAHs外,联合微生物修复往往能促进植物生长和提高PAHs的去除[14]。游离降解菌对植物生长表现出促进作用,在植物叶长、叶宽、根长和茎长上都有体现[15]。但将降解菌固定化处理后,油菜的生理生长表现变差,可能的原因是降解菌突破包衣与外界土壤接触可能会延缓,因此在同样的修复周期内植物生长就延迟,导致收获的生物量减少;另一可能的原因是,降解菌包埋在种子载体的包衣内,凝胶无法及时转运代谢产物,导致大量幼苗根系分泌物和降解菌代谢废物积累,使得植物生长受到抑制[16-17]。
将油菜与降解菌联合起来后,土壤中PAHs(无论是低环还是高环)含量都出现大幅下降,可见植物联合微生修复可以结合植物吸收与微生物降解的优点,既发挥了植物根系对污染物的吸收作用,又利用了根际微生物与植物根系的共生作用,可提高降解菌的降解效果,因此去除效果好[18]。油菜联合降解菌修复的T3、T4和T5处理对PAHs去除效果均优于单一修复,其中油菜包衣种子种植并接种复合菌剂的处理效果最佳,将降解菌固定化后,去除效果反而下降,这同样可能是因为凝胶包衣对降解菌利用有机污染物形成了障碍。
4 结 论
(1) 油菜包衣种子较未包衣种子的植株生物量增加,叶宽和茎长增长,色素含量增多,光合速率加快。
(2) 油菜联合降解菌可以互相促进、互为补充,从而显著提高生物量和光合速率等,对PAHs的降解效果增强,并可改善土壤pH,但将降解菌固定化的效果不如让降解菌游离化。
(3) 油菜对低环PAHs去除效果较好,主要是吸收作用;而降解菌可以更好地通过降解作用去除高环PAHs。

