宫颈癌细胞PAX1 基因甲基化的CRISPR 靶向调控系统的构建
张文帆,杨金豪,陈爽,时淑娟,王蓉
(1.天津医科大学医学检验学院,300203 天津;2.天津医科大学基础医学院解剖教研室,300070 天津)
配对基因盒1(paired box1,PAX1)基因属于Pax家族,是一种重要的转录因子[1],参与骨骼的发育形成[2]。早期研究表明,PAX1 基因在脊柱畸形[3]的发生、胸腺及甲状旁腺器官发育中上皮细胞的死亡及增殖[4-5]中发挥重要作用。近来,随着对DNA 甲基化的深入研究,PAX1 基因高甲基化与宫颈癌发生的相关性被广为报道[6]。此外,PAX1 基因甲基化与卵巢癌[7]、甲状旁腺癌[8]、口腔鳞癌[9]、头颈癌[10]、食管鳞癌[11]等的关系亦有报道。
DNA 甲基化引起的基因异常表达是一个可逆的过程,这为肿瘤的治疗提供了希望。但由于缺乏特异性干扰基因甲基化的靶向调控工具,限制了其药物的临床应用和甲基化基因标志物功能的深入研究。而CRISPR(Clustered regularly interspaced short palindromic repeats)技术的诞生则为解决以上这些研究难点带来了曙光。此外,CRISPR 系统里具有“剪刀”功能的Cas9 蛋白可被改造成dCas9(dead Cas9),既保留了与靶位点结合的功能,还可以附加激活[12]、抑制[13]、加甲基化和去甲基化[14]等效应分子,变成具有调控基因表达功能的工具,这为靶向甲基化基因的功能研究及药物开发开辟了道路。因此,本研究旨在采用最新的CRISPR 技术构建靶向宫颈癌PAX1 基因甲基化的调控系统,为后续的靶向治疗和基因功能的研究奠定基础。
1 材料和方法
1.1 细胞培养 人宫颈癌细胞CaSki(HPV18+)及SiHa(HPV16+)细胞系,正常细胞(人胚肾细胞HEK293T)(购自中舟新乔,上海),在含有10%胎牛血清(BI,美国)、100 U/mL 青霉素和100 mg/mL 链霉素(索莱宝,北京)的RPMI 1640、MEM、DMEM(HyClone,美国)培养基中分别进行培养。
1.2 单导向RNA(single guide RNA,sgRNA)设计、合成及质粒转染 经CRISPR-EAR 在线网站(http://crispr-era.stanford.edu/)[15]设计靶向PAX1 基因启动子区域的sgRNA,选取评分较高的4 个用于激活基因表达的sgRNA(act-sgRNA)(表1),通过Q5 超保真聚合酶(NEB,美国)进行体外两步PCR 法合成,纯化后存于-20℃。质粒Fuw-dCas9-Tet1CD(dCas9 -Tet1,#84475),Fuw -dCas9 -Tet1CD_IM(dCas9-Tet1m,Tet1 突变体,#84479)均来自于Addgene[14]。将每孔5×105个的细胞接种到6 孔板,24 h 后在6 孔板中共转染dCas9-Tet1CD(实验组)或dCas9-Tet1m(对照组)和单独或组合的actsgRNA,48 h 后加入含有zeocin(Invitrogen,美国)的培养基进行筛选。3 d 后收集细胞,分别提取DNA和RNA。
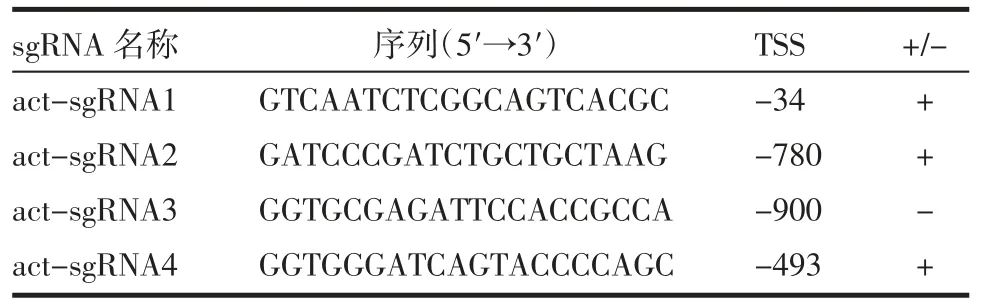
表1 用于靶向激活PAX1 基因表达的sgRNA 序列Tab 1 The sgRNA sequences for targeted activation of PAX1 expression
1.3 RNA 提取及荧光定量PCR(Real time PCR,RTPCR)用Trizol 试剂(Inviterogen,美国)提取细胞的总RNA,并使用Nano Drop2000c 检测RNA 的浓度和质量,取1 800 ng RNA 根据FastQuant RT 试剂盒(天根,中国)说明书进行逆转,以cDNA 为模板,采用SYBR green 试剂盒检测mRNA 的表达(GADPH 为内参),引物序列见表2。

表2 RT-PCR 引物Tab 2 The primers for RT-PCR
1.4 DNA 的亚硫酸处理(BS)和甲基化特异性PCR(MSP)DNA 提取同前所述采用氯酚法[16]。将抽提的DNA 通过Nano Drop2000c 进行浓度和质量检测后,健康女性的白细胞DNA 作为阴性对照(Leu),健康女性白细胞DNA 进行体外加甲基后作为阳性对照(IV)。参照EZ DNA Methylation Kit(Zymo Research)试剂盒说明书进行重亚硫酸氢盐处理。上述BS 后的DNA 为模板,使用Methyl primer express软件进行引物合成,序列见表3。采用Amplitaqgold酶(ABI,美国)进行PCR 反应,反应条件为:95℃预变性,5 min;94℃30 s,60℃30 s,72℃40 s,共40 个循环,72℃延伸10 min。反应产物用2%的琼脂糖凝胶电泳,Bio-Rad 成像分析仪观察结果。
1.5 焦磷酸测序(Pyrosequencing)用PyroMark Assay Design 2.0 软件进行引物设计(表3),对下游引物5'端进行生物素标记,以BS 后的DNA 为模板优化条件并进行PCR 扩增。按照PyroMark Q24 焦磷酸测序仪中甲基化分析要求对PCR 产物进行测序。

表3 MSP 及焦磷酸测序所用引物Tab 3 The primers for MSP and Pyro sequences
1.6 脱靶效应检测 通过在线工具COSMID(https://crispr.bme.gatech.edu/)[17]对PAX1-act-sgRNA3 的脱靶基因进行预测,选取具有脱靶可能的Top5 个基因,通过RT-PCR 检测5 个基因在实验组及对照组的表达差异,引物见表4。
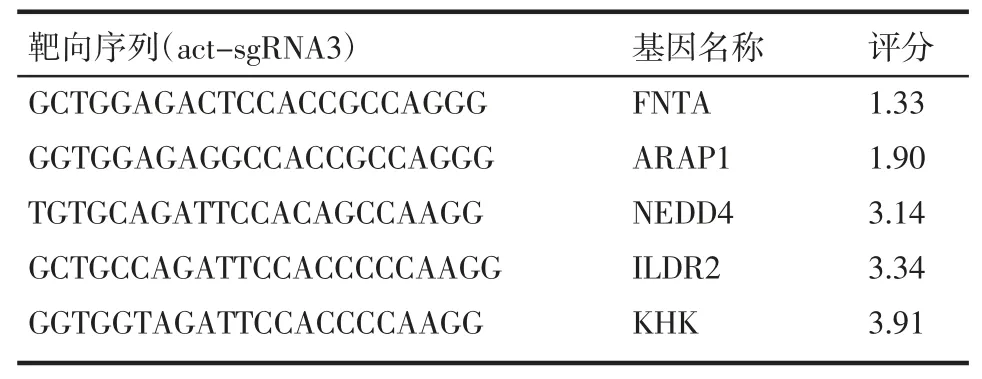
表4 脱靶效应评分较高的前5 个基因Tab 4 The top 5 genes with high off-target effect score
1.7 免疫印迹(Western blotting)细胞经RIPA 裂解液裂解后分离并提取蛋白,利用BCA 法定量检测蛋白含量,配置浓度为10%的SDS-PAGE 凝胶,每个加样孔均加入等质量的蛋白,电泳后转印至硝酸纤维素膜上,并置于5%的脱脂牛奶内封闭1.5 h,分别加入稀释的一抗:GAPDH(Bioss),PAX1(Abcam)过夜孵育,第2 天加入对应种属性的二抗,漂洗后加入ECL 发光试剂,置于Bio-Rad 凝胶成像仪成像,并通Image J 进行灰度值分析。
1.8 统计学处理 采用Graphpad Prism8.0 统计软件对数据进行统计分析。计量资料经正态性检验,符合正态分布的用表示,两组间表达差异比较采用t 检验,不符合正态分布的采用Mann-Whitney U 检验进行分析。P<0.05 为差异有统计学意义。
2 结果
2.1 PAX1 基因的启动子甲基化及表达水平验证MSP 结果表明PAX1 基因启动子在宫颈癌细胞CaSki 和SiHa 中呈现高甲基化,而在正常细胞HEK293T 细胞中呈现未甲基化(图1A)。在转录水平,PAX1 在宫颈癌细胞的表达显著低于HEK293T细胞(CaSki:t=9.13,SiHa:t=12.31,P<0.05)(图1B),同样,PAX1 在宫颈癌细胞的蛋白表达水平亦低于HEK293T 细胞(CaSki:t=16.72,SiHa:t=11.81,P<0.05)(图1C)。

图1 细胞系中PAX1 基因甲基化及表达水平验证Fig 1 Validation the methylation and expression level of PAX1 in cells
2.2 靶向激活PAX1 基因表达,降低其启动子的甲基化水平 将dCas9-Tet1 与4 个act-sgRNA 单独或联合共转染后,CaSki 细胞系中,相对于对照组,实验组act-sgRNA2、sgRNA3、sgRNA4 及sgRNA1+2+3+4 共转染组的PAX1 表达分别增加了3.49、35.95、33.63 及6.50 倍(t=5.84、11.16、9.79、8.72,均P<0.05),其中act-sgRNA3 组的上调作用最显著(图2A)。Pyrosequencing 结果表明相对于对照组,实验组的甲基化水平平均下降了22.21%(t=6.65,P<0.05)(图2B、2C)。
在SiHa 细胞中act-sgRNA2、sgRNA3、sgRNA4及sgRNA 共转染(sgRNA1+2+3+4)组的PAX1 表达相对于对照组分别增加了13.35、19.62、3.43 及5.29 倍(t=3.76、6.34、4.53、14.96,均P<0.05)(图2D),其中act-sgRNA3 组上调最明显。定量检测PAX1 基因甲基化水平后,其甲基化水平平均下降了19.62%(t=17.00,P<0.05)(图2E、2F)。

图2 基于dCas9-Tet1 靶向降低PAX1 基因启动子甲基化水平Fig 2 Targeted downregulated of the promter of PAX1 methylation based on dCas9-Tet1
2.3 脱靶效应验证 通过在线工具COSMID 预测调控效果最为明显的act-sgRNA3 实验组存在的脱靶基因,并选择Top 5 基因:FNTA、ARAP1、NEDD4、ILDR2 和KHK。其RT-PCR 结果表明,相对于对照组,CaSki 细胞中FNTA 基因表达上调了1.38 倍(t=8.68,P<0.05),SiHa 细胞中APAR1、NEDD4 基因分别是对照组的0.79、0.85 倍(t=5.00、9.41,P<0.05),其他未见显著变化,见图3。

图3 对dCas9-Tet1+act-sgRNA3 组合的脱靶效应检测Fig 3 Detection of off-target effect of dCas9-Tet1 and act-sgRNA3
3 讨论
宫颈癌是最常见的女性癌症之一,我国宫颈癌发病率占全球发病率的20.2%,并以每年10.5% 的速率增长,而且逐步年轻化,严重威胁我国女性的健康[18]。既往研究表明,PAX1 基因高甲基化与宫颈癌之间存在密切的联系[19]。其甲基化程度在宫颈癌不同病变时期中存在差异,在早期对指导宫颈癌患者进行特异性治疗有一定临床作用。靶向调控PAX1 基因甲基化水平为后期宫颈癌的精准治疗提供了思路。目前,美国食品与药品监督管理局(FDA)已批准了DNA 甲基化抑制剂如5-Aza-2-deoxycytidine(5'-Aza)等药物应用于败血病和淋巴瘤患者的治疗[20],但该类药物存在易获得耐药,在实体瘤中疗效较差,且缺乏特异性等诸多缺陷[21]。Zhang 等[22]亦发现在宫颈癌细胞中敲低DNA 甲基化转移酶DNMT1,虽可降低PAX1 基因的甲基化水平,增加其表达,但其特异性较差,其他基因亦被调控。
近来,有研究尝试利用CRISPR-dCas9-Tet1/DNMT3a 工具特异性调控Tau、TRIM58 基因的甲基化水平,从而为阿尔兹海默病[23]、肾透明细胞癌[24]等疾病的靶向治疗提供了新的思路。然而,在宫颈癌领域还未见报道,因此,本研究首次采用CRISPR 技术成功构建了激活PAX1 内源性表达的靶向基因甲基化的调控系统,为后续研究奠定了理论和实验基础。
DNA 甲基化主要发生在碱基胞嘧啶第5 位碳原子上,称为5-甲基胞嘧啶(5-methylcytosine,5-mC)[25]。研究发现,DNA 甲基化是可逆且呈动态变化的,主要由DNA 甲基化转移酶(DNMTs)和羟甲基化酶(Tets)动态调节[26]。DNMT1 和DNMT3A/3B 分别负责DNA 甲基化的建立和维持,而Tet 蛋白通过连续氧化将5-mC 转化为5-羟甲基胞嘧啶进而5-甲酰基胞嘧啶再而5-羧基胞嘧啶,然后被胸腺嘧啶DNA 糖基化酶(TDG)识别并消化,从而实现DNA 去甲基化[27]。Zhang 等[22]发现在宫颈癌细胞系HeLa 及SiHa 细胞中直接敲除DNMT1 后PAX1 的基因表达则分别是对照组的4.98、2.88 倍。而本研究将具有催化活性的Tet1 融合到dCas9 上,在特异性sgRNA 指导下,靶向PAX1 基因启动子区域进行去甲基化调控。结果表明,在CaSki 及SiHa 细胞中,单一act-sgRNA3 组有效的降低了PAX1 基因的甲基化水平,在CaSki 及SiHa 细胞中甲基化平均水平均降低。由此可见,本研究构建的CRISPR 系统的基因靶向干扰技术具有较高的调控效能。
此外,由于CRISPR 的脱靶效应一直是人们关注的问题,脱靶效应在治疗时可能对非靶向基因造成影响,带来不可预控的严重后果。既往研究表明提高sgRNA 的特异性可有效降低CRISPR 的脱靶效应[28-29]。Liu 等[30]发现,靶向启动子可设计特异性更高的sgRNA 并减少dCas9-Tet1 的潜在脱靶结合。因此,本研究通过CRISPR-ERA 在线工具,选择靶向于PAX1 基因启动子区域且特异性评分较高的sgRNA,最大程度减少CRISPR 系统的脱靶效应。目前检测CRISPR 脱靶效应的方法主要有模拟计算预测和基础研究实验方法[31]。本研究则结合计算预测和实验验证,通过COMSID 工具预测了act-sgRNA3的脱靶基因,并对act-sgRNA3 的脱靶效应进行了实验验证。结果表明,与对照组相比,实验组中脱靶基因的表达差异均小于2 倍,明显低于靶基因PAX1 上调的倍数,证明了本研究所用系统的脱靶效应较小。
CRISPR 甲基化调控系统在特异性的降低基因启动子甲基化水平的同时,可激活靶基因内源性的表达。既往研究发现,内源性基因表达具有独特的转录组和内源性表达水平[32]。根据UCSC(https://genome.ucsc.edu/),PAX1 基因具有3 种异构体和各种单核苷酸多态性(SNPs)。不同的SNPs 在神经嵴发育和青少年特发性脊柱侧凸中发挥不同的作用[33]。因此,激活内源性PAX1 表达对于观察细胞内部的真实情况是必要的。通过CRISPR 基因编辑技术内源性调控靶基因的表达,在精确治疗方面有很大的潜力。
综上所述,对宫颈癌中PAX1 基因的甲基化进行调控可有效地改变其表达水平。本研究建立的靶向PAX1 基因甲基化调控的工具对今后宫颈癌的靶向治疗具有重要的意义和价值。本课题组也将基于上述甲基化调控系统对PAX1 基因甲基化机制继续开展实验研究,为后续PAX1 甲基化对宫颈癌治疗潜力的挖掘奠定基础。

