PD-1抑制剂治疗相关中枢性尿崩症1例
孙蕾蕾,卞晓山,徐铠臻,王 飞,刘 红,赵丽慧
免疫检查点抑制剂 (immune checkpoint inhibitors, ICI)已成为治疗血液病和肿瘤的重要药物。免疫检查点作为免疫抑制分子,可避免T细胞过度激活导致的正常组织损伤和破坏。常见的免疫检查点包括细胞毒性T淋巴细胞相关抗原(cytotoxic T lymphocyte-associated antigen-4, CTLA-4)和程序性死亡蛋白-1(programmed cell death protein-1,PD-1),二者分别作用于免疫应答的起始阶段和效应阶段,抑制T细胞的活化及杀伤功能。ICI通过阻断CTLA-4通路、PD-1通路,上调抗肿瘤免疫应答,进而杀伤肿瘤细胞。
ICI调控免疫应答杀伤肿瘤的同时,过度活化的免疫细胞也可能导致机体产生自身免疫损伤,即免疫相关不良反应(immune-related adverse events, irAEs),可累及皮肤、肌肉、心血管系统、消化系统、神经系统、内分泌系统等多器官。内分泌系统irAES主要涉及垂体、甲状腺、胰腺、肾上腺等内分泌腺体,其中与垂体激素产生/释放有关的irAEs主要表现为一种或多种激素缺乏,垂体后叶激素缺乏极为罕见。irAEs引起抗利尿激素缺乏导致中枢性尿崩症(central diabetes insipidus,CDI)的病例,国外报道11例,国内4例,其中9例是全垂体炎背景下诊断的CDI,1例伴随垂体前叶转移,只有5例仅表现为尿崩症。在这5例中,2例与CTLA-4抑制剂联合PD-1抑制剂有关,2例与PD-1抑制剂有关,1例与PD-L1抑制剂有关。本文报告1例接受PD-1抑制剂治疗后表现为CDI的个案。
1 病例报告
患者,男,诊断CDI时64岁,于2017-06-07以“无明显诱因咳嗽、憋喘数月”就诊。行肺部CT示左肺下叶占位并纵隔淋巴结转移;电子支气管镜气管刷检物见部分癌细胞,免疫组化为CK7(+)、TTF-1(+)、CK5/6(-)、P40(-)、Ki-67阳性率为30%~40%;病理诊断腺癌。2017-06-13行基因检测EGFR基因示外显子18、19、20、21均为野生型。2017-06-15加入QL1101项目QL1101-002临床试验,接受QL1101/安维汀+紫杉醇+卡铂方案化疗2周期。7月31日复查CT,按RECIST标准评价部分缓解,继续该方案化疗4周期。2017-10-16查白细胞计数1.94×10/L,中性粒细胞计数0.46×10/L,复查疾病稳定,给予QL1101单药维持。
2018-01-20复查疾病进展,考虑QL1101单药治疗无效,退出试验研究,予多西他赛+替吉奥化疗1周期。2018-04-12予培美曲塞+顺铂方案化疗1周期,随后自服中药(具体成分不详细)治疗。2018-12-22予培美曲塞+奈达铂方案化疗6周期。2019-05-13复查疾病稳定,予培美曲塞单药2周期化疗,后患者自行停止治疗。
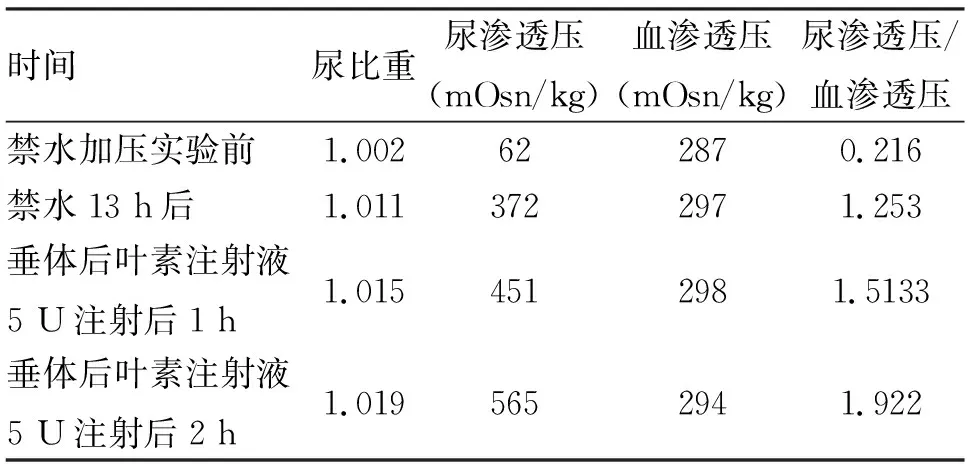
2019-12-29复查疾病进展,予培美曲塞+奈达铂化疗7周期。7周期治疗后评估病情,疾病进展,予安罗替尼(10 mg)治疗2周期后门诊复查CT,疾病进展,遂于2020-11-13开始行信迪利单抗免疫治疗(200 mg,1次/3周)至2021-07-01。患者于2021-06开始出现烦渴、多饮、多尿,于2017-06-25查尿渗透压71 mOsm/kg,血清渗透压277 mOsm/kg。转入内分泌科,此时诊断为:左肺腺癌 肺、肝、胸膜、肾上腺转移、骨转移CT×Ⅳ×MI,Ⅳ期,尿崩症。行垂体MRI:垂体高度约7 mm,上缘稍膨隆,垂体信号均匀,后叶TWI高信号未见显示,垂体柄居中,蝶鞍无扩大,视交叉及双侧海绵窦信号未见异常,轴位TWI序列显示双侧大脑半球白质区见斑点状长T长T信号,脑室系统形态及信号未见异常,检查结论为垂体后叶TWI高信号未显示;考虑脑内缺血变性灶。行禁水加压试验(表1),并完善垂体前叶部分激素化验(人生长激素0.536 ng/ml,正常范围0~1.41 ng/ml;胰岛素样生长因子-Ⅰ 132.91 ng/ml,正常范围75~223 ng/ml),诊断为部分性CDI。给予醋酸去氨加压素片(弥凝,辉凌制药)治疗,0.05 mg,口服,1次/d,尿量明显减少,后转入化疗科。2021-07-10予伊立替康 280 mg 化疗1周期。患者出院后未规律口服弥凝。于2021-08-09因“多尿、多饮、烦渴”再度入院,行垂体MRI平扫:垂体形态饱满,高度9 mm,神经垂体与腺垂体分界欠清,垂体柄居中,双侧海绵窦及视交叉未见明显异常。患者及家属否认DI家族史,否认精神性疾病病史、颅脑外伤或手术史,否认脑炎或脑膜炎病史,否认巨细胞病毒(CMV)视网膜炎病史,否认癫痫病史,否认卡马西平、两性霉素B、西多福韦、膦甲酸等用药史。查体无明显体毛脱落或第二性征萎缩等体征。在积极纠正患者一般情况的同时,继续给予弥凝口服,患者多饮、多尿情况较前好转,但已出现多处扩散,患者于2021-08-26出院,出院后半月余去世。
2 讨 论
CDI是由于精氨酸加压素(arginine vasopressin, AVP)神经元分泌AVP受损导致血浆AVP水平降低引起尿渗透压降低、尿量增加的一种内分泌疾病。当神经垂体仍保留有10%~20%的正常AVP分泌能力时,患者表现为部分性CDI。CDI病因多样:下丘脑、神经垂体及附近部位肿瘤、转移性肿瘤、头颅创伤、脑部感染性疾病、先天畸形、缺血、化学性中毒、全身炎症、自身免疫、Langerhans组织细胞增生症或其他肉芽肿病变等;少数CDI有家族史,还有约30%为特发性。本病例结合禁水加压实验结果及垂体MRI表现,可确诊为部分性CDI。关于CDI病因的诊断,病理活检是金标准,血浆AVP或血浆和肽素也意义明确,但二者均因技术、经济等原因无法进行。
该患者查体无明显体毛脱落或第二性征萎缩等体征,结合垂体前叶部分激素的测定,可排除全垂体炎。该患者在诊断CDI时的MRI检查尚无下丘脑或垂体占位、畸形、缺血的影像学表现,且2021-06的专科出入院病案亦没有脑部占位的相关记录,故下丘脑及垂体附近的原发肿瘤、转移性肿瘤、先天畸形、缺血等病因可基本排除。该患者无尿崩症家族史,无颅脑创伤、脑部感染性疾病、化学性中毒病史,相关病因可以排除。
文献[13]把Langerhans组织细胞增生症或其他肉芽肿病变、血管病变作为垂体炎的相关病因。但此类疾病发病机制尚未明确,确诊需要病理活检,相关性的尿崩症罕见,只有少量的病例报道。本病例无法从病理上排除以上病因,但发病年龄、病程发展等均不支持。本病例不排除不可检测的颅外肿瘤微转移、微病灶。颅外肿瘤的垂体转移率为1%~1.5%,尸检结果显示垂体转移率为1.9%,且在垂体转移性肿瘤患者中,50.7%存在神经垂体受累,男性病例以肺癌转移多见。但是,微转移、微病灶几乎不会导致神经垂体的严重损伤,以至于AVP分泌能力不足20%,表现出部分性CDI。
ICI相关尿崩症多发生于用药的5~36周。本例患者在使用PD-1抑制剂26周左右出现烦渴、多饮、多尿,禁水加压试验和垂体MRI记录明确,使用醋酸去氨加压素治疗后,患者症状明显缓解,结合患者PD-1抑制剂治疗史,考虑患者尿崩症为ICI相关垂体炎所致,而且为少见的垂体后叶受累。
ICI诱导垂体炎的确切发病机制尚不清楚。根据现有的病例报道推测其发病机制可能包括CD45+淋巴细胞活性增加、垂体前叶细胞血清抗体水平增高、IL-17通路的激活等。值得注意的是:在使用CTLA-4抑制剂和PD-1抑制剂的患者中,垂体炎的发生率分别为5.6%~6.4%和0.5%~1.1%,而两药联用时,该疾病的发生率为8.8%~10.5%。因此,大部分关于ICI诱导垂体损伤发病机制的数据都来自于CTLA-4抑制剂的应用,且这些机制多发生在垂体前叶。Okabe等在研究1例尼鲁单抗(PD-L1抑制剂)单药治疗相关的垂体炎病例时,做了第1例ICI相关垂体炎的尸检,发现在一些垂体细胞上存在PD-L1表达。
目前关于PD-1抑制剂相关性CDI的个案报道较少,随着多种新型抗肿瘤药物的研发和应用,irAEs在肿瘤患者的治疗和随访过程中应提高重视,这有利于不良反应的早发现、早诊断、早治疗,对提高患者的生存质量十分重要。

