烷氧基三联吡啶钌配合物的合成、结构及其与DNA相互作用
郭 辉汪 涛苏文卿李 丹陈兴星吴杰颖张 琼*,,3田玉鹏*,,3
(1安徽大学化学系,功能无机材料化学安徽省重点实验室,合肥230601)
(2安徽大学生命科学学院,合肥230601)
(3南京大学配位化学国家重点实验室,南京210023)
许多钌、铱、铂等贵金属配合物具有良好的生物特性[1-3],其中最受关注的是Ruギ配合物,该类配合物具有d6电子构型,有多种电子组态和电荷跃迁方式,形成的配合物光物理信息丰富,热力学稳定性高,且具有低毒性、易吸收等优点,被广泛应用于生物领域[4-8]。Ruギ配合物中,多吡啶类钌配合物易于构筑结构繁多的八面体构型,这类配合物可以识别DNA的二级结构,可作为DNA结构探针[9-11],近年来在抗癌药物的研发中崭露头角。
中山大学计亮年院士和巢晖课题组在该领域取得了显著成绩[12-14],他们设计、合成了一系列不对称钌配合物,可与DNA以2种方式结合[15]。配合物与DNA存在多种结合方式,DNA的双螺旋结构是由磷酸残基和脱氧核糖组成,其中磷酸带负电,可以和带正电的离子以静电引力结合,当配合物具有一个平面性较好的配体时,配合物就可以插入DNA分子的碱基对或双螺旋沟槽之中发生插入作用,同时还存在疏水作用、氢键等结合方式。我们希望通过对配体的修饰得到具有良好光物理性质和生物相容性的钌配合物[16-17]。因此,设计、合成了一种含柔性链的烷氧基三联吡啶配体,并与钌ギ配位。所制备的配合物不仅具有良好的刚性平面,可以很好地插入DNA分子,还含有氯离子或溶剂分子,更易与DNA静电结合[18-19];而且烷氧链和BF4-、PF6
-的引入极大增强其生物相容性,能够得到期望的具有优良生物相容性的钌配合物。
1 实验部分
1.1 试剂与仪器
2-吡啶甲酸乙酯、二乙二醇单甲醚、2,2′-联吡啶、四氟硼酸钾购自上海润捷化学试剂有限公司。六氟磷酸钾购自阿拉丁化学试剂公司。溴化乙锭(EB)购自麦克林化学试剂公司。硝酸银、氢化钠、活性炭、乙酸铵、溴己烷、18-C-6、碳酸钾、三乙胺、氯化锂、三氯化钌购自上海久岳化工有限公司。N,N-二甲基甲酰胺(DMF)、二甲亚砜(DMSO)购自江苏化学试剂有限公司。以上原料和溶剂均为AR级。文中紫外可见、荧光、圆二色谱测试所用配合物溶液均为10 μmol·L-1。理论计算采用含时密度泛函理论(TD-DFT)对配合物的紫外可见跃迁进行计算。DNA等生物大分子均溶于磷酸缓冲盐溶液(PBS)中,配成质量浓度5 mg·mL-1的溶液。每次测试前DNA等生物大分子与配合物溶液孵育5 min。
FT-IR谱图由NEXUS-870型红外光谱仪测得,经KBr压片。1H NMR和13C NMR谱图在Bruker公司的Bruker400 Ultra-shield核磁共振仪上获得。配合物的晶体结构是在SMART CCD(Seimens)X衍射仪上用MoKα射线测定的。质谱表征:MALDI-TOFMS在AXIMA-CFR plus型飞行时间质谱仪上测得,ESI-MS使用LCQ Fleet型质谱测定。紫外可见吸收光谱使用日立U-3900紫外可见分光光度计测定。分子对接用AutoDock4.2软件进行。
1.2 配合物的合成
配合物的合成步骤如图1所示。
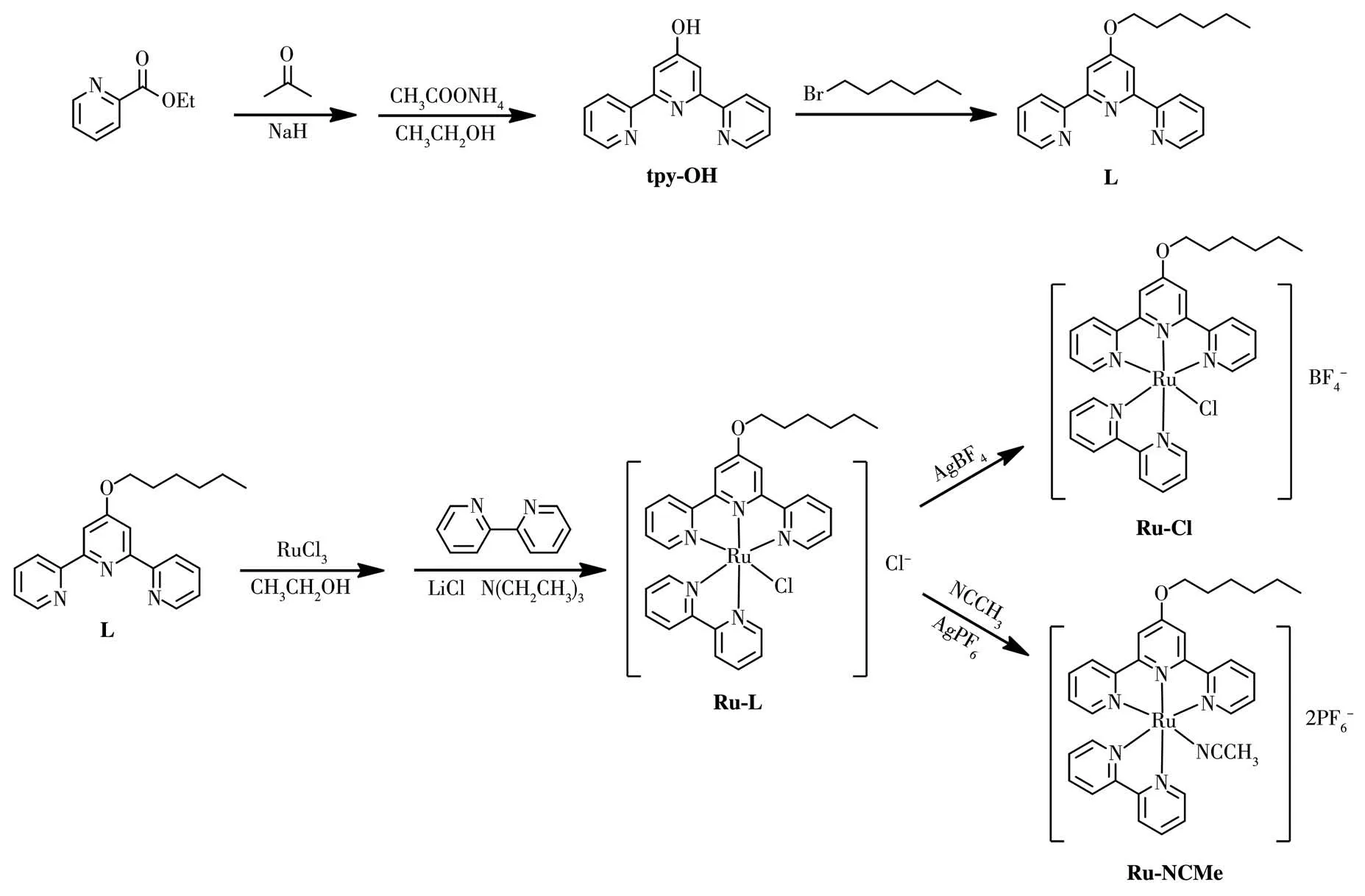
图1 配合物的合成路线Fig.1 Synthesis route of the complexes
1.2.1 配体L的合成
tpy-OH根据文献方法合成[20]。在150 mL的圆底烧瓶中依次加入tpy-OH(3.00 g,12.00 mmol)、溴己烷(3.95 g,48.00 mmol)、K2CO3(1.01 g,49.20 mmol)、0.5 g 18-C-6,加入100 mL丙酮溶解,80℃回流搅拌24 h。溶液由无色变成浅黄色,冷却到室温,抽滤得滤液。用旋转蒸发仪蒸出大量丙酮,加入500 mL蒸馏水,析出白色固体。抽滤并水洗3次,真空干燥,得到白色固体L3.60 g,产率92%。1H NMR(400 MHz,CDCl3):δ8.64(dd,J=4.7,0.6 Hz,2H),8.59(d,J=8.0 Hz,2H),7.96(s,2H),7.89(tt,J=9.1,4.5 Hz,2H),7.38(ddd,J=7.4,4.8,1.1 Hz,2H),4.19(t,J=6.5 Hz,2H),1.81(dq,J=13.1,6.6 Hz,2H),1.52~1.45(m,2H),1.39~1.30(m,4H),0.89(t,J=7.0 Hz,3H)。13C NMR(CDCl3,150 MHz):δ14.05,22.61,25.64,29.01,31.51,68.24,76.73,77.05,107.41,121.35,123.77,136.78,149.01,156.21,157.01,167.38。ESI-MS(m/z):[M]+计算 值333.25,实 验 值333.18;MALDI-TOF-MS:333.18。
1.2.2Ru-L的合成
称取2.00 g(6.00 mmol)L溶于50 mL乙醇中,将三氯化钌(1.34 g,6.50 mmol)先溶于50 mL乙醇再滴加到配体中,回流反应4 h。有棕黄色固体析出,抽滤出固体,依次用蒸馏水和乙醇各洗涤3次(3×20 mL)。在150 mL圆底烧瓶中,将棕黄色固体(0.54 g,1.00 mmol)加入到20 mL的混合溶剂乙醇/水(3∶1,V/V)中,搅拌均匀。再将2,2′-联吡啶(0.19 g,1.20 mmol)、LiCl(0.38 g,10.00 mmol)和3 mL三乙胺加入其中,回流搅拌4 h,冷却至室温,减压蒸出溶剂,用二氯甲烷/甲醇(20∶1,V/V)柱层析,得紫黑色固体。
1.2.3Ru-Cl的合成
取紫黑色化合物Ru-L,用甲醇溶解,在避光条件下加入AgBF4(0.23 g,1.20 mmol)的乙腈溶液,搅拌2 h,离心,取上清溶液,浓缩,得紫黑色产物,产量:0.51 g,产率:70.2%。m.p.332℃。ESI-MS(m/z):[MBF4
-]+计算值626.13,实验值626.33。1H NMR(400 MHz,DMSO-d6):δ10.08(d,J=5.2 Hz,1H),8.89(d,J=8.2 Hz,1H),8.75(d,J=8.1 Hz,2H),8.63(d,J=8.2 Hz,1H),8.54(s,2H),8.31(t,J=7.9 Hz,1H),8.02(t,J=6.5 Hz,1H),7.97(t,J=7.8 Hz,2H),7.76(t,J=7.9 Hz,1H),7.60(d,J=5.5 Hz,2H),7.44(d,J=5.9 Hz,1H),7.34(t,J=6.5 Hz,2H),7.09(t,J=6.3 Hz,1H),5.76(s,2H),4.46(t,J=6.4 Hz,2H),1.98~1.88(m,2H),1.63~1.53(m,2H),1.49~1.33(m,4H),0.94(t,J=6.8 Hz,3H)。IR(KBr,cm-1):3 428(m),2 971(vw),2 814(w),2 721(w),1 631(s),1 596(s),1 469(w),1 424(w),1 381(m),1 353(m),1 214(w),848(m),762(m),564(m)。
1.2.4Ru-NCMe的合成
在N2氛围下的史莱克瓶(包裹锡箔纸)中加入Ru-L(0.66 g,1.00 mmol)和AgPF6(0.14 g,2.21 mmol),加入30 mL乙腈,升高温度至80℃,反应7 h。冷却至室温,抽滤,将所得滤液蒸出部分乙腈,用水扩散得到红色固体。产量:0.58 g,产率:75.1%。m.p.271℃。ESI-MS(m/z):[M-2PF6-]2+计算值316.09,实验值316.17。1H NMR(400 MHz,DMSO-d6):δ9.64(d,J=5.2 Hz,1H),8.94(d,J=8.2 Hz,1H),8.84(d,J=8.0 Hz,2H),8.70(d,J=8.1 Hz,1H),8.63(s,2H),8.41(s,1H),8.11(t,J=7.8 Hz,2H),8.04(s,1H),7.93(s,1H),7.71(d,J=5.3 Hz,2H),7.49~7.41(m,3H),7.22(s,1H),4.48(t,J=6.2 Hz,2H),2.33(s,3H),1.99~1.89(m,2H),1.58(s,2H),1.40(d,J=12.1 Hz,4H),0.95(t,J=6.6 Hz,3H)。IR(KBr,cm-1):3 416(m),3 064(w),2 942(w),2 935(w),2 860(w),1 800(w),1 626(s),1 590(s),1 468(w),1 382(m),1 208(m),790(m),762(m),657(m)。
1.3 晶体数据收集与解析
取25 mg配合物Ru-Cl、Ru-NCMe分别溶解在10 mL乙醇中,用过滤针管过滤在透明光滑小瓶中,自然挥发数天,分别得到紫色、红色透明的针状晶体。选取大小适中的晶体作单晶X射线衍射分析,在SMART CCD(Siemens)X衍射仪上,用石墨单色器、MoKα射线(λ=0.071 069 nm)、ω/2θ扫描方式采集数据。利用SHELXTL-97程序,全矩阵最小二乘法定义F2直接法解析晶体结构,氢原子的坐标经差值Fourier合成获得,非氢原子坐标通过直接法获得。氢原子采用各向同性热参数修正,其它原子采用各向异性热参数修正。CCDC:1063055,Ru-Cl;1577329,Ru-NCME。
2 结果与讨论
2.1 Ruギ配合物的晶体结构
单晶解析后所得晶体学数据见表S1(Supporting information),主要键长、键角见表S2和S3。Ru-Cl、Ru-NCMe的晶体均为单斜晶系C2/c空间群。图2为Ru-Cl、Ru-NCMe的单分子椭球图。2个配合物的主体结构均为含配位单元的阳离子,阴离子分别为BF4-和PF6-离子。从晶体结构可以看出,三联吡啶与联吡啶所在平面相互垂直,中心Ru原子分别与三联吡啶和联吡啶的N原子以及Cl-离子(乙腈分子)发生配位,采取六配位模式,形成近似正八面体的构型。2个分子的N—Ru键的键长大致相等,在0.196 8~0.208 3 nm之间,说明在Ru原子附近的电子云分布较均匀。Ru-Cl分子的N4—Ru1—Cl1的角度为172.78°,Ru-NCMe分子的N6—Ru1—N5的角度为173.91°,这是由于Cl-离子的孤对电子与联吡啶N原子上电子排斥导致配位发生扭曲。在分子堆积方面(图S7),2个配合物的分子间都存在静电引力作用。Ru-NCMe晶体在PF6-的连接下沿着b轴方向形成一维链状结构,而Ru-Cl晶体由于有分子间氢键的存在,形成层状结构。如图3所示,Ru-Cl晶体中与Ru原子配位的氯原子和另外2个分子的吡啶环上的氢原子相连形成氢键。
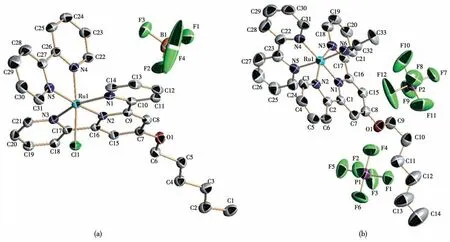
图2 配合物Ru-Cl(a)、Ru-NCMe(b)的50%椭球概率晶体结构图Fig.2 Crystal structure with 50%ellipsoidal probability of complexes Ru-Cl(a)and Ru-NCMe(b)
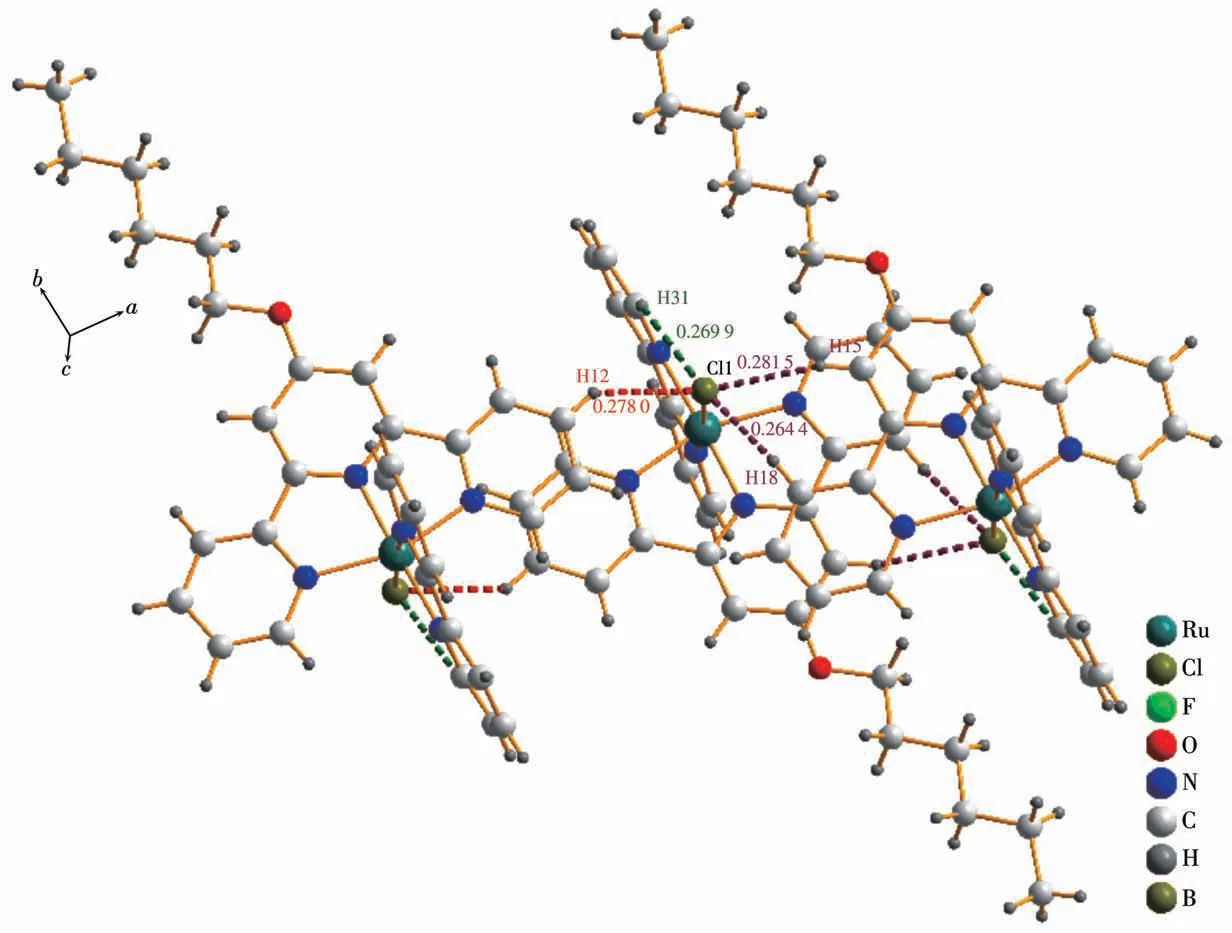
图3 配合物Ru-Cl的分子间氢键Fig.3 Intermolecular hydrogen bonds of complex Ru-Cl
2.2 Ruギ配合物的光学性质
2.2.1 紫外可见吸收光谱
测得2种配合物在不同极性溶剂中的紫外可见吸收光谱,结果如图4所示。从图4a和4b可以看出,这2种钌配合物在不同极性的溶剂中,吸收峰位置受溶剂极性影响较小,只发生了微小的移动。表明这2种配合物的基态偶极矩并不大,分子基态能级仅有微小的改变,且在与生物体环境相似的溶液中(φDMSO=10%的水溶液)仍具有良好性质(图4c)。在400~600 nm范围内Ru-Cl的最大吸收波长相比于Ru-NCMe有所红移,这是由Ru-Cl中氯离子配体的强吸电子性质引起的。同时因为含有Ru—Cl键,配体与金属离子结合更加稳定,配体与金属离子之间的电荷跃迁能级更低,电荷更容易跃迁,所以Ru-Cl配合物吸收波长相对较长,吸收峰更宽。
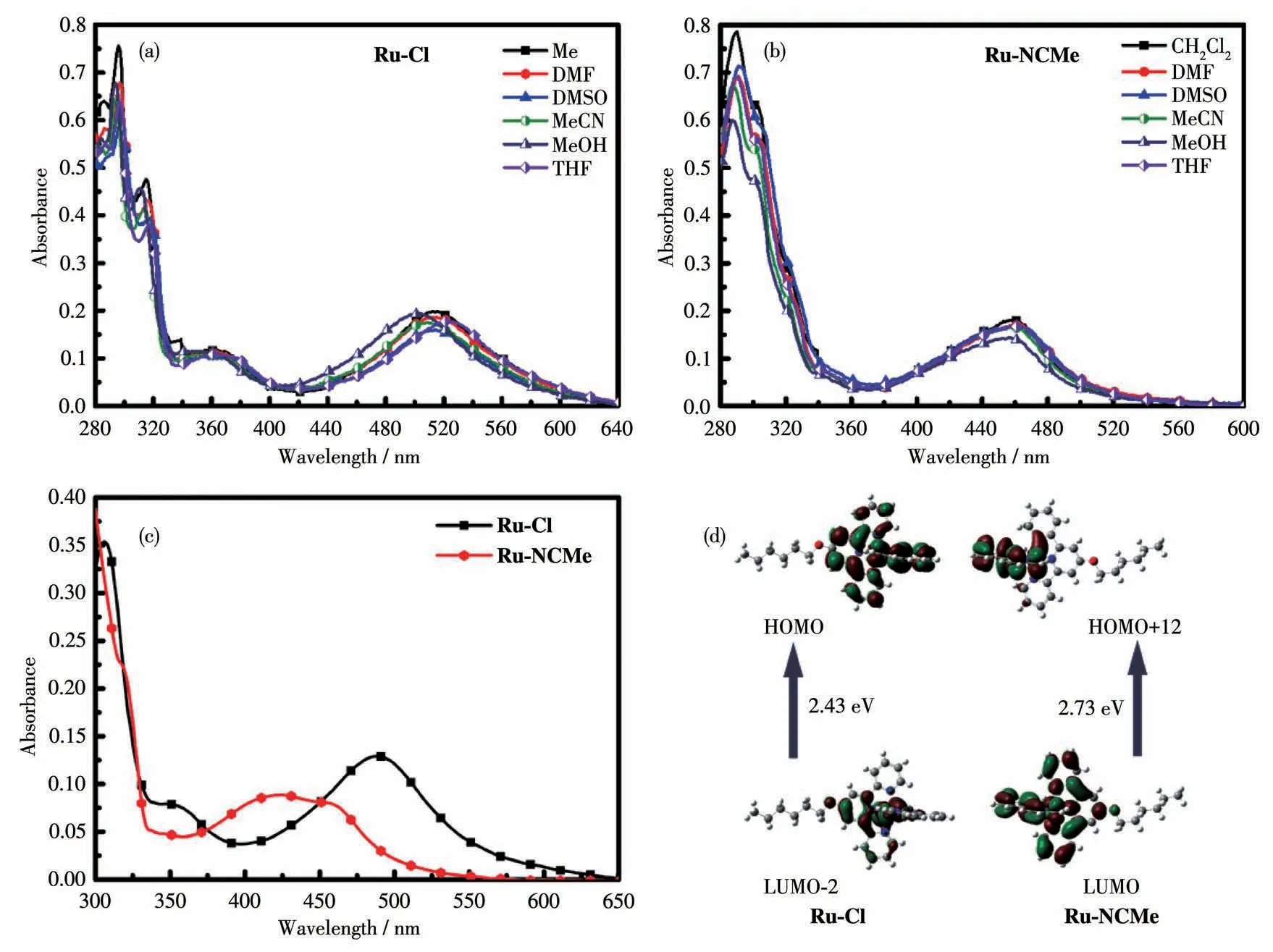
图4 (a)Ru-Cl和(b)Ru-NCMe在不同溶剂中的紫外可见吸收光谱;(c)Ru-Cl和Ru-NCMe在含DMSO(φDMSO=10%)的水溶液中的紫外可见吸收光谱;(d)Ru-Cl(510 nm)和Ru-NCMe(460 nm)的前线分子轨道能级图Fig.4 UV-Vis absorption spectra of(a)Ru-Cl and(b)Ru-NCMe in different solvents;(c)UV-Vis absorption spectra of Ru-Cl and Ru-NCMe in an aqueous solution containing DMSO(φDMSO=10%);(d)Frontier molecular orbitals energy diagram of Ru-Cl(510 nm)and Ru-NCMe(460 nm)
2.2.2 理论计算
由2种配合物的紫外可见吸收光谱图和理论计算可知,2个分子在290~300 nm均有吸收峰,可归属为配体内的π→π*特征吸收峰;在315 nm附近的吸收峰,可归属为配体到金属离子的电荷转移(LMCT)过程;而在520和460 nm的宽吸收峰是金属到配体的电荷转移(MLCT)的吸收峰。配合物Ru-Cl在380 nm附近的特征吸收峰可归属于分子内电荷转移(ICT)过程。前线分子轨道能级图如图4d所示,Ru-Cl分子的MLCT过程的电荷跃迁所需能量更低,这与上述推测结果一致。
2.3 Ruギ配合物与DNA作用
2.3.1 Ruギ配合物特异性识别DNA
在系统研究Ruギ配合物和DNA的相互作用之前,我们首先排除了配合物和一些常见的生物大分子发生相互作用的可能性。在相同浓度的生物大分子加入到配合物溶液之后,配合物的吸收强度有不同程度的下降。根据下降的程度制成如图5所示的柱状图,可以看到一些常见的氨基酸、卵磷脂和RNA等对配合物的吸收强度影响很小,只有在加入DNA时配合物吸收强度有明显变化。表明配合物对DNA有特异性识别作用,有望将其应用于复杂的生物体环境。
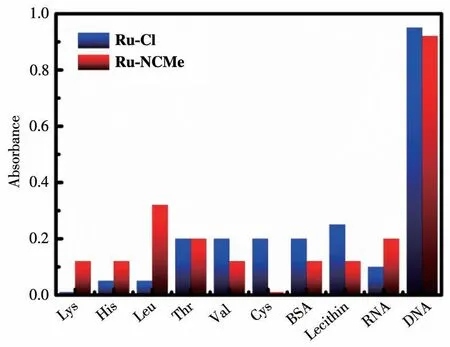
图5 与DNA、RNA、氨基酸作用后Ru-Cl和Ru-NCMe的吸收光谱变化图Fig.5 Changes in absorption spectra of Ru-Cl and Ru-NCMe after interacting with DNA,RNA,and amino acids
2.3.2 Ruギ配合物与DNA作用的吸收光谱
为了进一步探索配合物和DNA的结合,分别向2种Ruギ配合物溶液中加入DNA母液,测试其吸收光谱,结果见图6。从图6中可以看出,随着DNA的不断加入,2种Ruギ配合物溶液的吸收强度均有所减弱,表明2种配合物均与DNA发生作用。由配合物结构推测,这种作用可能是配合物的己氧基三联吡啶配体与DNA发生了插入作用,随着插入作用的不断增强,减色效果越来越明显。
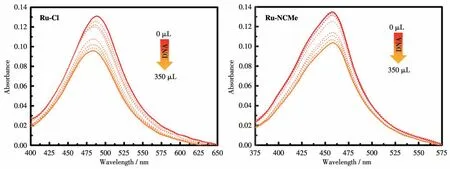
图6 与DNA相互作用后Ru-Cl、Ru-NCMe紫外可见吸收光谱的变化Fig.6 Changes in UV-Vis absorption spectra of Ru-Cl and Ru-NCMe after the interaction with DNA
2.3.3 Ruギ配合物与DNA作用的荧光光谱
DNA分子结构复杂,只通过一种方法很难确定配合物与其结合模式。为了确定Ruギ配合物与DNA的结合模式,采用DNA-EB体系来进一步研究配合物与DNA的作用机理。EB是一种可以嵌入DNA碱基之间的染色剂,与DNA结合后发出强烈的荧光。在其他可以和DNA发生插入反应的试剂加入后,先前与DNA结合的EB的荧光会发生变化,因此可以用配合物与EB的竞争实验间接来确定配合物与DNA的插入作用。
从图7可知,随着配合物加入量的增加,DNAEB体系的荧光强度逐渐降低,这可以说明Ruギ配合物与DNA发生了插入作用,导致体系荧光减弱。同时我们可以看出,在与EB竞争过程中,Ru-Cl与DNA作用比Ru-NCMe强,对体系的荧光强度减弱作用较明显。从紫外可见吸收光谱可知,2种分子均可以和DNA作用,而在荧光光谱中Ru-NCMe分子在与EB竞争实验中效果不明显,推测其有其它结合方式。从结构来看Ru-NCMe的第3配体为乙腈分子,其和中心金属结合能力较弱,易于离去,使配合物能以静电或配位方式与带负电的DNA结合。在Ru-Cl配合物中由于Ru—Cl键较稳定,即使能发生少部分水解,但是对与DNA的插入反应影响不大,荧光强度仍为明显降低的趋势。
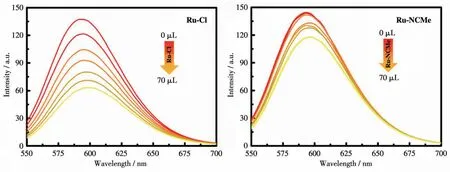
图7 加入Ru-Cl和Ru-NCMe后DNA-EB体系荧光光谱的变化Fig.7 Changes in fluorescence spectra of DNA-EB system after the addition of Ru-Cl and Ru-NCMe
2.3.4 Ruギ配合物与DNA作用的圆二色谱
圆二色谱(CD)法是一种可以直观地判断配合物有没有和DNA分子发生插入反应的方法[21-22]。如果配合物可以与DNA发生插入反应,配合物溶液的加入会使DNA的CD峰的强度发生变化。DNA加入2种配合物后的CD谱图如图8所示,随着Ru-Cl的加入,DNA在275 nm的峰强度逐渐降低,证明Ru-Cl可以和DNA发生插入反应,反观Ru-NCMe的加入对DNA的CD影响很小,峰的强度几乎没有变化,表明Ru-NCMe和DNA发生的反应不是以插入反应为主。
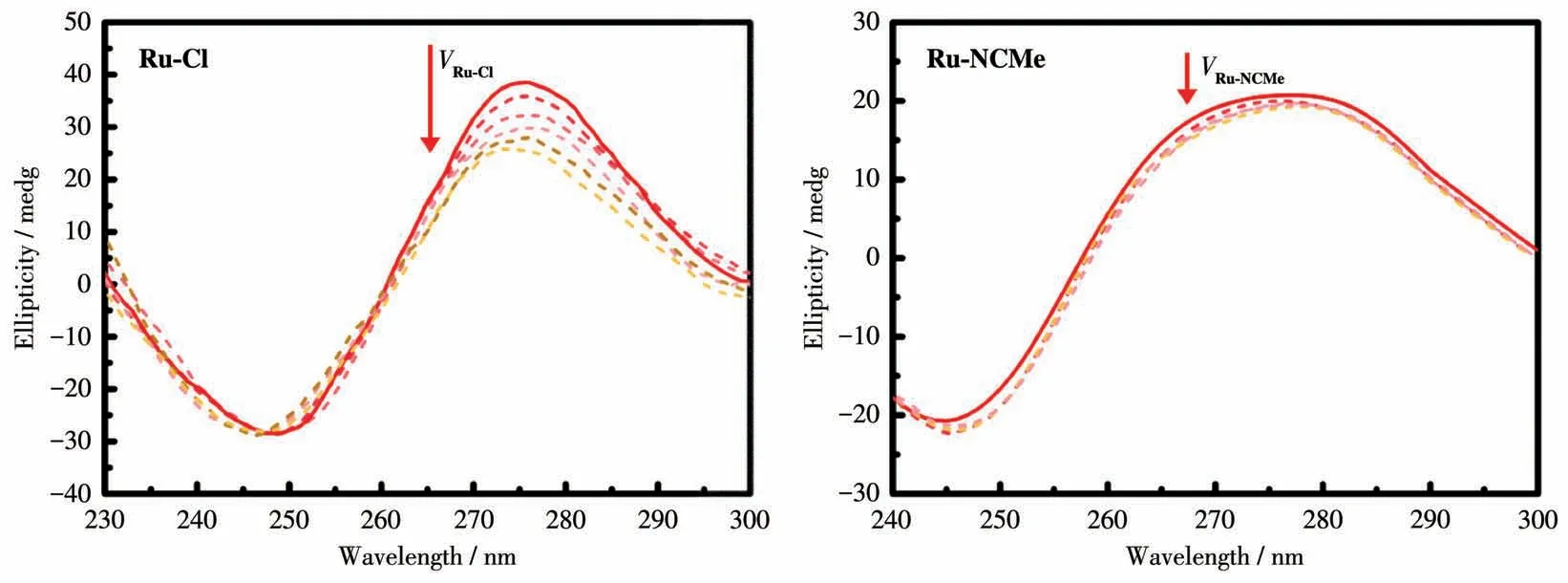
图8 加入Ru-Cl和Ru-NCMe后DNA的CD谱图的变化Fig.8 Changes in CD spectra of DNA after the addition of Ru-Cl and Ru-NCMe
2.3.5 Ruギ配合物与DNA作用的分子对接
通过理论模拟分子对接进一步研究配合物和DNA分子的具体结合方式。选取在DNA-EB体系中变化明显的Ru-Cl配合物,分子对接如图9所示。从图9a可以看出,配合物的烷氧基三联吡啶配体与DNA的结合位点位于DNA双螺旋的沟槽中。从图9b得知配合物和DNA之间存在疏水作用力,疏水作用类型分别为π-π、alkyl、π-alkyl,且DNA侧链上的NH2可以与配合物的氧原子形成氢键。
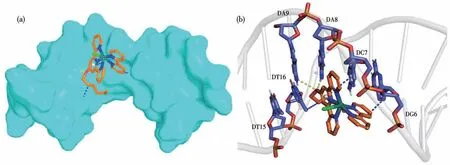
图9 DNA-配体表面结合位点(a)和Ru-Cl与碱基相互作用的棒状图(b)Fig.9 DNA-ligand surface binding site(a)and stick pattern of the interactions between Ru-Cl and base(b)
2.3.6 Ruギ配合物与DNA作用的核磁滴定
由分子对接我们知道配合物的烷氧基三联吡啶配体可以插入DNA分子双螺旋的沟槽中,且存在疏水作用和氢键。为了验证理论模拟的准确性,进行了Ruギ配合物与DNA的核磁滴定测试[23-24],测试结果如图10所示。随着DNA的加入,2种配合物苯环区氢的化学位移均往高场移动(红色)。这是由于配合物与DNA发生π-π堆积等疏水作用,使得苯环区化学位移发生变化。同时由于烷氧基三联吡啶中的氧原子与DNA分子的氨基以氢键相连,使得氧原子附近的氢的化学位移同样向高场移动(蓝色)。
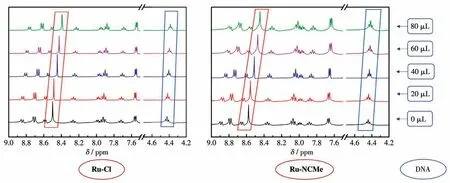
图10 随着DNA的加入Ru-Cl和Ru-NCMe核磁氢谱的变化Fig.10 Changes in 1H NMR spectra of Ru-Cl and Ru-NCMe after the addition of DNA
因为设计、合成的2种配合物均没有荧光,所以对这2种配合物与DNA的其它结合方式的验证受到限制,没有进行静电结合的实验验证。
3 结论
设计并合成了2种长链烷氧基三联吡啶钌配合物Ru-Cl、Ru-NCMe,通过单晶X射线衍射确定了它们的结构。经过DNA-EB竞争实验和圆二色谱研究发现,Ru-Cl可以和DNA发生插入反应,且插入效果明显。而经过理论模拟发现Ru-Cl除与DNA发生插入反应之外,还存在氢键和疏水作用。由于2种配合物有相同的三联吡啶配体,推测Ru-NCMe同样存在氢键和疏水作用,并通过核磁滴定得到了验证。本工作设计的2种配合物Ru-Cl、Ru-NCMe均可以特异性识别DNA,且存在多种结合方式,其中Ru-Cl以插入反应为主,表现出良好的稳定性,Ru-NCMe存在氢键和疏水作用,还有可能存在静电作用,而且乙腈分子配位提供了其它功能配体取代的活性位点。后期可以通过配体修饰使其荧光增强,得到能够特异性识别DNA的荧光探针,在癌症诊疗等方面拥有巨大潜力。
Supporting information is available at http://www.wjhxxb.cn

