益生菌发酵甘草对甘草酸含量及其抑菌活性的影响
樊梅娜,王丽荣,张国珍,陈盼盼,孟 洁,宁尚锴,李 梅
(1.山东碧蓝生物科技有限公司,山东泰安 271000;2.宁阳县畜牧兽医事业发展服务中心,山东泰安 271000;3.泰安市中医医院,山东泰安 271000)
中华人民共和国农业农村部第194 号公告中提出,自2020 年7 月1 日起,饲料生产企业将不能再生产含有促生长类药物饲料添加剂的商品饲料,这标志着中国饲料端已全面禁抗。寻找饲用抗生素替代品成为饲料行业面临的重要课题之一。以益生菌为代表的微生态制剂备受关注,其中枯草芽孢杆菌和植物乳杆菌是我国农业农村部公布的可直接饲喂动物且允许使用的常用益生菌,具有调节动物胃肠道菌群、促进营养物质消化吸收和提高动物机体免疫力等益生功能。中药甘草及其主要活性成分甘草酸能够发挥抗炎、抗病毒、免疫调节等功能。近期研究表明,甘草酸具有潜在的抗SARS-CoV-2 作用,有望成为COVID-19 的潜在治疗药物,更加凸显出甘草的重要应用价值。本实验室前期研究发现,枯草芽孢杆菌()NBL-B11027 及植物乳杆菌()NBL-B3003 已被证实能够抑制动物肠道病原菌增殖(未发表)。本试验旨在研究枯草芽孢杆菌 NBL-B11027和植物乳杆菌NBL-B3003 与中药甘草共发酵对甘草酸含量及其对饲用有害菌产气荚膜梭菌(,CP)抑菌活性的影响,以期进一步提高其抑菌活性并为益生菌与甘草在饲料行业协同应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株 枯草芽孢杆菌NBL-B11027(分离自禽养殖场)和植物乳杆菌NBL-B3003(分离自健康人体的唾液)由山东碧蓝生物科技有限公司研究院菌种室提供。
1.1.2 甘草 甘草购自泰安永春堂药店,甘草酸标准品(HPLC ≥98%)购自上海源叶生物科技有限公司。
1.1.3 培养基 MRS 培养基:蛋白胨10.0 g/L,牛肉提取物10.0 g/L,酵母提取物5.0 g/L,葡萄糖20.0 g/L,柠檬酸三铵2.0 g/L,乙酸钠5.0 g/L,MgSO0.1 g/L,MnSO0.05 g/L,KHPO2.0 g/L,吐温80 1.0 g/L。
LB 培养基:蛋白胨10.0 g/L,酵母提取物5.0 g/L,NaCl 10.0 g/L,pH 7.0~7.2。
胰蛋白胨-亚硫酸铁-环丝氨酸(TSC)培养基:胰蛋白胨15.0 g/L,大豆胨5.0 g/L,酵母提取物5.0 g/L,焦亚硫酸钠1.0 g/L,柠檬酸铁铵1.0 g/L,琼脂15.0 g/L,pH 7.4~7.8。
液体硫乙醇酸盐(FTG)培养基:胰酪胨15.0 g/L,-胱氨酸0.5 g/L,葡萄糖5.0 g/L,酵母提取物5.0 g/L,NaCl 2.5 g/L,硫乙醇酸钠0.5 g/L,刃天青0.001g/L,琼脂0.75 g/L。
1.2 枯草芽孢杆菌NBL-B11027 和植物乳杆菌NBL-B3003种子液制备 分别配置MRS 液体培养基和LB 培养基,将枯草芽孢杆菌NBL-B11027 接入LB 培养基中37℃,180 r/mim,培养16 h,活菌数为1.0×10CFU/mL,植物乳杆菌NBL-B3003 接入MRS 培养基中37℃静置培养16 h,活菌数为1.0×10CFU/mL。
1.3 益生菌发酵甘草 将甘草粉碎过80 目筛,以1.5%的中药添加量添加到LB 和MRS 培养基中,121 ℃灭菌25 min,以4% 的接种量分别接种枯草芽孢杆菌NBL-B11027 和植物乳杆菌NBL-B3003 种子液,NBL-B11027 于37℃,180 r/min 摇床发酵,NBL-B3003于37℃静置发酵,以未添加中药甘草的发酵组为对照,检测甘草对益生菌发酵pH(德国赛多利斯酸度计PB-10)、活菌数及发酵液对产气荚膜梭菌抑菌活性的影响;以未接菌的含甘草培养基为对照,检测益生菌发酵甘草对甘草酸含量变化的影响。
甘草酸含量增率=(发酵液中的甘草酸含量-发酵0 h 甘草酸含量)/发酵0 h 甘草酸的含量×100%
1.4 活菌数测定 采用平板菌落计数法,发酵结束后,每瓶取1 mL 发酵液于含生理盐水9 mL 试管中,充分震荡均匀后取1 mL 于下一个试管中,以此倍比稀释到合适的稀释度,将每个稀释度取1 mL 滴在灭菌平板上,设3 个重复,加入50℃ MRS 固体培养基或LB 固体培养基中,充分摇匀,37℃静置培养48 h,进行菌落计数。
1.5 甘草酸含量测定
1.5.1 发酵液中甘草酸的提取 取发酵上清液用3 mol/L HCl 调至pH 2.0 后,用丁醇(色谱纯)+乙酸乙酯(色谱纯)(3+7)萃取,除去水溶性杂质,再用1%氨水反萃取甘草酸,提取液用醋酸调至pH 中性后,加无水乙醇(色谱纯)使溶液为20%的乙醇溶液,再经0.45 μm滤膜过滤,供测定。
1.5.2 甘草酸标准溶液 用20%乙醇将甘草酸标准溶液溶解至1.0 mg/mL。
1.5.3 色谱分离条件 色谱柱:Kromasil C18(250 mm×4.6 mm,5.0 μm);流动相:水:乙腈:冰醋酸=63:37:0.15;流速:1.0 mL/min;检测波长:254 nm;柱温:25℃;进样体积:10 μL。
1.5.4 标准曲线绘制 准确吸取甘草酸标准溶液0.5、1.0、2.0、4.0、6.0、8.0 mL 置于10 mL 容量瓶中,用20%的乙醇定容至刻度,混匀后分别取10 μL 标准溶液注入高效液相色谱仪(日本岛津LC-20A),在色谱条件下进行测定,绘制标准曲线。
1.5.5 发酵液中甘草酸含量测定 准确吸取发酵提取液10 μL 注入高效液相色谱仪分离测定,以对照品峰的保留时间定性,以峰面积外标法定量。
1.6 产气荚膜梭菌抑菌性测定
1.6.1 病原菌的活化、培养和计数 将产气荚膜梭菌C8-0044 接入FTG 培养基中,37℃厌氧培养过夜。吸取菌液1 mL 于9 mL 生理盐水中,重复混匀后,再吸取1 mL 至另一只含9 mL 生理盐水的试管中,依次10倍倍比稀释至合适的稀释度,取稀释液1 mL 于平皿中,倒入(46±1)℃的TSC 培养基,待凝固后,倒置平皿于37℃厌氧培养箱中过夜培养,计算平板内的细菌数。
1.6.2 抑菌试验 过夜培养的病原菌稀释至浓度为1.0×10CFU/mL,取1 mL 稀释液与20 mL 相应的培养基混合后倒板,待凝固后用打孔器(直径7 mm)打孔,在孔内加入发酵液上清各80 μL,过夜培养,测定抑菌圈大小。
1.7 统计分析 采用SPSS 22.0 统计软件进行方差分析,采用独立样本T 检验对两组间数据进行比较,以<0.05 为差异显著性,<0.01 为差异极显著性判断标准。结果用平均值±标准差表示。
2 结果
2.1 不同益生菌发酵甘草对益生菌发酵液pH 及活菌数的影响 由表1 可知,相同发酵时间,添加甘草组益生菌发酵的活菌数高于对照组(<0.01)。枯草芽孢杆菌NBL-B11027 发酵过程中pH 呈先升高后稳定的趋势,枯草芽孢杆菌NBL-B11027 发酵甘草组28 h 活菌数较不添加甘草组增加了2.91 倍,发酵32 h 达到最大活菌数3.02×10CFU/mL,此时仍然没有形成芽孢,而未添加甘草组发酵24 h 后芽孢杆菌成孢率已达100%;植物乳杆菌NBL-B3003 发酵过程中pH 呈先降低后稳定的趋势,发酵甘草24 h 达到最大活菌数1.98×10CFU/mL,较不添加甘草组活菌数增加了1.57 倍。由于较低pH 对植物乳杆菌NBL-B3003 生长亦有抑制作用,导致发酵28 h 活菌数呈下降趋势。
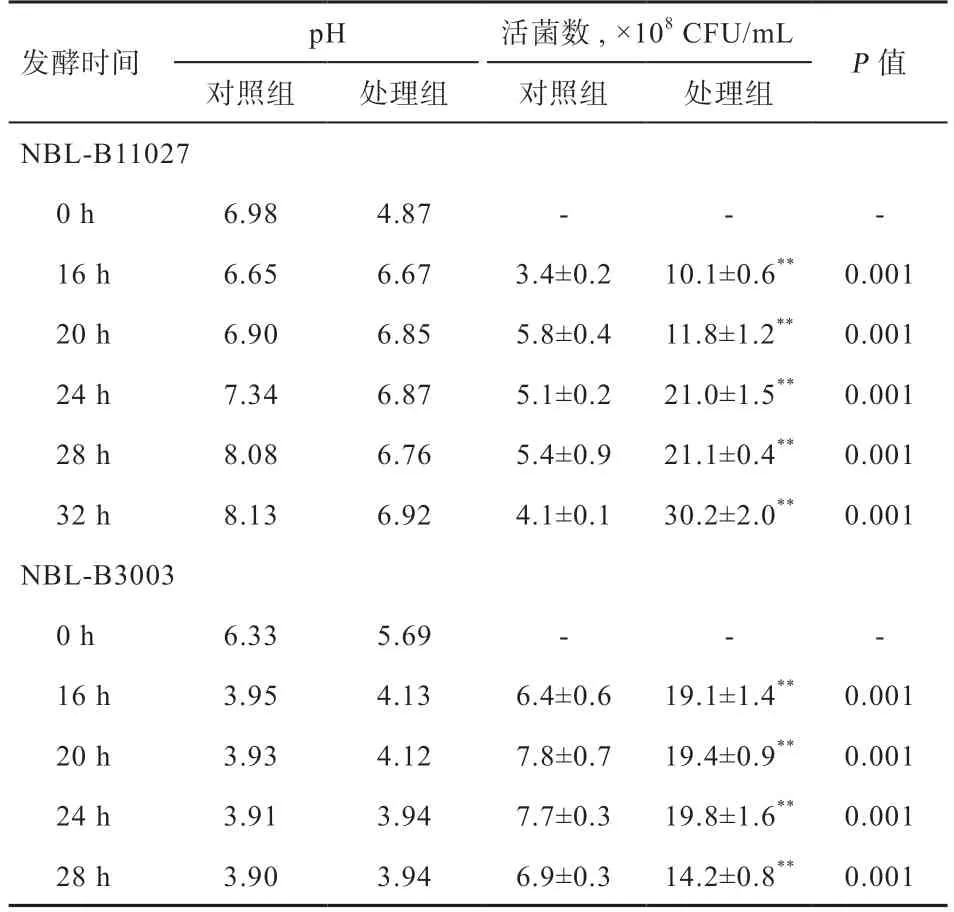
表1 不同益生菌发酵甘草对益生菌发酵液pH 及活菌数的影响
2.2 不同益生菌发酵甘草对益生菌体外抑制病原菌效果的影响 如表2 和图1 所示,发酵0 h 各处理对产气荚膜梭菌均无抑菌性,抑菌圈直径为0 mm;枯草芽孢杆菌NBL-B11027 在发酵28 h 达到最大抑菌活性,抑菌圈直径达17.5 mm,抑菌圈直径较对照组增加了4.5 mm;植物乳杆菌NBL-B3003 在发酵24 h 达到最大抑菌活性,抑菌圈直径达15.5 mm,较对照组增加了3.0 mm。由于枯草芽孢杆菌NBL-B11027 在未添加甘草组发酵24 h 后芽孢杆菌成孢率已达100%,且在添加甘草组发酵28 h后达到最大抑菌活性,所以选择发酵24 h 和28 h 测定甘草酸含量;而植物乳杆菌NBL-B3003 发酵20 h 进入稳定期,添加甘草发酵24 h 达到最大抑菌活性,所以选择稳定期之前的发酵16 h 和24 h 测定甘草酸含量。
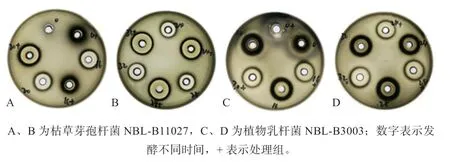
图1 不同益生菌发酵甘草对益生菌体外抑制产气荚膜梭菌效果的影响
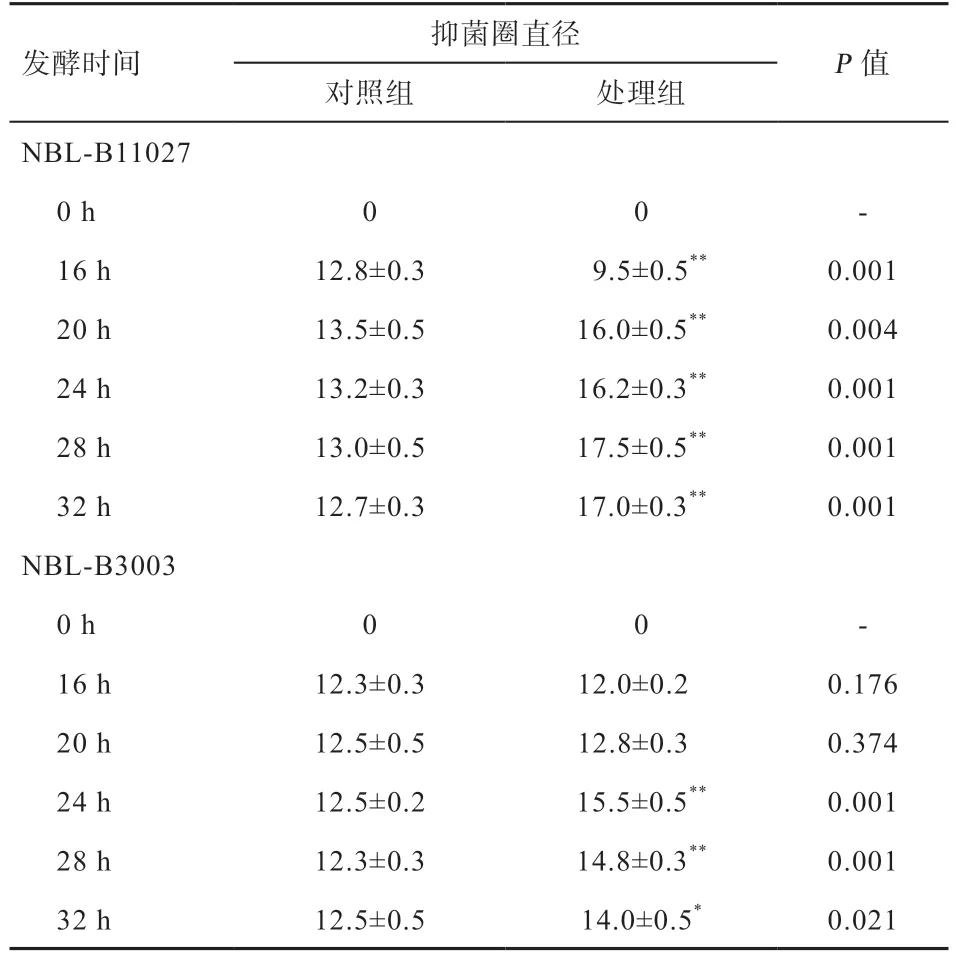
表2 不同益生菌发酵甘草对益生菌体外抑制产气荚膜梭菌效果的影响 mm
2.3 不同益生菌发酵甘草对甘草酸含量的影响 以甘草酸对照品的进样浓度(C)对其峰面积(S)进行线性回归,回归方程=2E+7-214723,=0.999,甘草酸在0.05~0.8 mg 呈良好的线性关系(图2)。如表3 所示,枯草芽孢杆菌NBL-B11027 发酵甘草的发酵过程中甘草酸含量显著增加,发酵28 h 的发酵液中甘草酸含量较发酵0 h 时增加154.31%,高于未添加益生菌组(<0.01);相反,植物乳杆菌NBL-B3003 发酵甘草的发酵过程中甘草酸含量显著降低,发酵24 h 检测甘草酸含量较发酵0 h 降低90.44%,低于未添加益生菌组(<0.01)。
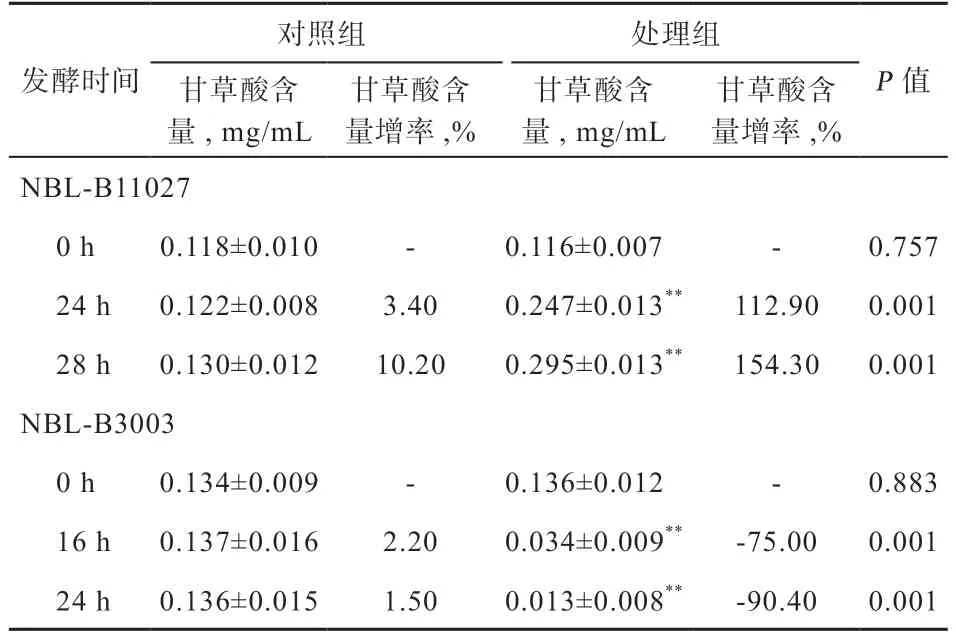
表3 不同益生菌发酵甘草对甘草酸含量的影响
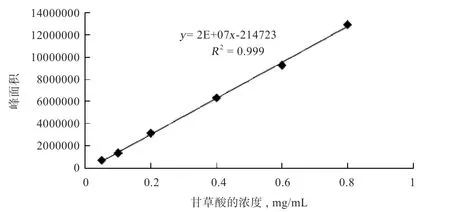
图2 甘草酸含量标准曲线
3 讨 论
随着益生菌研究的不断深入和现代中草药研究的发展,益生菌发酵中草药被广泛应用于饲料行业中。一方面,益生菌能够提高中草药的营养价值和活性成分含量,改善中草药的适口性;另一方面,中草药所含有的有机酸等成分能够抑制有害菌繁殖,促进益生菌生长。本研究结果表明,枯草芽孢杆菌NBL-B11027 发酵甘草,不仅增加了益生菌活菌数,且发酵后甘草酸含量也增加154.31%,呈现出良好的协同作用。王星懿等研究也表明,芽孢杆菌JM-11 发酵甘草,经条件优化发酵后甘草酸得率增加了33.20%。在共发酵过程中,枯草芽孢杆菌NBL-B11027 能够产生胞外酶等大量次生代谢产物,降解甘草细胞壁,从而增加了甘草酸的溶出;而甘草所富含的营养物质促进了枯草芽孢杆菌NBL-B11027的增殖。益生菌与中草药的协同作用可为新型微生态制剂的研发提供方向。
产气荚膜梭菌是造成动物坏死性肠炎的主要病原菌,饲料行业全面禁抗之前主要通过在饲粮中添加杆菌肽锌等抗生素进行抑制。本研究结果表明,发酵中药甘草能够进一步增加枯草芽孢杆菌NBL-B11027 及植物乳杆菌NBL-B3003 对产气荚膜梭菌的体外抑制活性。枯草芽孢杆菌分泌的细菌素、乳杆菌产生的乳酸等酸性物质均具有较强的抗菌作用,还能够通过生物屏障作用拮抗病原菌的吸附和定植;此外,添加甘草发酵可促进益生菌的增殖速度变快,也更有利于发挥抗菌作用。与饲用抗生素相比,益生菌及中药甘草具有天然、毒副作用小、不易在畜禽体内残留、长期使用不易产生耐药性等优点,能有效解决我国饲料行业长期使用抗生素带来的耐药性、药物残留等问题。
甘草酸作为中药甘草的主要活性成分,具有典型的肾上腺皮质激素样作用。研究表明,甘草酸能够刺激体内T 细胞产生-干扰素实现抗流感病毒活性,通过减少杯状细胞增生和黏蛋白5AC mRNA 表达来发挥抗炎作用。本研究结果表明,利用枯草芽孢杆菌NBL-B11027 发酵甘草,能够显著增加甘草到甘草酸的生物转化;但利用植物乳杆菌NBL-B3003 发酵甘草,发酵24 h 甘草酸含量却较未发酵时下降90.44%。研究表明,甘草酸可在人肠内细菌作用下转化为甘草次酸进入体循环;鼠李糖乳杆菌通过将大分子甘草酸去糖基化转化为甘草次酸,从而提高肝硬化病人口服甘草酸的生物利用度。本研究中植物乳杆菌NBL-B3003 发酵甘草后甘草酸含量下降,推测亦可能是由于植物乳杆菌NBL-B3003 促进了甘草酸的生物转化引起的,需要结合HPLC 等试验进一步加以明确。
4 结 论
本研究结果表明,饲用益生菌枯草芽孢杆菌NBL-B11027 和植物乳杆菌NBL-B3003 发酵甘草,能够增加其体外对产气荚膜梭菌的抑菌活性;不同益生菌发酵中药甘草能够显著影响发酵后甘草酸含量,NBL-B3003 发酵后甘草酸含量显著降低,NBL-B11027 发酵甘草则显著增加了甘草酸含量,表明利用枯草芽孢杆菌NBL-B11027和中药甘草共发酵生产甘草酸具有可行性,对于甘草酸的深入研究和工业化生产具有重要意义。

