生物类黄酮调控瘤胃微生态系统的作用
——聚焦甲烷减排
赵玉超 余诗强 蒋林树
(北京农学院动物科学技术学院,奶牛营养学北京市重点实验室,北京102206)
与单胃动物肠道微生物在消化养分上的角色不同,瘤胃微生物群落的组成和功能更加复杂,这使得反刍动物能够消化植物纤维。瘤胃微生物的功能与宿主生理状况密切相关,如其发酵饲料所产生的挥发性脂肪酸(volatile fatty acid,VFA)能为宿主提供能量、促进蛋白质合成以及调节瘤胃上皮发育等[1]。由于反刍动物对其微生物的典型依赖,瘤胃微生态系统被认为是了解宿主与微生物之间生态和进化关系的理想模型。
然而,瘤胃微生物也是温室气体(greenhouse gas,GHG)之一甲烷(CH4)的主要“贡献者”。联合国粮食及农业组织(FAO)估计,2050年人类对肉类和奶产品的需求将比2010年分别提高73%和58%[2]。动物生产带来的GHG排放已成为生态环境领域关注的热点。CH4是全球第二大GHG,其增温效应是二氧化碳(CO2)的28倍。Maasakkers等[3]估算,2010—2015年,全球平均每年CH4排放量约为548百万t,其中100百万~117百万t来源于畜禽饲养,而后者的约95%来自于反刍动物生产[4]。瘤胃CH4排放不仅加剧了温室效应,同样也造成了饲料能量浪费,CH4能量损失占到反刍动物饲粮总能的2%~12%[5],是反刍动物生产效率低下的原因之一[6]。因此,瘤胃CH4减排对反刍动物生产具有重要的生态和营养意义。
天然植物功能组分在调控瘤胃微生态系统、降低瘤胃CH4生成、改善宿主健康和生产性能方面具有潜在作用[7-8]。最常见的天然植物功能组分是酚类化合物,其中最大的一类是类黄酮,其种类超过8 000种,且广泛分布于各种植物中[9]。畜禽上的研究已证明,类黄酮具有抗氧化、抗菌和抗炎等生物活性[10]。诸多研究结果显示,类黄酮还能够通过抑制原虫或产甲烷菌来降低瘤胃CH4排放,是潜在的CH4抑制剂。因此,揭示类黄酮在瘤胃内的代谢规律及其与瘤胃微生物的相互作用,广泛评价其抑制CH4效果,对应用类黄酮作为瘤胃微生态系统的调节剂具有重要意义。
1 瘤胃代谢与CH4生成
瘤胃内包含细菌、真菌、原虫和古菌等大量微生物,在严格厌氧的环境中保持共生关系。饲粮碳水化合物可通过瘤胃微生物广泛发酵产生多种最终产物,主要包括VFA、CO2、氢气(H2)和CH4[11]。具体而言,瘤胃代谢可分为3个层级(图1):第1层级主要是纤维素和半纤维素的降解和代谢,微生物利用不同的糖基水解酶将这些聚合物分解成可溶的葡萄糖和戊糖等单体或低聚体[12];第2层级中,可溶性糖通过特定方式进入微生物细胞,通过糖酵解和磷酸戊糖途径产生各种有机酸、VFA及其他代谢物如CO2和H2[13];最后1个层级是一些代谢物如乳酸、琥珀酸、H2和CO2,进一步转化为丙酸、丁酸、乙酸和CH4等。
图1展示了瘤胃CH4生成的关键途径,其中最主要的第1条途径是氢(H)还原CO2生成CH4,1 mol CO2和4 mol H2生成1 mol CH4和2 mol H2O,涉及7步反应及一系列的辅酶因子和酶[14]。此途径产生的CH4占到了CH4总产量的82%[15],能够有效降低H2的分压,从而有利于持续发酵[14]。第2条途径是利用乙酸盐作为底物,虽然乙酸盐在瘤胃内含量较高,但乙酸发酵型产甲烷菌——甲烷八叠球菌目(Methanosarcinales)的生长速率较低,瘤胃流出率较高,且乙酸盐与H的结合力较低,因此,乙酸盐对CH4排放的贡献较小[16]。第3条途径是甲基化合物如甲醇、甲胺等作为供体,此途径产生的CH4占瘤胃总排放量的3%~5%[17]。

Methanol:甲醇;Acetate:乙酸;Butyrate:丁酸;Propionate:丙酸;Lactate:乳酸;Succinate:琥珀酸;Hydrogenotrophs:氢营养菌;Formate:甲酸;Formyl-MF:甲酰甲烷呋喃 formylmethanofuran;Formyl-H4SPt:甲酰四氢八叠蝶呤 formyl-tetrahydrosarcinapterin;Methenyl-H4SPt:甲川四氢八叠蝶呤 methenyl-tetrahydrosarcinapterin;Methylene-H4(S)Pt:甲叉四氢(八叠)蝶呤 methylene-tetrahydro(sarcina)pterin;Methyl-H4SPt:甲基四氢八叠蝶呤 methyl-tetrahydrosarcinapterin;Methyl-SCoM:甲基辅酶M methyl-coenzyme M;Methylotrophs:甲基营养菌;Methythiol:甲硫醇;Methylamine:甲胺;Acetoclastic methanogens:乙酸发酵产甲烷菌;Acetyl-Pi:乙酰磷酸 acetyl phosphate;Acetyl-CoA:乙酰辅酶A。
所有产甲烷菌都是古菌广古菌门(Euryarchaeota)的成员,包括7个目、28个属和113个种[11],其中目水平上甲烷杆菌目(Methanobacteriales)、甲烷微菌目(Methanomicrobiales)、甲烷马赛球菌目(Methanomassiliicoccales)和甲烷八叠球菌目(Methanosarcinales)在瘤胃中最常见[18];而甲烷短杆菌属(Methanobrevibacter)是瘤胃中最主要的产甲烷菌,占古菌群落的比例可高达70%[20]。目前,从瘤胃中分离得到的产甲烷菌种只有少数一部分,如反刍兽甲烷短杆菌(Methanobrevibacterruminantium)、米氏甲烷短杆菌(Methanobrevibactermillerae)、奥氏甲烷短杆菌(Methanobrevibacterolleyae)、甲酸甲烷杆菌(Methanobacteriumformicicum)、布氏甲烷杆菌(Methanobacteriumbryantii)、活动甲烷微菌(Methanomicrobiummobile)、奥兰汤基甲烷囊菌(Methanoculleusolentangyi)、史氏甲烷短杆菌(Methanobrevibactersmithii)和甲烷八叠球菌(Methanosarcinaspp.)[11]。根据瘤胃生成CH4的途径,可将产甲烷菌分为3类,包括氢营养菌(利用H还原CO2或甲酸盐生成CH4)、甲基营养菌(利用甲基化合物)和乙酸发酵产甲烷菌(利用乙酸作为前体)。
2 类黄酮的分类与特性
类黄酮,又名黄酮类化合物,因对人和动物具有健康益处而广受关注。大多数试验结果表明,类黄酮具有多种生物活性,包括清除自由基、抗炎、抗诱变、抗癌、抗过敏和抗氧化等[21]。类黄酮结构特征是由2个芳环(A环和B环)和1个含氧的3碳环(C环)组成的15个碳(C6—C3—C6)骨架,通过重排、烷基化、氧化和糖基化进行广泛修饰。根据类黄酮的基本化学结构再划分为亚类,其中最常见的是黄烷醇、黄酮、黄酮醇、异黄酮、黄烷酮和花青素等(表1)[22]。在大多数类黄酮(黄烷醇、花青素、黄烷酮和黄酮醇)中,B环都连接于C环的2号碳原子,而异黄酮例外,B环连接于C环的3号碳原子。由于A环和B环的羟基化、甲基化或糖基化不同,进而每个亚类衍生出了数量庞大的类黄酮,且主要以糖苷形式存在各种植物中。
3 类黄酮在瘤胃内的代谢
3.1 代谢特点
瘤胃微生态系统具有巨大的代谢能力,可以推断类黄酮在瘤胃内发生的许多反应与瘤胃微生物直接相关。但目前为止,类黄酮在反刍动物体内的代谢动力学及与瘤胃微生物的交互作用相关研究还很少,对于哪些瘤胃微生物可降解哪些类黄酮仍缺乏系统认知。图2总结了槲皮素、芹菜素、儿茶素、大豆苷元和染料木素在瘤胃中可能存在的转化过程。类黄酮在动物消化道内代谢可能涉及O-和C-脱糖基化、脱甲基、脱羟基、酯裂解、碳碳双键还原、异构化、环裂变、脂肪碳链延伸和截断和脱羧等[23-24]。这些反应将类黄酮转化为简单的酚酸,从而增强类黄酮的功能特性,同时改善其在胃肠道内的生物学利用率[25]。Berger等[26]发现瘤胃微生物通过降解糖苷键提高了芦丁(槲皮素-3-O-芦丁苷)的生物学利用率。脱糖基化导致槲皮素的释放,且在非泌乳奶牛的血浆中检测到了槲皮素及其甲基化(异鼠李亭、怪柳素)和脱羟基化(山奈酚)衍生物。Berger等[27]在体外进一步研究了槲皮素(100 μmol/L)在非泌乳奶牛瘤胃液中的降解特点,结果表明90%的槲皮素在5 h内降解,产物主要为4-二羟基苯乙酸、甲基儿茶酚和间苯三酚。Cui等[28]则在泌乳奶牛饲粮中添加芦丁(3 mg/kg DM),发现瘤胃液中芦丁和槲皮素浓度在饲喂8 h后降至对照组(不添加)水平,而2种化合物在十二指肠中浓度逐渐升高。
3.2 类黄酮与瘤胃微生物的互作
类黄酮在瘤胃内可能产生与母体化合物生物活性不同的产物,进而影响宿主健康[29];瘤胃微生物组成的个体差异也可能产生不同的类黄酮代谢物[30],这2种因素同时增加了研究的复杂性。研究表明,可转化类黄酮的肠道优势菌群主要是拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria)等[30],而这4个门也是瘤胃内的优势菌群[31-32]。特别是,厚壁菌门中的毛螺菌科(Lachnospiraceae)可对各种类黄酮进行O-和(或)C-脱糖基化和裂解[29]。此外,类黄酮聚合物分解产生的单体可能会发挥抑菌作用,抑制产甲烷菌和(或)原虫。因此,未来的研究目标需要将特定瘤胃微生物与类黄酮作用相关的代谢表型联系起来,进而建立类黄酮代谢与微生物的具体联系,同时还需要针对已经报道的菌种或分离新的菌种以鉴定各种类黄酮转化菌。
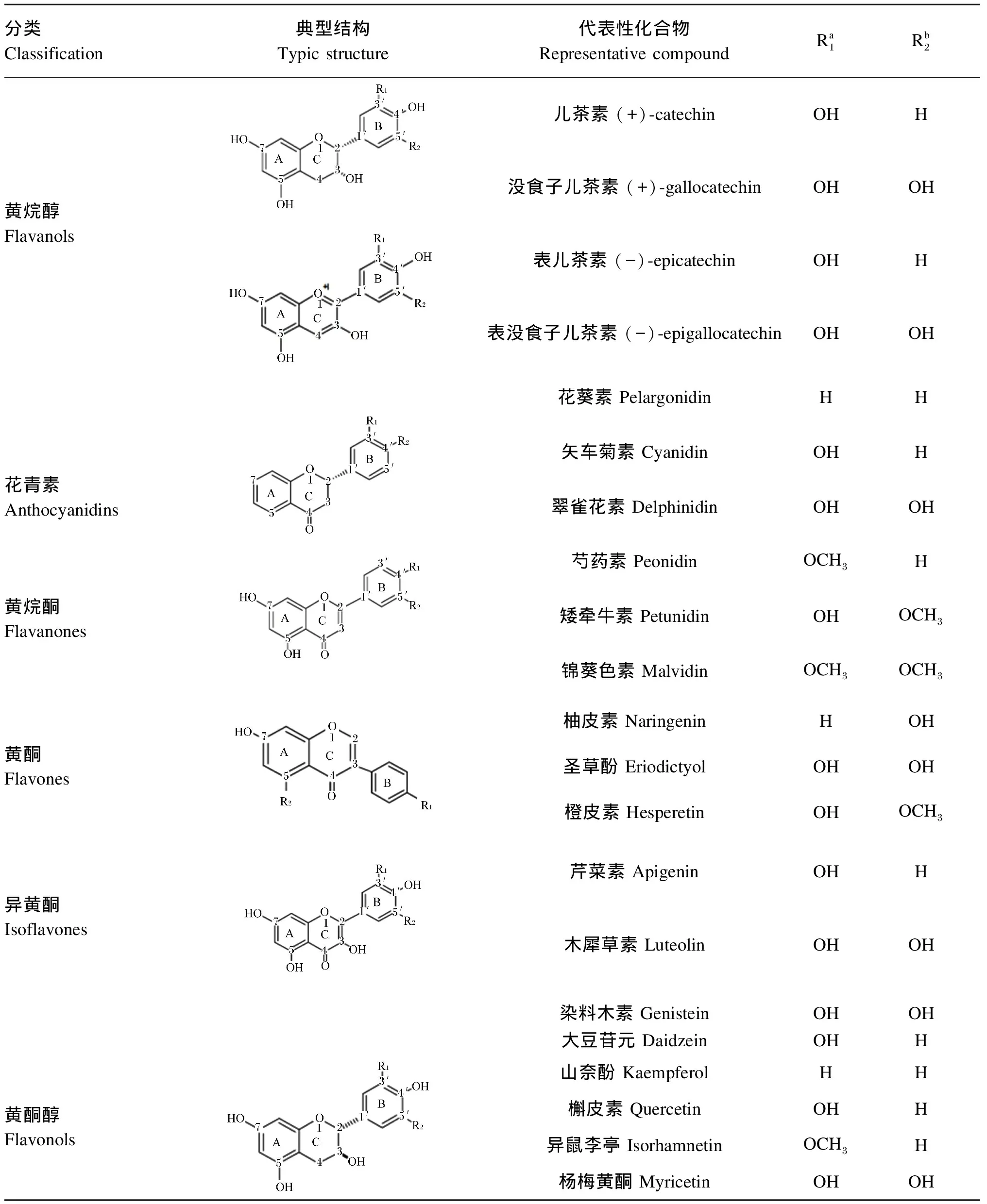
表1 类黄酮的分类及其代表性化合物参考
3.3 生物学利用率和瘤胃内转化
类黄酮在瘤胃内的代谢可能直接影响到母体化合物在体内的生物学利用率。单胃动物上明确了小肠是单体类黄酮吸收的主要部位,从聚合类黄酮中分离出来的单体类黄酮被肠道菌群脱糖基后在小肠远端和大肠中被吸收[33]。在反刍动物上,尚不清楚类黄酮是否能够被瘤胃上皮吸收。但根据前人的研究,血浆类黄酮浓度的峰值出现在槲皮素瘤胃内给药30~35 min时或采食富含异黄酮的饲粮1 h时[26,34]。考虑到饲粮在瘤胃内的停留时间远超1 h,因此,可能有部分类黄酮在瘤胃中被吸收[28,35]。Gohlke等[36]研究发现,经十二指肠灌注槲皮素后,奶牛血浆总黄酮醇浓度增加。因此,从瘤胃流出的类黄酮还可能会进一步被小肠吸收。类黄酮吸收后会被转运至肝脏,形成葡糖苷酸、硫酸盐或甲基结合化合物,最后随粪便或尿液排泄出去[24]。
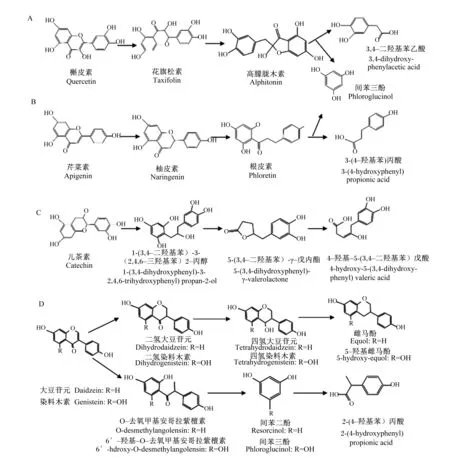
图2 类黄酮在瘤胃内可能的转化过程
类黄酮的生物活性取决于其化学结构、吸收率、分布和消除水平[37]。与其他亚类相比,异黄酮和黄酮醇在单胃动物中的生物学利用率更高,而花青素的生物学利用率较低[38]。反刍动物则不同,其对花青素生物学利用率则明显高于其他亚类[39]。Berger等[26]使用非泌乳奶牛比较了槲皮素的2种形式即配糖体(槲皮苷)和葡萄糖鼠李糖苷芦丁的体内(口服或静脉插管2种方式)代谢动力学,发现葡萄糖鼠李糖苷芦丁的生物学利用率显著高于槲皮苷,这可能是由于槲皮苷可在瘤胃内迅速降解,这一结果与单胃动物相反。有趣的是,Berger等[27]比较上述2种化合物在犊牛上的代谢(随初乳和代乳粉饲喂),结果显示槲皮苷的生物学利用率高于葡萄糖鼠李糖苷芦丁。这些矛盾的结果表明了动物胃肠道结构及微生物区系差异可能会对黄酮物质吸收代谢产生不同的结果,进而会对瘤胃发酵、免疫调节和生产性能产生差异化现象,这也再次突显了深入研究类黄酮在瘤胃内代谢吸收的重要性。
4 类黄酮对瘤胃CH4排放及相关菌群的调控作用
类黄酮通过抑制细胞质膜功能、抑制细菌细胞壁合成、抑制核酸合成或抑制能量代谢来抑制微生物[40],其抑菌潜力取决于羟基的数量、位置及脂肪族和糖基的存在。反刍动物摄入黄酮后,部分类黄酮可代谢为VFA[28,41],进而改变瘤胃菌群[42]。Balcells等[43]研究显示,在饲喂高精料饲粮的肉牛瘤胃瘘管中添加柑橘黄酮(300 mg/kg DM)可提高瘤胃乳酸利用菌埃氏巨型球菌(Megasphaeraelsdenii)的数量,降低乙酸/丙酸值,减少酸中毒的风险。而Seradj等[44]使用柑橘黄酮或其主要单体类黄酮也观察到了一致的结果。这表明类黄酮对瘤胃代谢具有一定的调控作用,而其是否能够降低CH4排放是本部分重点讨论的内容。表2和表3分别从单体类黄酮和植物提取物2个层面总结了类黄酮调控瘤胃发酵和CH4排放的研究进展。
4.1 单体类黄酮
前人针对不同单体类黄酮降低瘤胃CH4排放做了很多筛选工作。Oskoueian等[25]比较了黄酮、杨梅黄酮、柚皮苷、儿茶素、芦丁和山奈酚等6种单体类黄酮(45 g/kg)对体外瘤胃发酵的影响,结果显示柚皮苷和槲皮素在抑制原虫和产甲烷菌、降低CH4产量上作用最为显著,且不影响干物质降解率和瘤胃发酵;而另一项评估8种单体类黄酮的体外试验中,仅发现木犀草苷对CH4有显著抑制效果,且8种化合物对瘤胃微生物均没有影响[45]。类似的,Leiber等[46]发现芦丁可以减少体外CH4产量占总产气量的比例,但对瘤胃细菌和原虫数量均没有影响。以上研究说明,不同的类黄酮单体对瘤胃微生物、发酵参数和CH4排放的效果存在差异,这可能与其结构相关。与上述筛选结果不同的是,Berger等[27]和Andrés等[47]则报道体外添加槲皮素对瘤胃总产气量和CH4产量均没有显著影响。体内研究方面,López-Campos等[42]在羔羊饲粮中添加柚皮苷(1.5 g/kg)显著影响了瘤胃菌群结构,但并未分析菌群组成及瘤胃发酵。最近一项研究中,Jiménez-Ocampo等[48]首次评估了柚皮苷瘤胃瘘管给药(1.5和3.0 g/kg DM)对肉牛瘤胃发酵和CH4排放的影响,结果显示均没有显著影响。Stoldt等[49]在奶牛上的研究也得到类似结果。这说明,即使是添加单体类黄酮也可能在体内和体外、试验动物种类之间产生矛盾的试验结果。未来的研究应注重比较不同类黄酮单体之间组合添加的效果。
4.2 富含类黄酮的植物提取物
植物提取物通常含有多种类黄酮化合物,在调控瘤胃微生态系统中具备“组合效应”。Broudiscou等[50]筛选了黄酮含量较高的13种植物提取物,评定了其在连续培养中对瘤胃发酵和产CH4的影响,发现真实薰衣草(Lavandulaofficinalis)和毛果一枝黄花(Solidagovirga-aurea)促进了瘤胃发酵,而问荆(Equisetumarvense)和药用鼠尾草(Salviaofficinalis)则降低了产CH4量。在另一项研究中,Broudiscou等[51]比较了真实薰衣草和问荆提取物及异槲皮甙(一种存在于问荆植物中的类黄酮)在连续的体外瘤胃培养中对发酵参数和CH4的影响,结果表明添加提取物提高了乙酸和丙酸产量,其中真实薰衣草的增幅效果分别为60%和37%,问荆的增幅效果分别为59%和40%,而异槲皮苷的增幅较低,分别为29%和15%,且问荆趋向于抑制CH4生成。因此,含有类黄酮的植物提取物减少CH4产生的同时,也可促进微生物发酵。Tavendale等[52]使用反刍兽甲烷短杆菌(菌株号分别为DSM1093和YLM-1)进行体外培养,发现在培养基中添加源自Lotuspedunculatus的黄酮醇(0.25 mg/L)使得28%的DSM1093菌株生长受到抑制,且降低了CH4产量;而菌株YLM-1并未受到显著影响,这也表明类黄酮对产甲烷菌有直接影响。

表2 单体类黄酮对瘤胃CH4排放和瘤胃发酵的影响
此外,同样采用类黄酮含量较高的植物提取物,如沙棘黄酮[53]、桉树黄酮[54]、石榴黄酮[55]和桑叶黄酮[56],也观察到体外或体内瘤胃CH4产量和产甲烷菌丰度下降。而一些针对类黄酮提取物的研究中CH4产量和古菌等变化出现了不一致的响应,如Szulc等[57]发现,体外添加高剂量的杨梅黄酮-3-O-半乳糖苷的混合提取物降低了瘤胃古菌丰度,但并没有减少CH4排放;而Ramos-Morales等[58]则观察到甘草黄酮降低了CH4排放,但对细菌和古菌组成没有影响。这可能是由于瘤胃微生物对不同的类黄酮的适应性差异导致的。蜂胶黄酮也是关注度较高的类黄酮来源。蜂胶是蜜蜂从植物芽、花和分泌物中采集的树脂、胶和香脂物质的复杂混合物,然后与唾液分泌物、蜡和花粉粒混合而成[59]。与其他种类蜂胶相比,红蜂胶具有较高的异黄酮。体外试验表明,蜂胶黄酮具有抑制CH4排放的效果[59-60]。体内研究进一步证实,妊娠母羊饲粮中添加3 g/d的红蜂胶提取物显著降低了CH4排放量,且对瘤胃VFA具有促进作用[61]。
5 开发类黄酮作为CH4抑制剂需要进一步研究的问题
虽然一些研究表明,类黄酮表现出改善瘤胃发酵、降低CH4产量和提高饲料效率的潜力[62-63],但现有研究仍不足以支撑这些化合物可以用于实际生产。黄酮对瘤胃微生物的作用方式、最佳添加剂量和使用条件仍有待阐明[64]。对于如何解释不同研究之间的相互矛盾或无法重现的结果,则需要动物营养学家进一步研究影响黄酮调控效果的因素。
5.1 类黄酮来源
黄酮的类型和含量在植物物种之间存在巨大差异,同一物种的不同品种、生态型、栽培品系或单株植物之间,甚至同植物的各个部位之间都有很大不同,进而对瘤胃微生态产生不同差异[46]。这种变异性与植物(如遗传、年龄、成熟度、气候)、环境因素(如植物生长的条件)、农艺(如栽培和收获)或加工(如植物提取物的生产、储存、稳定性)等因素相关[65]。对于植物提取物而言,使用的提取溶剂及其稀释浓度和提取条件(如时间和温度)都可能会影响粗提物中类黄酮的浓度和活性。如Boussaada等[54]发现,不同溶剂提取的富含类黄酮的桉树提取物对体外瘤胃CH4生成影响不同。因此,首先应考虑的是对发挥作用的类黄酮进行最终鉴定和表征,只有对类黄酮单体进行结构表征,才有可能确保抑制CH4效果是由某类黄酮物质引起的,而使用植物材料或提取物时,往往其具体成分未经分析确认,并且其在瘤胃中效果被认为是先前报道且通常存在的化合物引起的,这类研究往往价值较低。
5.2 最适剂量
类黄酮在减少或抑制CH4生成方面的作用是剂量依赖性的。在低剂量下,这些化合物对瘤胃发酵几乎没有影响,达到最佳剂量后,继续添加可能不再发挥抑制作用。前文体内体外研究及不同种试验动物之间抑制CH4效果产生的较大差异也提示,应在同种试验条件下对提取物和单体类黄酮进行比较验证。如Seradj等[44]在体外条件下,比较了柑橘黄酮及其6种单体(200 μg/g DM),发现除了新北美圣草苷和柚皮苷外,均能降低瘤胃CH4产量,说明聚合物和单体在抑制CH4上可能具有不同的剂量阈值。而Stoldt等[49]发现荞麦种子提取物及其主要类黄酮单体芦丁(100 mg/kg BW)均不影响泌乳奶牛CH4排放,可能是芦丁在瘤胃内存留时间较短,不足以发挥抑CH4作用。因此,在商业化应用之前,必须为每种类黄酮精确添加剂量,同时兼顾成本,以减少CH4产量而不会对瘤胃发酵产生负面影响。
5.3 瘤胃微生物适应性
从前文和表2和表3可以看出,体外研究得到的效果比体内研究更明显,这很可能是因为类黄酮在分批或连续培养中分布更均匀,微生物能更快地接触到化合物的活性。鉴于影响瘤胃稀释率的因素较多,瘤胃内食糜会快速流出,因此很难确定黄酮在瘤胃内达到有效作用的所需剂量[66]。通常,植物活性物质只有在连续添加后才能在瘤胃中达到稳定浓度进而发挥作用[67]。相比之下,一些体内长期研究表明,添加类黄酮等活性物质后,对瘤胃发酵的影响随时间延长而减弱[48],这可能是由于瘤胃微生物对黄酮的适应性。适应机理可能涉及瘤胃内活性分子的降解或中和,或微生物对化合物的耐受或抗性机制的发展[68]。在这种情况下,CH4产量的减少可能是类黄酮最初表现出抗菌活性的短暂结果,这应该是大多数体内研究中降低CH4影响持续性有限的主要原因。而开发具有持久效果的类黄酮添加剂就有必要研究瘤胃微生物对黄酮的适应过程和机理。
6 小 结
类黄酮在天然植物中分布广泛,具有多种生物活性,是未来畜牧生产中极具潜力的饲料添加剂。现有研究证明,类黄酮在反刍动物瘤胃微生物生态系统调控,特别是抑制CH4生成中发挥重要作用,未来的研究应集中在类黄酮的精准定性定量、瘤胃内代谢和吸收规律、代谢产物与微生物之间的相互作用和瘤胃微生物的适应性,以进一步改进类黄酮降低瘤胃CH4排放,改善瘤胃内环境的效果。

