N-氨甲酰谷氨酸对荷藏杂交牛产奶性能和高原适应性的影响
姜奥宇 巴桑珠扎 李 斌 吴祎程 彭锦芬 吕小康 刘梓欣 黄喜妹 周传社* 陈 亮 谭支良
(1.中国科学院亚热带农业生态研究所,中国科学院亚热带农业生态过程重点实验室,畜禽养殖污染控制与资源化技术国家工程实验室,动物营养生理与代谢过程湖南省重点实验室,长沙410125;2.中国科学院大学,北京100049;3.西藏自治区农牧科学院畜牧兽医研究所,拉萨850000;4.中山市能和生物科技有限公司,中山528415;5.沈阳农业大学乡村振兴战略研究院,沈阳110866)
西藏地区高寒、低氧,基础物资十分匮乏,酥油(主要成分为乳脂)含有多种营养物质,是藏族人民的生活必需品。2019年,西藏自治区奶牛存栏约44.02万头,但产奶量仅为42.39万t,鲜奶缺口约7.59万t,奶牛品种原始以及单产不足的问题已严重制约西藏地区奶业发展。对此,西藏地区自2014年开始引进区外良种奶牛,但实际生产中发现,高海拔低氧环境中的良种奶牛易出现脂质和糖类代谢紊乱等问题,从而导致高原病的产生和恶化[1]。高原病常见于海拔2 000 m以上地区的奶牛群体,氧气浓度降低诱发奶牛肺动脉高压,进而导致胸部水肿和心衰竭等病变影响机体健康。研究表明,引进到拉萨地区的荷斯坦奶牛高原病致死率为36.72%,并且冬季空气中氧浓度降低与奶牛高死亡率存在相关性[2],严重阻碍西藏地区奶业发展,因此防控奶牛高原病,提升其适应性尤为重要。
精氨酸(Arg)作为一种条件性必需氨基酸和多功能性氨基酸,不仅可以调控乳腺上皮细胞增殖以及酪蛋白合成过程,而且在精氨酸酶作用下可水解成尿酸和鸟氨酸,参与多胺的合成[3]。除此之外,作为体内合成一氧化氮(NO)的唯一前体,Arg可通过多环鸟苷-3’, 5’-单磷酸依赖通路促进线粒体的氧化磷酸化反应,从而调节动物机体的葡萄糖、脂肪酸和氨基酸代谢[4]。但Arg直接添加到饲粮中,不仅成本高,而且易与赖氨酸在转运系统以及代谢通路中产生拮抗反应[5]。N-乙酰谷氨酸(N-acetylglutamate,NAG)是一种氨基酸衍生物,可通过激活氨基甲酰磷酸合酶-Ⅰ(CPS-Ⅰ)促进氨基甲酰磷酸合成,促进L-脯氨酸和谷氨酸转化为L-瓜氨酸,在天冬氨酸以及精氨酸代琥珀酸裂解酶的参与下,最终转化成L-Arg[6]。N-氨甲酰谷氨酸(N-carbamylglutamate,NCG)作为NAG的结构类似物,其功能与NAG相似,而且在机体代谢中稳定性较强,可以参与尿素循环来促进内源性Arg生成。Chacher等[7]通过24 h体外发酵试验发现,相比于Arg在瘤胃液环境中完全降解,NCG降解率仅为17.8%。因此,NCG作为稳定高效的添加剂,其在奶牛生产中的应用受到广泛关注。
Chacher等[8]研究发现,高产奶牛饲粮中添加20 g/d NCG时,乳、血浆和尿液中的尿素氮含量达到最低值,代谢蛋白质利用率提高。从围产前期开始饲喂NCG可以促进奶牛机体内源性Arg合成,显著提高乳腺血浆流量和氨基酸含量,改善围产后期奶牛肝脏功能和干物质采食量(DMI)[9]。Gu等[10]在泌乳中期奶牛饲粮中添加40 g/(头·d)NCG时,乳脂和乳蛋白含量分别提高7.89%和3.31%,血浆中内源性Arg合成的增强导致必需氨基酸和生糖氨基酸总量提高,使得乳品质得到明显改善。另有学者发现,NCG在围产期奶牛中应用效果最佳,其次为泌乳高峰期、泌乳早期和泌乳中期[11]。然而,NCG在奶牛上的研究主要集中在低海拔地区泌乳期和围产期奶牛上,针对NCG在高海拔低氧环境中奶牛的研究比较少见。
在高海拔低氧环境中,奶牛抗炎症以及葡萄糖和脂质代谢相关基因表达下调,盲肠与结肠中厚壁菌门/拟杆菌门降低,导致机体糖类和脂类代谢异常,能量供应不足,同时诱发奶牛体内炎症反应,加剧高原病恶化[1]。因此,奶牛转移到高原环境后需要提高其血液供氧能力,预防心血管系统障碍及其诱发的其他系统疾病,保障奶牛机体健康以维持正常泌乳水平。作为高效的血管舒张因子,NO早已被证实可抑制肺动脉血管收缩,提升高原肺水肿大鼠的存活率[12]。NCG可以促进内皮型一氧化氮合酶(endothelial nitricoxide synthase,eNOS)的合成,增加血浆中NO含量,进而改善肺血管壁结构,有效降低奶牛肺血管压力和心脏负荷[13]。因此,本研究旨在评价在泌乳期奶牛饲粮中添加NCG对奶牛养分表观消化率、泌乳性能、血清抗氧化以及抗高原反应指标的影响,为提升高海拔地区泌乳奶牛的生产性能提供科学依据和数据支持。
1 材料与方法
1.1 试验动物与试验设计
试验选择20头泌乳前期荷斯坦奶牛×西藏黄牛杂交第3代奶牛[胎次2.0±0.7,体重(413±42) kg,体况评分3.36±0.26],随机分为2组,每组10头。对照组(CON组)饲喂基础饲粮,试验组(NCG组)在基础饲粮中添加20 g/(头·d)NCG(中山市某生物科技有限公司,含量≥80%)。试验期45 d,其中预试期15 d,正试期30 d。试验于2021年6月12日至2021年7月25日在西藏自治区山南市巴桑奶牛养殖专业合作社(海拔3 700 m)进行。
1.2 饲粮与饲养管理
基础饲粮为合作社固定饲粮,以精料混合料以及粗饲料形式(精∶粗=1∶9)分开饲喂,基础饲粮组成及营养水平如表1所示。试验奶牛采用栓系式饲养,饲喂前将NCG与精料混合料预混合,然后与1/3粗饲料进行混合饲喂,每天饲喂2次(07:00和18:00),挤奶2次(06:30和17:00),奶牛自由采食及饮水,剩料量控制在3%~5%,称取每日给料量和剩料量,用于计算DMI。

表1 基础饲粮组成及营养水平(干物质基础)
1.3 样品采集与检测指标
1.3.1 饲粮和粪便中养分含量
在正试期第28~30天,采用直肠取粪法连续收集2组奶牛粪样6次,最后将每头牛的粪样均匀混合后取200 g左右,按照1/4粪重比例加入10%的酒石酸进行固氮,用于测定粪中养分和酸不溶灰分(AIA)含量。将饲粮和粪便样品置于65 ℃烘箱干燥72 h后,取出样品自然回潮24 h,随后将样品放入105 ℃烘箱直至恒重,取200 g样品粉碎后通过1 mm筛。饲粮和粪便中干物质(DM)、粗蛋白质(CP)、粗脂肪(EE)和粗灰分含量分别按照GB/T 6435—2014、GB/T 6432—2018、GB/T 6433—2006、GB 6438—2007方法进行测定,钙(Ca)含量按照GB/T 6436—2002的高锰酸钾法进行测定,磷(P)含量按照GB/T 6437—2002的分光光度法进行测定,中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量分别按照GB/T 20806—2006和NY/T 1459—2007的方法进行测定。参照Van Keulen等[14]提供的方法,利用粪和饲粮中的AIA做内源指示剂,计算养分表观消化率,计算公式如下:
养分表观消化率(%)=100×[1-(Ad×Nf)/
(Af×Nd)]。
式中:Ad和Af分别为饲粮和粪中的AIA含量(g/kg);Nd和Nf分别为饲粮和粪中某养分含量(g/kg)。
1.3.2 乳品质
在正试期第30天,在挤奶时间点分别采集奶样1次,将早、晚采集的奶样按5∶5混合,取50 mL加重铬酸钾防腐剂混合均匀,样品使用Milko Scan FT+200 76150型多功能乳成分分析仪(丹麦Foss Electric公司)进行检测,测定指标包括乳蛋白率、乳脂率、乳糖率及乳尿素氮、总固形物以及非脂乳固体含量,乳体细胞数量使用Fossomatic FC 79910体细胞分析仪(丹麦Foss Electric公司)测定。4%乳脂校正乳(FCM)产量计算公式[15]如下:
4%乳脂校正乳=M×(0.4+0.15F)。
式中:M为产奶量;F为乳脂率。
1.3.3 瘤胃发酵参数
在正试期第30天,在试验奶牛喂后2和6 h,使用MDW-15型胃管式瘤胃液采样器(中国上海硅狄科学仪器有限公司)通过奶牛口腔采集瘤胃液。将采集的瘤胃液装入10 mL离心管,使用UB-7型pH计(美国Denver Instrument公司)测定瘤胃液pH后,迅速放入-20 ℃冰箱保存,用于测定瘤胃液中氨态氮(NH3-N)含量。另取瘤胃液,4 ℃下15 000×g离心10 min,取上清液1.5 mL,加入0.15 mL 25%偏磷酸固定后置于-20 ℃冰箱保存,用于测定总挥发性脂肪酸(TVFA)及各挥发性脂肪酸(VFA)含量,瘤胃液中NH3-N和VFA含量分别参照Wang等[16]和Weatherburn等[17]方法测定。瘤胃液中微生物蛋白质(MCP)含量使用紫外分光光度计(UV1901,波长:260 nm)参照Zinn等[18]分光光度法进行测定。
1.3.4 血清生化与抗氧化指标
在正试期第29~30天,连续2 d于晨饲前使用真空采血管进行尾根静脉采血10 mL,4 ℃下2 040×g离心15 min,取2 mL上层血清于离心管中,置于-20 ℃冰箱保存。
血清生化指标:血清葡萄糖(GLU)、白蛋白(ALB)、尿素氮(UN)、甘油三酯(TG)、总胆固醇(TCHO)含量和谷丙转氨酶(ALT)、谷草转氨酶(AST)活性采用CX-4型全自动生化分析仪(美国Beckman公司)测定,所用试剂盒均购自南京建成生物工程研究所。
血清抗氧化指标:血清过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)活性分别采用相应的酶联免疫吸附测定(ELISA)试剂盒(中国江苏酶免实业有限公司)测定,测定方法参照试剂盒说明书;血清丙二醛(MDA)含量和总抗氧化能力(T-AOC)采用北京盒子生工科技有限公司对应试剂盒测定,测定方法参照试剂盒说明书;活性氧(ROS)含量采用荧光探针DCFH-DA技术进行检测,所用试剂盒购自上海碧云天生物技术有限公司。
1.3.5 血清抗高原反应因子
血清促红细胞生成素(EPO)、低氧诱导因子-1(HIF-1)、血管内皮生长因子(VEGF)、内皮素-1(ET-1)、C型利钠肽(CNP)含量和血管紧张素转化酶(ACE)、eNOS、诱导型一氧化氮合酶(iNOS)活性分别使用相应的ELISA试剂盒(中国江苏酶免实业有限公司)测定,测定方法参照试剂盒说明书;血清NO含量采用北京盒子生工科技有限公司对应试剂盒测定,测定方法参照试剂盒说明书。
1.4 数据统计分析
数据经Excel 2010初步处理,使用SPSS 26.0软件中的独立样本t检验进行组间差异显著性比较,P<0.05和0.05≤P<0.10分别表示具有显著差异和差异趋势,结果以平均值和均值标准误(SEM)表示。
2 结 果
2.1 DMI和养分表观消化率
由表2可知,NCG组4% FCM和饲料转化率比CON组分别提高39.35%和54.16%(P<0.05),但NCG组和CON组DM、CP、EE、NDF、ADF表观消化率以及DMI均无显著差异(P>0.05)。
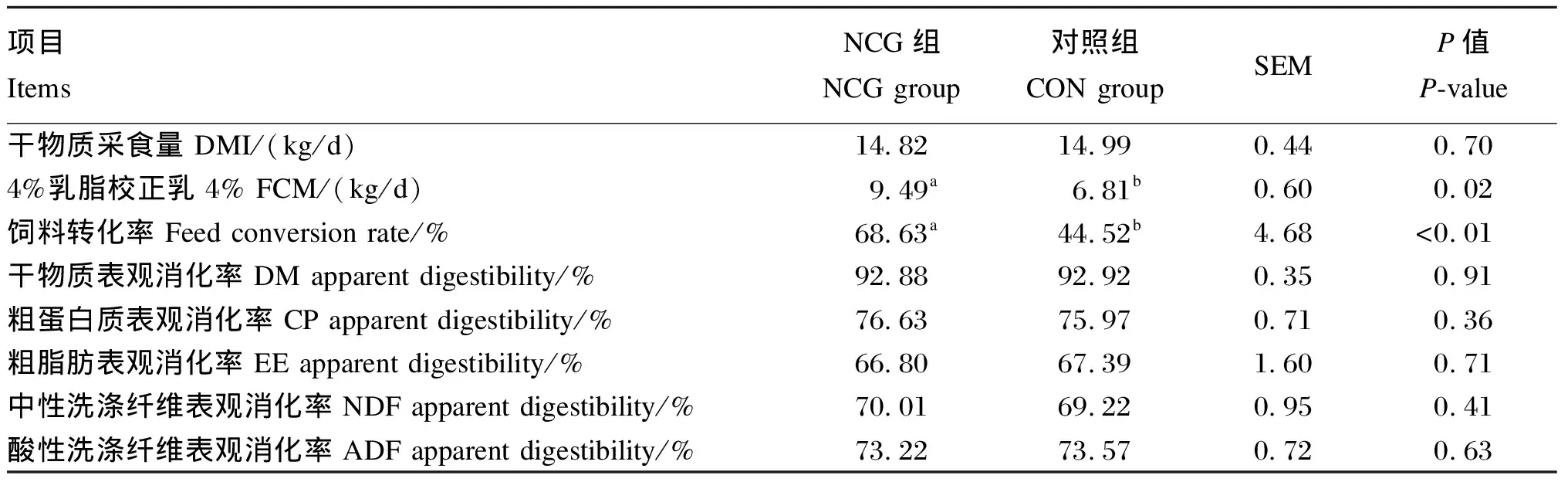
表2 NCG对奶牛DMI和养分表观消化率的影响
2.2 泌乳性能
由表3可知,NCG组产奶量和乳总固形物含量显著高于CON组(P<0.05),CON组乳糖率相较于NCG组具有升高的趋势(0.05
2.3 瘤胃发酵参数
由表4可知,与CON组相比,NCG组瘤胃液NH3-N含量降低38.11%(P<0.05),同时MCP含量提高12.43%(P<0.05),异戊酸含量显著降低(P<0.05),异丁酸含量具有降低的趋势(P=0.07),而乙酸/丙酸具有升高的趋势(P=0.07)。2组试验奶牛瘤胃液TVFA、乙酸、丙酸、丁酸、戊酸含量以及pH均无显著差异(P>0.05)。

表3 NCG对奶牛泌乳性能的影响

表4 NCG对奶牛瘤胃发酵参数的影响
2.4 血清生化指标
由表5可知,与CON组相比,NCG组血清TCHO含量和ALT活性分别降低25.78%和15.62%(P<0.05),TG含量显著升高(P<0.05),2组间血清GLU、ALB、UN含量和AST活性均无显著差异(P>0.05)。

表5 NCG对奶牛血清生化指标的影响
2.5 血清抗氧化指标
由表6和图1可知,与CON组相比,NCG组血清GSH-Px、SOD活性以及T-AOC显著升高(P<0.05),同时血清MDA含量显著降低(P<0.05),ROS含量显著降低(P<0.05),2组间血清CAT活性无显著差异(P>0.05)。

表6 NCG对奶牛血清抗氧化指标的影响

* 表示与CON组相比差异显著(P<0.05)。
2.6 血清抗高原反应因子
由表7可知,NCG组血清VEGF、NO含量以及eNOS、iNOS活性显著高于CON组(P<0.05),2组间血清EPO、HIF-1、ACE、ET-1和CNP含量无显著差异(P>0.05)。
3 讨 论
3.1 NCG对奶牛DMI和养分表观消化率的影响
在海拔3 600 m左右的拉萨地区,大气中氧分压仅为海平面的60%,奶牛由于供氧不足导致心率增加,平均呼吸频率和血氧饱和度低于健康水平,平均肺动脉压力陡增至健康水平近2倍,奶牛的生理机能面临严峻考验[1]。Qiao等[19]研究表明,高原地区的泌乳前期中国荷斯坦奶牛平均DMI为16.08 kg,而且DMI以及各养分消化率与低海拔地区奶牛相比无显著差异。与此同时,任利圆[20]在平原地区饲喂奶牛不同剂量NCG发现,各养分表观消化率相较对照组有所增加但差异不显著。本试验中,2组奶牛DMI以及各养分表观消化率无显著差异,这可能是因为饲粮粗纤维水平较高,奶牛采食后瘤胃降解速率降低,容易产生饱腹感[21]。这些数据表明,奶牛对饲粮养分的消化吸收作用受海拔因素影响较小,并且在高纤维饲粮水平下,NCG对奶牛采食量无显著增加效果。Cieslar等[22]研究发现,作为NCG代谢通路上的重要信号分子,NO可通过作用于环状鸟苷酸促进血管平滑肌松弛,增加奶牛乳腺血浆流量,促进乳腺血管增生从而增加产奶量,推测为本试验中NCG组奶牛4% FCM显著提升的原因之一,同时与下文中NCG提升奶牛泌乳性能的试验结果一致。
3.2 NCG对奶牛泌乳性能的影响
高原环境中氧气浓度低,而乳腺分泌乳汁能量需求较大,由此乳腺主要功能方式转化为无氧呼吸,易诱导乳腺细胞癌变和分化[23],泌乳性能随之受到影响。前人研究表明,荷斯坦奶牛在高原习服1年后,产奶量和乳蛋白率分别降低19.20%和4.22%,泌乳性能在低氧环境中受到抑制[24]。而董旭晟等[25]发现,在围产期奶牛饲粮中添加NCG可分别提升4% FCM产量和乳蛋白率13.08%和6.46%以上,且围产后期添加NCG的作用效果优于围产前期。本试验中,补充NCG提高了奶牛产奶量和总固形物含量,有效降低乳尿素氮含量,奶牛的氮素利用率得到改善,这可能是Arg参与机体氮素运输、储存、排泄以及尿素循环的结果。在精氨酸酶的作用下,Arg转化为鸟氨酸进入线粒体促进尿素循环,合成更多含氮化合物参与MCP以及乳蛋白合成[8]。同时NCG可提高奶牛血液中性粒细胞关键功能基因的表达,改善机体免疫系统的吞噬杀菌功能[11],因此,本试验中NCG组牛乳中体细胞数量相较于CON组减少9.10%。除此之外,NCG可通过激活细胞线粒体内的CPS-Ⅰ促进氨甲酰磷酸合成,转移至细胞质中进一步生成Arg及相关代谢产物,提升牛奶中Arg、脯氨酸和天冬氨酸含量[9]。丁洛阳[26]研究表明,NCG可通过“Arg-鸟氨酸-腐胺”代谢途径调控乳腺上皮细胞合成酪蛋白。因此,后续试验可进一步分析牛奶中各氨基酸以及蛋白质组分,为提升高海拔地区奶牛的乳品质提供数据支撑。
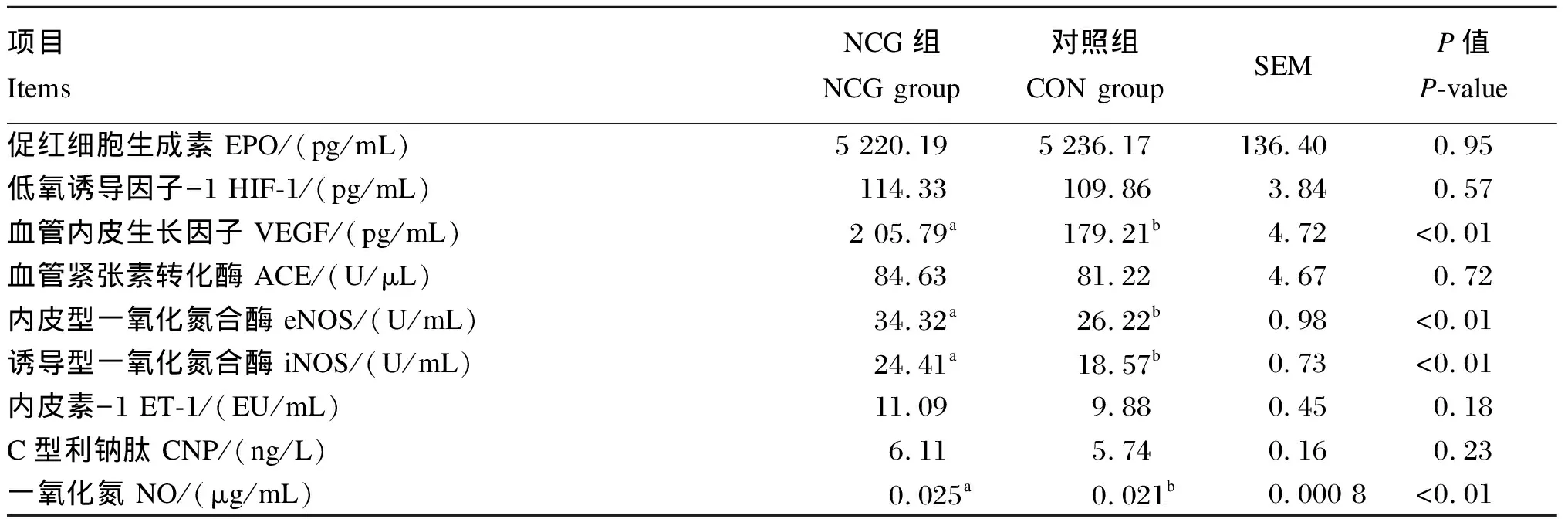
表7 NCG对奶牛血清抗高原反应因子含量的影响
3.3 NCG对奶牛瘤胃发酵参数的影响
研究表明,高海拔低氧环境会影响奶牛瘤胃微生物区系,降低瘤胃球菌属和短杆真菌属丰度,导致机体能量供应不足以及抗炎症作用减弱,加速奶牛高原病的产生[1]。瘤胃液pH是体现瘤胃内发酵状况的重要指标,本试验中,2组试验奶牛瘤胃液pH均处于正常范围(6.0~7.0)内[27],因此,在饲粮中添加NCG对奶牛瘤胃正常发酵无显著影响。瘤胃微生物利用内源和外源含氮物质代谢产生的NH3-N是合成MCP的主要原料,瘤胃内NH3-N以及MCP含量可反映微生物合成蛋白质的效率[28]。研究发现,饲粮中添加NCG可有效促进奶牛尿素循环,显著提升微生物利用NH3-N合成MCP的效率,并且满足奶牛泌乳活动的能量需求[29]。本试验结果表明,NCG组奶牛瘤胃微生物对NH3-N的利用程度显著高于CON组,这可能是因为NCG促进瘤胃上皮细胞和十二指肠细胞吸收NH3-N,为合成MCP提供充足氮源,减少NH3-N降解导致的氮源损失[30]。
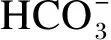
3.4 NCG对奶牛血清生化指标的影响
作为血清中的主要脂类物质,TG和CHOL能够反映机体吸收和代谢脂肪的状况。血清GLU可促进奶牛乳腺上皮细胞增殖,增加酪蛋白和哺乳动物雷帕霉素靶蛋白等基因表达量,改善乳腺上皮细胞对GLU的摄取能力[33],健康动物体内GLU含量保持动态平衡。姚琨[1]研究表明,患有高原病的奶牛体内Lcat、Apoc4和Rbp4等脂类、淀粉以及GLU代谢相关基因表达下调,导致机体糖酵解紊乱以及能量供应不足。本试验中,NCG组奶牛的血清CHOL含量相较于CON组降低25.77%,同时GLU含量有所增加,这说明补充NCG可促进奶牛肝脏糖异生代谢过程,协助氨基酸代谢并且对预防代谢性酸中毒具有重要作用。
肝脏细胞内ALT和AST贮存量较高,当肝脏细胞受损时,细胞膜通透性增加导致ALT和AST释放进入血液,因此可作为肝脏功能的评价指标[34]。本试验结果表明,NCG组奶牛血清ALT显著低于CON组,表明肝脏的生理功能得到改善,因此NCG对于高海拔低氧环境中奶牛的肝脏细胞具有良好的修复效果。白蛋白可稳定体内血浆渗透压、协助运输代谢物质,转化为组织蛋白后可参与组织生长以及受损组织修复。本试验中,2组试验奶牛血清ALB含量无显著差异,结合DMI以及CP表观消化率数据,说明NCG对奶牛消化吸收饲粮蛋白质无负面影响。
3.5 NCG对奶牛血清抗氧化指标的影响
Pena等[35]研究发现,低氧低压可诱发机体氧化应激,增加体内ROS和MDA含量,并通过相关炎症途径诱发高原肺水肿和脑水肿等高原病,揭示了氧化应激与高原病的相关性。
本试验结果表明,饲粮中添加NCG可显著提升血清GSH-Px和SOD活性以及T-AOC,血清中MDA和ROS含量分别降低31.63%和12.99%,奶牛抗氧化能力得到增强,机体氧化代谢维持动态平衡状态。NCG进入体内后,可通过提升抗氧化基因表达以及核因子红系2-相关因子2、Kelch样环氧氯丙烷相关蛋白-1和哺乳动物雷帕霉素靶蛋白等信号分子的含量,有效缓解脾脏氧化应激以及炎症反应[36]。赵相洋等[37]研究表明,NCG可通过转化成Arg抑制体内脂质氧化过程来降低MDA含量,同时下游产物NO也可中和血液中ROS,且饲粮中添加20 g/(头·d)NCG对机体抗氧化能力的提升效果最为明显。NCG组奶牛抗氧化性能得到提升,同时发生炎症反应以及高原病的概率降低,因此奶牛的泌乳性能和免疫性能得到保障,这与前人研究结果[10,29]一致。
3.6 NCG对奶牛血清抗高原反应因子含量的影响
研究发现,高原病奶牛血液中铁离子以及血细胞数含量显著降低,机体氧气输送能力大幅减弱,并且血管内膜结构受损进一步导致肺动脉高压和心脏衰竭等病变,难以适应高海拔低氧环境[1-2]。NOS包含iNOS、eNOS和神经型一氧化氮合成酶(nNOS)3种不同亚型,在NOS和四氢生物嘌呤的作用下,Arg代谢生成NO和瓜氨酸,NO可通过舒张血管平滑肌降低肺动脉血管阻力[38]。Wang等[12]研究发现,患有肺动脉高压的奶牛eNOS活性降低进而恶化病情,补充NCG可通过促进eNOS和内源性NO合成,降低奶牛平均肺动脉压力和外周收缩压力,对预防低氧环境下奶牛的心血管损伤发挥重要作用。本试验结果表明,NCG组奶牛血清eNOS、iNOS活性以及NO含量分别增加30.89%、31.45%和19.05%,说明试验奶牛摄取和转运NCG的能力未受到抑制,且NCG促进eNOS和iNOS表达的同时增加血清中NO含量,有利于维护奶牛心血管完整性,缓解高原适应症,改善奶牛体况以及生产性能。
作为一种高效的血管内皮细胞有丝分裂原和通透性因子,VEGF具有增强血管通透性、维持和重塑现有血管以及促进血管内皮细胞增殖等作用[39]。本试验结果表明,补充NCG可增加血清VEGF含量,促进低氧环境下奶牛体内新生毛细血管的形成,增强奶牛血液运输氧气的能力。ET-1是动物体内具有收缩血管功能的生物活性多肽,主要在肺部发挥收缩血管、促进腺体分泌和释放炎性介质等作用。本试验中,NCG组奶牛血清ET-1含量相比CON组增加12.25%,这可能是机体NO等舒张血管因子大量增加的原因导致ET-1含量代偿性增加,有利于血管压力保持动态平衡状态。
4 结 论
高海拔低氧环境中,NCG可提升瘤胃微生物对NH3-N的利用效率,有效减少奶牛体内氮源损失。同时,NCG可以维持机体GLU和脂质代谢平衡,改善奶牛肝脏代谢以及氮素循环,提高机体抗氧化以及免疫性能,降低炎症反应和高原病的发生概率。在奶牛体内,NCG可促进eNOS、iNOS、NO和VEGF等抗高原反应因子合成,不仅可通过促进乳腺血管增生来增加奶牛产奶量,而且可以维持心血管通道完整性,对缓解奶牛高原适应症具有重要意义。

