凤尾草总黄酮调控miR-1274a表达抑制胃癌>AGS细胞增殖、迁移和侵袭的机制研究
李威 王婷 张红蕾
胃癌是全球癌症相关死亡的第二大原因[1]。目前,胃癌主要采用手术联合放疗、化疗和靶向治疗等现代治疗策略,但仍存在疗效低、毒性大、复发转移率高等缺点。因此,研究胃癌进展的机制,确定有效的药物或治疗靶点具有重要意义。凤尾草总黄酮是从凤尾蕨科、凤尾蕨属植物Pteris multifida Poir中提取的有效活性成分,近年研究表明凤尾草总黄酮对多种癌症具有显著的抗肿瘤活性[2]。如凤尾草总黄酮可抑制宫颈癌细胞增殖和肿瘤形成,抑制骨肉瘤细胞迁移和侵袭[2,3]。然而,凤尾草总黄酮在胃癌中的抗癌功能未见报道。微小RNA(miRNA)是单链、内源性RNA转录本,其通过与靶向mRNA结合,导致mRNA降解和翻译抑制,参与多项细胞活动[4]。目前,多种miRNA已被证实在胃癌中表达失调,参与胃癌发生和进展[5]。miR-1274a在胃癌中表达上调,并直接靶向叉头转录因子4(FOXO4)加速胃癌细胞增殖和迁移[6]。前期预实验显示凤尾草总黄酮能够下调胃癌细胞中miR-1274a表达水平。因此,本研究假设凤尾草总黄酮通过下调miR-1274a在胃癌中发挥抗癌作用,并通过体外实验进行验证,为开发凤尾草总黄酮为新型抗胃癌药物提供实验依据。
1 材料与方法
1.1 材料与试剂 人胃癌细胞AGS、Ham’s F-12培养液、胎牛血清、青链霉素双抗购于武汉普诺赛生命科学公司;Lipofectamine 2000购自美国Invitrogen公司;miRNA模拟物(mimics)、miRNA抑制物(anti-miRNA)购自广州锐博生物公司;凤尾草由我院中药房提供;Transwell板(24孔)购自美国Corning公司;四甲基偶氮唑盐(MTT)试剂盒、辣根过氧化物酶标记山羊抗兔IgG(A0208)、基质金属蛋白酶2(MMP-2)兔源多克隆抗体(AF0234)、MMP-9兔源多克隆抗体(AF5234)、磷酸甘油醛脱氢酶(GAPDH)兔源单克隆抗体(AF1186)、TRIzol试剂购自上海碧云天生物研究所;Mir-X miRNA第一链合成试剂盒、SYBR Premix Ex Taq II购自大连Takara生物公司。
1.2 方法
1.2.1 凤尾草总黄酮制备[3]:将200 g凤尾草粉碎,按照料液比1∶120加入70%乙醇溶液,60℃条件下提取2次,2 h/次。合并提取液,经冻干得固体4.0 g,溶解于400 ml磷酸盐缓冲液中,15 000 r/min速度离心15 min,离心3次,收集上清液,0.22 mm滤膜过滤除菌后保存于4℃冰箱。以芦丁为对照测定总黄酮含量,溶液配制成总黄酮含量为10 mg/ml保存备用。
1.2.2 细胞培养:AGS细胞接种含有Ham’s F-12培养液(含10%胎牛血清、1%青链霉素双抗)的培养皿中置于含95%空气、5%CO2、37℃培养箱培养,当培养皿中细胞铺板率约80%时胰酶消化1∶3传代,换液频率为2~3次/周。选择第5代对数期AGS进行实验。
1.2.3 实验分组:将AGS细胞以1×105个/孔的密度接种24孔板,当细胞铺板率约50%时分别转染anti-miR-NC、anti-miR-1274a、miR-1274a mimics、miR-NC至AGS细胞中,具体步骤参照Lipofectamine 2000说明书。转染48 h收获AGS细胞,RT-qPCR检测miR-1274a的相对水平验证转染效果。用含0、5、10、20 g/L凤尾草总黄酮[3]的培养液孵育AGS细胞,记为对照组、凤尾草总黄酮-低组、凤尾草总黄酮-中组、凤尾草总黄酮-高组。转染anti-miR-NC的AGS细胞记为anti-miR-NC组;转染anti-miR-1274a的AGS细胞记为anti-miR-1274a组;用含20 g/L凤尾草总黄酮的培养液孵育转染miR-1274a mimics、转染miR-NC的AGS细胞,分别记为凤尾草总黄酮+miR-NC组、凤尾草总黄酮+miR-1274a组。
1.2.4 MTT法检测细胞增殖:将未转染AGS细胞,转染anti-miR-NC、anti-miR-1274a、miR-1274a mimics、miR-NC的AGS均以5×103个/孔密度接种96孔板,每组设置3个复孔。按照实验分组用含对应浓度凤尾草总黄酮的培养液孵育细胞48 h。更换为新鲜培养液,加入MTT溶液(20 μl)孵育4 h,加入二甲基亚砜(150 μl)反应15 min,低速振荡溶解结晶。酶标仪在490 nm测量吸光度(A)。抑制率=(1-实验组/对照组)×100%。实验重复3次。
1.2.5 平板克隆实验检测克隆形成:胰酶消化各组AGS细胞,用新鲜培养液重悬细胞。每组取300个AGS细胞接种6孔板,转动平板使细胞均匀分散。每组设置3个复孔。将6孔板放入含95%空气、5%CO2、37℃培养箱孵育12~14 d,当6孔板中出现肉眼可见的克隆时终止培养。弃去培养液,4%多聚甲醛固定细胞克隆,0.1%结晶紫染色。在显微镜下拍照,计数>50个细胞的克隆数。实验重复3次。
1.2.6 划痕愈合实验检测细胞迁移:每组取1×104个AGS细胞接种6孔板,放入含95%空气、5%CO2、37℃培养箱培养至细胞铺板6孔板底。每组设置3个复孔。用200 μl移液吸头尖端垂直6孔板直接划伤单层细胞。洗去细胞碎片,加入无血清培养基置,放入含95%空气、5%CO2、37℃培养箱培养。在初始培养时和培养24 h时用显微镜拍照,ImageJ测量初始划痕距离和24 h划痕距离。划痕愈合率(%)=(初始划痕距离-24 h划痕距离)/初始划痕距离×100%。实验重复3次。
1.2.7 Transwell实验检测细胞侵袭:将各组AGS细胞重悬在无血清培养基中,调整细胞浓度为1×105个/ml。向包被基质胶的Transwell装置上室加入200 μl 细胞悬液,向下室加入600 μl含10%胎牛血清的培养基。每组设置3个平行。放入含95%空气、5%CO2、37℃培养箱培养24 h。取出Transwell装置,擦去上室基质胶和残留的细胞。4%多聚甲醛固定侵袭细胞,0.1%结晶紫染色。将Transwell小室倒置在在显微镜下拍照,随机选择5个视野计数,用平均值表示AGS细胞侵袭数。实验重复3次。
1.2.8 蛋白质印记法检测MMP-2和MMP-9蛋白表达:RIPA裂解液提取AGS细胞总蛋白。定量后,设置电压100 V,时间90 min进行SDS-PAGE。每组设置3个平行。设置电流300 mA、电流30 min进行湿法转膜。取出硝酸纤维素(NC)膜,放入含5%脱脂奶粉的孵育盒中封闭2 h。取出NC膜,放入一抗稀释液中室温孵育2 h。取出NC膜,放入二抗稀释液(1∶3 000)室温反应1 h。化学发光试剂盒显色。Image J软件测定条带灰度值,将GAPDH作为参照,对MMP-2和MMP-9蛋白表达进行半定量分析。MMP-2抗体按照体积比1∶1 000稀释,MMP9抗体和二抗按照体积比1∶1 500稀释,GAPDH抗体按照体积比1∶2 000稀释。实验重复3次。
1.2.9 RT-qPCR检测miR-1274a表达:使用TRIzol试剂从各组AGS细胞中提取RNA,NanoDrop 1000分光光度计法评估提取RNA的浓度和质量(A260/A280值1.8~2.0为合格)。Mir-X miRNA第一链合成试剂盒合成cDNA,然后采用SYBR Premix Ex Taq II进行RT-qPCR检测miR-1274a表达。每组设置3个平行。将U6作为参照,2-ΔΔCt方法计算miR-1274a的相对水平。miR-1274a上游引物5’-GCCGAGTTCAGGTCCCT
GTT-3’,miR-1274a下游引物5’-CTCAACTGGTGTCG
TG GA-3’;U6上游引物5’-GCGCGTCGTGAAGCGTT
C-3’,U6下游引物5’-GTGCAGGGTC CG AGGT-3’。实验重复3次。
2 结果
2.1 凤尾草总黄酮对胃癌AGS细胞增殖的影响 与对照组比较,凤尾草总黄酮(低、中、高)组AGS细胞增殖抑制率显著升高(P<0.05),克隆形成数显著降低(P<0.05)。见表1。

表1 凤尾草总黄酮对胃癌AGS细胞增殖的影响
2.2 凤尾草总黄酮对胃癌AGS细胞迁移和侵袭的影响 与对照组比较,凤尾草总黄酮(低、中、高)组AGS细胞划痕愈合率、侵袭数以及MMP-2蛋白、MMP-9蛋白表达显著降低(P<0.05)。见图1,表2。

图1 凤尾草总黄酮对胃癌AGS细胞迁移侵袭相关蛋白表达的影响

表2 凤尾草总黄酮对胃癌AGS细胞迁移侵袭的影响
2.3 凤尾草总黄酮对胃癌AGS细胞miR-1274a表达的影响 与对照组比较,凤尾草总黄酮(低、中、高)组AGS细胞miR-1274a相对水平显著降低(P<0.05)。见表3。

表3 凤尾草总黄酮对胃癌AGS细胞miR-1274a表达的影响
2.4 干扰miR-1274a表达对胃癌AGS细胞增殖、迁移和侵袭的影响 anti-miR-1274a组AGS细胞中miR-1274a相对水平低于anti-miR-NC组(P<0.05),提示转染anti-miR-1274a可抑制miR-1274a表达。与anti-miR-NC组比较,anti-miR-1274a组AGS细胞增殖抑制率显著升高(P<0.05),克隆形成数、划痕愈合率、侵袭数以及MMP-2蛋白、MMP-9蛋白表达显著降低(P<0.05)。见表4,图2。

表4 干扰miR-1274a表达对胃癌AGS细胞增殖、迁移和侵袭的影响
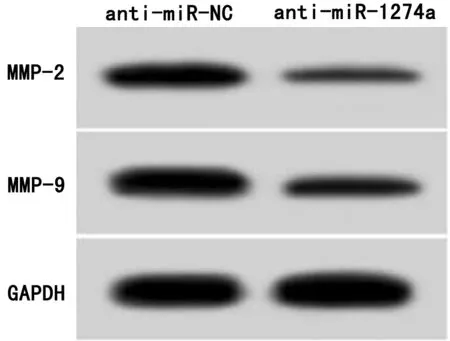
图2 干扰miR-1274a表达对胃癌AGS细胞迁移侵袭相关蛋白表达的影响
2.5 过表达miR-1274a逆转了凤尾草总黄酮(20 g/L)对胃癌AGS细胞增殖、迁移和侵袭的作用 与凤尾草总黄酮+miR-NC组比较,凤尾草总黄酮+miR-1274a组AGS细胞miR-1274a相对水平、克隆形成数、划痕愈合率、侵袭数以及MMP-2蛋白、MMP-9蛋白表达显著升高(P<0.05),增殖抑制率显著降低(P<0.05)。见图3,表5。
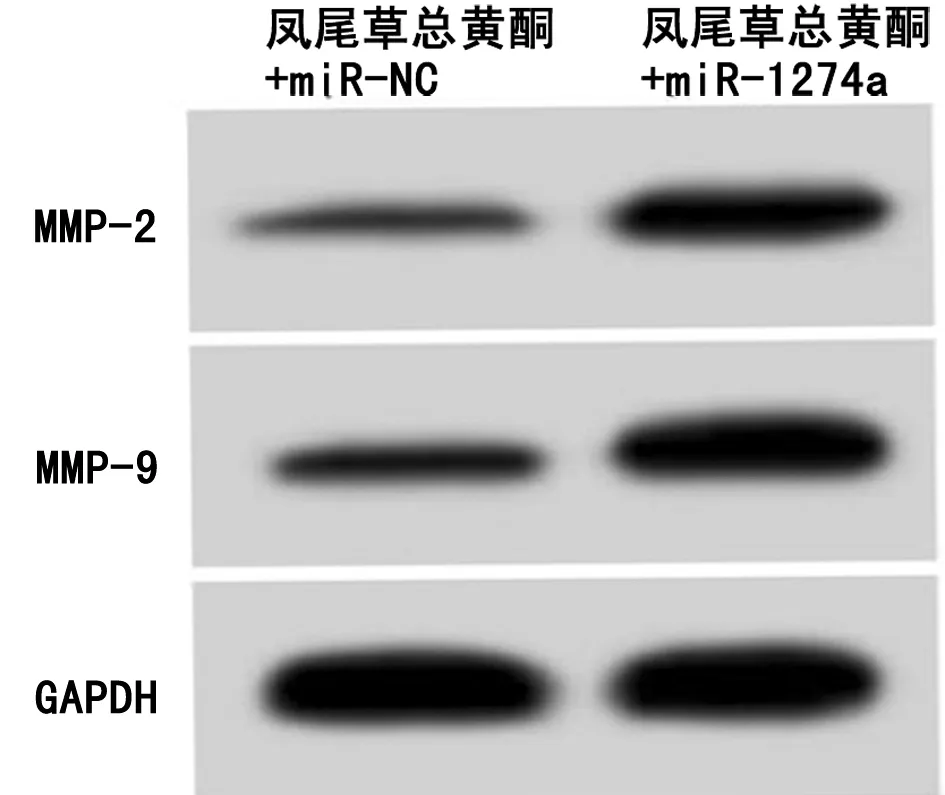
图3 过表达miR-1274a逆转了凤尾草总黄酮对胃癌AGS细胞迁移侵袭相关蛋白表达的作用

表5 过表达miR-1274a逆转了凤尾草总黄酮对胃癌AGS细胞增殖、迁移和侵袭的作用
3 讨论
中药天然产物具有生物活性广泛、低毒、价格低廉等优点,已成为新型抗肿瘤药物开发的巨大宝库[7]。已有的研究表明凤尾草总黄酮在多种癌症中具有抗癌活性,如凤尾草总黄酮可以改善荷瘤小鼠免疫功能,增强其抗氧化能力,抑制小鼠移植瘤H22的生长[8]。凤尾草总黄酮可以降低肺癌和脑胶质瘤细胞迁移能力[9,10]。本研究评估了凤尾草总黄酮对胃癌细胞的体外抗肿瘤作用。
本研究中,MTT和克隆形成实验结果表明,凤尾草总黄酮明显抑制胃癌细胞AGS增殖能力;划痕愈合实验和Transwell实验表明,凤尾草总黄酮还可降低AGS迁移和侵袭能力;此外,实验数据提示,凤尾草总黄酮对AGS细胞的抗增殖、抗迁移和抗侵袭功能具有显著的剂量依赖关系。国外的一项研究表明,肿瘤转移是一个连续、多步骤的过程,其中MMPs可降解细胞外机制中胶原、明胶、纤连蛋白等多种成分,在癌症转移中起关键作用[11]。既往研究表明胃癌组织中MMP-2和MMP-9的高表达与胃癌淋巴结转移、淋巴浸润密切相关,下调MMP-2和MMP-9表达可降低胃癌细胞转移能力[12]。本研究结果表明,凤尾草总黄酮以剂量依赖方式降低MMP-2和MMP-9表达,这进一步证实凤尾草总黄酮对胃癌细胞的迁移和侵袭抑制作用。因此,凤尾草总黄酮有可能成为胃癌侵袭转移的化疗抑制剂。
miRNA失调在胃癌等许多类型癌症中起着至关重要的作用,其差异表达能够调节肿瘤细胞生物学行为。研究显示,前列腺癌、结肠癌中miR-1274a表达上调,miR-1274a高表达与结肠癌淋巴结转移、血管浸润和TNM分期相关相关,并预示结肠癌患者总体生存期较差,抑制miR-1274a表达可降低结肠癌细胞的恶性潜能[13,14]。在透明肾细胞癌中抑制miR-1274a表达显著抑制癌细胞增殖并诱导细胞凋亡[15]。然而,miR-1274a在骨肉瘤miR-1274a表达降低,并促进骨肉瘤细胞的增殖、迁移和侵袭,这种差异可能与miR-1274a的组织特异表达模式相关[16-18]。本研究发现,凤尾草总黄酮显著降低AGS细胞中miR-1274a表达水平,提示凤尾草总黄酮可能通过调控miR-1274a发挥抗胃癌作用。体外功能验证表明,抑制miR-1274a表达显著下调MMP-2和MMP-9表达,降低AGS细胞增殖、迁移和侵袭能力,与凤尾草总黄酮的抗胃癌作用类似。回复实验显示,过表达miR-1274a能够减弱凤尾草总黄酮对AGS细胞恶性行为的抑制作用,这进一步证实凤尾草总黄酮至少通过下调miR-1274a在胃癌中发挥抗癌作用。然而,miR-1274a的下游靶点需要在未来的研究中进一步阐明和证实。
综上所述,凤尾草总黄酮对胃癌细胞具有抗增殖、抗迁移和抗侵袭作用,其机制与下调miR-1274a表达有关,表明凤尾草总黄酮在胃癌治疗中具有潜在的应用价值。

