circATRNL1靶向miR-181a-5p对高糖诱导肾小管上皮细胞损伤的影响
卢迪 黎瑶 梅希 邱平
糖尿病(DM)是一种常见的代谢性疾病,常伴有慢性肾脏损害、视网膜病变等并发症。据报道,超过1/3的DM患者将发展为糖尿病肾病(DN),已成为终末期肾病的主要病因[1]。肾小管损伤是DN的重要特征,研究显示高血糖刺激可诱导活性氧过量产生,导致肾小管上皮细胞凋亡增多;肿瘤坏死因子(TNF)-α等炎性因子可直接破坏肾结构,加剧肾小管损伤[2]。因此,抑制肾小管上皮细胞损伤可能是阻断DN进展的有效策略。环状RNA(circRNA)是一类具有闭环结构的非编码RNA(circRNA),其通过吸附特定微小RNA(miRNA)发挥竞争性内源RNA作用广泛参与细胞过程。许多研究报道circRNA靶向miRNA参与包括DN等DM并发症的进展[3,4]。研究发现miR-181a-5p在脓毒症、骨关节炎等炎症相关疾病中显著升高,抑制其表达对脂多糖诱导的肾小管上皮细胞损伤、白介素(IL)-1β诱导的软骨细胞损伤具有保护作用[5,6]。靶基因预测到circATRNL1与miR-181a-5p存在结合位点。已有研究指出circATRNL1能够抑制IL-1β诱导的软骨细胞炎性反应、细胞凋亡、细胞外基质降解[7]。因此,本研究探讨circATRNL1靶向miR-181a-5p对高糖诱导的肾小管上皮细胞(HK-2)凋亡和炎性反应的影响,为阻断DN进展提供潜在有效靶点。
1 材料与方法
1.1 材料 HK-2细胞(美国ATCC);DMEM培养液(美国Gibco公司);青链霉素双抗、胎牛血清(武汉普诺赛生物公司);pcDNA、pcDNA-circATRNL1、anti-miR-NC、anti-miR-181a-5p、si-circATRNL1、si-NC、miR-NC、miR-181a-5p mimics(上海吉玛制药公司);miRNA逆转录试剂盒(美国ABI公司);PrimeScript逆转录试剂试剂盒(大连Takara生物技术公司);SYBR Green PCR试剂盒(日本Toyobo公司);TNF-α酶联免疫吸附测定(ELISA)试剂盒、IL-6 ELISA试剂盒、RIPA裂解缓冲液、双荧光素酶报告基因检测试剂盒(上海碧云天生物公司);膜联蛋白V(annexin V)-异硫氰酸荧光素(FITC)(南京凯基生物科技公司);甘油醛-3-磷酸脱氢酶(GAPDH)兔多克隆抗体(A01021)、剪切型半胱氨酸蛋白酶9(Cleaved-caspase 9)兔多克隆抗体(ABP50009)、Cleaved-caspase3(IMG-5700)兔多克隆抗体、羊抗兔IgG二抗(A21020)(武汉艾美捷科技公司)。
1.2 方法
1.2.1 细胞培养与分组:HK-2细胞接种含10%胎牛血清+1%青链霉素双抗的DMEM培养液置于37℃、含5%CO2的培养箱培养。当细胞90%融合时1∶3传代。将对数期HK-2细胞以5×105个/孔接种于6孔板过夜,然后用Lipofectamine 2000将pcDNA(2 μg)、pcDNA-circATRNL1(2 μg)、anti-miR-NC(20 nmol/L)、anti-miR-181a-5p(20 nmol/L)、si-NC(20 nmol/L)、si-circATRNL1(20 nmol/L)、pcDNA-circATRNL1(2 μg)与miR-181a-5p mimics(20 nmol/L)、pcDNA-circATRNL1(2 μg)与miR-NC(20 nmol/L)分别转染HK-2细胞,收集转染48 h测定转染效果后进行后续实验。分别用含5.5 mmol/L、25 mmol/L葡萄糖的培养液孵育未转染HK-2细胞24 h[8],分别记为对照(Con)组、高糖(HG)组;用含25 mmol/L葡萄糖的培养液孵育转染pcDNA、pcDNA-circATRNL1、anti-miR-NC、anti-miR-181a-5p、pcDNA-circATRNL1+ miR-181a-5p mimics、pcDNA-circATRNL1+ miR-NC的HK-2细胞24 h,分别记为HG+ pcDNA组、HG+ pcDNA-circATRNL1组、HG+ anti-miR-NC组、HG+anti-miR-181a-5p组、HG+ pcDNA-circATRNL1+miR-181a-5p组、HG+ pcDNA-circATRNL1+miR-NC组。转染pcDNA、pcDNA-circATRNL1、si-NC、si-circATRNL1的HK-2细胞分别记为pcDNA组、pcDNA-circATRNL1组、si-NC组、si-circATRNL1组。
1.2.2 RT-qPCR检测circATRNL1和miR-181a-5p表达:用TRIzol试剂从各组HK-2细胞提取总RNA、miRNA和circRNA分别用miRNA逆转录试剂盒、PrimeScript逆转录试剂试剂盒进行逆转录,采用SYBR Green PCR试剂盒对miRNA和mRNA进行RT-qPCR。根据2-ΔΔCt法计算circATRNL1(内参为GAPDH)和miR-181a-5p(内参为U6)相对表达量。circATRNL1上游引物5’-ACTGGTTTCAACATTT TCTATTCAA-3’;circATRNL1下游引物5’-GCTTCACCCTTCCAGTATTT-3’;GAPDH上游引物5’-GAGTCAACGGATTTGGTCGTT-3’;GAPDH下游引物5’-TTGATTTTGGAGGGATCT CG-3’;miR-181a-5p上游引物5’-ACACTCCAGCTGGGAACATTCAACGCTGTCGG-3’;miR-181a-5p下游引物5’-TGGTGTCGTGGAGTCGA-3’;U6上游引物5’-CTCGCTTGGGCAGCACA-3’;U6下游引物5’-AACGCTTCACGAATTTGCGT-3’。
1.2.3 ELISA法检测细胞上清液中TNF-α和IL-6水平:细胞处理完毕后,收集上清液,2 000 r/min离心20 min。参照ELISA试剂盒说明书操作。
1.2.4 流式细胞术检测凋亡率:用胰蛋白酶消化HK-2细胞,预冷PBS洗涤后,用500 μl的1×结合缓冲液(含5 μl的annexin V-FITC和5 μl的碘化丙啶)重悬1×105个细胞,室温避光孵育20 min。流式细胞仪和FlowJo 8.7.1软件分析各组细胞凋亡情况。
1.2.5 Western blot检测Cleaved-caspase3和Cleaved-caspase9蛋白表达:用RIPA裂解缓冲液提取总蛋白,定量后,取适量蛋白样品在SDS/PAGE凝胶上分离并电转移到PVDF膜,然后在室温下将膜置于5%脱脂牛奶溶液中封闭1 h。随后将膜置于一抗溶液中4℃孵育过夜。次日,将膜与酶标二抗在室温下孵育1 h。滴加ECL试剂进行显色反应。Quantity One 3.0软件测定蛋白条带的相对灰度值,GAPDH为内参。
1.2.6 双荧光素酶报告实验:将含有miR-181a-5p结合位点对的circATRNL1野生型(WT)或突变型(MUT)序列分别克隆到pGL3载体,分别构建重组载体WT-circATRNL1、MUT-circATRNL1。用Lipo 2000将miR-181a-5p mimics或miR-NC分别与WT-circATRNL1或MUT-circATRNL1共转染HK-2细胞。48 h后,用双荧光素酶报告试剂盒评估荧光素酶活性,将萤火虫荧光素酶活性归一化为海肾荧光素酶活性表示相对荧光素酶活性。
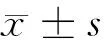
2 结果
2.1 circATRNL1和miR-181a-5p在高糖诱导的HK-2细胞损伤中的表达 与Con组比较,HG组HK-2细胞中circATRNL1相对水平显著降低(P<0.05),miR-181a-5p相对水平显著升高(P<0.05)。见表1。
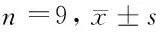
表1 circATRNL1和miR-181a-5p在高糖诱导的HK-2细胞损伤中的表达
2.2 circATRNL1过表达对高糖诱导HK-2细胞损伤的影响 HG组HK-2细胞中circATRNL1相对水平较Con组显著降低(P<0.05),凋亡率、Cleaved-caspase3和Cleaved-caspase9蛋白表达显著升高(P<0.05),细胞培养液中TNF-α和IL-6显著升高(P<0.05)。与HG+pcDNA组比较,HG+pcDNA-circATRNL1组HK-2细胞中circATRNL1相对水平显著升高(P<0.05),凋亡率、Cleaved-caspase3和Cleaved-caspase9蛋白表达显著降低(P<0.05),细胞培养液中TNF-α和IL-6水平显著降低(P<0.05)。见图1,表2。
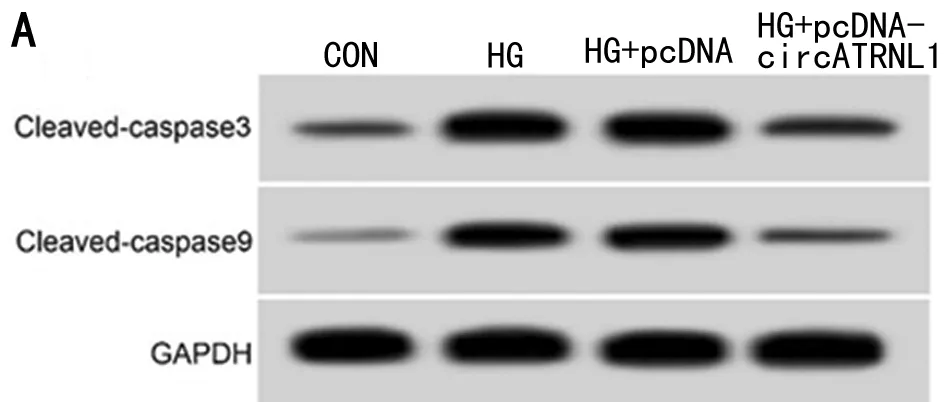
图1 circATRNL1过表达对高糖诱导的HK-2细胞凋亡的影响;A 凋亡相关蛋白表达;B 细胞凋亡流式图
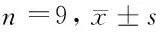
表2 circATRNL1过表达对高糖诱导HK-2细胞损伤的影响
2.3 circATRNL1靶向调控miR-181a-5p的表达 StarBase预测到circATRNL1与miR-181a-5p存在互补核苷酸序列。与miR-NC+WT-circATRNL1组比较,miR-181a-5p+WT-circATRNL1组HK-2细胞的相对荧光素酶活性显著降低(P<0.05);与miR-NC+MUT-circATRNL1组比较,miR-181a-5p+ MUT-circATRNL1组HK-2细胞的相对荧光素酶活性差异无统计学意义(P>0.05)。pcDNA-circATRNL1组HK-2细胞中miR-181a-5p表达水平显著低于pcDNA组(P<0.05);si-circATRNL1组HK-2细胞中miR-181a-5p表达水平显著高于si-NC组,差异有统计学意义(P<0.05)。见表3、4,图2。
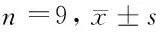
表3 双荧光素酶报告实验
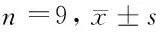
表4 circATRNL1调控miR-181a-5p表达
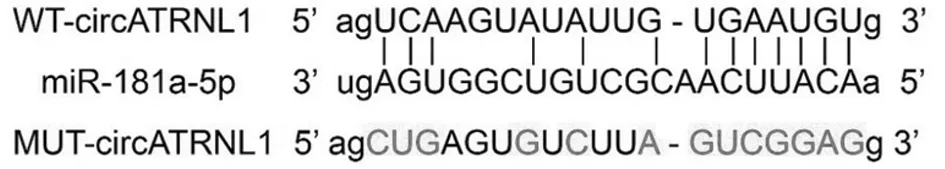
图2 circATRNL1的序列中含有与miR-181a-5p互补的核苷酸序列
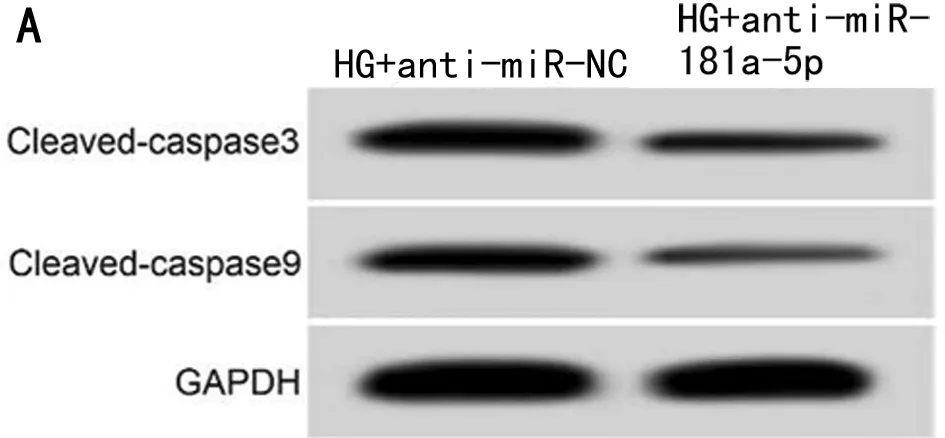
2.4 干扰miR-181a-5p表达对高糖诱导的HK-2细胞损伤的影响 与HG+anti-miR-NC组比较,HG+anti-miR-181a-5p组HK-2细胞中miR-181a-5p表达水平、凋亡率、Cleaved-caspase3和Cleaved-caspase9蛋白表达显著降低(P<0.05),细胞培养液中TNF-α和IL-6水平显著降低(P<0.05)。见表5,图3。
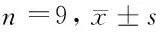
表5 干扰miR-181a-5p表达对高糖诱导的HK-2细胞损伤的影响
2.5 上调miR-181a-5p表达逆转了circATRNL1过表达对高糖诱导HK-2细胞损伤的作用 与HG+pcDNA
-circATRNL1+miR-NC组比较,HG+pcDNA-circATRNL1+miR-181a-5p组HK-2细胞中miR-181a-5p表达、凋亡率、Cleaved-caspase3和Cleaved-caspase9蛋白表达显著升高(P<0.05),细胞培养液中TNF-α和IL-6水平显著升高(P<0.05)。见图4,表6。
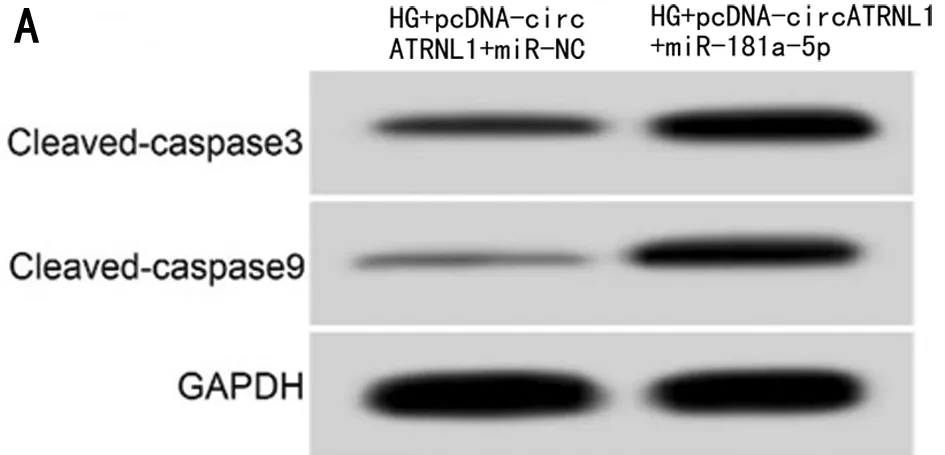
表6 上调miR-181a-5p表达逆转了circATRNL1过表达对高糖诱导的HK-2细胞损伤的作用
3 讨论
越来越多的研究表明circRNA在DN的发病机制中起着关键作用。Wang等[9]报道circ_0037128在DN模型和高糖处理的系膜细胞中表达明显增加,且敲减circ_0037128可抑制系膜细胞增殖和纤维化。Yao等[10]观察到circ_0000285通过靶向miR-654-3p激活丝裂原活化蛋白激酶6可促进高糖诱导的足细胞炎性反应。An等[11]发现干扰circ_0003928表达通过上调miR-151-3p抑制高糖诱导的HK-2细胞氧化应激和炎性反应,本研究结果显示高糖诱导后HK-2细胞circATRNL1表达显著下调,提示circATRNL1可能在DN的发病机制中起重要作用。功能分析显示,过表达circATRNL1可抑制高糖诱导的HK-2细胞凋亡以及炎性因子TNF-α、IL-6的释放。caspase9和caspase3分别是细胞凋亡的启动因子和效应因子,研究报道高糖刺激可激活caspase级联反应,诱导caspase9和caspase3活化,促进HK-2细胞凋亡[12,13]。本研究中过表达circATRNL1显著抑制高糖诱导的Cleaved-caspase3和Cleaved-caspase9蛋白表达上调,表明circATRNL1通过抑制caspase依赖凋亡途径抑制高糖诱导的HK-2细胞凋亡。因此,circATRNL1对高糖诱导的HK-2细胞损伤具有保护作用,这与circATRNL1在骨关节炎中的抗炎、抗凋亡作用[7]一致。
miR-199a-3p在各种疾病中调控细胞凋亡和炎性反应。研究显示链脲霉素诱导大鼠胰岛素瘤细胞中miR-199a-3p表达下调,过表达miR-199a-3p可抑制链脲霉素诱导的氧化应激和细胞凋亡[14]。miR-199a-3p还作为长链非编码RNA小核RNA宿主基因1(SNHG1)的下游靶点介导敲低SNHG1对帕金森病模型细胞损伤的保护作用[15]。然而,miR-199a-3p在急性脑缺血患者、大脑中动脉闭塞(MCAO)模型小鼠、糖氧剥夺复氧诱导的神经细胞中高表达,抑制其表达可减少MCAO小鼠脑梗死面积、损伤神经元数量,并减少糖氧剥夺复氧诱导的神经细胞凋亡[16],还可改善高糖诱导的心肌细胞氧化应激和炎性反应[17],这可能与miR-199a-3p在不同细胞中通过不同机制调控凋亡和炎性反应有关。本研究发现高糖诱导后HK-2细胞miR-199a-3p表达显著上调,抑制其表达可抑制caspase9和caspase-3激活,抑制高糖诱导的HK-2细胞凋亡和炎性因子释放,由于双荧光素酶报告实验证实miR-199a-3p是circATRNL1的直接靶点,RT-qPCR检测证实circATRNL1对miR-199a-3p具有靶向负性调控作用,且过表达circATRNL1和抑制miR-199a-3p表达对高糖诱导HK-2损伤的保护作用类似,提示可能存在circATRNL1/miR-199a-3p途径。深入研究显示,过表达miR-199a-3p可减弱过表达circATRNL1对高糖诱导HK-2损伤的保护作用,这进一步证实circATRNL1至少通过靶向miR-199a-3p调控DN进展。
综上所述,circATRNL1通过抑制细胞凋亡和炎性反应可减轻高糖诱导的肾小管上皮细胞损伤,其机制与靶向下调miR-199a-3p表达有关,circATRNL1和miR-199a-3p是DN的潜在有效治疗靶点。

