仑伐替尼联合氟伐他汀对小鼠肝癌移植瘤的抑制作用及其机制
雷 艺,程 旸,林鑫盛,孙朋辉,康 帅,李 成,李建聪,朱 云
(1.南方医科大学南方医院感染内科肝脏肿瘤中心,广东 广州 510515;2.广州医科大学附属广州市妇女儿童医疗中心消化科,广东 广州 510623;3.南方医科大学南方医院PET中心,广东 广州 510515)
肝细胞癌是一种常见的消化系统肿瘤,是全球第4大癌种。我国是世界上肝癌发病率最高的国家。2020年中国肝癌新发病例占全球0.45,死亡人数占全球0.47,位于世界前列[1]。原发性肝癌(hepatocellular carcinoma,HCC)起病隐匿,大部分肝癌患者诊断时即为中晚期。仑伐替尼是晚期肝癌的一线靶向治疗药物,作用于血管内皮细胞生长因子受体-1、-2 和 -3(vascular endothelial growth factor receptor,VEGFR)、成纤维生长因子受体-1、-2、-3 和 -4(fibroblast growth factor receptor,FGFR)、血小板衍生生长因子受体 α(platelet-derived growth factor receptor α,PDGFR α)、RET和 KIT,通过抑制肿瘤细胞增殖和肿瘤血管生成发挥抗肿瘤作用[2]。然而,仑伐替尼对肝癌患者生存期的延长仍有限,并可导致多种不良反应,包括蛋白尿、皮肤、消化系统和心血管毒性。这些不良反应导致临床上部分患者减量或停用。而且,对仑伐替尼的耐药性导致HCC进展,并已成为改善HCC患者预后的主要障碍[3]。因此,有必要寻找能与仑伐替尼发挥协同治疗作用的药物。
氟伐他汀作为他汀类药物,是临床常用的降血脂药物。近期研究发现,他汀类药物除了具有降低胆固醇的作用外,还可降低淋巴瘤、胶质瘤、胰腺癌等细胞的侵袭能力。他汀类药物也被认为具有治疗肝癌的潜力[4]。
然而,仑伐替尼联合氟伐他汀对肝癌的治疗作用目前未有研究报道。本研究拟探究仑伐替尼和氟伐他汀在小鼠肝癌皮下瘤模型中是否具有协同抗肿瘤作用,并进一步对效应背后的分子通路进行探讨。
1 材料与方法
1.1 实验动物和实验材料BALBc-nu裸小鼠由南方医科大学实验动物中心提供;HepG2肝癌细胞由中国科学院上海研究所提供;仑伐替尼购于Selleck Chemicals公司(货号s1164);氟伐他汀购于美国Sigma公司(货号SML0038);增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体(货号ab92552)、Toll样受体4 ( Toll like receptor 4,TLR4)抗体(货号ab22048)购于Abcam公司;免疫组化试剂盒购于CST公司(货号13079);TUNEL试剂盒购于默克公司(货号s7101)。
1.2 裸鼠皮下肝移植瘤模型构建4~6周龄裸小鼠,雌性,体质量(18~22) g,SPF级条件下饲养。将小鼠随机分成空白对照组(NC组)、氟伐他汀组(FLU组)、仑伐替尼组(LEN组)、仑伐替尼联合氟伐他汀组(LEN+FLU组),每组5只小鼠。小鼠腋窝皮下注射HepG2细胞悬液(1×105/只)。FLU组小鼠以氟伐他汀溶液灌胃(20 mg·kg-1·d-1);LEN组小鼠以仑伐替尼溶液灌胃(30 mg·kg-1·d-1);LEN+FLU组小鼠联用氟伐他汀(20 mg·kg-1·d-1)和仑伐替尼(30 mg·kg-1·d-1);NC组以对应溶剂灌胃。开始给药后每4 d测量肿瘤组织的大小,计算肿瘤体积(体积=1/2×长径×宽径2)。于第5周以异戊巴比妥钠腹腔注射麻醉,将皮下肿瘤组织完整剥离,测量瘤体体积。取部分组织放于4%中性甲醛中固定24 h,常规石蜡包埋,以备后续组织学检查;另一部分保存于-80 ℃超低温冰箱中备用。
1.3 免疫组织化学法检测PCNA、TLR4的表达将蜡块切片,脱蜡,采用免疫组织化学法进行染色。一抗(湿盒)4 ℃下孵育过夜,二抗37 ℃下孵育(湿盒)30 min,二氨基联苯胺显色约15 min,自来水水洗1次5 min,苏木精复染10 min,水洗5 min,封片。显微镜下每例随机选取5个高倍视野,由两位独立研究人员计数阳性细胞的百分率。
1.4 TUNEL法检测裸鼠移植瘤细胞凋亡切片常规脱蜡处理后,滴加3%过氧化物酶阻断剂,室温孵育10 min,去离子水洗3次。蛋白酶K 37 ℃孵育30 min(湿盒),磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗2次。TUNEL反应液37 ℃湿盒孵育60 min,以PBS冲洗3次。滴加辣根过氧化物酶标记的抗体,37 ℃湿盒孵育30 min,PBS冲洗3次。二氨基联苯胺显色约10 min,PBS冲洗3次。苏木精复染、脱水透明、封片。镜下观察。胞核中着棕黄色颗粒者为TUNEL阳性细胞。
1.5 实时荧光定量PCR法检测移植瘤组织TLR4 mRNA水平按照TRIzol RNA说明书提取裸小鼠皮下瘤组织RNA,反转录为cDNA。以cDNA为模板,按照实时荧光定量PCR试剂盒说明书扩增TLR4 mRNA。引物序列:TLR4上游5′-TTTGCTGGGGCTCATTCACT-3′,下游5′-CTCGGCACTTAGCACTGTCA-3′。反应条件:95 ℃ 3 min,95 ℃ 10 s,60 ℃ 30 s,共40个循环,溶解曲线65~95 ℃持续5 s。
1.6 Western blot法检测组织/细胞蛋白表达剪取适量小鼠皮下瘤组织,加入RIPA裂解液,剪碎组织(培养细胞搅动均匀),4 ℃裂解20 min,13 000 r·min-1离心10 min,测上清蛋白浓度,加入上样液,煮沸变性。按照试剂盒说明书进行细胞总蛋白萃取,煮沸变性。蛋白溶液经SDS电泳、转膜,5%BSA封闭,GAPDH为总蛋白的内参,加一抗4 ℃过夜。d 2加二抗,孵育45 min后漂洗,Odyssey成像系统扫描成像。
1.7 体外细胞培养和转染HepG2细胞常规培养至70%~80%融合度,按照说明书步骤进行TLR4-WT或对照质粒转染。转染24 h后,分别给予氟伐他汀(1 μmol·L-1)+仑伐替尼(5 μmol·L-1)或对应溶剂处理48 h,接着给予10 μg·L-1LPS处理24 h。

2 结果
2.1 联合用药明显抑制裸鼠肝癌移植瘤的生长4组小鼠的肿瘤生长曲线见Fig 1,FLU组的移植瘤体积与NC组无显著差异,而LEN组、LEN+FLU组的移植瘤体积明显小于NC组,且LEN+FLU组的移植瘤体积明显小于LEN组。联合用药组肿瘤倍增时间(tumor volume doubling time,TVDT)明显长于LEN组,FLU组和NC组。联合用药组的肿瘤延迟生长时间(tumor growth delay,TGD)较LEN组长,见Tab 1。以上结果表明,本实验剂量的氟伐他汀对小鼠肝癌移植瘤的生长无明显的抑制作用;而仑伐替尼可在一定程度上抑制肝癌移植瘤的生长;仑伐替尼联合氟伐他汀在抑制裸鼠肝癌移植瘤生长方面优于仑伐替尼单药。

Fig 1 Tumor growth curve for subcutaneous tumor of mice in various groupsNC:Control group,FLU:Fluvastatin group,LEN:Lenvatinib group,FLU+LEN:Fluvastatin plus Lenvatinib group.*P<0.05 vs NC;#P<0.05 vs LEN.

Tab 1 Comparison of TVDT and TGD among different groups (day,n=5)
2.2 联合用药明显抑制裸鼠肝癌移植瘤的增殖我们使用免疫组化法检测PCNA,检测裸鼠移植瘤组织中肿瘤细胞增殖水平。裸鼠移植瘤组织切片PCNA免疫组织化学见Fig 2。FLU组肿瘤组织PCNA阳性细胞较NC组无明显差异,LEN组、FLU+LEN组肿瘤组织PCNA阳性细胞较NC组显著降低(P<0.05),而LEN+FLU组肿瘤组织阳性细胞比例显著低于LEN组(P<0.05)。结果表明,本实验剂量的氟伐他汀对裸鼠肝癌移植瘤的增殖无明显抑制作用;仑伐替尼可以抑制肝癌移植瘤的增殖;仑伐替尼联合氟伐他汀可以显著抑制肝癌细胞的增殖,其效果明显优于仑伐替尼单药。

Fig 2 Immunohistonchemistry analysis for PCNA expression in tumor tissues of mice(×400)*P<0.05 vs NC;#P<0.05 vs FLU;ΔP<0.05 vs LEN.
2.3 联合用药可以显著促进裸鼠肝癌移植瘤细胞的凋亡使用TUNEL法检测裸鼠肝癌移植瘤的肿瘤细胞凋亡水平。镜下观察,胞核中着棕黄色颗粒的细胞为TUNEL阳性细胞,TUNEL检测显示:FLU组与NC组阳性细胞比例无明显差异;LEN组细胞凋亡水平高于NC组(P<0.05);FLU+LEN组的肿瘤细胞凋亡水平明显高于LEN组(P<0.05),见Fig 3。结果表明,本实验剂量下的氟伐他汀对裸鼠肝癌移植瘤细胞的凋亡无明显促进作用;仑伐替尼促进肝癌细胞的凋亡;而仑伐替尼联合氟伐他汀可以显著促进肝癌细胞的凋亡,且细胞凋亡水平明显高于仑伐替尼单药。

Fig 3 Apoptosis in subcutaneous tumor tissues of mice(×400)*P<0.05 vs NC;#P<0.05 vs FLU;ΔP<0.05 vs LEN.
2.4 联合用药明显抑制裸鼠肝癌移植瘤细胞TLR4的表达Fig 4为裸鼠肝癌移植瘤组织TLR4的mRNA检测结果,可见,FLU组TLR4mRNA水平较NC组无显著差异,而LEN组TLR4mRNA较NC组有明显上调,FLU+LEN组TLR4 mRNA水平明显低于LEN组(P<0.05)。免疫组织化学结果与荧光定量PCR结果相似,如Fig 5所示,FLU组与NC组TLR4阳性细胞比例无明显差异,LEN组TLR4阳性细胞较NC组明显增多,而FLU+LEN组TLR4阳性细胞比例明显低于LEN组(P<0.05)。以上结果说明,使用仑伐替尼可以上调TLR4的表达,而联合氟伐他汀后可显著抑制仑伐替尼引起的TLR4的表达升高。
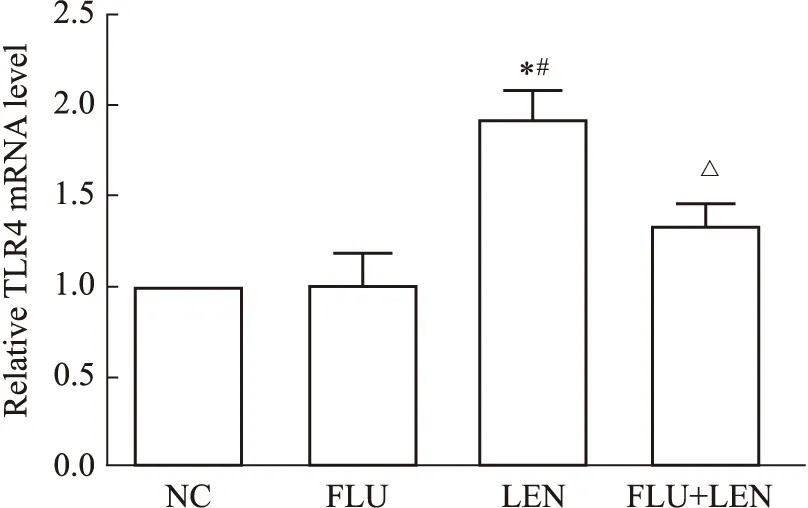
Fig 4 TLR4 mRNA level in tumor tissues of mice*P<0.05 vs NC;#P<0.05 vs FLU;△P<0.05 vs LEN.

Fig 5 TLR4 expression in subcutaneous tumor of mice(×400)
2.5 联合用药明显抑制裸鼠肝癌移植瘤细胞β-catenin的表达Western blot法检测小鼠移植瘤组织中β-catenin的蛋白表达水平。检测结果如Fig 6所示,LEN组小鼠组织中β-catenin的表达较NC和FLU组升高,而FLU+LEN组β-catenin的蛋白表达水平低于LEN组,见Fig 6。结果表明,仑伐替尼可以上调β-catenin的表达,而联合使用氟伐他汀可以抑制这一过程。
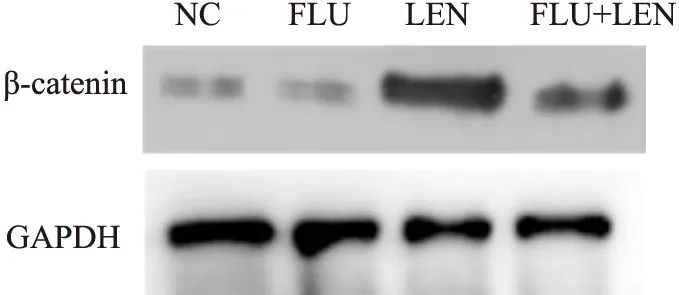
Fig 6 β-catenin expression in subcutaneous tumor tissues of mice
2.6 联合用药通过抑制TLR4的表达调控β-catenin的表达体外培养肝癌细胞中,分别转染TLR4-WT质粒/对照质粒,给予氟伐他汀+仑伐替尼/对照溶剂预处理,之后给予LPS以激活TLR4。培养72 h后Western blot法检测肝癌细胞β-catenin的表达,同时检测TLR4的表达。如Fig 7所示,LPS处理后,肝癌细胞TLR4表达增强,同时β-catenin表达增强(Fig 7,lane 1 vs.lane 2);而氟伐他汀联合仑伐替尼可明显抑制TLR4和β-catenin的表达(Fig 7,lane 3 vs.lane 2);在此基础上,通过TLR4质粒转染提高TLR4的表达可以反转氟伐他汀联合仑伐替尼诱导的β-catenin的表达下降(Fig 7,lane 4 vs.lane 3)。以上结果表明,氟伐他汀联合仑伐替尼可能通过抑制TLR4的表达调控β-catenin信号通路。
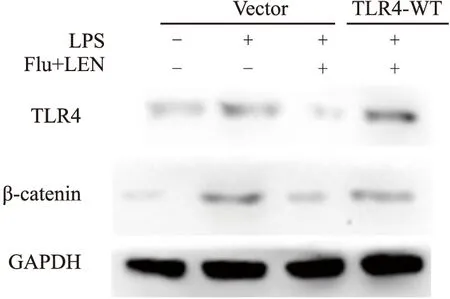
Fig 7 β-catenin protein expression in treated hepatoma cell lines
3 讨论
REFLECT研究奠定了仑伐替尼用于晚期HCC患者一线治疗的地位,然而,患者对HCC的治疗反应仍有限,在我国,大约有半数HCC患者出现对仑伐耐药的现象[3]。仑伐替尼的耐药性是HCC治疗中的挑战,需要探索仑伐替尼联合治疗以增强对肝癌的抗肿瘤作用,目前也有多项研究集中在联合治疗上。氟伐他汀被认为具有治疗肝癌的潜力[5]。本实验探索氟伐他汀联合仑伐替尼是否能增强仑伐替尼对小鼠肝癌移植瘤的抑制作用,并进一步探讨其中的机制。裸鼠皮下成瘤实验是进行药物抗肿瘤的经典实验。本实验采用4~6周龄雌性裸小鼠,构建裸小鼠皮下肝癌移植瘤模型,分别给予氟伐他汀单药、仑伐替尼单药、氟伐他汀联合仑伐替尼和对照溶剂。结果表明,仑伐替尼联合氟伐他汀可以显著抑制小鼠肝癌皮下瘤的生长,且作用明显强于仑伐替尼单药。
本研究选用PCNA和TUNEL两个指标来分别检测裸鼠肝癌移植瘤中肿瘤细胞的增殖和凋亡水平。实验结果显示,本实验剂量的仑伐替尼对肝癌细胞在裸小鼠体内的增殖有抑制作用,并能促进肝癌细胞的凋亡;而本实验剂量的氟伐他汀对肝癌细胞在裸小鼠体内的增殖和凋亡无明显作用。仑伐替尼联合氟伐他汀可以明显抑制肝癌细胞的增殖,并显著促进其凋亡,其效果明显优于仑伐替尼单药治疗。
Toll样受体(TLR)属于跨膜信号传导受体,在免疫细胞中表达较高。TLR4是TLR家族的成员,通过激活多种转录因子和调节下游蛋白如IKB激酶和丝裂原活化蛋白激酶(MAPK),诱导IL、IFN、TNF-β和其他炎症因子的产生。目前,在包括胃癌、结肠直肠癌和非小细胞肺癌在内的多种肿瘤中都存在TLR4的表达失衡,并且TLR4的异常高表达与肿瘤的发生和进展有关[6]。TLR4也参与了肝脏疾病的发生发展。TLR4/NF-κB 通路参与肝脏缺血再灌注损伤的进展[7]。TLR4信号通路可激活肝星状细胞,促进肝脏的纤维化。在肝癌中,TLR4也发挥重要作用[8]。多项研究表明,脂多糖诱导的TLR4信号通路的激活与原发性肝癌的发生有关,并可以促进肝癌的发展。在乙肝病毒相关的肝硬化和原发性肝癌中TLR4的表达上调,显著高于正常肝组织,TLR4通过激活ERK1/2,并与乙肝病毒x蛋白相互作用,促进肝癌进展。TLR4在复发肝癌患者肿瘤组织中的表达明显高于非复发肝癌患者,其表达与肝癌患者的预后不良相关。高表达TLR4者常早期复发,生存率低[9]。TLR4的表达可以促进肝癌的增殖、并抑制细胞凋亡、促进肝癌细胞的上皮细胞间充质转化[10]。另有研究表明,LPS-TLR4信号转导在诱导HCC干性中具有重要作用,TLR4有可能作为肝癌肿瘤干细胞的标记分子。在我们之前的研究中,HCC组织中TLR4的表达水平显著高于正常组织[11],与上述发现一致。
有研究表明,体外培养肝癌细胞中使用仑伐替尼可使TLR4显著上调[12]。本研究发现,裸小鼠肝癌皮下瘤模型中,仑伐替尼单药使用上调TLR4的表达,与前述体外实验的结果一致。而联合仑伐替尼和氟伐他汀可以协同抑制TLR4的表达。我们推测,上调TLR4的表达可能是仑伐替尼耐药的机制之一。然而,仑伐替尼上调TLR4表达的机制,目前尚无研究涉及,需要进一步探究。
Wnt /β-catenin信号通路在肝癌中处于活化状态,Wnt /β-catenin的异常激活与氧化应激代谢和Ras /丝裂原活化蛋白激酶通路有关,促进肝癌细胞的增殖、侵袭、耐药和进展[13]。此外,β-catenin轴可等通过上调 Oct4、SOX2 和Nanog来增加HCC细胞的肿瘤干细胞特征[14]。β-catenin的核定位可以协同促进耐药相关靶基因的表达[13]。已有研究表明,仑伐替尼以剂量和时间依赖性方式上调肝癌细胞系β-catenin表达,这可能是仑伐替尼耐药的原因之一[15]。我们的小鼠体内研究表明,给予仑伐替尼处理后,小鼠肿瘤细胞β-catenin的表达上调,与上述研究结果一致。但仑伐替尼上调肝癌β-catenin表达的具体机制尚不清楚。可能的潜在机制包括仑伐替尼在转录水平、翻译水平或翻译后修饰的直接调节;也可能是通过仑伐替尼靶向信号通路(如FGF/FGFR、RET、cKIT等)进行间接调节[15]。仍需要进一步的研究来探究这些潜在的机制。
TLR4参与调控Wnt通路。乳腺癌的体内和体外研究表明,TLR4调控的Akt/GSK3β/β-catenin信号通路参与了乳腺癌的进展[16]。在结肠癌中,TLR4激活β-catenin,导致肠道肿瘤的发生和发展[17]。已有研究表明,TLR4通过直接激活β-catenin的表达影响乙肝病毒相关的肝癌的进展[18]。本研究进一步探讨了仑伐替尼和氟伐他汀联用的可能机制,研究表明,仑伐替尼和氟伐他汀联用可以抑制β-catenin的表达。细胞实验提示,过表达TLR4可以反转仑伐替尼和氟伐他汀对β-catenin的抑制,这进一步表明,仑伐替尼联合氟伐他汀可能通过抑制TLR4的表达来抑制β-catenin的表达。
综上所述,在裸鼠肝癌移植瘤模型中,仑伐替尼联合氟伐他汀发挥了协同抗肿瘤作用,显著促进肿瘤细胞凋亡,抑制肿瘤细胞增殖,其机制可能通过抑制TLR4来抑制β-catenin信号通路。

