牙科钛种植体表面载药及控释的研究进展*
丁 彤 杨瑟飞
人工种植牙经过半个世纪的发展已成为牙列缺损和缺失的主流修复技术。自上世纪50 年代Rrånemark 发现骨结合[1]以来,钛及钛合金因为具有良好的组织相容性、耐腐蚀性和弹性模量接近骨组织而成为大多数临床医生在牙科领域种植手术时首选的材料。尽管钛及钛合金人工牙根的性能特点满足临床需求,但由于炎症、肉芽或纤维组织的优势生长以及异物反应都可能会限制人工牙根的骨结合[2,3],而且对于一些患有全身性疾病,如糖尿病、骨质疏松症等的患者,种植成功率不高且预后不佳[4]。全身用药一定程度上可以控制炎症发展,改善治疗效果,但其存在用药量大、局部效果欠佳、不良反应大等缺点,因此,能否局部给药成为学者们的关注点。由于种植体表面是直接与宿主骨组织接触的区域[5],而钛-骨界面是骨结合发生的部位,因此,学者们尝试从种植体表面物理形态到界面化学进行改性[6]。通过钛种植体自身加载药物(本文将发挥治疗作用的药物和生物活性分子,如生长因子、骨形成蛋白等统称为药物)并局部控制释放来最大限度地减少不良反应,改善钛骨结合的生物学效应,扩大人工种植牙适应证的范围,并提高种植的成功率。本文就目前国内外牙科钛种植体表面药物加载并控制释放的研究进展进行综述。
1.牙科钛种植体表面处理及药物加载方式
牙科钛种植体表面处理或改性以及药物加载的目标是通过影响骨细胞行为、表面化学反应和物理修饰的方式来促进骨结合和提高种植牙的长期成功率。Rousseau 等人认为以药物加载为目的进行表面处理的钛植入物不仅对局部组织没有负面影响,而且能够促进钛植入物周围更快的骨结合[7]。为了有效加载药物,钛种植体的表面处理或改性方式有物理机械、化学及生物化学等,按照药物与植体表面的接触方式大致分为直接对钛基材改性的非涂层加载和需中间层介导的涂层加载式两种方式,其中后者的药物加载策略可以分为后加载、共同加载和预加载三种模式。下面将钛种植体表面处理非涂层与涂层方式以及药物加载的策略分别进行论述。
1.1 钛种植体表面非涂层处理方式 非涂层抗菌钛或钛合金是指通过表面或整体改性的方法,向钛或钛合金中添加抗菌成分,从而具备抗菌性能。通常情况下非涂层钛基材的抗菌成分一般包括金属元素抗菌剂(银、锌、铜等)、金属化合物抗菌(YiO2、YiN 等)以及非金属元素抗菌剂(氟F 等),此类抗菌剂在钛基材上均匀分布,具有广谱抗菌性、不影响细胞的黏附与附着、良好的生物相容性,良好的稳定性和耐热性[14]。金属元素通常使用真空电弧熔炼法和粉末冶金法[15]使其与钛基材结合,N3-、F-等通过离子注入的方式添加在钛基材表面或基材内。
1.2 钛种植体表面药物加载的涂层载体 钛种植体表面药物加载的涂层载体主要有:羟基磷灰石涂层、二氧化钛纳米管涂层、生物可降解聚合物涂层和脂质体涂层。
1.2.1 羟基磷灰石涂层 骨骼和牙齿的主要矿物成分之一是羟基磷灰石(hydroxyapatite,HA),成分是磷酸钙,由于HA 与骨骼的矿物相结构和化学成分相似,因此表现出良好的生物相容性和骨传导性,能提高种植体初期骨结合的速度与强度,诱导骨组织迅速向其生长,其优异的力学性能和良好的生物相容性使该化合物成为适合骨再生医学的生物材料之一[8]。羟基磷灰石除了可以做涂层载体外,其本身也可以发挥药理作用,增加皮质骨的厚度。该涂层主要通过等离子喷涂的方式与钛基材结合。
1.2.2 二氧化钛纳米管涂层 YiO2纳米管(YiO2nanotubes,YNY)是通过阳极氧化技术在钛表面上设计的纳米结构阵列,其优点是高表面积、生物相容性好、耐腐蚀性、低成本且稳定,其多孔结构增强骨的再生和修复,促进成骨和软组织反应,有利于骨组织的生长和植入物固定,还可以通过加载和释放一系列药物(如抗生素、生长因子和其他生物大分子)来进一步增强其抗菌性能及成骨能力[9],这些特性促使YNY 成为药物加载涂层等生物医学应用的理想候选原料。更重要的是,YiO2纳米结构能够作为智能输送系统来控制植入物中的药物释放[10]。该涂层是通过阳极氧化法直接在钛基材上生成。
1.2.3 生物可降解聚合物涂层 聚合物-药物共轭是目前解决药物控制释放有前景的技术。将生物可降解聚合物作为支架通过连接体与治疗性的药物分子共价结合。生物可降解聚合物,包括天然和合成来源,具有不同的降解率,如海藻酸盐、壳聚糖、胶原蛋白、聚乳酸(polylactic acid,PLA)、聚乳酸-共-乙二醇(PLGA)等[11]。常用药物一般有:四环素、庆大霉素、诺氟沙星、钙三醇(calcitriol,VD3)、降钙素、骨形态发生蛋白2(bone morphogenetic protein 2,RMP-2)以及siRNA、miRNA等。此类共轭物优势在于增强药物溶解度、降低抗原性、可生物降解、灵活的与疏水和亲水药物结合、纳米级的尺寸、改进药代动力学参数、特定靶向。其本身并不具有治疗作用。
聚合物或类似特性的材料,如PLGA[12]、壳聚糖等,还可以用来制作静电纺纳米纤维,纳米纤维除上述的优势以外,还具有高渗透性的孔隙结构、稳定性好、高表面积和易于功能化的特点。此类涂层通过吸附作用、化学键合和层层自组装等与钛基材结合。
1.2.4 脂质体涂层 脂质体是利用磷脂双分子层膜所形成的囊泡包裹药物分子而形成的制剂。由于生物体细胞质膜基本结构也是磷脂双分子层膜,脂质体具有与生物体细胞相类似的结构,因此有很好的生物相容性。由于这种结构可以封装疏水、亲水和两亲的材料,因此有利于输送药物、蛋白质、营养物质、遗传物质、纳米材料等等[13]。脂质体通过双分子膜以共价结合的方式黏附在钛基材表面。
1.3 钛种植体涂层载体表面的药物加载方式钛种植体表面处理与改性的方法与药物加载的方式关系密切。钛种植体表面药物加载的过程通常是药物溶解后直接浸渍,但是对于一些不能溶解的药物或为了赋予药物新的特性,如提高生物利用度和药代动力学、减少毒副作用、控制释放和提高药物剂量等,会将药物制成纳米级的颗粒。之后通过涂层加载的方式将药物加载到钛种植体上。基于纳米药物加载递送系统而开发的纳米药物形式,包括聚合物纳米颗粒[16]、脂质体[13]、无机生物陶瓷纳米颗粒[17]、药物偶联物[18]、水凝胶纳米颗粒[19]等等。目前文献报道,学者们根据药物和涂层形成的顺序将药物加载策略分为三类:后加载、共同加载和预加载[20]。“后加载”(见图1a.)是在钛基材表面先制备纳米载体,然后加载药物以实现高载药量纳米药物递送,其纳米载体通常具有多孔结构,如羟基磷灰石、YiO2纳米管。Łosiewicz 等[21]通过生产具有药物洗脱性能的氧化物纳米管而后加载硫酸庆大霉素,在炎症条件下局部输送的药物。“共同加载”(见图1b.)是指在纳米粒子形成过程中装载或封装药物的策略,如聚合物-药物共轭,共价结合在共同加载中很重要。Wang 等[22]在钛植入物上成功构建了一个由PLGA 和YNY 组成的混合表面系统,目的是通过长期药物释放来预防细菌感染。“预加载”(见图1c.)是一种先产生药物纳米颗粒,然后构建一个稳定且能够保护药物核心的外壳的策略,如聚合物、脂质体等包裹药物涂层。Wei 等[23]把抗炎药物阿司匹林(aspirin,ASA)装入PLGA,通过电纺在钛上构建纳米纤维涂层。通过聚多巴胺(polydopamine,PDA)改性确保了纳米纤维涂层对钛的附着力。
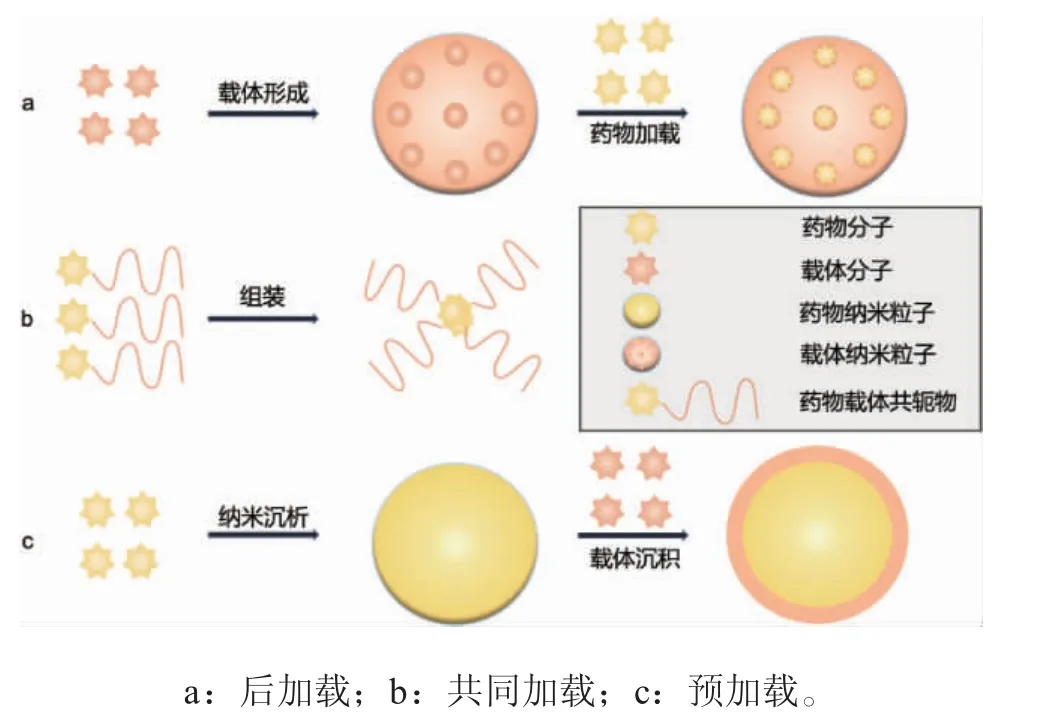
图1 药物加载策略
钛种植体表面不但可以加载单一的药物,而且能够加载几种药物发挥不同的作用,形成多药的控制释放。Wei 等[24]构建了壳聚糖和聚乳酸-乙二醇酸颗粒组成的新型结构水凝胶,这种生物相容物质可以加载万古霉素和rhRMP-2,药物释放后可分别完成抗菌和促进成骨功能。这种系统可作为一种很有前途的涂层材料,以改善种植牙的表面条件,增强手术后的骨整合。
2.钛种植体表面加载药物后受控释放的策略
现代药物输送系统[28]将药物控制释放机制分为主动释放和被动释放,并且讨论物理参数pH 和温度对药物控制释放的影响。主动释放是指药物在被某种物质激活或受到某种特殊环境的影响下释放,主要包括与配体结合的靶向释放和聚合物-药物共轭释放。被动释放是指药物无论有无激活物质都持续的释放,主要包括高孔隙度和高表面积的扩散释放。需要说明的是,控制释放的策略并不是一个单一的机制,药物释放所受影响颇多,各个策略之间也是相互交叉影响的,且非常复杂。
无论何种载体产生的药物释放都由药物递送方式和药物特性彼此之间的相互作用决定。选择合适的药物递送方式,需要考虑的因素有药物溶解性、受体的生物特性、作用部位和清除率等[25]。药物的特点,例如浓度、尺寸、表面电荷和亲疏水性等[26]也会影响药物性能及其生物分布。其他因素如pH、温度、沉积时间、控释薄膜的生物学特征等[27]也会影响药物释放。
2.1 钛种植体表面加载药物的主动释放 钛种植体表面加载药物的主动释放主要见于与配体结合靶向和聚合物-药物共轭物(PDC)来控制释放。在与配体结合靶向中,聚合物先与抗体、蛋白质和肽[10]等配体功能化,再与目标部位表达的受体相互作用[11]。聚合物-药物共轭物的优势在于提高水溶性、增强稳定性、延长血浆半衰期、主动细胞内输送、改变生物分布以及通过靶向部分进行定向输送。
Yzeng 等[28]构建了基于合成末端改性的聚β-氨基酯[Poly(β-amino ester),PRAE]纳米颗粒,以优化siRNA 向人骨髓间充质干细胞(human bone marrow mesenchymal stem cells,HRMSCs)的输送,修饰过的PRAE 能够与siRNA 形成紧密的连接,然后在细胞质中引起有效的、环境触发的释放,通过增强HRMSCs 分化来达到成骨增强的作用。Liu 等[29]基于PLGA 薄膜构建了miRNA-204抑制剂共轭金纳米颗粒(AuNPs)药物靶向输送系统,药物释放提高了2 型糖尿病大鼠RMSC 的成骨分化能力,促进骨结合。
2.2 钛种植体表面加载药物的被动释放 钛种植体表面加载药物的被动释放主要受涂层载体的孔隙度和表面积影响并依赖于特定组织或细胞的生理特性。钛种植体表面涂层能够提高孔隙度和增大表面积的有YiO2纳米管[30]、纳米粒子(纳米金刚石、羟基磷灰石、生物活性玻璃等)。
根据菲克定律,在单位时间内通过垂直于扩散方向的单位截面积的扩散物质流量(称为扩散通量diffusion flux,用J 表示)与该截面处的浓度梯度(concentration gradient)成正比,数学式表达如下:

公式中,D 称为扩散系数(m2/ s),C 为扩散物质(组元)的体积浓度(原子数/ m 或kg/ m),dC/ dx为浓度梯度,“-”号表示扩散方向为浓度梯度的反方向,即扩散组元由高浓度区向低浓度区扩散。扩散通量J 的单位是kg/ m2·s。YNY 结构中载药的释放动力学由扩散过程控制,其中主要控制参数是扩散系数、浓度梯度、孔径、长度和表面化学[32,33]。在扩散系数和浓度相同情况下,药物释放与YNY的尺寸有很大关系。Shi Q 等[27]根据不同长度和直径的YNY 分组实验,明确了药物释放率与YNY 尺寸(直径、长度、纵横比和体积)的关系,这些参数的增加都会延长药物散布的持续时间。最显著影响药物释放的参数是长宽比,长宽比较高的YNY 释放药物的速度较慢。Nazlı 等[34]研究了YNY 长度与阳极氧化时间之间的关系,认为YNY 的长度受阳极化时间控制,药物释放时间随着纳米管长度的延长而延长。因此,YNY 的长度与阳极氧化时间和药物释放时间成正比。
纳米粒子(通常范围为1~100 nm)是药物输送的理想载体,能够允许药物在体内快速积累到目标区域[26]。纳米粒子具有一定的粗糙度,增加了表面积,使载药量加大,这种纳米范围的粗糙化对成骨细胞增殖和植入组织中的细胞反应很重要。尼尔斯等[35]利用聚合物型纳米粒子的可降解性和药物的扩散达到控制释放的目的,通过壳聚糖纳米粒子涂层降解来控制释放RMP-2,提高降解率就会提高释放效率。另外纳米凝胶[31]因具有较高的孔隙率,而具有较高的药物负载能力,在纳米凝胶表面进行特殊化的修饰,同样可以达到给药的目的。
控制药物有序释放,有时还需和其他方式结合来达到目的,如层层自组装(Layer-by-Layer,LbL)是利用带相反电荷的聚电解质在材料表面交替沉积形成聚电解质多层膜(PEM)。调节聚电解质类型、膜层厚度和膜层中负载的物质可以获得不同表面性质的涂层[36]。Guan 等[37]在溶菌酶功能化的直接金属激光烧结钛(DMLS-Yi)上LbL 形成的含有米诺环素的透明质酸和壳聚糖(chitosan,CS)多层聚电解质酸,旨在抑制致病性微生物感染,随着抗菌多层涂层的分解,扩散释放的米诺环素浓度缓慢下降。层层自组装为控制药物有序释放提供了有利的参考。
2.3 物理参数对钛种植体表面加载药物受控释放的影响 钛种植体表面的载药涂层可以被pH、温度、光和磁场[38]等的物理刺激修改并响应。我们主要论述物理参数pH 和温度对药物控制释放的影响。
2.3.1 pH 对药物释放的影响 钛种植体表面的载药涂层在pH 控制释放的情况下,通过以下两个参数影响释放:药物在释放介质中的溶解度和载体材料的稳定性。贾等[39]合成了一种释放布洛芬的核心壳结构,药物释放量随pH 值的降低而增加。当pH 值在7 到5 之间,形成质子化叔胺基团,载体与水的亲和力增加,疏水材料变为亲水,亲水形式利于水的结合,药物通过溶解释放;当pH 值在5 到3 之间,载体的膨胀利于溶液中药物的释放。Zhou 等[40]构建了具有抗菌和成骨能力的银聚合物纳米纤维(AgNPs)/ 庆大霉素(Gen)负载丝纤维蛋白(SF)涂层,释放的Ag+取决于体液的pH 值,释放率随着pH 值的降低而增加,酸性条件下的质子化导致CS 屏障层坍塌和Ag+的静电排斥。说明了药物在释放介质中的溶解度和载体材料稳定性对于pH 控制释放的重要性。
另外,学者们设计了pH 敏感纳米粒子载体,Dehousse 等[41]利用三甲基壳聚糖(YMC)构建了一种pH 敏感的聚合物纳米粒子载体去递送siRNA,向其加入对pH 敏感的甲基丙烯酸(MAA)共聚物形成pH 敏感的MAA-YMC-siRNA 给药系统。该颗粒制备简单、安全、体外siRNA 输送显著改善。这种pH 敏感的纳米粒子为种植体表面载药并控制释放提供了新的思路和方法。
2.3.2 温度对药物释放的影响 温度控制药物释放是一个成熟的技术,适用于不同类型的涂层载体和药物。钛种植体表面加载的药物无论温度如何,释放都会存在,但一些受温度影响的载体当达到目标温度时,释放量就会最大化。Jiang 等[42]使用带有螺旋体功能化聚二甲基氨基乙基丙烯酸酯作为载体,对香豆素102 进行了受控释放,结果表明温度可以在释放中发挥作用:60℃时释放量大于25℃。由于聚合物亲水性降低,温度升高会导致聚合物收缩和药物释放。此外,一些生物分子如热敏脂质体也可以作热控制释放的载体。虽然在钛种植体植入的过程中会产生一定的热量,但这种温度的改变是暂时且不稳定的,而生物体内的温度是基本恒定的,基本上温度控制药物释放目前还只能停留在体外实验阶段,因炎症产生的温度升高也还不足以明显改变药物的释放规律。
3.总结
本综述明确了以药物加载为目的的牙科钛种植体表面处理,并对控制释放的方法进行初步讨论。目前钛植入物表面载药主流的表面处理方式是涂层技术,不同的涂层有不同的特点,应用最为广泛的是YiO2纳米管涂层和聚合物涂层,加载药物的技术日趋成熟,受控释放的机制还需更多的实验研究来探索。作为钛种植体的涂层,需要抗磨损失效才能在植入后稳定发挥药物的作用,如何构建能抗磨损失效的涂层载体也是一个技术难点。药物装载并控制释放在组织工程再生领域前景广阔,纳米和聚合物领域的药物缓释研究平台还不成熟,但随着材料学的发展,药物智能受控释放技术将会革新现有的药物缓释研究,更广泛地应用到牙科种植修复临床领域。

