microRNA-23b-3p对高糖诱导的人晶状体上皮细胞自噬和凋亡的抑制作用及其机制
刘文兰 王莉 杨扬 闫瑾 何媛
1西安医学院医学技术学院,西安 710021;2西安医学院第一附属医院眼科,西安 710077
糖尿病是一种严重危害人类健康的内分泌疾病,其在全球范围内的发病率呈上升趋势。糖尿病性白内障(diabetic cataract,DC)是糖尿病患者的主要眼部并发症之一,其发病年龄较早,进展较快[1-2]。糖尿病患者的白内障发病率是非糖尿病人群的2~5倍,成为导致视力损害的主要原因[3]。研究表明晶状体上皮细胞凋亡在白内障的发展中起着至关重要的作用[4];此外,人晶状体细胞主要通过自噬降解衰老的细胞器和蛋白质以维持晶状体的透明度[5]。高糖诱导的晶状体上皮细胞凋亡可能是DC形成的原因之一,但是具体的发病机制尚不十分清楚。微小RNA(microRNA,miRNA)是一类长度为21~23个核苷酸的非编码单链小RNA,通过靶向mRNA分子的3'-非翻译区(untranslated region,UTR),以mRNA降解或翻译抑制的方式沉默基因表达[6-7]。越来越多的研究表明miRNA在白内障的发病机制中起着重要作用,如先天性白内障、后发性白内障以及DC[8-10]。miR-23b-3p已被证实在晶状体组织中高度表达[11],然而miR-23b-3p是否参与DC的发病仍不清楚。因此,本研究拟探讨miR-23b-3p对高糖诱导的人晶状体上皮细胞自噬和凋亡的调节作用,为DC的防治提供实验依据。
1 材料与方法
1.1 材料
1.1.1标本及细胞来源 收集2019年9月至2020年10月在西安医学院第一附属医院行白内障手术的DC患者30例30眼和单纯白内障患者30例30眼的晶状体前囊膜组织,分别作为DC组和单纯白内障组,置于冻存管中液氮保存备用。DC组中男19例19眼,女11例11眼,年龄61~81岁,平均(64.1±6.9)岁。对照组中男17例17眼,女13例13眼,年龄61~79岁,平均(62.2±9.2)岁。DC患者诊断为2型糖尿病,术前空腹血糖<7.8 mmol/L,病程为4~7年;单纯白内障患者为无糖尿病病史的白内障患者。排除标准:(1)除糖尿病外其他原因造成的白内障患者;(2)合并青光眼、玻璃体积血等其他眼部疾病者;(3)患者临床资料不完善、不配合治疗者;(4)有严重心、脑、肝、肾功能障碍者。2个组患者性别构成比、年龄比较差异均无统计学意义(均P>0.05)。本研究方案经西安医学院第一附属医院伦理委员会审核批准(批文号:LSL2019037)。每位患者及家属均被告知实验目的并签署知情同意书。人晶状体上皮细胞系HLEB3来自中国科学院ATCC细胞库。
1.1.2主要试剂及仪器 DMEM培养基(美国Gibco公司);Annexin V-FITC/PI细胞凋亡检测试剂盒(美国Sigma公司);Trizol试剂、LipofectamineTM2000转染试剂(美国Invitrogen公司);TaqMan microRNA逆转录试剂盒(北京百奥莱博科技有限公司);PrimeScript RT-PCR试剂盒、SYBR Green试剂盒(日本Takara公司);RIPA裂解液(上海碧云天公司);BCA蛋白含量测定试剂盒(美国Thermo公司);ECL试剂盒(北京拜尔迪生物技术有限公司);兔抗人原钙黏附蛋白17(protocadherin 17,PCDH17)抗体(HPA026817)(美国Sigma公司);兔抗人c-Jun氨基末端激酶(c-Jun N-terminal kinases,JNK)抗体(ab199380)、兔抗人磷酸化(p-)JNK抗体(ab47337)、兔抗人c-Jun抗体(ab40766)、兔抗人p-c-Jun抗体(ab32385)、兔抗人微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3B)抗体(ab192890)、兔抗人哺乳动物ATG6同源蛋白(a mammalian homolog of yeast Atg6/Vps30,Beclin-1)抗体(ab207612)、兔抗人B淋巴细胞瘤-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体(ab32503)、兔抗人B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体(ab32124)、山羊抗兔二抗(ab205718)(美国Abcam公司);双荧光素酶报告基因载体pGL3、双荧光素酶报告基因检测试剂盒(美国Promega公司);miR-23b-3p拟似物、阴性对照(negative control,NC)拟似物(深圳华大基因公司)。紫外分光光度计(美国Lab Tech公司);实时荧光定量PCR仪(美国Applied Biosystems公司);Thermo VarioskanTMLUX多功能酶标仪(美国Thermo Fisher Scientific公司);CO2培养箱(美国赛默飞世尔公司);倒置普通光学显微镜(日本Olympus公司);电子显微镜(日本电子JEOL公司);流式细胞仪(美国BD公司);凝胶成像分析系统(美国Bio-Rad公司)。
1.2 方法
1.2.1细胞培养及分组处理 将人晶状体上皮细胞系HLEB3接种于DMEM/F12培养基(含体积分数10%胎牛血清、质量分数1%青霉素,质量分数1%链霉素)6孔板中培养,待细胞达到80%融合时,弃掉培养液,将其分为正常对照组和高糖组,分别于含5 mmol/L葡萄糖的培养基和含25 mmol/L葡萄糖的培养基中37 ℃、体积分数5% CO2条件下培养48 h。随后取高糖培养基培养的细胞,随机分为miR-23b-3p拟似物组、NC拟似物组、NC-siRNA组、PCDH17-siRNA组、miR-23b-3p拟似物+Vector组、miR-23b-3p拟似物+pcDNA-PCDH17组,根据LipofectamineTM2000试剂盒说明书分别进行转染,继续培养24 h,用于后续实验。
1.2.2实时荧光定量PCR法检测各组细胞中miR-23b-3p、PCDH17相对表达量 收集前囊膜组织及转染后的各组细胞,使用Trizol试剂提取总RNA,采用紫外分光光度计测定提取的RNA浓度和纯度。根据PrimeScript RT-PCR试剂盒说明书将RNA逆转录为cDNA,检测miR-23b-3p表达时,按照TaqMan microRNA逆转录试剂盒说明书将miRNA逆转录为cDNA。使用SYBR Green进行荧光定量PCR。miR-23b-3p正向引物序列为5'-GAGCATCACATTGCCAG GG-3',反向引物序列为5'-GTGCAGGGTCCGAGGT-3';U6正向引物序列为5'-GCTTCGGCAGCACATATACTAAAAT-3',反向引物序列为5'-CGCTTCACGAATTTGCGTGTCAT-3';PCDH17正向引物序列为5'-CTTGCCGATGTTGCCTA T-3',反向引物序列为5'-CCATCTGTTGCTGCTTTC-3';GAPDH正向引物序列为5'-TGACTTCAACAGCGACA CCCA-3',反向引物序列为5'-CACCCTGTTGCTGTAGC CAAA-3'。引物均由大连Takara公司设计合成。PCR反应体积为25 μl,引物1 μl,cDNA 2 μl。PCR反应条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火及延伸30 s,共40个循环。GAPDH和U6分别作为mRNA和miRNA的内参,采用2-ΔΔCt法计算每个样本中目标基因的相对表达量。
1.2.3双荧光素酶报告基因系统验证miR-23b-3p与靶基因PCDH17的关系 将含有miR-23b-3p结合位点的野生型(wild type,WT)和突变型(mutant type,MUT)PCDH17 3'-UTR克隆到pGL3载体中,得到荧光素酶报告载体。将细胞以1×104/ml的密度接种至96孔板中,分为NC拟似物组、miR-23b-3p拟似物组,待细胞密度达到70%融合时,将WT和MUT PCDH17分别与miR-23b-3p拟似物、NC拟似物共转染到各组细胞中,放于细胞培养箱中继续培养48 h。用双荧光素酶分析系统检测各组细胞荧光素酶活性。设置3个复孔,取平均值,实验重复3次。
1.2.4Western blot法检测各组细胞中JNK、p-JNK、c-Jun、p-c-Jun、LC3B、Beclin-1、Bax及Bcl-2蛋白表达 收集各组转染后的细胞,加入适量的RIPA裂解液提取蛋白,使用BCA蛋白分析试剂盒测定蛋白质量浓度。取30 μg蛋白样品进行SDS-PAGE凝胶电泳,并转印至甲醇活化的PVDF膜,用5%脱脂奶粉在室温条件下封闭PVDF膜1 h;加入JNK、p-JNK、c-Jun、p-c-Jun、LC3B、Beclin-1、Bax、Bcl-2、GAPDH一抗(均1∶ 1 000稀释),4 ℃孵育过夜,TBST漂洗3次;加入相应二抗(1∶ 2 000)37 ℃孵育1 h,TBST漂洗3次;采用ECL试剂盒进行显色,采用凝胶成像分析系统进行检测,使用ImageJ软件对条带进行量化分析。以GAPDH作为内参照,计算各目的蛋白的相对表达量。
1.2.5流式细胞术检测HLEB3细胞凋亡率 取正常对照组、高糖组、miR-23b-3p拟似物组、NC拟似物组、NC-siRNA组、PCDH17-siRNA组转染48 h的细胞,用胰蛋白酶消化并收集细胞,磷酸盐缓冲液洗2次;调整细胞数量至1×105个/孔,加入195 μl的Annexin V-FITC结合液,反复轻轻吹打细胞,用移液管将细胞充分混合成单细胞悬液。在单细胞悬液中加入5 μl的Annexin V-FITC和10 μl的碘化丙啶,混合均匀,放入暗盒中孵育10 min。将单细胞悬液转移至流式细胞仪专用离心管中,流式细胞仪上样检测。
1.3 统计学方法
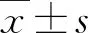
2 结果
2.1 单纯白内障组和DC组前囊膜组织中miR-23b-3p相对表达量比较
DC组患者晶状体组织中miR-23b-3p相对表达量为0.35±0.15,明显低于单纯白内障组患者的1.00±0.09,差异有统计学意义(t=44.627,P<0.01)(图1)。
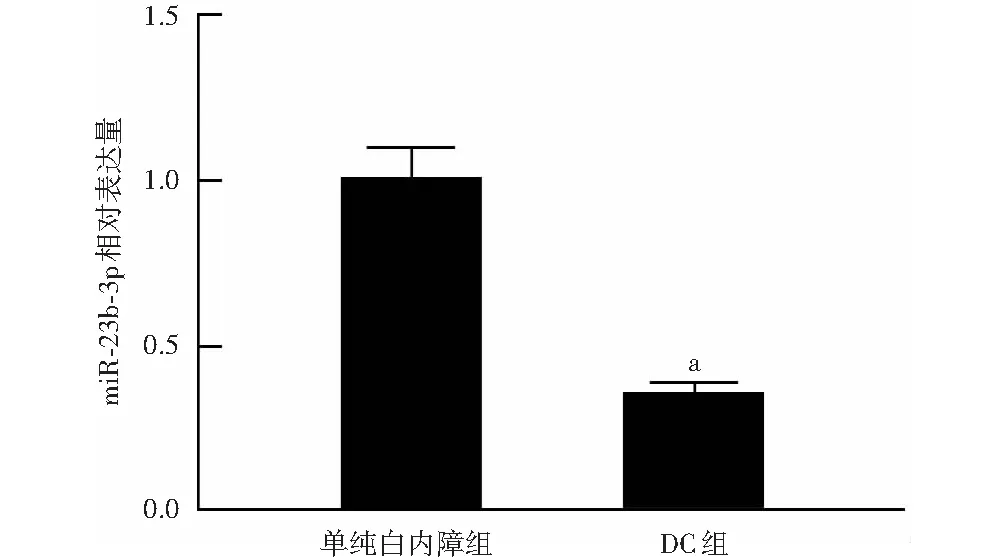
图1 各组患者前囊膜组织中miR-23b-3p相对表达量比较 与单纯白内障组比较,aP<0.01(独立样本t检验,n=30) miR:微小RNA;DC:糖尿病性白内障Figure 1 Comparison of the relative expression level of miR-23b-3p in anterior capsular membrane between two groups Compared with simple cataract group,aP<0.01 (Independent samples t test,n=30) miR:microRNA;DC:diabetic cataract

表1 各组细胞中miR-23b-3p相对表达量比较(x±s)Table 1 Comparison of relative expression of miR-23b-3pamong different groups (x±s)组别样本量miR-23b-3p相对表达量正常对照组31.00±0.11高糖组30.39±0.08aNC拟似物组30.42±0.07miR-23b-3p拟似物组31.63±0.16bF值21.325P值<0.001 注:与正常对照组比较,aP<0.05;与NC拟似物组比较,bP<0.05(单因素方差分析,LSD-t检验) miR:微小RNA;NC:阴性对照 Note:Compared with normal control group,aP<0.05;compared with NC mimics group,bP<0.05 (One-way ANOVA,LSD-t test) miR:microRNA;NC:negative control
2.2 各miRNA转染组细胞中miR-23b-3p相对表达量及细胞凋亡和自噬相关蛋白比较
正常对照组、高糖组、NC拟似物组、miR-23b-3p拟似物组细胞中miR-23b-3p及LC3B Ⅱ/Ⅰ、Beclin-1、细胞凋亡率、Bcl-2、Bax蛋白相对表达量总体比较,差异均有统计学意义(F=21.325,P<0.001;F=28.318,P=0.002;F=17.634,P=0.007;F=26.537,P=0.003;F=15.482,P=0.001;F=22.325,P<0.001)。与正常对照组比较,高糖组中miR-23b-3p表达量显著降低,细胞凋亡率升高,LC3B Ⅱ/Ⅰ比值、Beclin-1以及Bax蛋白表达量显著升高,Bcl-2蛋白表达量显著下降,差异均有统计学意义(均P<0.05);与NC拟似物组比较,miR-23b-3p拟似物组细胞中miR-23b-3p表达量显著升高,细胞凋亡率降低,LC3 Ⅱ/Ⅰ比值、Beclin-1以及Bax蛋白表达量显著下降,Bcl-2蛋白表达量显著升高,差异均有统计学意义(均P<0.05)(图2,表1、2)。
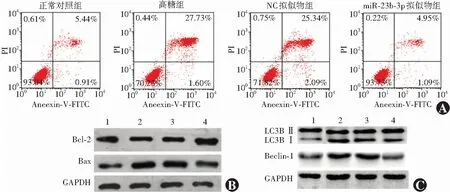
图2 各组细胞凋亡率以及凋亡、自噬蛋白的表达 A:各组细胞凋亡流式细胞图 B:各组细胞凋亡相关蛋白表达电泳图 C:各组细胞自噬相关蛋白表达电泳图 1:正常对照组;2:高糖组;3:NC拟似物组;4:miR-23b-3p拟似物组 NC:阴性对照;miR:微小RNA;Bcl-2:B淋巴细胞瘤-2;Bax:B淋巴细胞瘤-2相关X蛋白;GAPDH:甘油醛-3-磷酸脱氢酶;LC3B:微管相关蛋白1轻链3;Beclin-1:哺乳动物ATG6同源蛋白Figure 2 Apoptosis rate and expression of apoptotic and autophagy-related proteins in different groups A:Flow cytometry of cell apoptosis B:Electrophoretogram of apoptotic proteins C:Electrophoretogram of autophagy-related proteins 1:normal control group;2:high glucose group;3:NC mimics group;4:miR-23b-3p mimics group NC:normal control;miR:microRNA;Bcl-2:B-cell lymphoma-2;Bax:Bcl-2 associated X protein;GAPDH:glyceraldehyde-3-phosphate dehydrogenase;LC3B:microtubule-associated protein 1 light chain 3;Beclin-1:a mammalian homolog of yeast Atg6/Vps30
2.3 miR-23b-3p靶向结合PCDH17验证
生物信息学数据库预测miR-23b-3p直接靶向结合PCDH17 3'-UTR。miR-23b-3p拟似物组WT-PCDH17荧光素酶活性为1.00±0.11,明显低于NC拟似物组的0.42±0.05,差异有统计学意义(t=7.306,P=0.004);miR-23b-3p拟似物组与NC拟似物组MUT-PCDH17荧光素酶活性分别为1.00±0.09和0.98±0.08,差异无统计学意义(t=0.314,P=0.952)。miR-23b-3p拟似物组细胞中PCDH17 mRNA相对表达量为0.41±0.04,明显低于NC拟似物组的1.00±0.09,差异有统计学意义(t=9.483,P=0.001)(图3)。

图3 miR-23b-3p靶向PCDH17验证 A:miR-23b-3p与野生型PCDH17基因存在靶向结合位点 B:各组细胞野生型荧光素酶活性比较 与NC拟似物组比较,aP<0.05(独立样本t检验,n=3) C:各组细胞突变型荧光素酶活性比较 与NC拟似物组比较,P=0.952(独立样本t检验,n=3) D:各细胞转染组PCDH17 mRNA相对表达量比较 与NC拟似物组比较,aP<0.05(独立样本t检验,n=3) WT:野生型;PCDH17:原钙黏附蛋白17;miR:微小RNA;MUT:突变型;NC:阴性对照Figure 3 Validation of miR-23b-3p targeting PCDH17 A:Targeted binding sites of miR-23b-3p and wild-type PCDH17 B:Comparison of wild luciferase activity between two groups Compared with NC mimics group,aP<0.05 (Independent samples t test,n=3) C:Comparison of mutant luciferase activity between two groups Compared with NC mimics group,P=0.952 (Independent samples t test,n=3) D:Comparison of the relative expression of PCDH17 mRNA between different transfection groups Compared with NC mimics group,aP<0.05 (Independent samples t test,n=3) WT:wild type;PCDH17:protocadherin 17;miR:microRNA;MUT:mutant type;NC:negative control
2.4 各siRNA转染组细胞中PCDH17 mRNA相对表达量比较
正常对照组、高糖组、NC-siRNA组、PCDH17-siRNA组细胞中PCDH17 mRNA相对表达量分别为1.00±0.04、3.42±0.16、3.35±0.13和1.42±0.09,总体比较差异有统计学意义(F=41.183,P=0.001);其中高糖组细胞中PCDH17 mRNA相对表达量高于正常对照组,PCDH17-siRNA组细胞中PCDH17 mRNA相对表达量低于NC-siRNA组,差异均有统计学意义(均P<0.05)(图4)。

图4 各组细胞中PCDH17 mRNA相对表达量比较 F=41.183,P=0.001.与正常对照组比较,aP<0.05;与NC-siRNA组比较,bP<0.05(单因素方差分析,LSD-t检验,n=3) PCDH17:原钙黏附蛋白17;NC:阴性对照Figure 4 Comparison of the relative expression level of PCDH17 mRNA among different groups F=41.183,P=0.001.Compared with normal control group,aP<0.05;compared with NC-siRNA group,bP<0.05 (One-way ANOVA,LSD-t test,n=3) PCDH17:protocadherin 17;NC:negative control
2.5 各siRNA转染组凋亡率、细胞凋亡和自噬相关蛋白表达比较
与NC-siRNA组相比,PCDH17-siRNA组细胞凋亡率降低,LC3B-Ⅱ/Ⅰ比值、Beclin-1以及Bax蛋白相对表达量显著下降,Bcl-2蛋白相对表达量显著升高,差异均有统计学意义(t=9.116,P=0.001;t=12.413,P=0.004;t=5.349,P=0.006;t=3.273,P=0.001;t=8.419,P<0.001)(图5,表3)。

图5 各组细胞凋亡及自噬和凋亡相关蛋白表达情况 A:各组细胞凋亡流式细胞图 B:各组自噬和凋亡相关蛋白表达电泳图 NC:阴性对照;PCDH17:原钙黏附蛋白17;siRNA:小干扰RNA;Bax:B淋巴细胞瘤-2相关X蛋白;Beclin-1:哺乳动物ATG6同源蛋白;LC3B:微管相关蛋白1轻链3;Bcl-2:B淋巴细胞瘤-2;GAPDH:甘油醛-3-磷酸脱氢酶Figure 5 Cell apoptosis and the expression of autophagy- and apoptosis-related proteins in two groups A:Flow cytometry of cell apoptosis B:Electrophoretogram of autophagy- and apoptosis-related proteins NC:normal control;PCDH17:protocadherin 17;siRNA:small interfering RNA;Bax:Bcl-2 associated X protein;Beclin-1:a mammalian homolog of yeast Atg6/Vps30;LC3B:microtubule-associated protein 1 light chain 3;Bcl-2:B-cell lymphoma-2;GAPDH:glyceraldehyde-3-phosphate dehydrogenase
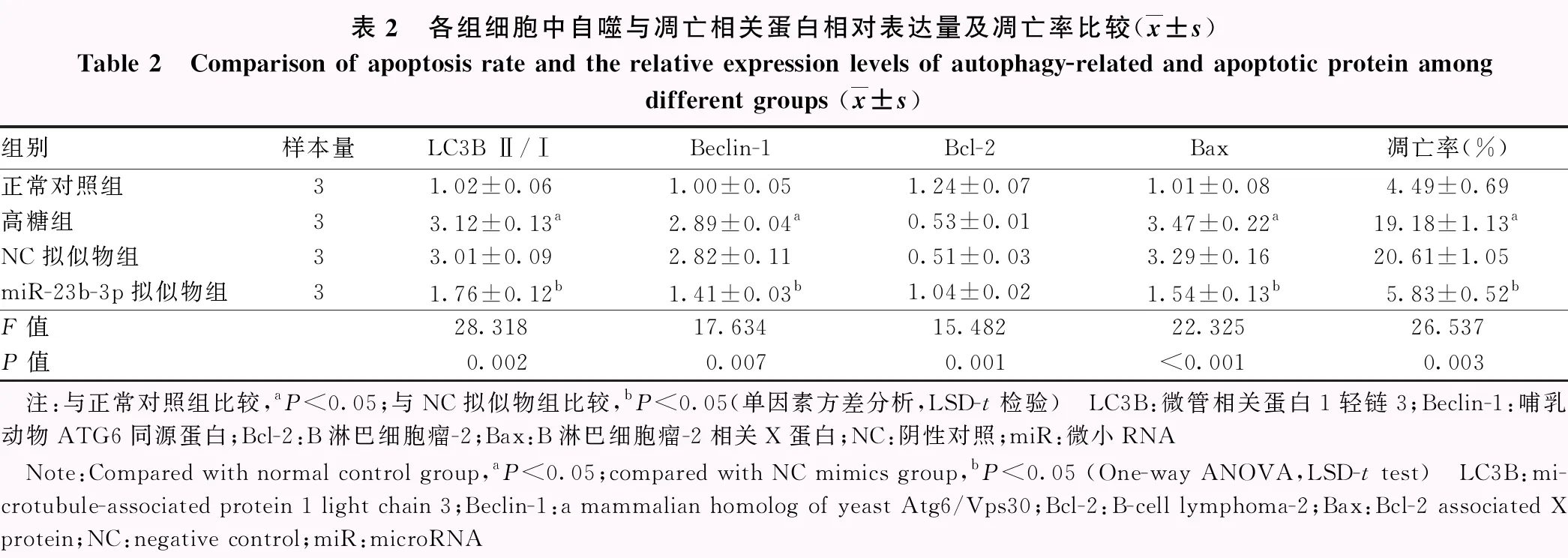
表2 各组细胞中自噬与凋亡相关蛋白相对表达量及凋亡率比较(x±s)Table 2 Comparison of apoptosis rate and the relative expression levels of autophagy-related and apoptotic protein amongdifferent groups (x±s)组别样本量LC3B Ⅱ/ⅠBeclin-1Bcl-2Bax凋亡率(%)正常对照组31.02±0.061.00±0.051.24±0.071.01±0.084.49±0.69高糖组33.12±0.13a2.89±0.04a0.53±0.013.47±0.22a19.18±1.13aNC拟似物组33.01±0.092.82±0.110.51±0.033.29±0.1620.61±1.05miR-23b-3p拟似物组31.76±0.12b1.41±0.03b1.04±0.021.54±0.13b5.83±0.52bF值28.31817.63415.48222.32526.537P值0.0020.0070.001<0.0010.003 注:与正常对照组比较,aP<0.05;与NC拟似物组比较,bP<0.05(单因素方差分析,LSD-t检验) LC3B:微管相关蛋白1轻链3;Beclin-1:哺乳动物ATG6同源蛋白;Bcl-2:B淋巴细胞瘤-2;Bax:B淋巴细胞瘤-2相关X蛋白;NC:阴性对照;miR:微小RNA Note:Compared with normal control group,aP<0.05;compared with NC mimics group,bP<0.05 (One-way ANOVA,LSD-t test) LC3B:mi-crotubule-associated protein 1 light chain 3;Beclin-1:a mammalian homolog of yeast Atg6/Vps30;Bcl-2:B-cell lymphoma-2;Bax:Bcl-2 associated X protein;NC:negative control;miR:microRNA
2.6 各共转染组细胞中JNK通路蛋白以及自噬和凋亡蛋白比较
NC拟似物组、miR-23b-3p拟似物组、miR-23b-3p拟似物+Vector组、miR-23b-3p拟似物+pcDNA-PCDH17组细胞中p-JNK/JNK、p-c-Jun/c-Jun、LC3B Ⅱ/Ⅰ、Beclin-1、Bcl-2、Bax蛋白相对表达量总体比较,差异均有统计学意义(F=24.724,P=0.004;F=19.319,P=0.008;F=23.418,P=0.009;F=17.562,P=0.011;F=20.263,P=0.001;F=15.249,P=0.005);其中与NC拟似物组比较,miR-23b-3p拟似物组细胞中p-JNK/JNK比值和p-c-Jun/Jun比值显著降低,差异均有统计学意义(均P<0.05);与miR-23b-3p拟似物+Vector组比较,miR-23b-3p拟似物+pcDNA-PCDH17组细胞中p-JNK/JNK比值和p-c-Jun/c-Jun比值升高,LC3B Ⅱ/Ⅰ比值和Beclin-1以及Bax蛋白相对表达量显著升高,Bcl-2蛋白相对表达量显著降低,差异均有统计学意义(均P<0.05)(图6,表4)。
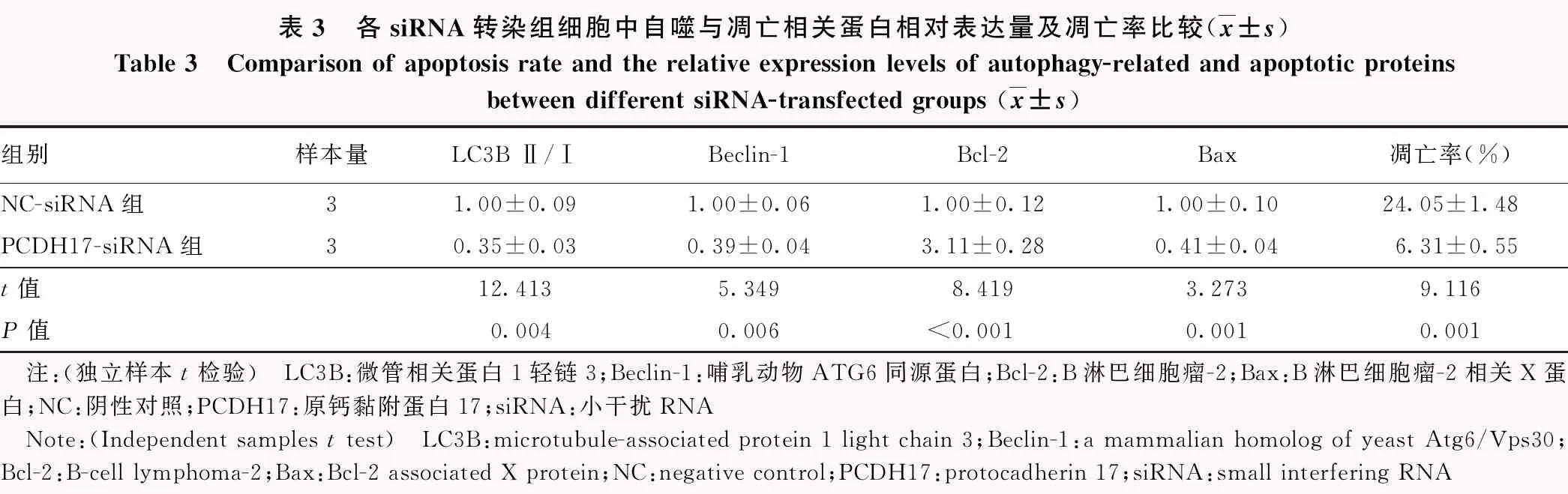
表3 各siRNA转染组细胞中自噬与凋亡相关蛋白相对表达量及凋亡率比较(x±s)Table 3 Comparison of apoptosis rate and the relative expression levels of autophagy-related and apoptotic proteinsbetween different siRNA-transfected groups (x±s)组别样本量LC3B Ⅱ/ⅠBeclin-1Bcl-2Bax凋亡率(%)NC-siRNA组31.00±0.091.00±0.061.00±0.121.00±0.1024.05±1.48PCDH17-siRNA组30.35±0.030.39±0.043.11±0.280.41±0.046.31±0.55t值12.4135.3498.4193.2739.116P值0.0040.006<0.0010.0010.001 注:(独立样本t检验) LC3B:微管相关蛋白1轻链3;Beclin-1:哺乳动物ATG6同源蛋白;Bcl-2:B淋巴细胞瘤-2;Bax:B淋巴细胞瘤-2相关X蛋白;NC:阴性对照;PCDH17:原钙黏附蛋白17;siRNA:小干扰RNA Note:(Independent samples t test) LC3B:microtubule-associated protein 1 light chain 3;Beclin-1:a mammalian homolog of yeast Atg6/Vps30;Bcl-2:B-cell lymphoma-2;Bax:Bcl-2 associated X protein;NC:negative control;PCDH17:protocadherin 17;siRNA:small interfering RNA

图6 各共转染组细胞中JNK通路蛋白以及自噬和凋亡蛋白表达电泳图 与NC拟似物组比较,miR-23b-3p拟似物组细胞中p-JNK、p-c-Jun、LC3B Ⅱ/Ⅰ和Beclin-1以及Bax蛋白表达条带较窄,强度较弱,Bcl-2蛋白条带较宽,强度较强;与miR-23b-3p拟似物+Vector组比较,miR-23b-3p拟似物+pcDNA-PCDH17组细胞中p-JNK、p-c-Jun、LC3B Ⅱ/Ⅰ和Beclin-1以及Bax蛋白表达条带较宽,强度较强,Bcl-2蛋白条带较窄,强度较弱 1:NC拟似物组;2:miR-23b-3p拟似物组;3:miR-23b-3p拟似物+Vector组;4:miR-23b-3p拟似物+pcDNA-PCDH17组 LC3B:微管相关蛋白1轻链3;Beclin-1:哺乳动物ATG6同源蛋白;GAPDH:甘油醛-3-磷酸脱氢酶;Bax:B淋巴细胞瘤-2相关X蛋白;Bcl-2:B淋巴细胞瘤-2;JNK:c-Jun氨基末端激酶Figure 6 Electrophoretogram of JNK pathway proteins,autophagy-related and apoptotic proteins in different co-transfection groups Compared with NC mimics group,the expression bands of p-JNK,p-c-Jun,LC3B Ⅱ/Ⅰ,Beclin-1 and Bax were narrower and weaker,while the expression band of Bcl-2 was wider and stronger in miR-23b-3p mimics group;compared with miR-23b-3p mimics+Vector group,the expression bands of p-JNK,p-c-Jun,LC3B Ⅱ/Ⅰ,Beclin-1 and Bax were wider and stronger while the expression band of Bcl-2 was narrower and weaker in miR-23b-3p mimics+pcDNA-PCDH17 group 1:NC mimics group;2:miR-23b-3p mimics group;3:miR-23b-3p mimics+Vector group;4:miR-23b-3p mimics+pcDNA-PCDH17 group LC3B:microtubule-associated protein1 light chain 3;Beclin-1:a mammalian homolog of yeast Atg6/Vps30;GAPDH:glyceraldehyde-3-phosphate dehydrogenase;Bax:Bcl-2 associated X protein;Bcl-2:B-cell lymphoma-2;JNK:c-Jun N-terminal kinases

表4 各共转染组细胞中不同蛋白相对表达量比较(x±s)Table 4 Comparison of relative expression level of different proteins among co-transfection groups (x±s)组别样本量p-JNK/JNKp-c-Jun/JunLC3B Ⅱ/ⅠBeclin-1Bcl-2BaxNC拟似物组31.01±0.021.00±0.061.00±0.051.00±0.081.00±0.021.00±0.03miR-23b-3p拟似物组30.43±0.03a0.31±0.01a0.33±0.03a0.39±0.04a3.14±0.13a0.31±0.01amiR-23b-3p拟似物+Vector组30.41±0.010.33±0.020.35±0.020.40±0.013.11±0.080.35±0.03miR-23b-3p拟似物+pcDNA-PCDH17组30.91±0.08b0.93±0.05b0.93±0.07b0.95±0.06b1.42±0.06b0.96±0.07bF值24.72419.31923.41817.56220.26315.249P值0.0040.0080.0090.0110.0010.005 注:与NC拟似物组比较,aP<0.05;与miR-23b-3p拟似物+Vector组比较,bP<0.05(单因素方差分析,LSD-t检验) JNK:c-Jun氨基末端激酶;LC3B:微管相关蛋白1轻链3;Beclin-1:哺乳动物ATG6同源蛋白;Bcl-2:B淋巴细胞瘤-2;Bax:B淋巴细胞瘤-2相关X蛋白;NC:阴性对照;miR:微小RNA;PCDH17:原钙黏附蛋白17 Note:Compared with NC mimics group,aP<0.05;Compared with miR-23b-3p mimic+Vector group,bP<0.05 (One-way ANOVA,LSD-t test) JNK:c-Jun N-terminal kinases;LC3B:microtubule-associated protein 1 light chain 3;Beclin-1:a mammalian homolog of yeast Atg6/Vps30;Bcl-2:B-cell lymphoma-2;Bax:Bcl-2 associated X protein;NC:negative control;miR:microRNA;PCDH17:protocadherin 17
3 讨论
miRNA广泛参与细胞凋亡、增生、分化及应激反应等,其异常表达与多种疾病的发生密切相关。研究报道miRNA在白内障发展过程中异常表达,其在DC形成的机制研究中也受到越来越多的关注[12-13]。目前研究表明,miR-23b-3p在多种组织细胞中具有重要作用,可能抑制骨肉瘤细胞的增生和侵袭,并通过下调SIX1促进细胞凋亡[14]。miR-23b-3p通过调控HS6ST2激活骨关节炎患者软骨细胞中的p38 MAPK促进基质降解[15]。miR-23b通过靶向肌醇多磷酸多激酶(inositol phosphate multikinase,IPMK)抑制神经炎症,在脑溢血患者中起保护作用[16]。此外,Zhao等[17]研究发现miR-23b-3p通过SIRT1依赖性信号通路调节糖尿病视网膜病变中高糖诱导的细胞代谢。在年龄相关性白内障患者晶状体前囊膜组织中,circZNF292可通过海绵吸附miR-23b-3p调控晶状体上皮细胞氧化应激和凋亡[18]。目前miR-23b-3p在DC中的作用及机制尚不清楚。本研究中采用高糖培养HLEB3细胞作为DC模型,研究miR-23b-3p在DC中的作用机制。
晶状体上皮细胞的功能改变被认为是白内障发生的细胞基础。最近的研究表明,晶状体上皮细胞凋亡和自噬在白内障的发生和发展中起着重要作用。有研究显示,晶状体上皮细胞凋亡可能是DC形成的始动因素[19-20]。自噬溶酶体途径对维持晶状体透明至关重要。大量研究证实自噬在多种类型的白内障发生和发展中发挥作用[21-22]。微管相关蛋白1轻链3亚家族LC3B是参与自噬形成的重要泛素化系统,是细胞自噬水平的重要评价标准。LC3-Ⅱ/Ⅰ的比值常用来评估自噬水平。Beclin-1主要参与自噬的起始阶段,是评价自噬水平的重要标志物之一。先前的研究表明,高浓度葡萄糖可诱导血管内皮细胞自噬[23]。本研究结果也显示,在高糖条件下培养的晶状体上皮细胞中LC3B及Beclin-1表达升高,促凋亡蛋白Bax表达显著升高,抗凋亡蛋白Bcl-2表达下降,细胞出现自噬和凋亡。PCDH17属于原钙粘蛋白基因家族,已被证明与细胞凋亡和自噬有关[24-26]。目前尚无文献报道PCDH17在DC中的作用。本研究发现高糖环境下HLEB3细胞中PCDH17 mRNA表达升高,沉默PCDH17表达后细胞自噬和细胞凋亡水平均显著下降,推测PCDH17在DC中可能具有重要作用。但本研究未进行PCDH17蛋白水平的检测,在之后的研究中应重点关注PCDH17在DC中的作用机制。此外,有研究表明自噬和凋亡之间具有复杂的相互作用,激活自噬可促进视网膜神经节细胞存活,抑制自噬可降低视神经退行性病变过程中细胞的存活[27]。本研究结果发现DC形成过程中细胞凋亡与自噬均发生显著变化,然而自噬与细胞凋亡的关系尚不清楚,仍有待进一步研究。
本研究还探索了miR-23b-3p对高糖诱导的HLEB3细胞中JNK信号通路的潜在影响。JNK属于丝裂原活化蛋白激酶家族,可结合磷酸化c-Jun的转录活化结构域,在调节细胞炎症反应、细胞凋亡和细胞自噬中发挥重要作用[28-29]。在本研究中,miR-23b-3p过表达使p-JNK/JNK比值和p-c-Jun/Jun比值显著降低,而PCDH17过表达可逆转这一结果,说明在高糖诱导的HLEB3细胞中,miR-23b-3p通过调控PCDH17抑制了JNK信号通路的激活。
综上所述,miR-23b-3p通过靶向PCDH17抑制JNK通路,促进高糖诱导的HLEB3细胞自噬和凋亡。以上结果为DC发生和发展的分子机制提供了新的见解,同时为miR-23b-3p成为DC治疗的靶点提供了实验依据。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明刘文兰:参与研究选题,研究设计,研究实施,论文撰写、修改及定稿;王莉:参与研究设计、数据分析、对文章的知识性内容作批评性审阅;杨扬:参与研究实施、数据采集与分析、论文修改;闫瑾:参与数据采集与分析、论文修改;何媛:参与研究实施、资料收集

