腹腔穿刺引流对重症急性胰腺炎大鼠胰腺细胞焦亡的影响及其意义
吴俊,卢一琛,黄竹,蒋文,且华吉,刘江涛,孙红玉,3*,汤礼军*
1西南交通大学医学院,四川 成都 610063;2西部战区总医院全军普通外科中心/四川省胰腺损伤与修复重点实验室,四川 成都 610083;3西部战区总医院基础医学实验室,四川 成都 610083
重症急性胰腺炎(severe acute pancreatitis,SAP)是一种病情严重、病死率高达30%的临床急腹症[1],其特征是广泛的胰腺组织坏死、后续感染、全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)及并发多器官功能障碍综合征[1-2]。SAP病死率高的关键原因是目前尚无有效的措施能控制其进展。在SAP早期,腹腔内常会出现胰腺炎相关腹水(pancreatitis associated ascite fluid,PAAF),其内含有大量胰酶、游离脂肪酸、内毒素等有害物质[3-4]。已经证实早期实施腹腔穿刺引流(abdominal paracentesis drainage,APD)引流腹水能够降低SAP患者全身炎症反应、多器官功能障碍综合征的发生率及病死率[4-6]。然而,APD治疗SAP的机制尚不明确[7],对其进行深入探讨可为临床行APD治疗SAP提供理论依据,并为寻找相应的治疗靶点及研究相关药物辅助治疗提供思路。
细胞焦亡是由含半胱氨酸的天冬氨酸蛋白水解酶(caspase)-1、4及5介导的一种程序性细胞死亡方式[8-9],其中caspase-1介导的焦亡是其经典激活途径,特征是促炎因子释放及溶解性死亡[10-11]。一方面,切割的caspase-1分解白细胞介素(interleukin,IL)-1β及IL-18前体为有活性的形式;另一方面,切割的caspase-1切割gasdermin家族蛋白D(gasdermin D,GSDMD),切割的GSDMD N末端蛋白可识别质膜上的磷酸肌醇及心磷脂,形成膜孔,导致细胞死亡,此为焦亡的特征性改变;具有活性的IL-1β、IL-18等内容物从膜孔被释放,可募集更多的炎性细胞,从而扩大炎症反应。本研究探讨APD治疗对SAP胰腺组织细胞焦亡的影响及其意义,以期进一步认识APD治疗SAP的机制。
1 材料与方法
1.1 实验动物及主要试剂 48只SPF级SD大鼠(220~250 g)购自成都恩斯维尔生物科技有限公司。牛磺胆酸钠购自美国Sigma公司;大鼠脂肪酶、淀粉酶生化检测试剂盒购自南京建成生物工程研究所;IL-1β、IL-6、IL-18、肿瘤坏死因子(tumor necrosis factor,TNF)-α酶联免疫吸附实验(enzymelinked immunosorbent assay,ELISA)检测试剂盒购自上海拙彩生物科技有限公司;反转录聚合酶链反应(reverse transcription quantitative polymerase chain reaction,RT-PCR)检测试剂盒One Step SYBR PrimeScript RT-PCR KitⅡ购自日本TaKaRa公司;Bradford蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;pro-caspase-1及凋亡相关的斑点样蛋白(apoptosis-associated speck-like protein,ASC)抗体购自美国Abcam公司,核苷酸结合寡聚化结构域样受体3(nucleotide-binding oligomerization domainlike receptor 3,NLRP3)抗体购自美国Thermo Fisher公司,cleaved-caspase-1抗体、GSDMD抗体、GAPDH抗体及山羊抗兔二抗均购自武汉三鹰生物技术有限公司,cleaved-GSDMD抗体购自武汉ABclonal公司;RNA提取试剂及全蛋白提取试剂盒购自北京索莱宝科技有限公司;动物用麻醉药异氟烷购自深圳市瑞沃德生命科技有限公司。
1.2 方法
1.2.1 动物分组及模型制备 48只大鼠首先在独立通气笼中适应性喂养1周,术前禁食12 h,不禁饮。采用随机数字表法将其分为SAP组、APD组及假手术组,每组16只。SAP组使用5%牛磺胆酸钠构建SAP模型。具体操作如下:采用异氟烷麻醉动物后,在剑突下1 cm处沿腹白线开腹,然后在十二指肠上寻找胰胆管开口,穿刺针穿刺进入胰胆管,夹闭胰胆管两端并固定穿刺针,使用微量输液泵均匀输注牛磺胆酸钠溶液,剂量为0.1 ml/100 g,速度为12 ml/h。输注结束后压力维持5 min,取下穿刺针及动脉夹,关腹。APD组按SAP组的操作成功构建SAP模型后,在动物右下腹放置引流管,引流管外接真空负压吸引球,关腹。假手术组采用与SAP组相同的方式开腹并找到胰腺,翻动胰腺数次后关腹。术后禁食不禁饮。所有大鼠于建模后12 h处死,收集其血清及胰腺组织。实验过程符合国家有关实验动物的管理及使用规定。
1.2.2 胰腺组织病理学检查 采用4%多聚甲醛溶液固定胰腺组织,经脱水、石蜡包埋后,制备厚4 μm的切片并进行HE染色。在光学显微镜下观察其病理形态学改变,由两位病理医师参照Schmidt等[12]报道的评分标准独立地对胰腺损伤程度从水肿、坏死、出血、炎性细胞浸润等方面进行评分。
1.2.3 血清脂肪酶、淀粉酶活性检测 于造模后12 h经腹主动脉采集大鼠血液样本,静置30 min后,以3500 r/min离心20 min,收集上清液,采用全自动生化分析仪检测血清脂肪酶及淀粉酶的活性,具体操作步骤严格按照说明书进行。
1.2.4 ELISA法检测血清炎性因子水平 采用ELISA试剂盒检测血清IL-1β、IL-6、TNF-α及IL-18的水平,具体操作步骤严格按照说明书进行。
1.2.5 RT-PCR检测胰腺组织相关基因mRNA的表达水平 采用Trizol法提取胰腺组织总RNA,使用NanoDrop-2000微量紫外分光光度计测定RNA浓度及光密度(OD)值,OD260/OD280值在1.8~2.0符合标准。采用一步法PCR试剂盒进行反转录及扩增,具体条件如下:42 ℃ 5 min;95 ℃ 5 s、60 ℃ 30 s,共40个循环。以GAPDH作为内参照基因,引物均由上海生工生物工程有限公司合成,具体序列见表1。

表1 RT-PCR引物序列Tab. 1 Primer sequences of RT-PCR
1.2.6 Western blotting检测胰腺组织caspase-1、cleaved-caspase-1、ASC、NLRP3、GSDMD及cleaved-GSDMD蛋白的表达水平 使用全蛋白提取试剂盒,按照说明书提取胰腺组织总蛋白,使用Bradford蛋白浓度测定试剂盒检测蛋白样品的浓度,然后加入蛋白质载样缓冲液煮沸后分装,置于–80 ℃保存。通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)体系分离目标蛋白,将目标蛋白转移至PVDF膜后,使用5%脱脂牛奶室温封闭2 h。加入一抗在4 ℃摇床上孵育12 h,一抗的稀释比例如下:caspase-1(1:1000)、cleaved-caspase-1(1:2000)、A SC(1:1000)、NLRP3(1:1000)、GSDMD(1:5000)、cleaved-GSDMD(1:1000)、GAPDH(1:5000)。一抗孵育结束后,使用TBST洗涤3次,室温下加入二抗(1:10 000)孵育1 h,洗涤3次后在Azure c300化学发光成像系统上检测蛋白的表达情况。
1.2.7 透射电镜观察胰腺组织 使用3%戊二醛预固定约0.1 mm3的胰腺组织,使用1%四氧化锇再固定,丙酮逐级脱水后采用Ep812树脂包埋,进行超薄切片后使用醋酸铀及枸橼酸铅染色,使用JEM-1400Flash透射电子显微镜进行观察。
1.3 统计学处理 采用GraphPad Prism 8.0及SPSS 22.0软件进行统计学分析。计量资料以±s表示,方差齐时,多组间比较采用方差分析,进一步组间两两比较采用LSD-t检验;方差不齐时,多组间比较采用非参数检验(Kruskal-Wallis检验),进一步组间两两比较采用Mann-WhitneyU检验。P<0.05为差异有统计学意义。
2 结 果
2.1 APD对SAP大鼠胰腺组织病理损伤的影响 造模12 h后,HE染色结果显示SAP组胰腺组织出现了大片坏死、间质水肿、大量炎性细胞浸润及胰腺小叶结构紊乱等改变,组织病理学总评分及4个方面(水肿、坏死、出血、炎性细胞浸润)的具体评分均明显增高,而假手术组胰腺组织结构基本正常;APD组胰腺组织结构损伤与SAP组比较明显减轻:坏死面积明显减少,胰腺小叶结构基本清晰,炎性细胞浸润减轻,病理学评分也较SAP组明显降低,差异有统计学意义(P<0.05,图1)。

图1 各组大鼠胰腺组织病理损伤情况比较Fig. 1 Comparison on the pathological injury of pancreatic tissue of each group of rats
2.2 APD对SAP大鼠脂肪酶、淀粉酶及炎性指标的影响 SAP组脂肪酶及淀粉酶活性较假手术组明显升高,APD组较SAP组明显下降,差异均有统计学意义(P<0.05)。与假手术组比较,SAP组血清IL-6、TNF-α、IL-1β、IL-18水平明显升高,但APD组较SAP组均明显下降,差异有统计学意义(P<0.05,图2)。

图2 各组大鼠血清脂肪酶、淀粉酶活性及炎性因子水平比较Fig. 2 Comparison on the serum lipase and amylase activity, and inflammatory cytokines levels in each group of rats
2.3 APD对SAP大鼠胰腺组织焦亡通路相关基因mRNA表达的影响 RT-PCR检测结果显示,SAP组的caspase-1、NLRP3、ASC及GSDMD的mRNA表达水平明显高于假手术组,差异有统计学意义(P<0.05);与SAP组比较,APD组的caspase-1、NLRP3、ASC及GSDMD的mRNA表达水平明显下降,差异有统计学意义(P<0.05,图3)。
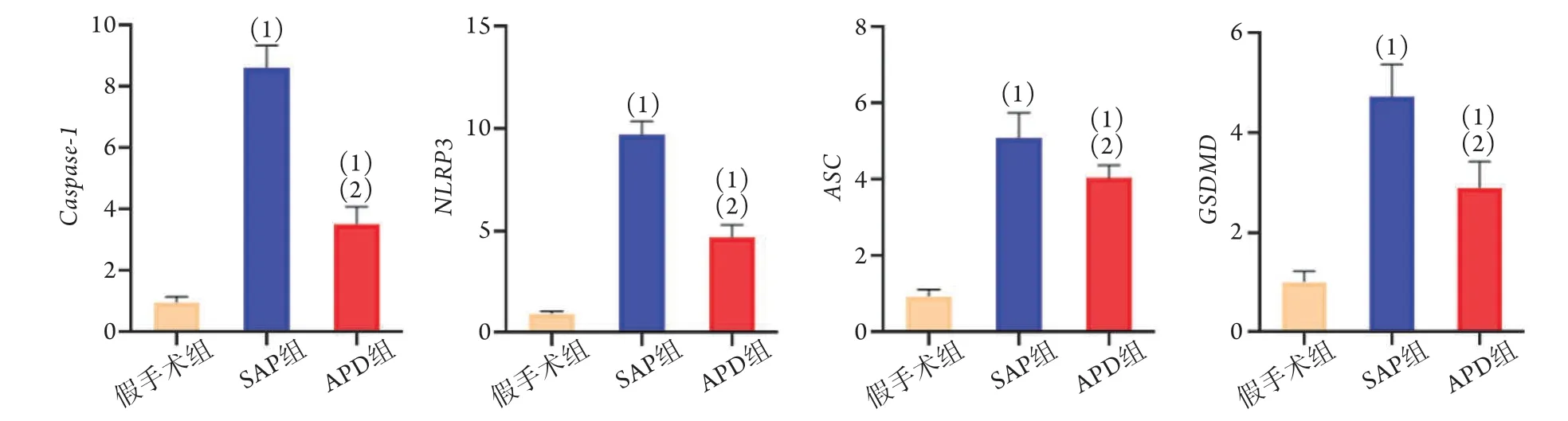
图3 各组大鼠胰腺组织焦亡通路相关基因mRNA相对表达量比较Fig. 3 Comparison on the relative expressions of pyroptosis path-related mRNAs of pancreatic tissues in each group of rats
2.4 APD对SAP大鼠胰腺组织IL-1β及IL-18的mRNA水平的影响 RT-PCR检测结果显示,SAP组IL-1β及IL-18的mRNA表达水平明显高于假手术组,APD组IL-1β及IL-18的mRNA表达水平明显低于SAP组,差异有统计学意义(P<0.05,图4)。

图4 各组大鼠胰腺组织IL-1β及IL-18 mRNA相对表达量比较Fig.4 Comparison on the expression levels of IL-1β and IL-18 mRNAs of pancreatic tissues in each group of rats
2.5 APD对SAP大鼠胰腺组织焦亡通路相关蛋白表达的影响 Western blotting检测结果显示,与假手术组比较,SAP组的焦亡通路相关蛋白caspase-1、cleaved-caspase-1、NLRP3、ASC、GSDMD及cleaved-GSDMD表达水平均明显升高,差异有统计学意义(P<0.05);APD组上述焦亡通路相关蛋白表达水平低于SAP组,差异有统计学意义(P<0.05,图5)。

图5 各组大鼠胰腺组织焦亡通路相关蛋白相对表达量比较Fig. 5 Comparison on the expression levels of pyroptosis path-related proteins of pancreatic tissues in each group of rats
2.6 APD对SAP大鼠胰腺腺泡细胞超微结构及细胞膜完整性的影响 透射电镜观察显示,与假手术组比较,SAP组出现了明显的线粒体及内质网扩张,核染色质凝聚,在细胞膜上出现了明显的膜孔形成(即焦亡的特征性改变)。与SAP组比较,APD组线粒体及内质网扩张明显减轻,核染色质凝聚明显减少(图6)。
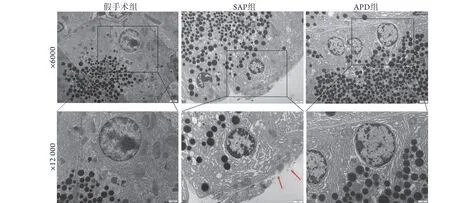
图6 APD对各组大鼠胰腺腺泡细胞超微结构及细胞膜完整性的影响Fig. 6 Effects of APD on the structure of subcellular organelles and the integrity of cell membranes of pancreatic acinar cells in each group of rats
3 讨 论
SAP是一种发病率高、进展迅速且病死率高的消化系统疾病,与机体免疫反应密切相关并能诱发器官衰竭,以至早期死亡[2,12-13]。在急性胰腺炎发病早期,主要是由损伤的细胞引发局部炎症反应,从而进一步释放促炎因子,募集更多的炎性细胞,并可能诱发SIRS[14],持续的SIRS易导致全身器官功能紊乱及器官衰竭[15-16]。已经证实PAAF中含有大量有毒物质,如炎性介质、消化酶及内毒素等,它们能够刺激机体产生大量促炎因子,加重全身炎症反应并可导致器官衰竭[17-19]。本研究结果表明,行APD治疗即排除腹水的有毒物质后,可以明显降低血清中TNF-α、IL-1β及IL-6等炎性因子水平,有效控制全身炎症反应,减轻胰腺病理损伤。因此,探明APD的治疗机制有助于为临床行APD治疗SAP提供证据,也有利于寻找相应治疗靶点,为研究相关药物辅助治疗SAP提供思路。
细胞焦亡是一种促炎形式的溶解性细胞死亡方式,经典的焦亡途径包括caspase-1激活、膜孔形成及细胞内容物释放[9,20-22]。Caspase 1的激活需要NLRP3炎性复合物的参与,它由NLRP3、ASC及pro-caspase-1组成。NLRP3被认为是细胞内损伤的感受器,能够对病原相关分子模式及损伤相关分子模式做出反应[23]。活化的NLRP3把信号传递给下游的ASC,后者可作为桥梁募集pro-caspase-1,形成炎性复合体并切割pro-caspase-1为有活性的caspase-1。活性caspase-1切割GSDMD,切割的GSDMD识别并结合到细胞膜形成膜孔,诱导焦亡形成[11,20-21]。有研究表明,细胞焦亡参与多种疾病的进展及组织损伤[20-21]。例如,在糖尿病大鼠模型中,NLRP3激活诱导的焦亡会加重心肌缺血再灌注损伤[24]。本研究发现,SAP大鼠胰腺组织的NLRP3、ASC、pro-caspase-1、cleaved-caspase-1、GSDMD及cleaved-GSDMD表达均明显升高,表明NLRP3激活caspase-1诱导的焦亡在SAP形成中起重要作用。在透射电镜下可观察到SAP大鼠胰腺组织细胞膜孔的形成,进一步证实了焦亡的形成。此外,细胞焦亡及凋亡在形态学上有一些共同特征,如核染色质凝聚[25]。经APD治疗后,caspase-1诱导的焦亡相关蛋白表达明显降低,且胰腺组织损伤明显减轻,超微结构紊乱也明显好转,核染色质凝聚明显减少,提示APD治疗可通过降低caspase-1诱导的焦亡减轻SAP的胰腺损伤。
Caspase-1被激活后,会募集并裂解IL-1β及IL-18前体为有活性的IL-1β及IL-18[9]。焦亡形成的膜孔会导致IL-1β及IL-18从细胞内释放到细胞外,进而诱导并加重全身反应。已有研究证实IL-1β是无菌性炎症及损伤反应的重要因子[26]。在急性胰腺炎中,IL-1β被认为是导致早期炎症扩散的主要细胞因子[27]。不仅如此,Xu等[28]在体外使用IL-1β处理胰腺腺泡细胞AR42J,发现其可通过介导自噬紊乱使AR42J细胞内的酶原提前激活,提示IL-1β还会损伤正常腺泡细胞。IL-18以其能激活γ干扰素(interferon-γ,INF-γ)而被知晓[29]。早在2007年的一项研究就表明,caspase-1激活的IL-18参与了急性胰腺炎的进展[30]。最近的一项研究表明,SIRS及代偿性抗炎反应综合征在急性胰腺炎中同时发生,其中IL-18通过诱导2型辅助T细胞(T-helper 2,Th2)介导的反应发挥促炎作用,IL-18缺陷小鼠能够减少T细胞激活而不增加Th2介导的反应[31]。在本研究中,SAP组大鼠血清炎性因子IL-1β、IL-18、IL-6及TNF-α水平明显升高,经过APD处理后,上述炎性因子水平明显下降;胰腺组织的IL-1β及IL-18的mRNA表达水平也明显降低,提示APD治疗能够减轻全身及局部的炎症反应。
实际上,焦亡一旦发生即可导致大量细胞内容物释放,细胞内容物包含大量有害物质如三磷酸腺苷(adenosine triphosphate,ATP)、游离脂肪酸、高迁移率族蛋白B1(high mobility group box 1,HMGB1)等[32-33]。ATP、游离脂肪酸可以通过P2X7受体激活NLRP3炎性复合体,加重胰腺损伤及炎症反应[34-35]。HMGB1是一种重要的炎性介质,可通过Toll样受体(Toll-like receptor,TLR)-4及TLR-9诱导并增强急性胰腺炎的无菌性炎症反应[36-37]。本课题组前期研究发现,SAP大鼠腹水及血清中的HMGB1含量均明显升高,中和腹水HMGB1可明显减轻胰腺损伤及全身炎症反应[38]。
综上所述,NLRP3炎性小体激活的caspase-1介导的焦亡在SAP大鼠胰腺中被激活,并参与SAP的病情进展;早期实施APD可通过抑制NLRP3炎性小体激活的caspase-1介导的焦亡,减轻局部及全身炎症反应,进而减轻SAP的胰腺损伤,为临床早期实施APD以及开发抑制焦亡治疗SAP的药物提供了依据。

