细胞型朊蛋白在结直肠癌中的表达及其与预后的关系
杜耀,陈海峰,李卫平,孔智渊,朱露露,王益
1南昌大学第一附属医院胃肠外科,江西 南昌 330006;2苏州大学附属太仓医院(太仓市第一人民医院)消化内科,江苏太仓 215400;3苏州大学附属太仓医院(太仓市第一人民医院)胃肠外科,江苏 太仓 215400;4苏州大学附属太仓医院(太仓市第一人民医院)病理科,江苏 太仓 215400
结直肠癌(colorectal cancer,CRC)是常见的消化道恶性肿瘤,也是癌症新发第三大病因、死亡第二大病因[1],目前多数患者确诊时已属中晚期,该病早期诊断的缺失给外科行根治性手术带来了极大的困难;尽管中晚期患者术后可辅以放化疗,但总体疗效不理想[2],5年生存率仅约40%[3]。因此,寻找一种敏感度和特异度均较高的肿瘤标志物对CRC的早期诊断和预后判断具有重要的临床价值。朊蛋白(prion protein,PrP)是引起疯牛病的致病体,包括细胞型(cellular prion protein,PrPC)和致病型(scrapie associated prion protein,PrPSc)两种空间构象。有研究发现,PrPC在神经系统中发挥着重要作用,且在肿瘤的发生、增殖和转移中扮演着重要角色,与肿瘤的多种恶性生物学行为关系密切[4]。本课题组前期研究发现,PrPC在胃肠癌组织中呈高表达,且其阳性表达与直肠癌淋巴结转移、TNM分期及分化程度密切相关[5]。本研究探讨了PrPC在CRC组织中的表达情况,并分析其与CRC临床病理特征及预后的关系。
1 资料与方法
1.1 研究对象 收集2016年1月-2017年1月苏州大学附属太仓医院(太仓市第一人民医院)胃肠外科经手术切除的CRC标本50例及癌旁正常组织标本(距肿瘤组织2 cm以上) 30例。纳入标准:临床资料完整;术前未行放化疗;术后经病理检查确诊并进行门诊或电话随访。排除标准:术前或术中发现远处转移;行姑息性手术切除;合并其他部位恶性肿瘤。本研究经苏州大学附属太仓医院(太仓市第一人民医院)医学伦理委员会审批(批号:KY-2020-15)。
1.2 主要试剂及仪器 兔抗人PrPC多克隆抗体(ab6664)购自美国Abcam公司;DAB显色试剂盒(K5007)、EnVision抗鼠/兔通用型免疫组化检测试剂盒购自丹麦Dako公司。半自动脱水机(TP1020)、全自动石蜡包埋机(EG1150)、全自动石蜡切片机(RM2235)购自德国Leica公司;尼康显微摄影图像处理软件(H500S电子显微镜)购自日本Nikon公司。
1.3 免疫组化SP法检测PrPC的表达 所有标本经石蜡包埋、切片(厚度4 μm)后,行免疫组化染色,按照免疫组化检测试剂盒说明书步骤操作。以已知阳性CRC组织切片作为阳性对照,以PBS缓冲液代替一抗作为阴性对照。
结果判定:显微镜下观察细胞质和(或)细胞核呈棕色或黄色判定为阳性着色。随机选取10个200倍视野,计数1000个细胞,并根据每个视野中阳性细胞数比例和染色程度进行评分:阳性细胞数比例<10%记0分,10%~25%记1分,25%~50%记2分,50%~75%记3分,≥75%记4分。将CRC组织与阴性对照进行着色强度评分:无染色为阴性(0分),细胞质和(或)细胞核呈淡棕色为弱阳性(1分),棕色为阳性(2分),深棕色为强阳性(3分)。根据阳性细胞数比例与染色强度评分的乘积将组织染色结果进行分级:0~1为阴性(–),2~4为弱阳性(+),5~8为阳性(++),9~12为强阳性(+++)。阳性率(%)=(阳性例数+强阳性例数)/总例数×100%。所有免疫组化染色结果均由两位病理医师在不知任何临床和病理资料的情况下以上述标准进行评估,如意见不一致则由第三位病理医师进行判定。
1.4 根据该判定标准,PrPC阳性表达共34例(包括阳性26例,强阳性8例),设为PrPC阳性表达组;PrPC阴性表达共16例(包括弱阳性11例,阴性5例),设为PrPC阴性表达组。PrPC表达与临床病理特征及预后的关系 采用Spearman检验分析CRC组织中PrPC阳性表达与临床病理特征的相关性。随访截至2021年1月,应用Kaplan-Meier法分析PrPC表达与CRC患者预后的关系,应用多因素Cox比例风险回归模型分析CRC预后的影响因素。
1.5 统计学处理 采用SPSS 17.0软件进行统计分析。计数资料以例(%)表示,采用χ2检验比较CRC组织与癌旁正常组织PrPC阳性表达率的差异。P<0.05为差异有统计学意义。
2 结 果
2.1 CRC组织中PrPC的表达情况 PrPC在CRC组织及癌旁正常组织中存在不同程度的阳性表达,PrPC阳性染色主要位于细胞核(图1A)。PrPC在癌旁正常组织中阳性表达率为20.0%(6/30),在CRC组织中为68.0%(34/50)[结肠癌组织:67.9%(19/28),直肠癌组织:68.2%(15/22)],差异有统计学意义(χ2=17.28,P<0.01,图1B)。
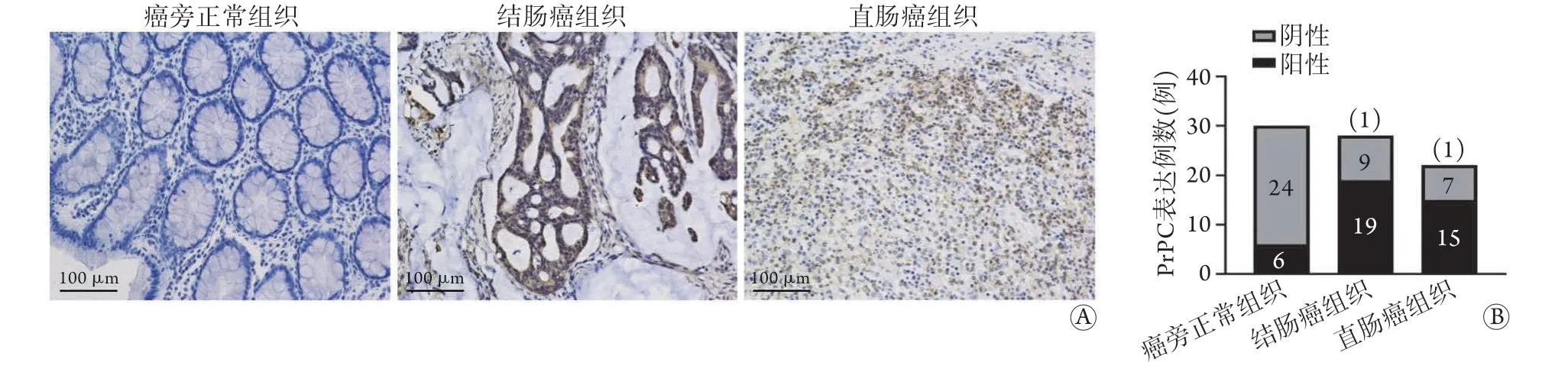
图1 PrPC在CRC组织中的表达情况(SP ×200)Fig.1 Expression of PrPC in colorectal cancer tissues (SP ×200)
2.2 CRC组织中PrPC阳性表达与临床病理特征的关系 Spearman相关分析显示,CRC组织中PrPC阳性表达与TNM分期、肿瘤浸润深度、肿瘤分化程度、脉管侵犯及淋巴结转移明显相关(P<0.05),与年龄、性别、肿瘤位置及肿瘤最大径无相关性(P>0.05,表1)。2.3 PrPC表达与CRC预后的关系 随访截至2021年1月,除1例失访外,余49例获得完整随访,随访时间为6~68个月,随访期间32例死亡,中位随访时间为48个月。Kaplan-Meier法分析显示,PrPC阴性表达组患者的生存时间为(62.0±7.0)个月,5年总体生存率为50.3%;PrPC阳性表达组患者的生存时间为(45.0±4.1)个月,5年总体生存率为7.0%。两组生存情况比较,差异有统计学意义(P=0.015,图2)。
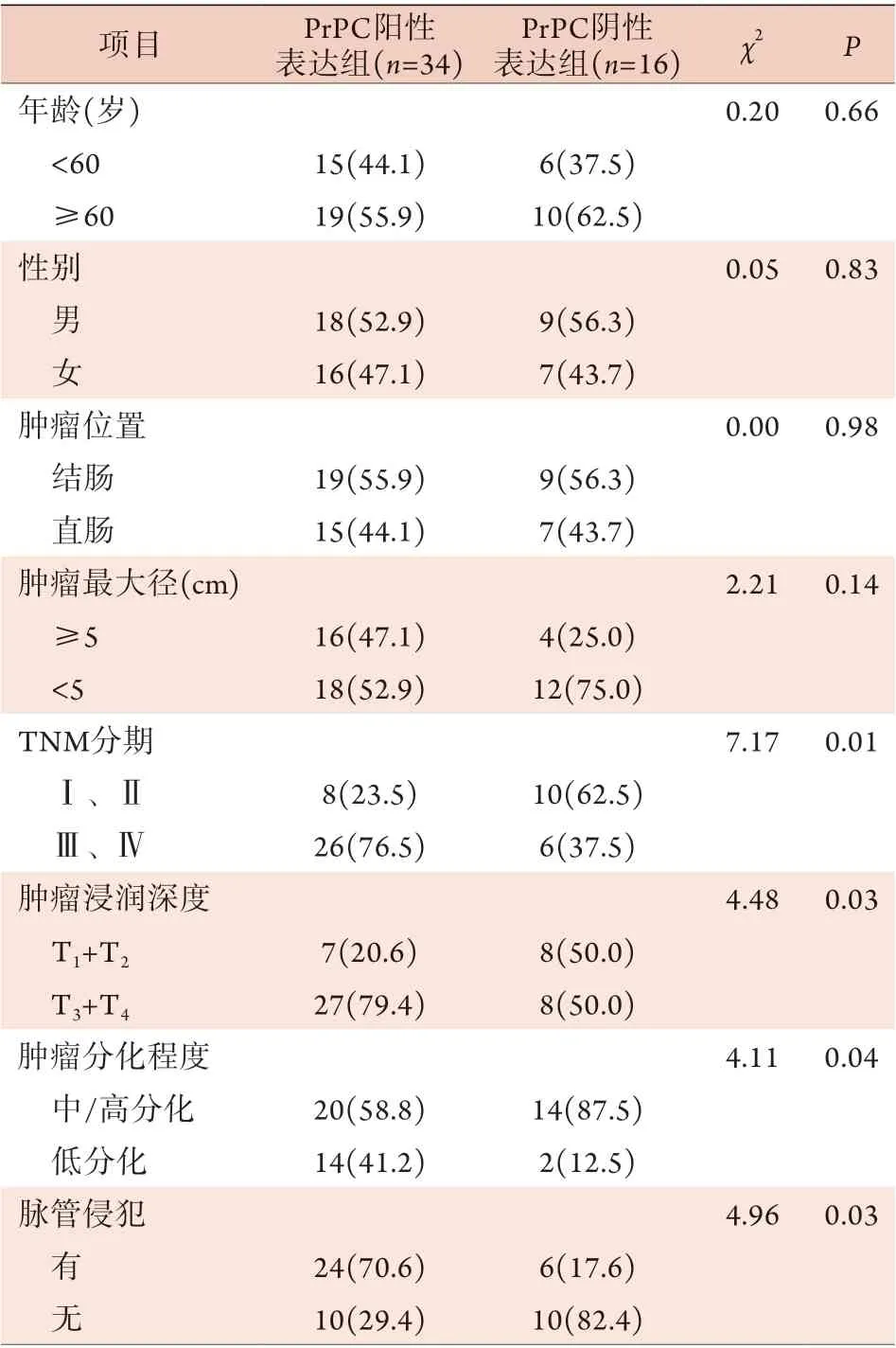
表1 CRC组织中PrPC阳性表达与临床病理特征的关系[例(%)]Tab.1 Relationship between positive PrPC expression and clinicopathological features in colorectal cancer tissues [n(%)]
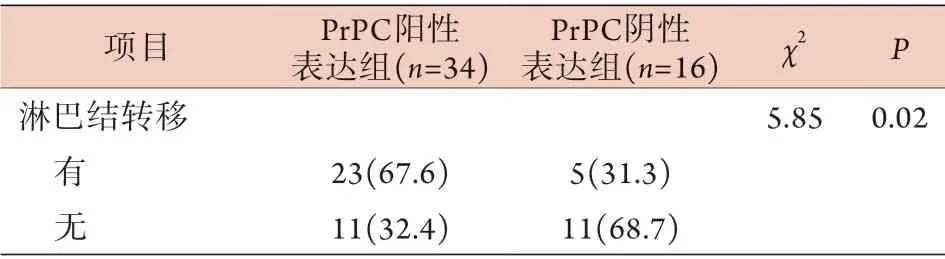
(续 表)
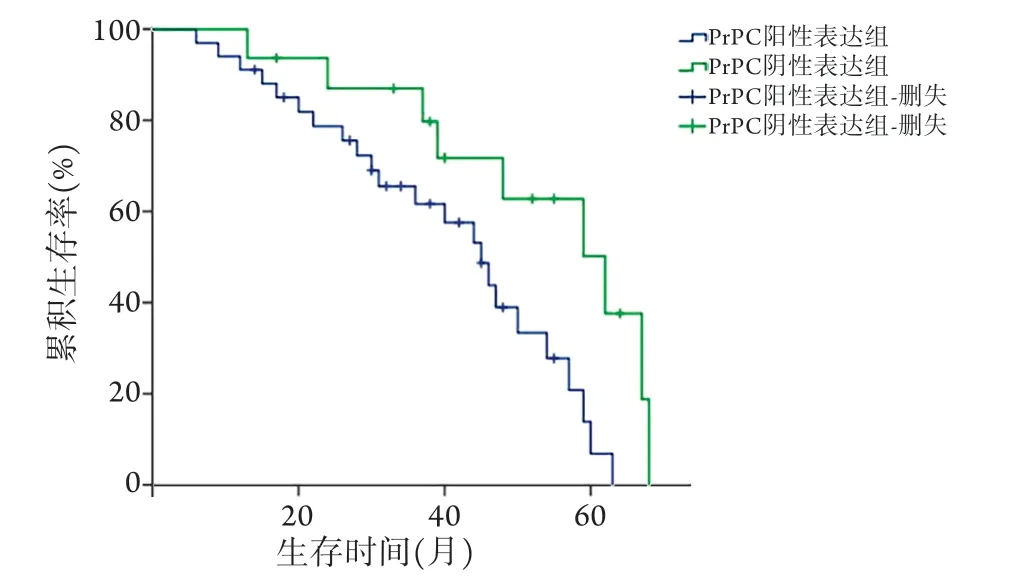
图2 PrPC阳性表达和阴性表达CRC患者Kaplan-Meier生存曲线Fig.2 Kaplan-Meier survival curves for CRC patients with positive and negative expression of PrPC
2.4 CRC的预后影响因素分析 单因素分析结果显示,TNM分期、脉管侵犯、淋巴结转移及PrPC阳性表达与CRC的预后有关(P<0.05),年龄、性别、肿瘤位置、肿瘤最大径、肿瘤浸润深度及肿瘤分化程度与CRC的预后无关(P>0.05,表2)。
将单因素分析中P<0.1的变量[TNM分期(Ⅰ-Ⅱ期赋值为0,Ⅲ-Ⅳ期赋值为1)、肿瘤浸润深度(T1-T2期赋值为0,T3-T4期赋值为1)、肿瘤分化程度(中/高分化赋值为0,低分化赋值为1)、脉管侵犯(有脉管侵犯赋值为0,无脉管侵犯赋值为1)、淋巴结转移(有淋巴结转移赋值为0,无淋巴结转移赋值为1)及PrPC表达(阳性表达赋值为0,阴性表达赋值为1)]纳入Cox回归模型进行多因素分析,结果显示,TNM分期和PrPC阳性表达是CRC患者预后的独立影响因素(P<0.05,表2)。
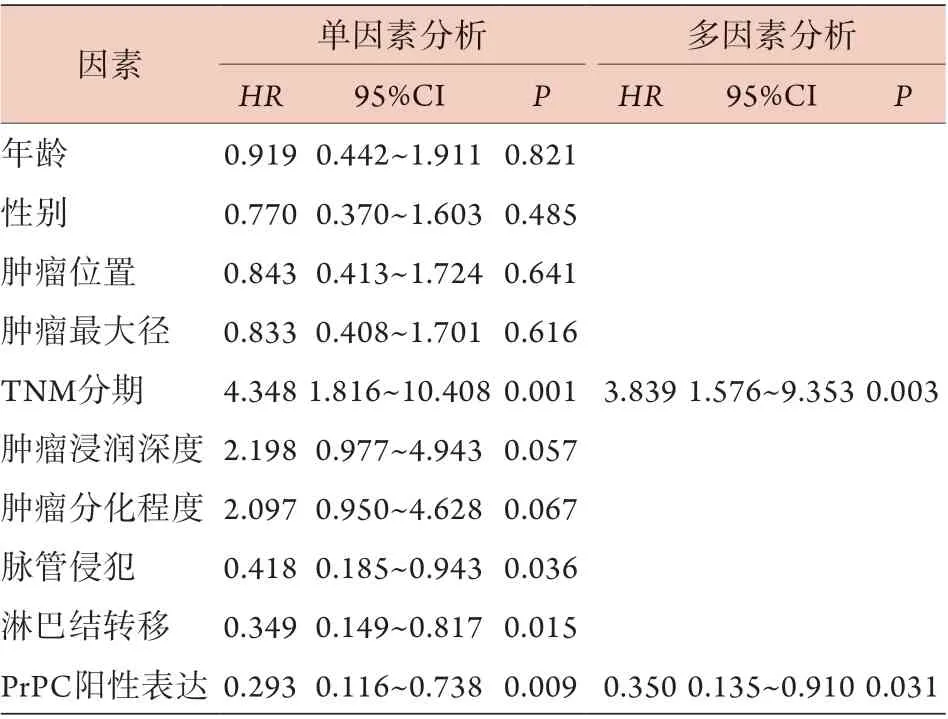
表2 CRC预后影响因素的单因素和多因素分析Tab.2 Univariate and multivariate analysis of the prognosis in colorectal cancer
3 讨 论
Pr P C 是一种含有2 5 3 个氨基酸的蛋白质,由PRNP基因编码,其N端含有5个八肽重复区,可结合Cu2+、Zn2+和Mn2+等金属离子[6]。PrPC也是一种正常细胞广泛表达的糖基化磷脂酰肌醇(glycophosphatidylinositol,GPI)锚定糖蛋白,在哺乳动物体内高度保守,在神经系统中分布最为广泛,其次为胃肠道。既往研究发现,PrPC参与口腔癌[7]、CRC[8]、胃癌[9]、肺癌[10]及乳腺癌[11]等多种肿瘤的发生发展,且其表达与多种肿瘤细胞的耐药、增殖、凋亡、迁移及侵袭等过程有关[12]。王敏等[7]研究发现,PrPC低表达可抑制口腔癌细胞的增殖、黏附、迁移及侵袭;动物实验结果显示,PrPC低表达可抑制裸鼠移植瘤的生长。Gil等[13]对乳腺癌细胞中的PrPC进行过表达及沉默,发现PrPC可通过激活ERK和NF-κB信号通路促进乳腺癌细胞的侵袭及迁移,且与乳腺癌的进展及预后不良相关。本团队前期针对胃肠癌的研究发现,下调PrPC的表达对结肠癌HT29细胞的增殖无明显影响,但可增加细胞对化疗药物顺铂的敏感性[14];抑制PrPC的表达可促进顺铂诱导的胃癌细胞(SGC7901)和结肠癌细胞(HT29)凋亡,其机制可能与上调促凋亡蛋白Bax和caspase-3以及下调抗凋亡蛋白Bcl-2的表达有关[15]。王伟建等[16]研究发现,PrPC表达下调后,CRC细胞(Lovo和SW480)的增殖和侵袭能力均明显降低,表明PrPC表达与细胞增殖及侵袭密切相关,PrPC高表达可促进CRC细胞的增殖及侵袭。既往有研究发现,PrPC介导的胃癌耐药与PI3K/Akt途径激活密切相关,抑制PI3K/Akt途径的活性可逆转PrPC介导的胃癌耐药[17]。Du等[18]发现,PrPC参与了CRC干细胞的转移,其具体机制与PrPC通过ERK2信号通路介导上皮-间充质转化过程有关。另有研究发现,使用多柔比星处理结肠癌LS174T细胞后,PrPC高表达可上调细胞中凋亡抑制蛋白XIAP的表达,抑制结肠癌细胞凋亡,表明PrPC可通过抵抗多柔比星诱导的细胞凋亡而促进结肠癌的进展[19]。上述研究提示,PrPC可能对癌症的发生、进展及细胞耐药有重要影响。
既往研究证实,PrPC在胃癌、胰腺癌及乳腺癌等组织和细胞中呈高表达[20-22],且其表达水平明显高于癌旁正常组织[23]。本研究结果显示,PrPC在CRC组织及癌旁正常组织中均存在不同程度的阳性表达,且其在CRC组织中的阳性表达率明显高于癌旁正常组织,提示PrPC阳性表达可能与CRC的发生发展有关。进一步探讨CRC组织中PrPC阳性表达与临床病理特征的关系发现,PrPC阳性表达与TNM分期、肿瘤浸润深度、肿瘤分化程度、脉管侵犯及淋巴结转移密切相关,其中CRC分期晚、肿瘤浸润深度深、中/高分化、有脉管侵犯及淋巴结转移的患者PrPC阳性表达率较高,表明随着CRC的进展PrPC表达逐渐增高,与孙杨安等[23]、梁聪等[24]及郑彦涛等[25]的研究结果一致。同时PrPC与胃癌[26]、胰腺癌[27]、头颈部鳞状细胞癌[28]及喉癌[29]的相关研究也得出了类似结论。最近王可楹等[30]发现,PrPC的表达与口腔癌分化程度及年龄相关,而与性别、肿瘤浸润深度、TNM分期及淋巴结转移无关,与上述研究结果存在较大差异。分析原因可能与纳入研究的肿瘤部位和类型不同有关。因此,临床有望通过测定PrPC的表达水平来判断和评估CRC的侵袭程度及淋巴结转移情况。Zhou等[31]对238例胃癌患者进行随访,发现PrPC高表达与胃癌预后不良相关;Du等[18]也发现,PrPC表达水平与CRC患者的生存率呈负相关;而Tang等[32]对480例胃癌患者进行研究发现,胃癌组织中PrPC的表达明显下调,且PrPC表达下调与胃癌患者生存率低相关,这一结果与上述研究相反,分析原因可能是由于使用不同的标本资源和抗体有关。此外,目前绝大多数研究是基于免疫组化分析的结果,该方法本身可能影响实验结果,且免疫组化存在一定的人为主观性。当前针对PrPC表达与CRC预后关系的研究国内外鲜见。本研究对50例CRC患者进行随访,除1例失访外,余49例获得完整随访,统计分析显示,PrPC阴性表达患者的生存时间明显长于PrPC阳性表达患者,与Zhou等[31]和Du等[18]的研究结果相似。进一步应用Cox比例风险模型进行多因素分析,结果显示,TNM分期及PrPC阳性表达是CRC预后的独立影响因素,提示PrPC有望成为评估肿瘤TNM分期、分化程度及有无脉管侵犯的一种新的生物学指标,可帮助临床医师预测CRC的预后。鉴于PrPC在CRC组织和癌旁正常组织中的差异表达,后续可进一步针对此分子开发靶向药物。目前已有靶向PrPC治疗阿尔兹海默症的相关研究[33],但与PrPC相关的肿瘤靶向治疗研究少见,这为后续研究提供了新的方向。
综上所述,本研究结果表明,PrPC表达水平与CRC患者的预后密切相关,但其具体作用机制尚不清楚,未来仍需深入研究。PrPC阳性表达是影响CRC预后的独立危险因素,但鉴于当前的研究结果存在较大差异,加之本研究样本量较小且为单中心研究,该结果仍需后续多中心大样本临床研究加以验证。

