阿魏酸通过Sirt1/NLRP3通路抑制电离辐射引起的人小肠上皮细胞炎症
张雪梅,胡昌坤,刘桂芳,谢光辉,梅 雨,张慧婷,高 月,马增春
(1.广东药科大学中药学院,广东 广州 510006;2.军事科学院军事医学研究院辐射医学研究所,北京 100850;3.安徽医科大学基础医学院,安徽 合肥 230032)
放射性肠炎是腹盆腔肿瘤放疗后最常见的并发症,主要症状为电解质失衡、腹痛、腹泻和脱水等,严重者可出现肠梗阻、肠穿孔甚至死亡[1]。小肠是人体内对电离辐射最敏感的器官之一,由于肠上皮分裂快速,在受到高剂量电离辐射时会产生急性损伤[2],导致肠通透性增加和肠黏膜屏障功能障碍,诱发多种肠道疾病。研究表明,电离辐射产生过量的活性氧(reactive oxygen species,ROS)等自由基能够抑制小肠黏膜再生,导致放射性肠炎。当肠黏膜屏障受到破坏时,肠道可向血循环中释放促炎因子和其他炎症介质,严重者肠道内细菌从肠腔转移至血循环中,并释放内毒素,引起全身性炎症反应[3]。因此,保护肠道免受辐射引起的炎症损伤至关重要。目前对于放射性肠炎,除对症治疗外尚无有效的治疗药物,因此迫切需要开发有效的防治新药。
沉默信息调节因子1(silence information regulator 1,Sirt1)是一类腺嘌呤二核苷酸(NAD+)依赖性去乙酰化酶,能使多种组蛋白和非组蛋白底物去乙酰化,从而调节氧化应激、炎症、衰老和凋亡等细胞过程[4]。Sirt1的激活可改善全身照射诱导的骨髓损伤、间充质干细胞炎症和卵巢炎症[5-7]。在辐射诱导的肠道损伤中,激活Sirt1也有一定的保护作用[1]。因此,Sirt1可能是治疗放射性肠炎的关键因子。Nod样受体家族蛋白3(Nod-like receptor pyrin domain containing protein 3,NLRP3)炎症小体是一种多蛋白复合物,识别特定的信号后通过凋亡相关斑点样蛋白(apoptosis associated specklike protein containing a CARD)招募胱天蛋白酶1,促进下游促炎因子白细胞介素1β(interleukin-1β,IL-1β)合成和释放,进而引发一系列炎症反应[8]。Sirt1可通过对炎症转录因子去乙酰化作用抑制NLRP3炎症小体的表达而发挥抗炎作用[9]。近年来研究发现,NLRP3炎症小体表达上调在辐射损伤中起着关键作用[10],如NLRP3炎症小体激活参与辐射诱导的肠道损伤[11]。因此,Sirt1/NLRP3通路可能是防治放射性肠炎的重要靶点。
阿魏酸是植物界普遍存在的一种酚类植物成分。本课题组前期研究表明,阿魏酸作为具有抗辐射作用的中药方剂四物汤中的一个有效成分,在辐射引起的氧化、炎症和凋亡等方面起到很好的抗辐射作用[9,12]。阿魏酸可通过抑制 NLRP3 炎症小体减轻辐射诱导的AHH-1细胞和小胶质细胞炎症[13-14],也可通过增加小肠绒毛细胞核中高迁移率族蛋白B1而抑制炎症反应,从而发挥对放射性肠损伤的保护作用[15]。据报道,阿魏酸可通过激活Sirt1减轻辐射引起的炎症反应[16]。因此,本研究以Sirt1/NLRP3通路为切入点,进一步探索阿魏酸防治放射性肠损伤的作用机制,为治疗放射性肠损伤提供参考。
1 材料与方法
1.1 药物、细胞、试剂和仪器
阿魏酸,纯度≥99.0%,美国Sigma-Aldrich公司,精密称取阿魏酸粉末970.95 μg,加入二甲亚砜1 mL,配制浓度为5 mmol·L-1的母液,分装避光保存于-20℃备用;使用时用含2%胎牛血清的RPMI 1640培养基稀释至所需浓度;据预实验结果,确定阿魏酸给药浓度为0.01,0.10和1.00 μmol·L-1。人小肠上皮细胞HIEC6,深圳市豪地华拓生物科技有限公司,以含10%胎牛血清、1%青霉素和链霉素的RPMI 1640培养基于37℃,5%CO2的细胞培养箱中培养。RPMI 1640培养基,美国Gibco公司;特级胎牛血清,Lonsera乌拉圭(南美)公司;二甲亚砜,北京InnoChem科技有限公司;人IL-1β ELISA试剂盒,江苏酶免实业有限公司;兔抗人NLRP3抗体和CoraLite594标记山羊抗兔IgG抗体,美国Proteintech公司;兔抗人Sirt1抗体,美国Abcam公司;兔抗人胱天蛋白酶1和IL-1β抗体,成都正能生物技术有限责任公司;兔抗人活化胱天蛋白酶1抗体,美国Signalway Antibody公司;免疫染色固定液、洗涤液、封闭液、抗体稀释液和抗荧光淬灭封片剂(含DAPI),上海碧云天生物技术有限公司;PCR试剂盒,北京全式金生物。MCO-20AIC型恒温细胞培养箱,日本SANYO公司;ME204型精密分析天平,梅特勒-托利多仪器(上海)有限公司;FACS Calibur型流式细胞仪,美国Bacton Dickinson公司。VICTORTM X5型多标记酶标仪,美国Perkin Elmer公司;JY96-Ⅱ型超声波细胞粉碎机,宁波新芝生物科技股份有限公司;ImageQuant LAS 500型显影仪,美国General Electric公司;电泳仪、电泳槽和转膜仪,美国Bio-Rad公司;活细胞成像微孔板检测仪,美国Bio-Tek公司;60Co γ射线辐照装置由军事医学研究院辐射医学研究所提供,单次照射剂量率为64.46 cGy·min-1。
1.2 CCK-8法检测HlEC6细胞存活率
取对数生长期HIEC6细胞接种于96孔板中,每孔8×103细胞。细胞接种24 h后分别经60Co γ射线4,6,8,10和14 Gy照射。每组设4复孔。照射后继续培养24 h,按CCK-8试剂盒说明书操作,随后于全波长酶标仪测定各孔450 nm吸光度(A450nm)值,计算细胞存活率。细胞存活率(%)=(照射组A450nm-空白对照组A450nm)/(细胞对照组A450nm-空白对照组A450nm)×100%。
1.3 DCFH-DA探针法测定HlEC6细胞内ROS水平
取对数生长期HIEC6细胞接种于100 mm大皿中,培养24 h后分别以60Co γ射线4,6,8,10和14 Gy照射,每组设3复孔。照射后24 h收集细胞,将细胞悬浮于已稀释的DCFH-DA中,37℃孵育20 min。用RPMI 1640培养基洗涤细胞3次,以充分除去未进入细胞内的DCFH-DA。细胞装载探针后用流式细胞仪检测平均荧光强度(每组检测1×104细胞,计算每细胞内平均荧光强度),表示细胞内ROS水平。
1.4 ELlSA检测HlEC6细胞上清中lL-1 β含量
取对数生长期HIEC6细胞接种于100 mm大皿中,设细胞对照组、照射组、照射+阿魏酸0.01,0.10和1.00 μmol·L-1组。各组培养12 h后,照射+阿魏酸组加入阿魏酸;继续培养12 h后,照射组和照射+阿魏酸组以60Co γ射线10 Gy单次照射。照射后24 h收集细胞上清,用ELISA试剂盒检测IL-1β含量。
1.5 免疫荧光法检测HlEC6细胞NLRP3蛋白表达水平
取对数生长期HIEC6细胞接种于20 mm激光共聚焦小皿中,细胞分组和处理同1.4。照射后24 h用PBS清洗细胞2次,每次10 min。用封闭液室温封闭30 min,洗涤3次,室温固定2 h后加入兔抗人NLRP3抗体(1∶500)4℃冰箱孵育过夜。洗涤3次,每次10 min;加入CoraLite594标记的山羊抗兔IgG抗体(1∶500)室温孵育1 h。洗涤3次,每次10 min。用活细胞成像微孔板检测仪检测细胞内NLRP3荧光强度。所观察区域荧光强度总和与区域面积的比值,表示NLRP3蛋白表达水平。
1.6 实时定量PCR检测Sirt1、NLRP3、胱天蛋白酶1和IL-1β mRNA表达水平
取对数生长期HIEC6细胞接种于100 mm大皿中,细胞分组和处理同1.4。照射后24 h采用Trizol法提取HIEC6细胞总RNA。据逆转录试剂盒说明书将其逆转录为cDNA。以cDNA为模板,用实时定量PCR检测Sirt1、NLRP3、胱天蛋白酶1和IL-1 βmRNA表达水平。引物序列见表1,由生工生物工程(上海)股份有限公司合成。PCR反应条件为:94℃变性30 s,随后94℃退火30 s和60℃延伸30 s共40~50次循环。所有目的基因mRNA定量结果均通过熔解曲线分析验证PCR产物的特异性,确保产物无引物二聚体,每样本重复3次。用2-ΔΔCt表示目的基因mRNA表达水平。

Tab.1 Sequences of primers for real time-quantitative PCR(RT-qPCR)
1.7 Western印迹法检测Sirt1、NLRP3、胱天蛋白酶1、活化胱天蛋白酶1和lL-1 β蛋白表达水平
取对数生长期HIEC6细胞接种于100 mm大皿中,细胞分组和处理同1.4。照射后24 h提取细胞总蛋白,按照BCA试剂盒说明书进行蛋白定量后,每个样孔加入30 μg蛋白样品,以10%SDSPAGE进行电泳,湿法转PVDF膜后,用含5%脱脂奶粉的TBST室温封闭3 h,一抗〔抗Sirt1(1∶1000)、NLRP3(1∶1000)、胱天蛋白酶1(1∶1000)、活化胱天蛋白酶1(1∶1000)和IL-1β(1∶1000)〕4℃孵育过夜,洗膜后加入CoraLite594标记山羊抗兔IgG抗体(二抗),室温孵育1 h,再次洗膜后用ECL化学发光法显影。以β肌动蛋白作为内参,采用Image J图像分析软件对蛋白条带积分吸光度(integrated absorbance,IA)值进行分析。待测蛋白相对表达水平用IA目标蛋白/IAβ肌动蛋白表示。
1.8 统计学分析
实验结果数据用±s表示,采用SPSS 25.0软件进行统计分析,采用GraphPad Prism 8.0软件作图,用单因素方差分析(one-way ANOVA)分析数据,组间比较方差齐用LSD检验,方差不齐采用DunnettT3检验。P<0.05为差异具有统计学意义。
2 结果
2.1 60Co γ射线对HlEC6细胞存活率的影响
与细胞对照组比较,60Co γ射线4,6,8,10和14 Gy照射后24 h,细胞存活率均显著下降(P<0.01)(图1),提示60Co γ射线可导致HIEC6损伤。
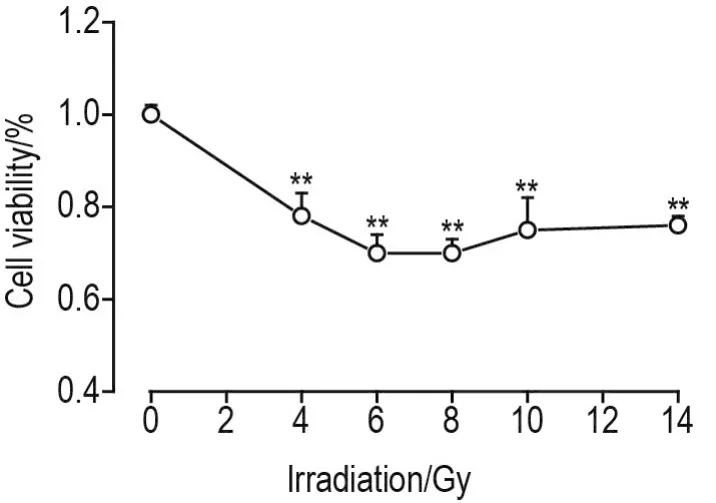
Fig.1 Changes of cell viability of human intestinal epithelia cells HlEC6 24 h after60Co γ ray irradiation.HIEC6 cells were irradiated with60Co γ rays at 4,6,8,10 and 14 Gy,and then cultured for 24 h.Cell viability was detected by CCK-8 kit.Cell viability(%)=(A450 nmof radiation group-A450 nmof blank group)/(A450nmof cell control group-A450 nmof blank group)×100%.±s,n=4.**P<0.01,compared with cell control(0)group.
2.2 60Co γ射线对HlEC6细胞内ROS水平的影响
图2结果显示,与细胞对照组相比,60Co γ射线4,6,8,10和 14 Gy照射后 24 h,HIEC6细胞内ROS水平均显著升高(P<0.01),其中10 Gy组最为明显,表明γ射线可导致HIEC6细胞氧化损伤,HIEC6细胞对10 Gy辐射剂量较为敏感。因此后续实验照射剂量选为10 Gy。

Fig.2 Changes of reactive oxygen species(ROS)level in HlEC6 cells 24 h after60Co γ ray irradiation.See Fig.1 for the cell treatment.The intracellular ROS level was detected by DCFH-DA probe method and expressed by the mean fluorescence intensity(FI)of 1×104cells per group.B was the quantitative result of A.±s,n=3.**P<0.01,compared with cell control group.
2.3 阿魏酸对照射后HlEC6细胞上清中lL-1 β含量的影响
图3结果显示,与细胞对照组相比,照射组HIEC6细胞上清中IL-1β含量显著升高(P<0.01);与照射组相比,照射前12 h预先给予阿魏酸0.10 μmol·L-1可使细胞上清中IL-1β含量显著降低(P<0.01),0.01和1.00 μmol·L-1作用不明显,提示阿魏酸0.10 μmol·L-1可降低γ射线引起的HIEC6细胞炎症反应。

Fig.3 Effect of ferulic acid(FA)on level of lL-1 β in supernatant of HlEC6 cells 24 h after60Co γ ray irradiation determined by ELlSA.The cells of irradiation+FA 0.01,0.10 and 1.00 μmol·L-1groups were pretreated with FA for 12 h before a single irradiation of60Co γ ray with 10 Gy was performed.24 h after irradiation IL-1β level was determined.±s,n=3.**P<0.01,compared with cell control group;##P<0.01,compared with irradiation group.
2.4 阿魏酸对照射后HlEC6细胞NLRP3蛋白表达水平的影响
图4结果显示,与细胞对照组相比,照射组红色荧光强度显著增强(P<0.05);与照射组相比,照射前12 h预先给予阿魏酸0.01,0.10和1.00 μmol·L-1,红色荧光强度减弱(P<0.01),其中0.10和1.00 μmol·L-1作用更为明显。由此表明,照射后HIEC6细胞NLRP3蛋白表达升高,预先给予阿魏酸可逆转照射导致的NLRP3蛋白表达升高。

Fig.4 Effect of FA on NLRP3 protein expression level in HlEC6 cells 24 h after60Co γ ray irradiation(live cell imaging).See Fig.3 for the cell treatment.The NLRP3 protein expression level was expressed as the ratio of the sum of FI and the area of the field of vision.B was the semi-quantitative result of A.±s,n=3.*P<0.05,compared with cell control group;##P<0.01,compared with irradiation group.
2.5 阿魏酸对照射后HlEC6细胞Sirt1/NLRP3通路相关基因mRNA表达的影响
图5结果显示,与细胞对照组相比,照射组Sirt1mRNA水平显著降低(P<0.05),NLRP3、胱天蛋白酶1和IL-1βmRNA水平显著升高(P<0.05,P<0.01)。照射前12 h预先给予阿魏酸0.01,0.10和1.00 μmol·L-1,与照射组相比,Sirt1mRNA水平升高(P<0.05,P<0.01),NLRP3、胱天蛋白酶1和IL-1βmRNA水平被明显抑制(P<0.05,P<0.01)。

Fig.5 Effect of FA on mRNA expressions of genes related to Sirt1/NLRP3 pathway in HlEC6 cells 24 h after60Co γ ray irradiation detected by RT-qPCR.See Fig.3 for the cell treatment.±s,n=3.*P<0.05,**P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with irradiation group.
2.6 阿魏酸对照射后HlEC6细胞Sirt1/NLRP3通路相关蛋白表达的影响
图6结果显示,与细胞对照组相比,照射组Sirt1蛋白表达水平明显降低(P<0.01),NLRP3、胱天蛋白酶1、活化胱天蛋酶1和IL-1β蛋白表达水平均显著升高(P<0.01)。与照射组相比,照射前12 h预先给予阿魏酸0.01,0.10和1.00 μmol·L-1,Sirt1蛋白表达明显升高(P<0.01),NLRP3、活化胱天蛋白酶1和IL-1β蛋白表达被明显抑制(P<0.05,P<0.01)。

Fig.6 Effect of FA on expressions of proteins related to Sirt1/NLRP3 pathway in HlEC6 cells after60Co γ ray irradiation detected by Western blotting.See Fig.3 for the cell treatment.B1 and B2 were the semi-quantitative results of A.IA:integrated absorbance.x±s,n=3.**P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with irradiation group.
3 讨论
电离辐射引起的细胞损伤常表现为细胞增殖受抑制,产生过多的ROS自由基从而激活相关的信号通路。肠上皮细胞是机体抵御外界刺激侵入黏膜下层的第一道屏障,对维持肠道健康具有重要作用。为此,本研究室选择人小肠上皮细胞HIEC6进行了预实验,用CCK-8法检测60Co γ射线4,6,8,10和14 Gy照射后12,24,36和48 h细胞存活率。结果表明,照射后24 h HIEC60细胞存活率随照射剂量的增加平稳下降。因此,本研究选用HIEC6细胞并选用照射后24 h为检测时间点为进行实验。
电离辐射能够刺激细胞产生过多的ROS,ROS作为调节炎症信号通路的次级信使可引发一系列炎症反应。本研究通过检测60Co γ射线4,6,8,10和14 Gy照射后细胞存活率和细胞内ROS水平,发现细胞存活率均明显降低,10 Gy照射剂量下ROS水平升高更为明显。因此,后续实验选择10 Gy为照射剂量。
本研究结果表明,照射前12 h预先给予阿魏酸0.01,0.10 和 1.00 μmol·L-1,其中 0.10 μmol·L-1可显著降低照射导致的IL-1β分泌增多,提示阿魏酸可有效改善照射诱导的HIEC6细胞炎症反应。
ROS被认为是NLRP3炎症小体激活调控的中心,辐射导致体内产生过多的ROS可通过激活NLRP3蛋白复合体诱导炎症发生[17]。为验证阿魏酸是否通过抑制NLRP3炎症小体改善辐射导致的HIEC6细胞炎症反应,本研究用免疫荧光实验检测HIEC6细胞内NLRP3蛋白表达。结果表明,照射后HIEC6细胞中NLRP3蛋白表达显著增强,预先给予阿魏酸可抑制其表达,表明NLRP3炎症小体参与辐射引起的HIEC6细胞炎症反应,阿魏酸改善辐射导致的HIEC6细胞炎症反应可能与抑制NLRP3表达有关。
Sirt1在调节炎症反应中起到重要的作用,在体外实验中沉默Sirt1基因可引起肿瘤坏死因子α,IL-1β和IL-6等炎症因子水平升高,也可通过去乙酰化加工进而抑制NLRP3表达,发挥抗炎作用[18]。为此,本研究用实时定量qPCR和Western印迹实验进一步验证阿魏酸是否是通过激活Sirt1抑制NLRP3炎症小体,从而减轻辐射诱导的HIEC6细胞炎症反应。结果表明,照射后HIEC6细胞Sirt1 mRNA和蛋白表达水平均显著降低,NLRP3、活化胱天蛋白酶1和IL-1β mRNA和蛋白表达水平均显著升高;预先给予阿魏酸,Sirt1 mRNA水平和蛋白表达水平均显著升高,NLRP3、活化胱天蛋白酶1和IL-1β mRNA和蛋白表达水平均显著降低。由此进一步提示,阿魏酸可能是通过激活Sirt1抑制NLRP3炎症小体的活化而改善辐射引起的HIEC6细胞炎症反应。
综上,阿魏酸可通过激活Sirt1、抑制NLRP3炎症小体活化而抑制活化胱天蛋白酶1和IL-1β表达,从而抑制辐射诱导的小肠上皮细胞HIEC6炎症反应。本研究为治疗放射性肠损伤提供了新靶点。

