亚精胺对脂多糖诱导损伤的人脐静脉内皮细胞自噬的影响及机制
谌 赟,石沁祎,蔡 毅,戴 婷,刘 敏
(1.武汉市第六医院,湖北 武汉 430000;2.黄石市阳新县人民医院,湖北 黄石 435299)
动脉粥样硬化(atherosclerosis,AS)是导致心血管疾病的主要原因之一,多发于高血压、高血脂、吸烟和老年人群,近年来随着人们生活方式的改变和人口老龄化的发展,AS发病率逐年升高[1-2]。AS发病机制复杂,目前还未完全清楚,其中由Ross[3]首次提出的“动脉粥样硬化内皮损伤学说”受到学术界广泛认可,此学说指出,血管内皮功能障碍始终存在于AS疾病中,血管内皮损伤会加重AS。因此,研究内皮细胞的损伤机制并探索改善损伤的药物对AS的治疗有着重要意义。亚精胺(spermidine,SPD)是一种多胺,广泛存在于生物体内[4],对内环境稳态的维持具有重要作用[5]。SPD具有多种生理作用,参与调节多种生物学过程,主要包括自噬、细胞凋亡、细胞增殖、抗炎和抗氧化等,而SPD调控的诸多生理过程通常与SPD诱导细胞自噬有关[6]。自噬是细胞清除损伤细胞器和蛋白质等物质的机制之一,普遍存在于真核细胞生物中,对维持细胞的代谢平衡具有重要作用[7]。参与自噬调控的蛋白众多,其中腺苷酸激活蛋白激酶-哺乳动物雷帕霉素靶蛋白(adenylate activated protein kinase/mammalian target of Rapamycin,AMPK/mTOR)信号通路是调节自噬的重要途径[8],研究表明,SPD能够通过调节自噬延缓AS和血管衰老[9-10],但其分子机制仍不明确。本研究以人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)为研究对象,利用脂多糖(lipopolysaccharide,LPS)诱导HUVEC构建内皮细胞损伤模型,探究SPD对内皮细胞损伤模型的影响,并进一步探究SPD的抗AS作用是否与AMPK-mTOR信号通路有关。
1 材料与方法
1.1 试剂和主要仪器
SPD、LPS、AMPK抑制剂多索霉素(dorsomorphin,Dor)和AMPK激活剂阿卡地新(acadesine,Aicar)(中国阿拉丁公司);PBS、0.25%胰蛋白酶、CCK8试剂盒、抗荧光衰减封片剂(含DAPI)、Triton X-100、5%BSA封闭液、十二烷基硫酸钠、TEMED、过硫酸铵、Tween-20、RIPA(强)组织细胞快速裂解液和BCA蛋白浓度测定试剂盒(中国Solarbio公司);AnnexinⅤ-FITC/PI凋亡检测试剂盒(美国BD公司);甲醛(国药集团);一抗:兔抗人微管相关蛋白1轻链3-Ⅰ(microtubule-associated protein 1 light chain 3-Ⅰ,LC3-Ⅰ)、LC3-Ⅱ、核孔糖蛋白62(nucleopore glycoprotein 62,P62)、GAPDH、AMPK、m-TOR、P70核糖体蛋白S6激酶(P70 ribosomal protein S6 kinase,P70S6K)、真核细胞翻译起始因子4E结合蛋白1(eukaryotic cell translation initiation factor 4E-binding protein 1,4EBP1)单抗、荧光基团488标记的山羊抗兔IgG(二抗)和辣根过氧化物酶标记的山羊抗兔IgG(二抗)(中国Bioswamp公司);兔抗人磷酸化AMPK(p-AMPK)、p-mTOR、p-4EBP1单抗(英国Abcam公司);兔抗人p-P70S6K单抗(美国CST公司);蛋白质Marker(美国Helix公司);PVDF转移膜、化学发光试剂(美国Millipore公司);原代内皮细胞培养体系(中国iCell公司)。
超净工作台(苏州智净净化设备有限公司;型号:SW-CJ-1D);生物安全柜(美国Spantech公司;型号:BSC-1300IIB2);CO2恒温培养箱、移液器(美国Thermo公司;型号分别为311和F3);倒置荧光显微镜(德国Leica公司;型号:DMIL LED);流式细胞仪(中国艾森生物;型号:NovoCyte);电泳仪(美国BIO-RAD公司;型号:mini protean 3 cell);酶标仪(芬兰雷勃公司;型号:MK3);高速冷冻离心机(杭州奥盛仪器有限公司;型号:iCEN-24k);全自动化学发光分析仪(上海天能科技有限公司;型号:Tanon-5200)。
1.2 细胞培养
HUVEC来源于中国科学院上海细胞库。HUVEC在含10%灭活胎牛血清、1%青霉素和链霉素双抗的DMEM完全培养基中,置37℃、5% CO2、饱和湿度的孵箱内培养。HUVEC用含10%胎牛血清的DMEM培养基1∶2传代培养。待细胞呈对数生长时即开始实验。
1.3 CCK8法检测HUVEC细胞存活率
收集细胞悬液,接种到96孔板中,过夜培养使细胞贴壁。分别加入不同浓度SPD(0,10,100,1000和2500 μmol·L-1)处理1,2和3 h后,加LPS 1 mg·L-1孵育24 h,每孔加入10 μL CCK8溶液,孵育1 h。酶标仪检测450 nm波长处各孔的吸光度(A450nm)值。确定后续实验SPD浓度和时间为100 μmol·L-1,3 h。
另取培养的细胞,SPD(0,50,100和200 μmol·L-1)预处理 3 h,加 LPS 1 mg·L-1孵育 24 h,以含有10% CCK8的新鲜培养基为空白组,检测细胞存活率。细胞存活率(%)=(药物组A450nm-空白组A450nm)/(细胞对照组A450nm-空白组A450nm)×100%。
1.4 细胞分组和处理
HUVEC分成7组,细胞对照组、模型组、模型+SPD(100 μmol·L-1预处理 3 h)组、模型+Dor(10 μmol·L-1预处理 1 h)组、模型+SPD+Dor(SPD 100 μmol·L-1预处理 3 h,Dor 10 μmol·L-1预处理1 h)组、模型+Aicar(0.5 mmol·L-1预处理1.5 h)组、模型+SPD+Aicar(SPD 100 μmol·L-1预处理 3 h,Aicar 0.5 mmol·L-1预处理1.5 h)[11],药物预处理后,模型组和用药组分别加LPS1mg·L-1共同孵育24h[12]。
1.5 流式检测细胞凋亡
取1.4分组处理的细胞,400×g,4℃离心5 min,弃上清后加入1 mL预冷的PBS,吹打混匀,400×g,4℃离心5 min,弃上清后将细胞重悬于200 μL PBS,加入 10 μL AnnexinⅤ-FITC和 10 μL PI,轻轻混匀,4℃避光孵育30 min,最后加入300 μL PBS,随即进行流式检测。使用NovoExpress分析软件进行分析检测细胞凋亡率。
1.6 免疫荧光检测自噬相关蛋白LC3-Ⅰ,LC3-Ⅱ和P62表达水平
取1.4分组处理的细胞接种于12孔板,PBS清洗2次;加入1 mL 4%多聚甲醛室温固定30 min,PBS清洗2次;加入1 mL 0.5%Triton X-100室温通透20 min,PBS清洗2次;加入1 mL 5%BSA,37℃封闭1 h,弃封闭液;分别加入一抗(1∶200)LC3-Ⅰ,LC3-Ⅱ和P62,4℃孵育过夜,PBS清洗2次;按1∶200稀释二抗,37℃孵育1 h,PBS清洗2次;加入300 μL抗荧光淬灭封片液(含DAPI),荧光显微镜观察拍照,Image J软件统计细胞荧光强度,表示蛋白表达水平。
1.7 Western印迹法检测细胞自噬相关蛋白表达水平和AMPK-mTOR通路相关蛋白磷酸化水平
取1.4分组处理的细胞,吸去培养液,适量预冷的1×PBS洗涤2次,吸去PBS,按每1×106细胞加入裂解液(含有蛋白酶和磷酸酶抑制剂)200 μL,4℃充分裂解细胞,将细胞刮入1.5 mL EP管中,4℃,12 000×g离心10 min,取上清,BCA试剂盒检测蛋白浓度并定量。每孔上样量为20 μg蛋白,将样品于10%SDS-PAGE电泳,电转至PVDF膜。5%脱脂奶粉室温封闭4℃过夜,分别加入一抗(1∶1000),室温孵育 1 h。洗膜 3次后,加二抗(1∶10 000),室温孵育1 h。洗膜3次后,将膜放置在暗室中,将ECL发光液A和B等量混匀,加在膜正面与之充分接触,最后将膜置于全自动化学发光分析仪中检测,通过TANON GIS软件读取相关条带积分吸光度值,以目标蛋白与内参蛋白积分吸光度值比值表示蛋白的表达水平,以磷酸化蛋白条带与其总蛋白条带积分吸光度比值表示蛋白磷酸化水平。
1.8 统计学分析
实验结果数据以±s表示,采用SPSS 25.0分析。多组间比较使用单因素方差分析,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 SPD预处理对LPS诱导的HUVEC存活率的影响
CCK8法检测结果(表1)显示,与细胞对照组比较,模型组的细胞存活率显著降低(P<0.01);与模型组相比,模型+SPD 50,100和200 μmol·L-1组细胞存活率显著升高(P<0.01),且SPD浓度越高细胞存活率越高。

Tab.1 Effect of spermidine(SPD)on cell viability of human umbilical vein endothelial cells (HUVECs)injured by lipopolysaccharide(LPS)by CCK8 assay
2.2 SPD预处理对LPS诱导的HUVEC凋亡率的影响
流式检测细胞凋亡的结果见图1,与细胞对照组相比,模型组细胞凋亡率显著升高(P<0.01);与模型组相比,模型+SPD组和模型+Aicar组细胞凋亡率显著降低(P<0.01),模型+Dor组细胞凋亡率显著升高(P<0.01);与模型+Dor组相比,模型+SPD+Dor组细胞凋亡率显著降低(P<0.01);与模型+Aicar组相比,模型+SPD+Aicar组细胞凋亡率显著降低(P<0.01),提示SPD能显著降低LPS诱导的内皮损伤细胞凋亡率。
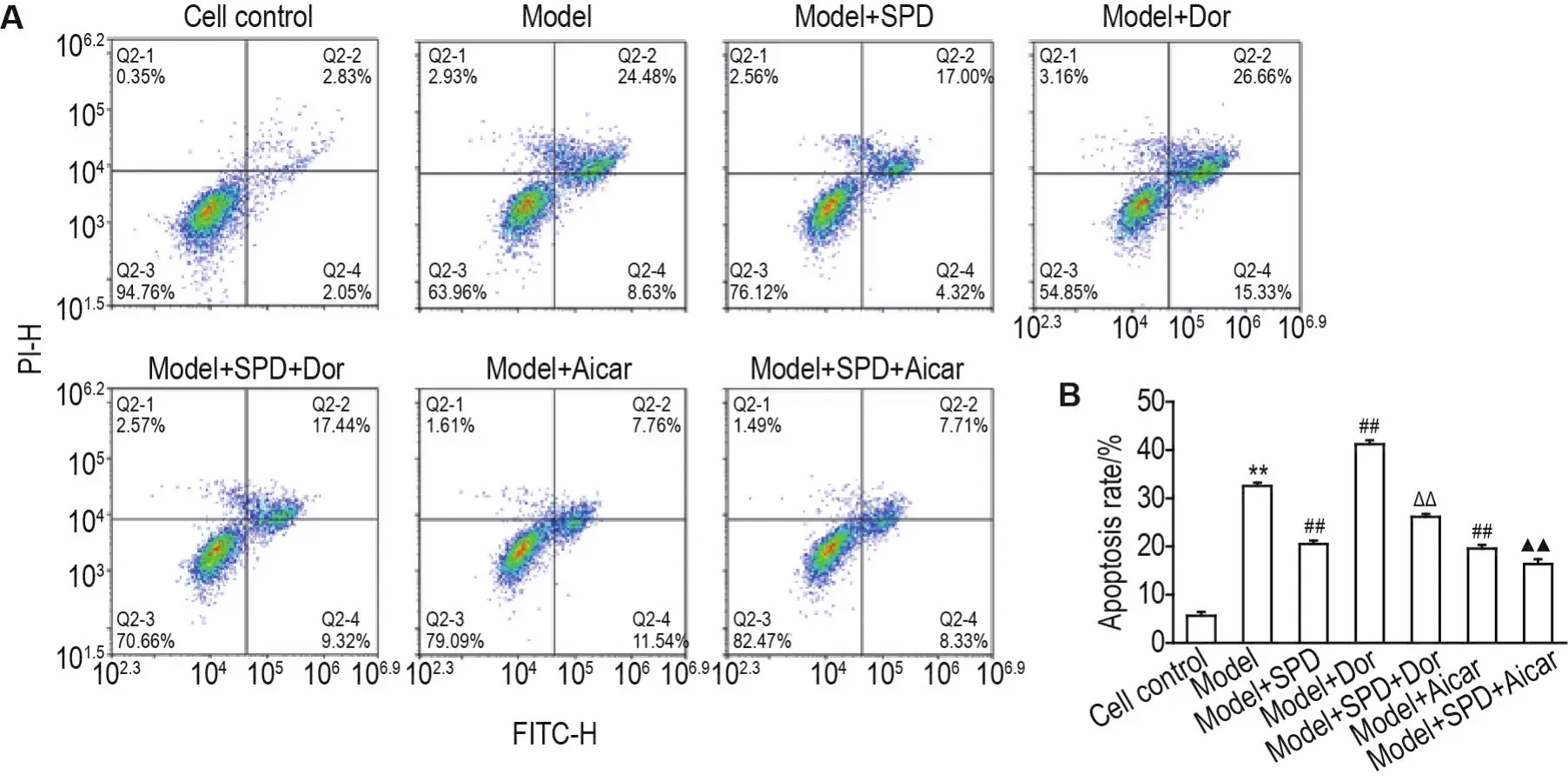
Fig.1 Effect of SPD on apoptosis rate of HUVECs injured by LPS by flow cytometry.HUVECs were pretreated with SPD 100 μmol·L-1for 3 h,dorsomorphin(Dor)10 μmol·L-1for 1 h,acadesine(Aicar)0.5 mmol·L-1for 1.5 h,then LPS 1 mg·L-1was added and co-incubated for 24 h.±s,n=3.**P<0.01,compared with cell control group ;##P<0.01,compared with model group;△△P<0.01,compared with model+Dor group;▲▲P<0.01,compared with model+Aicar group.
2.3 SPD预处理对LPS诱导的HUVEC自噬相关蛋白LC3-Ⅰ,LC3-Ⅱ和P62表达影响
2.3.1 免疫荧光法
免疫荧光结果见图2,与细胞对照组相比,模型组LC3-Ⅰ和P62蛋白荧光强度升高(P<0.01),LC3-Ⅱ蛋白荧光强度降低(P<0.01);与模型组相比,模型+SPD组和模型+Aicar组LC3-Ⅰ和P62蛋白荧光强度降低(P<0.01),LC3-Ⅱ蛋白荧光强度升高(P<0.01),模型+Dor组,LC3-Ⅰ和P62荧光强度升高(P<0.01),LC3-Ⅱ荧光强度变化不明显;与模型+Dor组相比,模型+SPD+Dor组LC3-I和P62蛋白荧光强度显著降低(P<0.01),LC3-Ⅱ蛋白荧光强度升高(P<0.01);与模型+Aicar组相比,模型+SPD+Aicar组LC3-I蛋白荧光强度显著降低(P<0.01),而LC3-Ⅱ和P62蛋白荧光强度变化不明显。

Fig.2 Effect of SPD on autophagy of HUVECs injured by LPS by immunofluorescence assay.See Fig.1 for the cell treatment.B was the semi-quantitative result of A.LC3:microtubule-associated protein 1 light chain 3.±s,n=3.**P<0.01,compared with cell control group;##P<0.01,compared with model group;△△P<0.01,compared with model+Dor group;▲▲P<0.01,compared with model+Aicar group.
2.3.2 Western印迹法
Western印迹结果见图3,与细胞对照组相比,模型组LC3-Ⅰ和P62蛋白表达显著升高(P<0.01),LC3-Ⅱ蛋白表达水平显著降低(P<0.01);与模型组相比,模型+SPD组和模型+Aicar组LC3-Ⅰ和P62蛋白表达水平显著降低(P<0.01),LC3-Ⅱ蛋白表达水平显著升高(P<0.01),模型+Dor组,LC3-Ⅰ蛋白表达水平显著升高(P<0.01),LC3-Ⅱ蛋白表达水平显著降低(P<0.01),P62蛋白表达水平升高,但无统计学差异;与模型+Dor组和模型+Aicar组相比,模型+SPD+Dor组和模型+SPD+Aicar组LC3-Ⅰ和P62蛋白表达水平显著降低(P<0.01),LC3-Ⅱ蛋白表达水平显著升高(P<0.01)。提示SPD能够通过调控自噬相关蛋白的表达促进LPS诱导的HUVEC自噬。
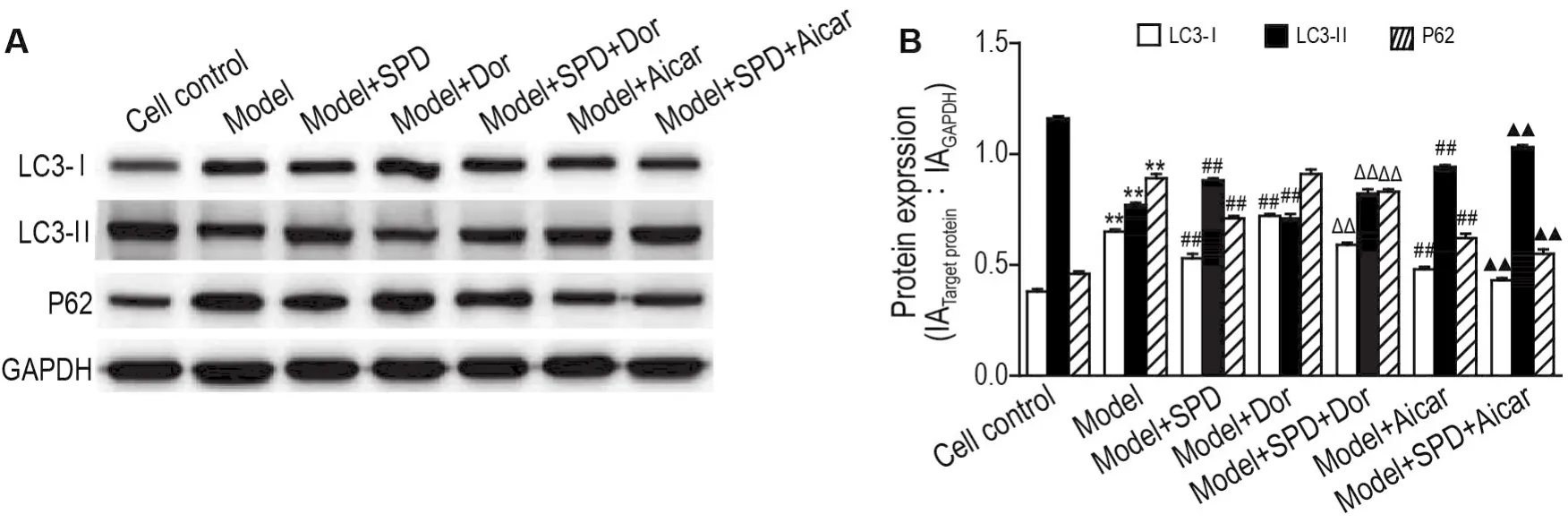
Fig.3 Effect of SPD on autophagy related protein expressions of HUVECs injured by LPS by Western blotting.See Fig.1 for the cell treatment.B was the semi-quantitative result of A.IA:integral absorbance.±s,n=3.**P<0.01,compared with cell control group;##P<0.01,compared with model group;△△P<0.01,compared with model+Dor group;▲▲P<0.01,compared with model+Aicar group.
2.4 SPD预处理对LPS诱导的HUVEC AMPK/mTOR通路相关蛋白磷酸化的影响
结果如图4所示,与细胞对照组相比,模型组AMPK蛋白磷酸化水平显著降低(P<0.01),mTOR,P70S6K和4EBP1蛋白磷酸化水平显著升高(P<0.01);与模型组相比,模型+SPD组和模型+Aicar组的AMPK蛋白磷酸化水平显著升高(P<0.01),mTOR,P70S6K和4EBP1蛋白磷酸化水平显著降低(P<0.01),模型+Dor组趋势与之相反;与模型+Dor组相比,模型+SPD+Dor组AMPK蛋白磷酸化水平显著升高(P<0.01),mTOR,P70S6K和4EBP1蛋白磷酸化水平显著降低(P<0.01);与模型+Aicar组相比,模型+SPD+Aicar组AMPK蛋白磷酸化水平无统计学差异,mTOR和4EBP1蛋白磷酸化水平显著降低(P<0.05),P70S6K蛋白磷酸化水平无统计学差异。提示SPD能调控LPS诱导损伤的HUVEC中AMPK/mTOR通路相关蛋白的磷酸化。

Fig.4 Effect of SPD on phosphorylation of adenylate activated protein kinase/mammalian target of Rapamycin(AMPK/mTOR)pathway related protein of HUVECs injured by LPS by Western blotting.See Fig.1 for the cell treatment.B1-B4 were the semi-quantitative results of A.P70S6K:P70 ribosomal protein S6 kinase.±s,n=3.**P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with model group;△△P<0.01,compared with model+Dor group,▲P<0.05,▲▲P<0.01,compared with model+Aicar group.
3 讨论
本研究结果表明,SPD能够提高内皮损伤细胞的存活率,显著降低细胞的凋亡率,提示SPD对LPS诱导的HUVEC细胞具有保护作用。
自噬的动态过程叫自噬流,只有自噬流通畅,细胞自噬才会正常进行,否则将会产生清除障碍,引起细胞损伤[13]。LC3和P62在细胞自噬的过程中有着重要的作用[14]。P62可以与泛素蛋白结合,并在自噬的过程中被降解,自噬流通畅时,P62表达水平较低[15]。本研究结果表明,LPS诱导的HUVEC中LC3-Ⅰ和P62表达上调,LC3-Ⅱ表达下调,表明LPS处理使HUVEC的自噬流发生异常。而SPD干预后,自噬标志蛋白向相反趋势变化,说明SPD可使HUVEC自噬流通畅,促进HUVEC发生自噬。
AMPK/mTOR信号通路是调节细胞自噬的关键通路,当细胞受到刺激时AMPK发生磷酸化,使下游mTOR的磷酸化被抑制,进而促进自噬的发生[16]。P70S6K,4EBP1为mTOR的下游因子。研究报道,SPD能够通过AMPK/mTOR通路调节自噬保护肝细胞[17]和心肌细胞[18]等细胞的损伤。本研究Western印迹结果显示,SPD能够上调p-AMPK并下调m-TOR,p-P70S6K和p-4EBP1的表达,表明SPD能够促进AMPK激活发生磷酸化,并抑制下游因子的磷酸化,促进自噬发生;加入AMPK抑制剂Dor和AMPK激活剂Aicar,Dor组与SPD组趋势相反,而Aicar组与SPD组趋势相同,促进AMPK磷酸化。表明SPD能促进LPS诱导损伤的HUVEC中AMPK磷酸化,抑制m-TOR及下游因子磷酸化,通过激活AMPK/mTOR通路促进自噬。
综上所述,SPD预处理可改善LPS诱导的HUVEC损伤,降低细胞凋亡率,促进细胞自噬,其机制可能与激活AMPK-mTOR信号通路有关。

